ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Клональная экспансия является ключевой особенностью антиген-специфического ответа Т-клеток. Тем не менее, клеточный цикл Т-клеток, реагирующих на антиген, был плохо изучен, отчасти из-за технических ограничений. Описан проточный цитометрический метод анализа клонально расширяющихся антиген-специфических CD8 Т-клеток в селезенке и лимфатических узлах вакцинированных мышей.
Abstract
Клеточный цикл антиген-специфических Т-клеток in vivo был исследован с использованием нескольких методов, каждый из которых обладает некоторыми ограничениями. Бромодеоксиуридин (BrdU) отмечает клетки, которые находятся в S-фазе или недавно завершены, а карбоксифлуоресцеин сукцинимидиловый эфир (CFSE) обнаруживает дочерние клетки после деления. Однако эти красители не позволяют идентифицировать фазу клеточного цикла на момент анализа. Альтернативный подход заключается в использовании Ki67, маркера, который высоко экспрессируется клетками во всех фазах клеточного цикла, кроме фазы покоя G0. К сожалению, Ki67 не допускает дальнейшей дифференцировки, поскольку он не отделяет клетки в S-фазе, которые привержены митозу, от клеток в G1, которые могут оставаться в этойфазе, переходить в цикл или переходить в G0.
Здесь мы описываем метод проточной цитометрии для захвата «снимка» Т-клеток в различных фазах клеточного цикла во вторичных лимфоидных органах мыши. Метод сочетает в себе окрашивание Ki67 и ДНК с основным комплексом гистосовместимости (MHC)-пептидно-мультимерным окрашиванием и инновационной стратегией гатинга, что позволяет успешно дифференцировать антиген-специфические CD8 Т-клетки в G0,вG1 и в фазах S-G2/Mклеточного цикла в селезенке и дренирующих лимфатические узлы мышей после вакцинации вирусными векторами, несущими модельный антигенный кляп вируса иммунодефицита человека (ВИЧ)-1.
Критическими шагами метода были выбор красителя ДНК и стратегия гатинга для повышения чувствительности анализа и включения высокоактивированных / пролиферирующих антиген-специфических Т-клеток, которые были бы пропущены текущими критериями анализа. Днк-краситель, Hoechst 33342, позволил получить высококачественную дискриминацию пиков ДНК G0/G1 и G2/M, сохраняя при этом мембранное и внутриклеточное окрашивание. Метод имеет большой потенциал для расширения знаний о реакции Т-клеток in vivo и улучшения анализа иммуномониторинга.
Introduction
Наивные Т-клетки подвергаются клональному расширению и дифференцировке при антиген-прайминге. Дифференцированные Т-клетки демонстрируют эффекторные функции, которые необходимы для клиренса антигена и для поддержания антиген-специфической памяти, что является ключом к длительной защите. Во время первых шагов первичного ответа наивное взаимодействие Т-клеток с антигенпрезентирующими клетками (АПК) в специализированных нишах в лимфоидных органах имеет решающее значение для индуцирования огромной пролиферации Т-клеток, которая характеризует фазу клонального расширения1,2,3. Взаимодействие Т-клеток и АПК тонко регулируется концентрацией и персистенцией антигена, костимулирующих сигналов и растворимых факторов (цитокинов и хемокинов), влияющих на количество и качество клонального потомства Т-клеток4,5,6,7.
Несмотря на интенсивные исследования клональной экспансии Т-клеток, до сих пор неизвестно, завершают ли антиген-праймированные Т-клетки весь свой клеточный цикл в месте распознавания антигена или они мигрируют в другие органы во время прогрессирования клеточного цикла. Этот недостаток знаний обусловлен свойствами доступных инструментов для анализа клеточного цикла. К ним относятся моноклональные антитела (mAbs), специфичные для ядерного маркера Ki67, и клеточные красители, которые либо идентифицируют клетки, прошедшие S-фазу клеточного цикла (например, бромодеоксиуридин (BrdU)), либо дискриминируют дочерние клетки и их предков (например, карбоксифлуоресцеин сукцинимидиловый эфир (CFSE)).
Однако клеточные меченые красители, такие как CFSE и BrdU, не позволяют определить, размножались ли клетки, обнаруженные в конкретном органе, локально или, скорее, мигрировали в этот участок после деления8,9. Более того, внутриядерный белок, Ki67, способен отличать клетки только в G0 (Ki67-отрицательные клетки) от клеток в любой другой фазе клеточного цикла (Ki67-положительные клетки). Таким образом, анализ Ki67 не отличает клетки в активной пролиферации (т.е. в S,G2или M) от клеток вG1,которые могут либо быстро прогрессировать до деления, либо оставаться в течение длительных периодов в G1, либо возвращаться кпокоям 10,11.
Здесь мы описываем новый метод проточной цитометрии для анализа клеточного цикла антиген-специфических CD8 Т-клеток12 из селезенки и лимфатических узлов (LN) вакцинированных мышей(Рисунок 1). Метод использует комбинацию Ki67 и окрашивания ДНК, которое ранее использовалось для анализа клеточного цикла мышиного костного мозга (БМ) кроветворных клеток13,14. Здесь мы успешно применили окрашивание ДНК Ki67 plus вместе с недавно опубликованной инновационной стратегией12для анализа клонального расширения CD8 Т-клеток. Мы смогли четко различать антиген-специфические CD8 Т-клетки в G0,вG1и в фазах S-G2/ M в селезенке и дренирующих LN вакцинированных мышей.
Protocol
Мыши были размещены в Plaisant Animal Facility, и работа была выполнена в соответствии с разрешением Министерства здравоохранения Италии No 1065/2015-PR. Протокол следовал руководящим принципам ухода за животными в соответствии с национальными и международными законами и политикой (Директива ЕС 2010/63/UE; Законодательный декрет Италии 26/2014).
1. Приготовление среды и окрашивающего раствора
- Подготовка полной среды: среда Мемориального института Розуэлл Парк (RPMI) с 2 мМ глутамина, 100 ЕД / мл пенициллина / стрептомицина, 50 мкМ бета-меркаптоэтанола и 10% объема / объема (v / v) фетальной бычьей сыворотки (FBS)
- Подготовка буфера окрашивания: фосфатно-буферный физиологический раствор без Ca2 +/ Mg2 + (PBS) с 1% массы / объема (мас. / об.) бычьего сывороточного альбумина (BSA) и 2 мМ этилендиаминтетрауксусной кислоты динатриевой соли (ЭДТА)
2. Лечение мышей
- Прайм 7-8-недельных самок balb/c мышей путем внутримышечной (т.m) инъекции в квадрицепсы вируса иммунодефицита человека (ВИЧ)-1-gag-экспрессирующего-шимпанзе аденовирусного вектора (ChAd3-gag) с дозой 107 вирусных частиц.
- Через 1-4 месяца после прайминга усиливают один раз мышей путем и.m инъекции ВИЧ-1-кляп-экспрессирующего модифицированного вируса вакцины Анкара (MVA-кляп) в дозе 106 бляшек, образующих бляшки.
- На 3-й день после форсирования жертвуйте усиленными мышами при вывихе шейки матки и анализируйте их параллельно с необработанными мышами.
- Собирайте LN, дренирующие квадрицепсы (подвздошные, подколенные и паховые) и селезенки у усиленных и необработанных мышей. Кроме того, соберите БМ с двух задних ног у необработанных мышей и используйте этот БМ для настроек проточного цитометра и в качестве положительного контроля для анализа клеточного цикла(рисунок 2).
ПРИМЕЧАНИЕ: Генерация векторов ChAd3-gag и MVA-gag, как описаноранее 12,15,16,17.
3. Выделение дренажных клеток LN, селезенки и BM
- Выделение клеток селезенки и LN
- Поместите 5 мл полной среды в каждую из двух пробирок по 15 мл и держите их на льду, готовые к сбору органов.
- Приносят в жертву взрослую мышь при вывихе шейки матки.
- Поместите мышь на спину и стерилизуйте поверхность кожи 70% v/v этанолом.
- Чтобы собрать паховые ЛЬН, сделайте ножницами продольный разрез на животе ~1 см, а разрез растяните щипцами.
- Визуализируйте паховые LN на внутренней поверхности кожи, и собирайте их щипцами. Поместите паховые LN в одну из двух пробирок по 15 мл, подготовленных на этапе 3.1.1.
- Чтобы собрать селезенку, сделайте перитонеальный разрез ножницами и удалите селезенку. После разрезания окружающей соединительной ткани поместите селезенку во вторую трубку объемом 15 мл, приготовленную на этапе 3.1.1.
- Чтобы собрать подвздошные LN, отодвиньте кишечник в сторону и визуализируйте подвздошные LN близко к нижней полой вене, а затем соберите их с помощью щипцов. Поместите подвздошные LN в ту же трубку, содержащую паховые LN.
ПРИМЕЧАНИЕ: Чтобы получить достаточное количество LN-клеток для окрашивания (см. раздел 4), часто необходимо объединить подколенные, паховые и подвздошные LN от одной мыши. Все эти LN дренируют квадрицепсы (место вакцинации i.m). Этот протокол использует только одну 15-литровую трубку объединенных LN. - Чтобы собрать подколенные LN, возьмите кожу задних ног и осторожно потяните ее вниз, чтобы раскрыть мышцы. Затем вставьте щипцы между мышцами под коленным суставом и соберите подколенные LN. Поместите подколенные LN в ту же трубку, содержащую паховые и подвздошные LN.
ПРИМЕЧАНИЕ: См. примечание после раздела 3.1.7. - Поместите селезенку в 70-мкм клеточный ситечко в 60-миллиметровой чашке для культивирования, заполненной 5 мл полной среды. Используя шприц-поршень объемом 5 мл, аккуратно размяйте орган до его полного дезагрегирования.
- Снимите ситечко и перенесите клеточную суспензию в чистую трубку объемом 15 мл.
- Добавьте 5 мл полной среды в чашку для культивирования и тщательно вымойте посуду и ситечко, чтобы убедиться, что все клетки были восстановлены. Бассейн с остальной частью суспензии клеток селезенки в трубку объемом 15 мл.
- Для объединенных паховых, подвздошных и подколенных LN подготовьте одноклеточную суспензию в соответствии с процедурой, аналогичной той, которая используется на этапах 3.1.9-3.1.11 для селезенки.
- Центрифужные ячейки при 400 × г в течение 10 мин при 4 °С. Выбросьте супернатант и повторно суспендируйте гранулы клеток в PBS.
- Подсчитайте клетки с камерой Нойбауэра, используя буфер лизиса эритроцитов и 0,04% v/v трипан синего цвета в PBS.
- Изоляция БМ-клеток
- Поместите 5 мл полной среды в трубку объемом 15 мл и держите ее на льду, готовой к сбору задних ног.
- Приносят в жертву взрослую мышь при вывихе шейки матки.
- Стерилизуют поверхность кожи 70% v/v этанолом.
- Сделайте ножницами поперечный разрез ~1 см на вентральной коже, крепко обхватите кожу с обеих сторон разреза и осторожно потяните вниз, чтобы раскрыть мышцы задних ног.
- Чтобы устранить кожу с задней части задних ног, удерживая мышь в положении лежа на спине, поместите зажим под колено и потяните вверх, чтобы обнажить мышцы.
- Отрежьте кости на двух конечностях одной задней ноги: тазовом/тазобедренном суставе и лодыжке.
- Переместите обе задние ноги в трубку объемом 15 мл, подготовленную на этапе 3.2.1. Держите трубку на льду.
- Возьмите задние лапы из трубки объемом 15 мл и перенесите их на папиросную бумагу. Обрежьте задние ноги чуть ниже коленного сустава, чтобы удалить большеберцовую кость. Рассекните бедренную и большеберцовую кости от окружающих мышц, удалите лишнюю ткань с помощью ножниц и смочите папиросную бумагу.
- Отрежьте концы кости ножницами, чтобы обнажить внутренний стержень костного мозга. Вставьте большеберцовую и бедренную кости в экстракционную трубку БМ (см. подготовку в пунктах 3.2.9.1-3.2.9.218),с самым широким концом внизу.
- Вырежьте наконечник пипетки объемом 200 мкл на линии чуть выше конца наконечника и на линии 100 мкл.
- Поместите среднюю часть в верхнюю, большую часть наконечника и поместите ее в микрофьюжную трубку объемом 1,5 мл.
- Раскрутите экстракционную трубку BM при 800 × г в течение 1 мин.
- Отбросьте кость и энергично повторно суспендируйте гранулу в 1 мл полной среды, чтобы удалить любые кластеры. Отфильтруйте клеточную суспензию через фильтр 70 мкм, размещенный на верхней части трубки объемом 15 мл.
- Дважды промывайте экстракционную трубку BM 1 мл полной среды. Фильтруйте через фильтр 70 мкм и объединяйте объем с остальной частью клеточной суспензии, полученной на этапе 3.2.11.
ПРИМЕЧАНИЕ: Одна трубка объемом 15 мл будет содержать клетки обеих задних ног мыши. - Центрифужные ячейки при 400 × г в течение 10 мин при 4 °С. Выбросьте супернатант и повторно суспендируйте ячейку гранулы в PBS.
- Подсчитайте клетки с камерой Нойбауэра, используя буфер лизиса эритроцитов и 0,04% v/v трипан синего цвета в PBS.
4. Окрашивание клеток селезенки, ЛН и БМ
- Разделить образцы клеток, подлежащие окрашиванию, на 3 подгруппы: образцы клеток для компенсации,включая БМ-клетки от необработанных мышей, которые должны быть окрашены только Hoechst 33342 (далее именуемые Hoechst) и клетки селезенки от необработанных мышей, которые будут использоваться для приготовления смеси мертвых / живых клеток для компенсации красителя мертвых клеток; положительный контроль для анализа клеточного цикла,состоящего из образца БМ от необработанных мышей; и экспериментальные образцы, содержащие образцы селезенки и LN от необработанных и вакцинированных мышей.
ПРИМЕЧАНИЕ: Убедитесь, что имеется достаточное количество клеток селезенки и LN для анализа достаточного количества специфических для кляпа CD8 Т-клеток. Часто необходимо использовать объединенные клетки селезенки и объединенные LN-клетки от 3 вакцинированных мышей и окрашивать два или более идентичных образцов объединенных клеток, каждый из которых содержит 3 × 106 клеток. Объединяйте идентичные образцы на этапе окрашивания Hoechst. Аналогичным образом, окрашивание объединяют клетки селезенки и LN-клетки от 3 необработанных мышей и объединяют идентичные образцы в конце. Отложите неокрашенный образец клеток селезенки от необработанной мыши для использования для настройки инструмента и компенсации. - Подготовьте смесь мертвых/живых клеток для компенсации красителя мертвых клеток (эта смесь клеток будет окрашена только красителем мертвых клеток).
- Нагрейте водяную баню при 65 °C.
- Возьмем аликвоту клеток селезенки (~3 × 106).
- Переложите клеточную суспензию в микрофьюжную трубку, поместите ее на водяную баню при 65 °C в течение 5 мин, а затем сразу же поместите на лед на 10 мин.
- Смешайте термоубитые клетки с живыми клетками селезенки (~3 ×10 6)в соотношении 1:1 и перенесите половину смеси на 96 хорошо круглой нижней пластины (~3 × 106 клеток/ колодец для контроля окрашивания мертвых клеток).
- Окрашивание мертвых клеток экспериментальных образцов, положительный контроль анализа клеточного цикла и смеси мертвых и живых клеток
- Перенос селезенки, ЛН, БМ клеток (3 × 106 клеток/лунка) и смеси мертвых/живых клеток (секция 4.2) в 96-луночную круглодонную пластину, согласно схеме окрашивания (стадия 4.1), и центрифугу при 400 × г в течение 3 мин при 4°С.
- Повторно суспендировать каждую ячейку гранулы в 50 мкл мертвого клеточного красителя, разведенного в PBS, и повторно суспендировать путем пипетирования вверх и вниз 3 раза сразу.
- Инкубировать в течение 30 мин при 4 °C, защищенные от света.
- Промыть ячейки 2 раза с помощью окрашивающего буфера; первый раз с 200 мкл и второй раз с 250 мкл. Для каждой промывки центрифуги вводят пластину при 400 × г в течение 3 мин при 4 °С.
- Отбросьте супернатант и повторно суспендируйте гранулу клетки в 20 мкл PBS.
- Окрашивание мембранных клеток основным комплексом гистосовместимости (MHC)-пептидными мультимерами и mAbs.
- Учитывая необходимые объемы по схеме окрашивания (настройки проточного цитометра, табл. 1),готовят следующие реагенты:
- Разбавить mAb 2.4G2 в буфере окрашивания в соответствии с соответствующим разбавлением (см. Таблицу материалов); для каждого образца, подлежащего окрашиванию, используйте 10 мкл этого разведения.
ПРИМЕЧАНИЕ: 2.4G2 mAb блокирует неантиген-специфическое связывание иммуноглобулинов с fcγIII и FcγII рецепторами. - Разбавить меченый Н-2к(d) Аллофикоцианин (APC)-меченый Аллофикоцианином (APC)тетрамер (Тетр-кляп) в окрашивающем буфере для получения соответствующего разбавления (см. Таблицу материалов); для каждого образца, подлежащего окрашиванию, используйте 20 мкл этого разбавления.
- Получают смесь антител путем разбавления mAbs в буфере окрашивания в соответствии с соответствующим разбавлением (см. Таблицу материалов),которое было ранее определено в экспериментах по титрованию; для каждого образца, подлежащего окрашиванию, используйте 20 мкл этой смеси антител.
ПРИМЕЧАНИЕ: Здесь использовались анти-CD3e перидинин хлорофилловый белок (PerCP-Cy5.5) (клон 145-2C11), анти-CD8a блестящий ультрафиолетовый (BUV805) (клон 53-6.7) и анти-CD62L фикоэритрин цианин7 (PECy7) (клон MEL-14).
- Разбавить mAb 2.4G2 в буфере окрашивания в соответствии с соответствующим разбавлением (см. Таблицу материалов); для каждого образца, подлежащего окрашиванию, используйте 10 мкл этого разведения.
- Добавляют 10 мкл ранее разбавленного 2,4 Г2 мАБ (стадия 4.4.1.1) и инкубируют в течение 10 мин при 4°С, защищенные от света.
- Добавьте 20 мкл ранее разбавленного APC Tetr-gag (стадия 4.4.1.2) и 10 мкл H-2k(d) AMQMLKETI фикоэритрина (PE) пентамера (пент-кляп). Инкубировать в течение 15 мин при 4 °C, защищенных от света.
- Добавляют 20 мкл ранее приготовленной смеси антител (стадия 4.4.1.3) и инкубируют 15 мин при 4°С, защищенной от света.
ПРИМЕЧАНИЕ: Таким образом, конечный объем составляет 80 мкл на скважину (этап 4.3.5, этапы 4.4.2-4.4.4). - Промывайте ячейки 200 мкл окрашивающего буфера. Центрифуга при 400 × г в течение 5 мин при 4 °С.
- Повторно суспендируют ячейку гранулы в 250 мкл окрашивающего буфера и переносят клеточную суспензию в пробирки по 5 мл. Добавьте в пробирку 1 мл окрашивающего буфера и центрифугу при 400 × г в течение 5 мин при 4 °C.
- Возьмем аликвоту БМ-клеток (3 × 106 клеток) (см. список образцов клеток, раздел 4.1), которые будут использоваться для компенсации канала Хёхста (Hoechst 33342 возбуждается ультрафиолетовым лазером (настройки проточного цитометра(таблица 2)),и перенесите клеточную суспензию в трубку объемом 5 мл. Добавьте в пробирку 1 мл окрашивающего буфера и центрифугу 400 × г в течение 5 мин при 4 °C.
- Учитывая необходимые объемы по схеме окрашивания (настройки проточного цитометра, табл. 1),готовят следующие реагенты:
5. Фиксация/пермеабилизация
- Подготовьте свежий буфер фиксации/пермеабилизации, разбавив 1 часть концентрата фиксации/пермеабилизации 3 частями разбавителя фиксации/пермеабилизации, в соответствии с инструкциями производителя.
- Отбросьте супернатант и импульсный вихрь образцов, чтобы полностью дезагрегировать гранулу.
- Добавьте 1 мл свежеприготовленного буфера фиксации/пермеабилизации в каждую трубку, включая трубку с неокрашенными клетками селезенки (3 x 106,см. список образцов клеток, раздел 4.1) и вихрь.
- Инкубировать в течение 16 ч при 4 °C.
ПРИМЕЧАНИЕ: Здесь протокол можно приостановить.
6. Внутриклеточное окрашивание
- Окрашивание Ki67
- Готовят свежий буфер пермеабилизации 1x путем разбавления буфера пермеабилизации 10x дистиллированной водой, согласно инструкциям производителя. Перед использованием буфер пермеабилизации 1x должен быть отфильтрован через фильтр 0,45 мкм для устранения агрегатов.
- Разбавляют mAb Ki67 флуоресцеин изотиоцианат (FITC) (клон SolA15) в буфере пермеабилизации 1x (см. Таблицу материалов),как определено ранее в экспериментах по титрованию (конечный объем 100 мкл на образец).
- Добавьте 3 мл буфера пермеабилизации 1x в каждую пробирку и центрифугу при 400 × г в течение 5 мин при комнатной температуре (RT).
- Отбросьте супернатант и повторите шаг 6.1.3.
- Выбросьте супернатант и повторно суспендируйте клеточную гранулу в 100 мкл ранее разбавленного mAb Ki67 FITC (этап 6.1.2).
- Инкубировать в течение 30 мин на RT, защищенном от света.
- Промыть ячейки 2 раза 4 мл буфера пермеабилизации 1х. Для каждой промывочной центрифуги по 400 × г в течение 5 мин при РТ.
- Повторное суспендирование клеточной гранулы в PBS с учетом следующих объемов: 350 мкл PBS для образцов, которые будут получены непосредственно на проточном цитометре; 250 мкл PBS для образцов, инкубируемых с Hoechst незадолго до проточной цитометрии (раздел 6.2).
- Окрашивание ДНК
- Добавьте 250 мкл 4 мкг/мл Hoechst в PBS к каждому образцу (конечная концентрация Hoechst составляет 2 мкг/мл).
ПРИМЕЧАНИЕ: В случае, если были подготовлены два или более идентичных образца по 250 мкл в PBS, объедините их на этом этапе и добавьте равный объем 4 мкг/мл раствора Hoechst в PBS (конечная концентрация Hoechst составляет 2 мкг/мл). Количество клеток сильно влияет на стадию окрашивания ДНК. Используйте один и тот же номер ячейки в каждом образце. Имейте в виду, что даже немного уменьшенное количество клеток (например, из-за потери клеток на предыдущих этапах промывки) приводит к более высокому связыванию Hoechst с ДНК и более высокой интенсивности Hoechst. - Инкубировать в течение 15 мин на RT, защищенном от света.
- Центрифугировать образцы при 400 × г в течение 5 мин при РТ.
- Повторное суспендирование клеточной гранулы в 350 мкл PBS.
- Добавьте 250 мкл 4 мкг/мл Hoechst в PBS к каждому образцу (конечная концентрация Hoechst составляет 2 мкг/мл).
7. Подготовка компенсационных образцов бисера
- Получают 5 мкл антитела, разбавляя mAb в буфере окрашивания соответствующим образом.
ПРИМЕЧАНИЕ: Для каждого фторхром-конъюгированного mAb, используемого в эксперименте, подготовьте соответствующий компенсационный образец шарика. - Вихревой отрицательный контроль и Анти-Крыса / Хомяк Ig, κ Comp Бусины перед использованием.
- Для каждого образца введите одну каплю (~20 мкл) отрицательных контрольных шариков CompBeads и одну каплю Anti-Rat/Hamster Ig,k CompBeads.
- Добавьте 5 мкл предварительно разбавленного антитела (стадия 7.1) в трубку и пипетируйте вверх и вниз.
- Инкубировать в течение 15 мин при 4 °C, защищенных от света.
- Промывайте образцы 2 мл окрашивающего буфера. Центрифуга при 400 × г в течение 5 мин при 4 °С.
- Выбросьте супернатант и повторно суспендируйте гранулу, добавив 500 мкл PBS в каждую трубку и вихрь.
8. Приборо-компенсационная установка и получение экспериментального образца на проточном цитометре
ПРИМЕЧАНИЕ: Обратитесь к настройкам проточногоцитометра (таблица 2)для конфигурации цитометра.
- Общий инструмент и настройка компенсации
- Откройте программное обеспечение для получения образцов (см. раздел Таблица материалов)и создайте новый эксперимент, щелкнув Новый эксперимент в разделе ленты рабочей области и выбрав Новый пустой эксперимент.
- Дважды щелкните созданный эксперимент, чтобы открыть его.
- В окне Настройки цитометра нажмите «Параметры» и выберите все каналы (например, PE, APC и т. Д.), Используемые в панели окрашивания, включая параметры «Прямой рассеяние» (FSC) и «Боковое рассеяние» (SSC).
- Выберите линейную шкалу в качестве параметра Hoechst, сняв флажок log scale, и проверьте ширину (W) импульса напряжения для FCS, SSC и Hoechst.
ПРИМЕЧАНИЕ: Все параметры отображаются по умолчанию в логарифмической (логарифмической) шкале, за исключением FSC и SSC, которые находятся в линейном масштабе. Все параметры анализируются по площади (А) и высоте (Н) импульса напряжения. - На глобальном листесоздайте точечную диаграмму с FSC-A по оси x и SSC-A по оси Y.
- Запустите образец неиспорченного селезенки, щелкнув Получить данные на панели мониторинга сбора.
- Установите соответствующие параметры FSC и SSC для визуализации ячеек, изменив значения напряжения в разделе Параметры, и создайте затвор для выбора всех ячеек, отображаемых на точечной диаграмме FSC-A/SSC-A, щелкнув Polygon Gate на панели инструментов рабочей области Глобального листа.
- Отображение закрытых ячеек в гистограммах с каждым параметром флуоресценции по оси X.
- Запустите неокрашенные и полностью окрашенные образцы селезенки, чтобы настроить флуоресцентный детектор (PMT), чтобы иметь четкое разделение между отрицательными и положительными сигналами окрашенных клеток для каждого параметра флуоресценции.
- Чтобы выполнить настройку компенсации, щелкните Эксперимент на ленте рабочей области и в разделе Настройка компенсации выберите Создать элементы управления компенсациями. Снимите флажок Включить неиспорченную управляющую трубку/колодец и нажмите кнопку ОК.
ПРИМЕЧАНИЕ: Эта операция приведет к созданию образца с именем Compensation Controls и обычного рабочего листа, содержащего несколько листов, соответствующих каждому выбранному параметру. - Запустите образец компенсационных бусин (см. раздел 7); установите соответствующие настройки FSC и SSC для визуализации шариков путем изменения значений напряжения и порога сбора 5000 по параметрам FSC в окне цитометра.
- Отрегулируйте затвор P1 на популяции бусин и убедитесь, что положительные и отрицательные пики видны на оси X. Повторите эту операцию для каждого образца шарика компенсации и, наконец, запишите каждый файл образца, щелкнув Записать данные на панели мониторинга сбора (запишите не менее 5 000 событий для каждого образца).
- Для каждого зарегистрированного образца шарика установите затворы P2 и P3 на положительный и отрицательный пики соответственно.
- Запустите образцы ячеек для компенсации (см. шаги 4.2 и 4.4.7, а также разделы 5 и 6). Измените напряжения FSC и SSC и пороговое значение, чтобы визуализировать ячейки, настроить затвор P1 и, наконец, записать каждый файл образца (записать не менее 10 000 событий). Установите затворы P2 и P3 на положительный и отрицательный пики соответственно.
ПРИМЕЧАНИЕ: Для компенсации канала Хёхста используйте G0/G1 в качестве отрицательного пика (P3) и G2/M в качестве положительного (P2). - Щелкните Эксперимент в разделе ленты рабочей области и в разделе Настройка компенсации выберите Рассчитать компенсацию.
- Присвойте созданному параметру компенсации имя, свяжите и сохраните его в текущем эксперименте.
- Получение экспериментальных образцов
- Откройте образец, щелкнув Новый образец на панели инструментов браузера, и создайте стратегию блокировки на глобальном листе.
ПРИМЕЧАНИЕ: Стратегия сбора образцов аналогична стратегии анализа выборки, описанной на рисунке 3 и в разделе 9. - Отображение всех событий в гистограмме с CD3-A по оси X. Создайте интервальный вентиль, чтобы выбрать только ячейки CD3+.
- На панели мониторинга приобретениявыберите шлюз хранилища в качестве Все события для образцов LN и Либо Все события, либо Ячейки CD3+ для образцов селезенки.
- Запустите экспериментальные образцы на низкой скорости и, наконец, запишите все файлы, убедившись, что собрано не менее 100-200 антиген-специфических CD8 Т-клеток для каждого образца от вакцинированных мышей.
ПРИМЕЧАНИЕ: Размер файла экспериментальных образцов обычно велик (30-120 МБ), особенно когда частота антиген-специфических CD8 Т-клеток низкая. Следовательно, большое количество событий (> 1 × 106)должно быть собрано для регистрации по меньшей мере 100-200 антиген-специфических CD8 Т-клеток. Большие файлы могут замедлить последующий процесс анализа данных. Получение только CD3+ клеток в образцах селезенки (см. шаг 8.2.2 выше) полезно для уменьшения размера файла. - Запустите и запишите положительный контроль для анализа клеточного цикла, то есть образца БМ от необработанных мышей.
- Откройте образец, щелкнув Новый образец на панели инструментов браузера, и создайте стратегию блокировки на глобальном листе.
9. Анализ данных
- Откройте программное обеспечение (см. Таблицу материалов)и создайте различные группы, соответствующие различным органам для анализа, щелкнув Создать группу в разделе ленты рабочей области (т. Е. Создать группу «a-LNs»; "b-селезенка"; "с-БМ").
ПРИМЕЧАНИЕ: Вновь созданные группы появятся в списке групп, в то время как группа «Компенсация» автоматически генерируется программным обеспечением. - Откройте окно Изменить группу, дважды щелкнув имя группы, и убедитесь, что вновь созданные группы синхронизированы. Если нет, поставьте галочку на функции Синхронизировано.
- Перетащите каждый FCS-файл в соответствующую группу.
- Создайте стратегию gating, начиная с группы "a-LNs".
- Дважды щелкните по полностью окрашенному образцу в группе, чтобы открыть окно графика; Оси x и Y помечены как в файлах FCS (см. настройки проточного цитометра, таблица 2).
- Отображение общего количества событий, полученных для этого образца, в виде точечного графика с ДНК-A на оси x и ДНК-W на оси Y.
- Выберите только одну ячейку, щелкнув Прямоугольник в разделе инструмента gating окна графика.
ПРИМЕЧАНИЕ: Одиночные клетки имеют значения ДНК-А следующим образом: 2N (низкий): между 2N и 4N (промежуточный) или равный 4N (высокий), в то время как значения ДНК-W идентичны для всех из них (шаг 1 на рисунке 3). - Дважды щелкните по центру прямоугольного затвора, чтобы отобразить одиночные ячейки на точечном графике с параметром FSC-A по оси X и красителем мертвых ячеек по оси Y.
- Выберите только живую популяцию ячеек, щелкнув Polygon в разделе инструмента gating окна графика. Живые клетки отрицательны для красителя мертвых клеток (шаг 2 на рисунке 3).
- Дважды щелкните в центре полигонального затвора, чтобы отобразить ячейки на точечном графике с параметром FSC-A по оси x и параметром SSC-A по оси Y.
- Нажмите на Rectangleи создайте «расслабленные» ворота, чтобы включить все одиночные живые ячейки в этот график12 (шаг 3 на рисунке 3).
- Дважды щелкните по центру «расслабленных» ворот, чтобы отобразить ячейки в виде точечного графика с CD3 по оси X и CD8 по оси Y.
- Выберите CD3+CD8+ ячейки, нажав на Polygon (шаг 4 на рисунке 3).
- Дважды щелкните в центре затвора CD3+CD8+, чтобы отобразить ячейки на точечном графике с Tetr-gag на оси X и Pent-gag на оси Y.
- Выберите антиген-специфические CD8 Т-клетки (положительные как для Tetr-gag, так и для Pent-gag), нажав на Polygon (шаг 5 на рисунке 3).
- Дважды щелкните в центре специфического для кляпа затвора, чтобы отобразить клетки на точечном графике с ДНК-A по оси X и Ki67 по оси Y(рисунок 4).
- Выделите ячейки в различных фазах цикла ячеек, щелкнув Quad в разделе инструмента gating окна графика.
ПРИМЕЧАНИЕ: Клетки в фазе G0 представляют собой клетки с низким содержанием ДНК Ki67neg (нижний левый квадрант); клетки вG1 представляют собой Ki67pos-ДНК низко (верхний левый квадрант); клетки в S-G2/Mявляются Ki67pos-ДНК промежуточными/высокими (верхний правый квадрант)(рисунок 4). - Скопируйте стратегию блокировки, созданную в одном образце, в соответствующую группу, чтобы применить ворота ко всем образцам группы.
- Повторите шаги с 9.5 по 9.18 для "группы a-LN".
- Убедитесь, что все ворота подходят для каждого образца группы "b-spleen". Чтобы проанализировать клеточный цикл среди клеток BM (положительный контроль), нажмите в центре «расслабленного» затвора, чтобы отобразить клетки на точечном графике с ДНК-A по оси X и Ki67 по оси Y.
- Убедитесь, что все затворы подходят для каждого образца из 3 групп (т. Е. Для клеток из селезенки, LN и BM).
ПРИМЕЧАНИЕ: Одноячеечный популяционный затвор (этап 9.7) и четырехугольный затвор для клеточного цикла (этап 9.17) могут иметь разные координаты затвора в разных образцах, главным образом из-за возможных незначительных различий интенсивности красителя Hoechst между образцами (раздел 6.2). По этой причине может потребоваться модифицировать одноклеточный популяционный затвор и четырехугольный затвор для клеточного цикла в каждом образце. Это будет сделано следующим образом: дважды щелкните по имени группы и удалите синхронизацию из свойств группы. Эта операция позволяет модифицировать затворы в одном образце без изменения тех же затворов во всех других образцах группы. После удаления синхронизации при необходимости измените ворота. - Чтобы визуализировать результаты, полученные в результате этого анализа, щелкните Редактор макетов в разделе ленты рабочей области, чтобы открыть его. Перетащите каждый вентиль стратегии затвора в области примера в редактор макета и разместите графики в соответствии с последовательностью стратегии захвата. При необходимости измените тип графика, дважды щелкнув по соответствующему графику в макете и выбрав соответствующий тип в окне Определение графика.
- Щелкните группу и выполните итерацию по функциям на ленте макета, чтобы визуализировать результаты, полученные в каждом органе, и сравнить различные образцы.
Representative Results
Фазы клеточного цикла клеток из селезенки, LN и BM мышей Balb/c были проанализированы с использованием флуоресцентного красителя ДНК Hoechst и анти-Ki67 mAb, в соответствии с протоколом, обобщенным на рисунке 1. Это окрашивание позволило дифференцировать клетки в следующих фазах клеточного цикла: G0 (Ki67neg, с 2N ДНК, определяемым как DNAlow), G1 (Ki67pos, DNAlow) и S-G2/ M (Ki67pos, с содержанием ДНК, содержащимся между 2N и 4N, или равным 4N ДНК, определенной как DNA промежуточный / высокий).
Сначала мы провели анализ клеточного цикла клеток BM для воспроизведения ранее опубликованных результатов13,14, а затем проанализировали интересующие клетки, то есть CD8 Т-клетки. На рисунке 2 показан типичный пример анализа клеточного цикла BM-клеток(рисунок 2A). Протокол дал низкий коэффициент вариации (CV) пиков ДНК G0/G1 иG2/M, что указывает на отличное качество окрашивания ДНК(рисунок 2B,показывающий пример с CV < 2,5; CV всегда было < 5 во всех экспериментах).
Затем мы применили тот же протокол к антиген-специфическим CD8 Т-клеткам вакцинированных мышей. Мышей BALB/c вакцинировали против антигенного кляпа ВИЧ-1, используя Chad3-кляп для прайминга и MVA-кляп для бустирования, оба спроектированы для переноса кляпа ВИЧ-1. В день (d) 3 после повышения мы проанализировали частоту специфических для кляпа CD8 Т-клеток из селезенки и дренирующих LN. Мы воспользовались недавно определенной стратегией гатинга для Т-клеток на ранней стадии иммунного ответа, которая, в отличие от обычной стратегии, подходит для обнаружения высокоактивированных антиген-реагирующих CD8 Т-клеток12. Мы реализовали новую стратегию в пять последующих шагов. На шаге 1 мы исключили дублеты или агрегаты с помощью ДНК-A/-W gate, а на шаге 2 мы идентифицировали живые клетки путем исключения мертвых клеточных маркеров. На шаге 3 мы идентифицировали интересующую популяцию, используя нетрадиционный «расслабленный» затвор FSC-A/ SSC-A(рисунок 3A)вместо канонического узкого лимфоцитарного затвора12. После захвата CD3+CD8+ клеток (шаг 4 на рисунке 3A)мы идентифицировали специфические для кляпа CD8 Т-клетки с помощью двух различных мультимеров MHC, то есть Pent-gag и Tetr-gag (шаг 5 на рисунке 3A). Мы использовали два мультимера вместо одного для улучшения чувствительности обнаружения CD8 T-клеток у вакцинированных мышей, не увеличивая фон окрашивания у необработанных мышей(рисунок 3B и C,шаг 5). Таким образом, мы успешно дифференцировали необработанных мышей (0,00% и 0,00% антиген-специфических CD8 Т-клеток в LN и селезенке соответственно) от вакцинированных мышей (0,46% и 0,29% антиген-специфических CD8 Т-клеток в LN и селезенке соответственно, рисунок 3В и С).
Примечательно, что протокол позволил нам иметь чрезвычайно низкий фон в антиген-специфических CD8 T-клеточных воротах LN и селезенки необработанных мышей (обычно 0,00% и максимум 0,02%). Сравнение участков FSC-A/SSC-A показал, что клетки, специфичные для кляпа, имели высокий уровень SSC-A и FSC-A(рисунок 3D),подтверждая необходимость использования «расслабленного» затвора FSC-A/SSC-A для захвата этих клеток. Затем мы оценили процентное содержание CD8-специфических CD8 Т-клеток в разных фазах клеточного цикла(рисунок 4A). Мы обнаружили, что специфические для кляпа CD8 Т-клетки в селезенке и даже больше в дренирующих LN содержали высокую долю клеток в фазах S-G2/ M на 3-й день после буста (18,60% и 33,52% соответственно).
Кроме того, мы обнаружили, что специфические для кляпа CD8 Т-клетки в фазах S-G2/ M имели высокий FSC-A и SSC-A при наложении на общие CD8 Т-клетки из того же органа(рисунок 4B). Экспрессия CD62L специфическими для Кляпа CD8 Т-клетками была низкой, как и ожидалось для активированных Т-клеток, за исключением нескольких клеток в G0 вLN (рисунок 4C). В целом, эти результаты подтвердили, что «расслабленный» затвор (этап 3 фиг.3A, B и C)должен был включать все пролиферирующие антиген-специфические CD8 Т-клетки12. Протокол был чрезвычайно ценным для «моментальной» оценки фаз клеточного цикла антиген-специфических CD8 Т-клеток во время анализа и экспрессии CD62L клетками в разных фазах клеточного цикла.

Рисунок 1: Схема протокола анализа клеточного цикла антиген-специфических CD8 Т-клеток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2:Анализ клеточного цикла клеток BM. Клетки BM от необработанных мышей Balb/c окрашивали и анализировали с помощью проточной цитометрии. (A) Пример стратегии гатинга. Мы остановились на отдельных клетках на участке ДНК-A/-W (слева), а затем на живых клетках путем исключения красителя мертвых клеток (посередине). Затем для всех ячеек БМ (справа) использовался «расслабленный» затвор FSC-A/SSC-A. (B) Пример анализа клеточного цикла клеток БМ (слева). Мы использовали комбинацию Окрашивания Ki67 и ДНК для идентификации клеток в следующих фазах клеточного цикла: G0 (нижний левый квадрант, клетки Ki67neg-DNAlow), G1 (верхний левый квадрант, Ki67pos-DNAlow), S-G2/ M (верхний правый квадрант, Ki67pos-DNA промежуточный / высокий). Показан флуоресцентный минус один (FMO) контроль Ki67 mAb (в середине) и гистограммы ДНК (справа). На графике гистограммы ДНК левая и правая вентили соответствуют пику ДНК G0/G1 иG2/M соответственно, а числа представляют коэффициенты вариации (CV) каждого пика. На всех остальных графиках числа представляют собой процент ячеек в указанных затворах. На рисунке показан 1 репрезентативный эксперимент из 5. В каждом эксперименте мы анализировали объединенные BM-клетки 3 мышей. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3:Анализ антиген-специфических CD8 Т-клеток из LN и селезенки. Мышей Balb/c вводили внутримышечно (i.m.) с Chad3-gag и усиленным i.m. с MVA-клягом. На 3-й день после форсирования дренирование клеток LN и селезенки у вакцинированных и необработанных контрольных мышей окрашивали и анализировали с помощью проточной цитометрии. а) схема стратегии определения отдельных ячеек в пять этапов для выявления отдельных ячеек (этап 1); живые клетки (Шаг 2); лимфоциты (Шаг 3); CD8 Т-клетки (Шаг 4); и клетки, специфичные для кляпа (шаг 5). (В-С) Пример графиков: анализ клеток (В) LN и (С) селезенки необработанных (сверху) и вакцинированных (нижних) мышей. Мы идентифицировали отдельные клетки на участке ДНК-A/-W на шаге 1. Затем, на шаге 2, мы выбрали живые клетки путем исключения красителя мертвых клеток. На шаге 3 мы использовали неканонические «расслабленные» ворота для лимфоцитов. На шаге 4 мы идентифицировали CD8 Т-клетки по их двойной экспрессии CD3 и CD8. Затем мы идентифицировали клетки, специфичные для кляпа, а не гэг-специфические на этапе 5, основываясь на их способности связывать меченые фторхромом H-2kd-gag-Pentamer (Pent-gag) и H-2kd-gag-Tetramer (Tetr-gag), или нет, соответственно. (D) Профили FSC-A/SSC-A клеток, специфичных для кляпа (синий), а не для кляпов (серый), после вскрытия, как описано выше. Числа представляют проценты ячеек в указанных воротах. На рисунке показан 1 репрезентативный эксперимент из 5. В каждом эксперименте мы анализировали объединенную селезенку и объединенные LN-клетки 3 вакцинированных мышей и 3 необработанных мышей. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4:Анализ клеточного цикла антиген-специфических CD8 Т-клеток. Мышей вакцинировали, как показано на рисунке 3, а анализ клеточного цикла клеток, специфичных для кляпа, проводили на 3-й день после форсирования, после гастинга в 5 шагов, как на рисунке 3. (A)Пример анализа клеточного цикла специфических CD8 Т-клеток из LNs (сверху) и селезенки (снизу) вакцинированных мышей. Фазы клеточного цикла были идентифицированы, как показано на рисунке 2B. Панели представляют собой ячейки в G0,в G1и в S-G 2 / M(слева)и флуоресценция минус один (FMO) управления Ki67 mAb (справа). Числа представляют проценты ячеек в указанных воротах. (B) Точечные графики FSC-A/SSC-A, показывающие специфические для кляпа CD8 Т-клетки в фазах S-G2/ M (красным цветом), наложенные на общее количество CD3+CD8+ Т-клеток (серым цветом) из LNs (вверху) и селезенки (снизу) вакцинированных мышей. (C) Смещенные гистограммы, показывающие экспрессию CD62L специфическими для кляпа CD8 Т-клетками в G0 (зеленый), в G1 (синий)и в S-G 2 / M (красный) из LNs (вверху) и селезенки (снизу) вакцинированных мышей. Оси Y указывают на нормализованное число событий. На рисунке показан 1 репрезентативный пример из 5 независимых экспериментов с 15 мышами. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный материал: настройки проточного цитометра. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Discussion
Хотя клональное расширение Т-клеток интенсивно изучается, некоторые аспекты остаются неизвестными, главным образом потому, что инструменты, доступные для его исследования, немногочисленны и имеют свои недостатки. С этой точки зрения мы создали высокочувствительный проточный цитометрический метод для анализа клеточного цикла антиген-специфических CD8 Т-клеток на ранних этапах после вакцинации на мышиной модели. Протокол основан на комбинации Ki67 и окрашивания ДНК, которое ранее использовалось для анализа клеточного цикла кроветворных клеток BM у мышей13,14. Чтобы адаптировать протокол к антиген-специфическим CD8 Т-клеткам, нам пришлось рассмотреть несколько критических вопросов, включая выбор красителя ДНК, соответствующие условия для получения сопоставимого окрашивания ДНК в разных образцах и стратегию анализа данных.
Многие красители доступны для окрашивания ДНК, включая йодид пропидия и 7-аминоактиномицин D; мы выбрали Hoechst, потому что он был совместим с окрашиванием мембраны и протоколом мягкой фиксации / пермеабилизации, необходимым для окрашивания Ki67. В то же время окрашивание Хёхстом позволило получить гистограмму ДНК отличного качества, т.е. пики ДНК G0/G1 иG2/Mимели гораздо более низкий коэффициент вариации (CV), чем пики ДНК, обычно получаемые с помощью других ДНК-красителей, например, DRAQ519. Действительно, Хёхст может окрашивать ДНК даже в живых клетках20.
Некоторые стратегии были использованы, чтобы избежать колебаний интенсивности Хёхста в разных образцах одного и того же эксперимента. Окрашивание Hoechst проводилось непосредственно перед получением образца на проточном цитометре, чтобы свести к минимуму снижение интенсивности красителя с течением времени. Для тех, кто заинтересован в воспроизведении протокола в больших экспериментах с многочисленными образцами, мы рекомендуем выполнять окрашивание Hoechst на нескольких образцах одновременно. Еще одним недостатком является то, что интенсивность Hoechst может сильно зависеть от количества клеток во время инкубации с красителем. По этой причине мы настоятельно рекомендуем всегда использовать одинаковое количество клеток и одинаковый объем на образец для окрашивания ДНК. Если для сбора на проточном цитометре требуется большое количество клеток, мы рекомендуем подготовить два или более одинаковых образца, а затем объединить их непосредственно перед этапом окрашивания Hoechst.
Ключевым моментом протокола является стратегия анализа данных. Недавно мы опубликовали новую стратегию анализа Т-клеток на ранних стадиях иммунного ответа, которая позволила нам повысить чувствительность обнаружения антиген-специфических Т-клеток12. Мы применили эту стратегию к данным, показанным здесь следующим образом. Во-первых, мы исключили клеточные агрегаты на графике ДНК-A/W. Во-вторых, после уничтожения мертвых клеток мы использовали довольно большие лимфоцитарные ворота на участке FSC / SSC («расслабленные ворота»). С помощью этой стратегии мы смогли включить высокоактивированные антиген-специфические CD8 Т-клетки в S-G2/ M, которые обычно пропускаются текущими стратегиями гатинга, поскольку эти клетки имеют высокий FSC-A и SSC-A. Таким образом, анализ данных представляет собой критическую часть метода, которая необходима для получения чувствительного обнаружения активированных /пролиферирующих антиген-специфических Т-клеток.
Метод предотвращает возможность пропуска критических данных Т-клеток на ранних стадиях иммунного ответа и открывает новые перспективы для иммуномониторинга Т-клеток. Будущее улучшение может заключаться в том, чтобы включить окрашивание для фосфогистона 3, которое позволит дифференцировать G2 и M21. Текущее ограничение заключается в том, что клетки должны быть зафиксированы и проницаемы для окрашивания ядерного маркера Ki67. Таким образом, клетки не могут быть использованы для других видов анализа, таких как сортировка и последующий функциональный анализ. Более того, красители ДНК, в том числе Hoechst, обычно мешают геномному анализу ДНК и не подходят для этого типа оценки. Идентификация мембранных маркеров, которые коррелируют с различными фазами клеточного цикла и которые могут быть окрашены на живых клетках, может преодолеть это ограничение. В заключение, метод имеет большой потенциал для оценки активированных / пролиферирующих Т-клеток в нескольких контекстах, таких как вакцинация, инфекция, иммуноопосредованные заболевания и иммунотерапия.
Disclosures
А. Фолгори и С. Капоне являются сотрудниками Reithera Srl. A. Никосия названа изобретателем по патентной заявке WO 2005071093 (A3) «Носители аденовирусной вакцины шимпанзе». Другим авторам нечего раскрывать.
Acknowledgments
Эта работа была поддержана Reithera, проектом MIUR 2017K55HLC_006 и грантом 5 × 1000 от Associazione Italiana Ricerca sul Cancro (AIRC). Следующий тетрамер был получен через тетрамерную установку NIH: APC-конъюгированный H-2K (d) ВИЧ-кляп 197-205 AMQMLKETI.
Materials
| Name | Company | Catalog Number | Comments |
| 1-200 μL universal fit bulk packed pipet tips | Corning | CLS4866-1000EA | |
| 2.4G2 anti-FcγR mAb | BD | 553141 | 10 μg/ml final concentration |
| 5 ml syringe plunger | BD Emerald | 307733 | |
| 15 ml conical tubes | MercK Millipore | SBHA025SB | |
| 60 mm TC-treated Cell Culture Dish | Falcon | 353002 | |
| 70 μm cell strainer | Falcon | 352097 | |
| 96-well Clear Round Bottom TC-treated Culture Microplate | Falcon | 353077 | |
| Anti-Rat/Hamster Ig,k/Negative Control Compensation Particles | BD- Bioscience | 552845 | |
| Beta-mercaptoethanol | Sigma | M3148 | |
| Bovine Serum Albumin | Sigma | A07030 | |
| BUV805 Rat Anti-Mouse CD8a | BD- Bioscience | 564920 | 4 μg/ml final concentration |
| Dulbecco's Phosphate Buffer Saline w/o Calcium w/o Magnesium | Euroclone | ECB4004L | |
| Eppendorf Safe-Lock Tubes, 1.5 mL | Eppendorf | 30120159 | |
| Ethanol | Sigma | 34852-1L-M | |
| Ethylenediaminetetraacetic Acid Disodium Salt solution (EDTA) | Sigma | E7889 | |
| Fetal Bovine Serum | Corning | 35-079-CV | |
| Filcon, Sterile, Syringe-Type 70 μm | Falcon | 352350 | |
| Fixable Viability Dye eFluor 780 | eBioscience | 65-0865-14 | 1:1000 final concentration |
| Foxp3 / Transcription Factor Staining Buffer Set | eBioscience | 00-5523-00 | This Set contains fixation/permeabilization concentrate and diluent, and permeabilization buffer 10x |
| H-2k(d) AMQMLKETI allophycocyanin (APC)-labelled tetramer | provided by NIH Tetramer Core Facility | 6 μg/ml final concentration | |
| H-2k(d) AMQMLKETI phycoerythrine (PE) labelled pentamer | Proimmune | F176-2A-E - 176 | 10 μL / sample |
| Hoechst 33342, Trihydrochloride, Trihydrate - 10 mg/mL Solution in Water | ThermoFisher | H3570 | |
| Ki-67 Monoclonal Antibody (SolA15), FITC | eBioscience | 11-5698-82 | 5 μg/ml final concentration |
| L-Glutamine 100X (200 mM) | Euroclone | ECB3000D | |
| Millex-HA Filters 0,45 µm | BD | 340606 | |
| Penicillin/Streptomycin 100X | Euroclone | ECB3001D | |
| PE/Cyanine7 anti-mouse CD62L Antibody | Biolegend | 104418 | 0.2 μg/ml final concentration |
| PerCP-Cy™5.5 Hamster Anti-Mouse CD3e | BD- Bioscience | 551163 | 4.4 μg/ml final concentration |
| Red Blood Cell Lysis Buffer | Sigma | R7757 | |
| Round-Bottom Polystyrene Tubes, 5 mL | Falcon | 352058 | |
| RPMI 1640 Medium without L-Glutamine with Phenol Red | Euroclone | ECB9006L | |
| Software package for analyzing flow cytometry data | FlowJo | v.10 | |
| Software for acquisition of samples at flowcytometer | BD FACSDiva | v 6.2 | |
| Trypan Blue Solution | Euroclone | ECM0990D |
References
- Castellino, F., et al. Chemokines enhance immunity by guiding naive CD8+ T cells to sites of CD4+ T cell-dendritic cell interaction. Nature. 440 (7086), 890-895 (2006).
- Zhang, N., Bevan, M. J. CD8(+) T cells: foot soldiers of the immune system. Immunity. 35 (2), 161-168 (2011).
- Bajénoff, M., et al. Highways, byways and breadcrumbs: directing lymphocyte traffic in the lymph node. Trends Immunology. 28 (8), 346-352 (2007).
- Bevan, M. J., Fink, P. J. The CD8 response on autopilot. Nature Immunology. 2 (5), 381-382 (2001).
- Van Stipdonk, M. J., Lemmens, E. E., Schoenberger, S. P. Naïve CTLs require a single brief period of antigenic stimulation for clonal expansion and differentiation. Nature Immunology. 2 (5), 423-429 (2001).
- Kaech, S. M., Wherry, E. J., Ahmed, R. Effector and memory T-cell differentiation: implications for vaccine development. Nature Review Immunology. 2 (4), 251-262 (2002).
- Beverley, P. C. Primer: making sense of T-cell memory. Nature Clinical Practice Rheumatology. 4 (1), 43-49 (2008).
- Parretta, E., et al. CD8 cell division maintaining cytotoxic memory occurs predominantly in the bone marrow. Journal of Immunology. 174 (12), 7654-7664 (2005).
- Di Rosa, F. Maintenance of memory T cells in the bone marrow: survival or homeostatic proliferation. Nature Review Immunology. 16 (4), 271 (2016).
- Di Rosa, F. Two niches in the bone marrow: a hypothesis on life-long T cell memory. Trends in Immunology. 37 (8), 503-512 (2016).
- Di Rosa, F. Commentary: Memory CD8(+) T cells colocalize with IL-7(+) stromal cells in bone marrow and rest in terms of proliferation and transcription. Frontiers in Immunology. 7, 102 (2016).
- Simonetti, S., et al. Antigen-specific CD8 T cells in cell cycle circulate in the blood after vaccination. Scandinavian Journal of Immunology. 89 (2), 12735 (2019).
- Wilson, A., et al. c-Myc controls the balance between hematopoietic stem cell self-renewal and differentiation. Genes & Development. 18 (22), 2747-2763 (2004).
- Hirche, C., et al. Systemic virus infections differentially modulate cell cycle state and functionality of long-term hematopoietic stem cells in vivo. Cell Report. 19 (11), 2345-2356 (2017).
- Colloca, S., et al. Vaccine vectors derived from a large collection of simian adenoviruses induce potent cellular immunity across multiple species. Science Translational Medicine. 4 (115), (2012).
- Di Lullo, G., et al. Marker gene swapping facilitates recombinant Modified Vaccinia Virus Ankara production by host-range selection. Journal of Virological Methods. 156 (1-2), 37-43 (2009).
- Di Lullo, G., et al. The combination of marker gene swapping and fluorescence-activated cell sorting improves the efficiency of recombinant modified vaccinia virus Ankara vaccine production for human use. Journal of Virological Methods. 163 (2), 195-204 (2010).
- Mouse phenotype. , Available from: https://www.mousephenotype.org/data/secondaryproject/3i (2020).
- Yoon, H., Kim, T. S., Braciale, T. J. The cell cycle time of CD8+ T cells responding in vivo is controlled by the type of antigenic stimulus. PLoS One. 5 (11), 15423 (2010).
- Pauklin, S., Vallier, L. The cell-cycle state of stem cells determines cell fate propensity. Cell. 155 (1), 135-147 (2013).
- Vignon, C., et al. Flow cytometric quantification of all phases of the cell cycle and apoptosis in a two-color fluorescence plot. PLoS One. 8 (7), 68425 (2013).
Tags
Иммунология и инфекция выпуск 167 антиген-специфические CD8 Т-клетки клеточный цикл Ki67 краситель ДНК проточная цитометрия селезенка лимфатические узлы мышьErratum
Formal Correction: Erratum: A DNA/Ki67-Based Flow Cytometry Assay for Cell Cycle Analysis of Antigen-Specific CD8 T Cells in Vaccinated Mice
Posted by JoVE Editors on 11/03/2021.
Citeable Link.
An erratum was issued for: A DNA/Ki67-Based Flow Cytometry Assay for Cell Cycle Analysis of Antigen-Specific CD8 T Cells in Vaccinated Mice. The Authors section and a figure were updated.
The authors section was updated from:
Sonia Simonetti*1,2, Ambra Natalini*1,2, Giovanna Peruzzi3, Alfredo Nicosia4, Antonella Folgori5, Stefania Capone5, Angela Santoni2, Francesca Di Rosa1
1Institute of Molecular Biology and Pathology, National Research Council of Italy (CNR),
2Department of Molecular Medicine, University of Rome “Sapienza”,
3Center for Life Nano Science, Istituto Italiano di Tecnologia,
4Department of Molecular Medicine and Medical Biotechnology, University of Naples Federico II,
5Reithera Srl
* These authors contributed equally
To:
Sonia Simonetti*1,2, Ambra Natalini*1,2, Giovanna Peruzzi3, Alfredo Nicosia4, Antonella Folgori5, Stefania Capone5, Angela Santoni2,6, Francesca Di Rosa1
1Institute of Molecular Biology and Pathology, National Research Council of Italy (CNR),
2Department of Molecular Medicine, University of Rome “Sapienza”,
3Center for Life Nano Science, Istituto Italiano di Tecnologia,
4Department of Molecular Medicine and Medical Biotechnology, University of Naples Federico II,
5Reithera Srl
6IRCCS, Neuromed
* These authors contributed equally
Figure 1 was updated from:
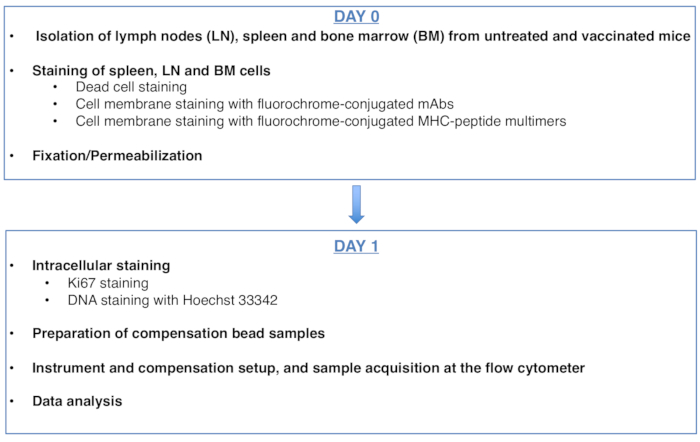
Figure 1: Scheme of the protocol for cell cycle analysis of antigen-specific CD8 T cells. Please click here to view a larger version of this figure.
To:
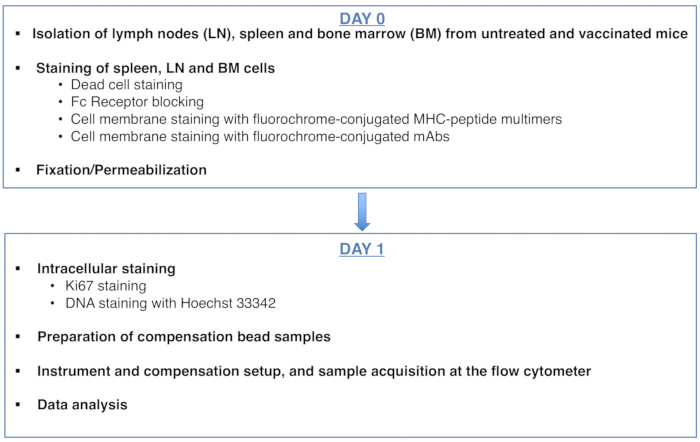
Figure 1: Scheme of the protocol for cell cycle analysis of antigen-specific CD8 T cells. Please click here to view a larger version of this figure.



