Summary
La microestrazione a fase solida di vaporizzazione totale (TV-SPME) vaporizza completamente un campione liquido mentre gli aliti vengono assorbiti su una fibra SPME. Ciò consente di partizionare l'alita solo tra il vapore solvente e il rivestimento in fibra SPME.
Abstract
Gas Cromatografia - La Spettrometria di Massa (GC-MS) è una tecnica frequentemente utilizzata per l'analisi di numerosi aliti di interesse forense, tra cui sostanze controllate, liquidi infiammabili ed esplosivi. GC-MS può essere accoppiato con la microesportione a fase solida (SPME), in cui una fibra con un rivestimento sorptivo viene posizionata nello spazio della testa sopra un campione o immersa in un campione liquido. Gli aliti vengono assorbiti sulla fibra che viene quindi posta all'interno dell'ingresso GC riscaldato per il desorbimento. Total Vaporization Solid-Phase Microextraction (TV-SPME) utilizza la stessa tecnica dell'immersione SPME ma immerge la fibra in un estratto di campione completamente vaporizzato. Questa completa vaporizzazione si traduce in una partizione tra solo la fase di vapore e la fibra SPME senza interferenze da una fase liquida o da qualsiasi materiale insolubile. A seconda del punto di ebollizione del solvente utilizzato, TV-SPME consente grandi volumi di campioni (ad esempio, fino a centinaia di microlitri). La derivazione on-fiber può essere eseguita anche utilizzando TV-SPME. TV-SPME è stato utilizzato per analizzare i farmaci e i loro metaboliti nei capelli, nelle urine e nella saliva. Questa semplice tecnica è stata applicata anche a droghe di strada, lipidi, campioni di carburante, residui esplosivi post-esplosione e inquinanti nell'acqua. Questo documento evidenzia l'uso di TV-SPME per identificare adulteranti illegali in campioni molto piccoli (quantità di microliter) di bevande alcoliche. Sia il gamma-idrossibutirrato (GHB) che il gamma-butyrolattone (GBL) sono stati identificati a livelli che si sarebbero trovati nelle bevande a spillo. La derivazione da parte di un agente trimetilsilil permise la conversione della matrice acquosa e del GHB nei loro derivati TMS. Nel complesso, TV-SPME è facile, veloce e non richiede alcuna preparazione del campione oltre a posizionare il campione in una fiala headspace.
Introduction
La microesportazione a fase solida (SPME) è una tecnica di campionamento in cui un campione liquido o solido viene posto in una fiala headspace e una fibra SPME, rivestita con un materiale polimerico, viene quindi introdotta nello spazio della testa del campione (o immersa in un campione liquido). L'alita viene assorbito sulla fibra e quindi la fibra viene posta all'interno dell'ingresso GC per il desorbimento1,2. La microestrazione a fase solida di vaporizzazione totale (TV-SPME) è una tecnica simile a quello dell'immersione SPME, ma vaporizza completamente un campione liquido prima che gli aliti siano adsorbiti sulla fibra. Ciò consente di partizionare l'alita solo tra il vapore solvente e il rivestimento della fibra, consentendo di adsorbire più dell'alita sulla fibra e con conseguente buona sensibilità3. Sono disponibili varie fibre SPME e la fibra deve essere scelta in base all'alita di interesse, solvente / matrice e agente di derivazione. Cfr. tabella 1 per gli aliti TV-SPME consolidati.
| campione | Aaliti | Fibra SPME consigliata | Riferimenti |
| Capelli umani | Nicotina, cotinina | Polidimetilsilossano/diviniilbenzene (PDMS/DVB), poliacrilato (PA) | 3 |
| Polvere senza fumo | Nitroglicerina, difenilammina | Polidimetilsilossano (PDMS), polietilene glicole (PEG) | 7, 8 |
| Carburante da corsa | Metanolo, nitrometano | piolo | 9 |
| Acqua | Idrocarburi aromatici policiclici | Pdms | 10 |
| bevande | ɣ-idrossibutirrico, ɣ-butirrolattone | Pdms | Questo lavoro |
| Polvere solida | Metanfetamina, anfetamina | PDMS/DVB | inedito |
La tabella 1. Fibre SPME consigliate con aliti TV-SPME affermati.
Per eseguire TV-SPME, gli aliti vengono sciolti in un solvente e un'aliquota di questa miscela viene posta in una fiala headspace. I campioni non devono essere filtrati perché solo il solvente e gli aliti volatili vaporizzeranno. Per garantire la vaporizzazione totale del campione devono essere utilizzati volumi specifici di campioni liquidi. Questi volumi sono determinati usando la legge del gas ideale per calcolare il numero di talpe di un solvente moltiplicato per il volume molare del liquido (Equazione 1). Equazione 1
Equazione 1
dove Vo è il volume del campione (mL), P è la pressione di vapore del solvente (bar), Vv è il volume del flaconcino (L), R è la costante di gas ideale (0,083145), M è la  massa molare del solvente (g/mol), T è temperatura (K), ed
massa molare del solvente (g/mol), T è temperatura (K), ed  è la densità del solvente (g/mL). 3 la commissione per i
è la densità del solvente (g/mL). 3 la commissione per i
Per usare la pressione di vapore corretta, l'equazione di Antoine (Equazione 2) è usata per tenere conto dell'influenza della temperatura:4 Equazione 2
Equazione 2
dove T è temperatura e A, B e C sono le costanti di Antoine per il solvente. L'equazione 2 può essere sostituita nell'equazione 1, producendo: Equazione 3
Equazione 3
L'equazione 3 fornisce il volume del campione (Vo) che può essere completamente vaporizzato in funzione della temperatura e del solvente utilizzato.
Per eseguire la derivazione con TV-SPME, la fibra SPME viene prima esposta a un flaconcino contenente l'agente di derivazione per un periodo di tempo predeterminato a seconda dell'anale. La fibra SPME viene quindi esposta a una nuova fiala contenente l'anale di interesse. Questa fiala viene riscaldata all'interno di un agitatore riscaldato. L'alita viene quindi adsorbito sulla fibra con l'agente di derivazione. La derivazione dell'alita e/o della matrice avviene sulla fibra prima di essere inserita nell'ingresso GC per il desorbimento. La figura 1 mostra una rappresentazione del processo TV-SPME con derivazione.

Figura 1: Rappresentazione del processo TV-SPME con derivazione. La fibra SPME entra prima nel flaconcino di derivazione dove l'agente di derivazione (cerchi gialli) si assorbe sulla fibra. La fibra viene quindi introdotta nel campione (cerchi blu) e riscaldata. La formazione della derivata (cerchi verdi) avviene sulla fibra durante il tempo di estrazione. Clicca qui per visualizzare una versione più grande di questa figura.
TV-SPME è utile perché consente di derivare l'alita durante il processo di estrazione, riducendo i tempi di analisi. Altri metodi, come l'iniezione di liquido, richiedono che l'alita reagisca con l'agente derivatista in soluzione prima di essere iniettato nel GC. TV-SPME richiede anche poca o nessuna preparazione del campione. Una matrice contenente un anale può essere posizionata direttamente nel flaconcino dello spazio di testa e analizzata. Molti composti di interesse sono compatibili con TV-SPME. I composti devono essere solubili in un solvente e sufficientemente volatili da consentire la vaporizzazione. Inoltre, i composti devono essere termicamente stabili per essere analizzati da GC-MS. TV-SPME è stato utilizzato per analizzare farmaci e metaboliti di farmaci, carburanti da corsa, idrocarburi aromatici policiclici e materiali esplosivi3,5,6,7,8,9,10.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Preparazione generale del campione TV-SPME e analisi GC-MS
NOTA: se il campione è già sciolto in una matrice, passare al passaggio 1.2.
- Estrarre o sciogliere il campione solido in un solvente sufficiente (acqua, metanolo, acetone, ecc.) per raggiungere la concentrazione desiderata. I campioni liquidi possono essere utilizzati "così com'è".
NOTA: La quantità di campione solido utilizzato dipende dalla concentrazione desiderata del campione. Si raccomandano concentrazioni inferiori a 1 ppm (w/v) per evitare di sovraccaricare la colonna GC. L'alita deve essere solubile nel solvente organico scelto.- Assicurarsi che il campione si sia completamente sciolto.
- Calcolare il volume necessario per vaporizzare completamente il campione utilizzando l'equazione 3 alla temperatura scelta. Ad esempio, se l'esperimento deve essere eseguito a 60 °C, calcolare il volume necessario per vaporizzare completamente il solvente a 60 °C.
- Trasferire questo volume del campione in una fiala headspace e fissare il cappuccio. I metodi accettabili per il trasferimento di campioni liquidi su scala microliter includono manualmente tramite siringa di vetro, una siringa elettronica di vetro o un robot autocampionatore in grado di trasferimenti liquidi per la preparazione del campione.
- Se si deriva il campione, preparare l'agente di derivazione corretto posizionando ~1 mL dell'agente in una fiala dello spazio di testa.
- Scegliere l'agente di derivazione in base al tipo di derivazione necessaria: alchilazione, acilazione o silinazione. In questo caso, l'agente di derivazione raccomandato per i gruppi funzionali di acido carbossilico e alcol trovato su GHB è O-bis (trimetilsilil) trifluoroacetamide (BSTFA). L'agente di derivazione può essere utilizzato "così com'è" e non richiede diluizione. Un mL di agente di derivazione è sufficiente per garantire la completa saturazione della fibra SPME.
ATTENZIONE: Gli agenti di derivazione sono tossici e devono essere maneggiati in una cappa aspirante.
- Scegliere l'agente di derivazione in base al tipo di derivazione necessaria: alchilazione, acilazione o silinazione. In questo caso, l'agente di derivazione raccomandato per i gruppi funzionali di acido carbossilico e alcol trovato su GHB è O-bis (trimetilsilil) trifluoroacetamide (BSTFA). L'agente di derivazione può essere utilizzato "così com'è" e non richiede diluizione. Un mL di agente di derivazione è sufficiente per garantire la completa saturazione della fibra SPME.
- Impostare la temperatura di incubazione/estrazione corretta in base al calcolo del passaggio 1.2. Questa temperatura garantisce la vaporizzazione totale, l'estrazione sufficiente del campione e la completa derivazione (se necessario).
- Selezionare i parametri GC-MS (programma di temperatura del forno, portata, temperatura di ingresso, ecc.) in base alla classe dei composti di interesse. Vedere il passaggio 3 per un set di parametri di esempio.
- Assicurarsi che il rivestimento di ingresso corretto (ad esempio, 2 mm di diametro interno o meno) sia nell'ingresso GC.
- Assicurarsi che la fibra SPME sia stata adeguatamente condizionata ed è in buone condizioni di lavoro prima di iniziare l'analisi.
- Variare i parametri di condizionamento in base al tipo di fibra SPME utilizzata. Si prega di consultare le istruzioni in fibra SPME per una corretta temperatura e tempo di condizionamento. In generale, l'analisi di diversi spazi vuoti in fibra SPME fino a quando non sono riproducibili è sufficiente per caratterizzare una fibra SPME come completamente condizionata.
2. Preparazione del campione di gamma-idrossibutirrato (GHB) e Gamma-butyrolactone (GBL)
- Preparare un campione di GHB e/o GBL in acqua con una concentrazione inferiore a 1 ppm.
- Trasferire 1 μL di questo campione su una fiala headspace da 20 mL utilizzando uno dei metodi descritti al punto 1.2.1.
- Si noti che l'analisi dei campioni acquosi richiede i volumi di campioni più bassi. Ad esempio, un μL di acqua vaporizzerà completamente in una fiala headspace da 20 mL a 60 °C.
- Limitare immediatamente la fiala.
- Posizionare ~1 mL di BSTFA + 1% di trimeticlorosilano (TMCS) in una fiala e un cappuccio separati dello spazio di testa da 20 mL.
NOTA: GBL non deriva. Tuttavia, è ancora necessario un passaggio di derivazione per garantire che il solvente d'acqua si dia una derivazione e non interferisca con il campione.
ATTENZIONE: BSTFA è tossico e deve essere maneggiato in una cappa aspirante.
3. Parametri GC-MS e configurazione per GHB e GBL in acqua
- Creare un metodo utilizzando i seguenti parametri GC-MS:
Temperatura iniziale del forno: 60 °C trattenuti per 1 minuto.
Programma forno: 15 °C/minuto.
Temperatura finale del forno: 280 °C, trattenuta per 1 minuto.
Portata: 2,5 mL/minuto (flusso ottimizzato per la velocità per una colonna i.d. da 0,25 mm).
Temperatura di ingresso: 250 °C.
Temperatura della linea di trasferimento: 280 °C. - Assicurarsi che all'interno dell'ingresso GC sia stato posizionato un rivestimento di ingresso SPME stretto (2 mm i.d. o meno).
- Assicurarsi che la fibra SPME PDMS/DVB sia stata adeguatamente condizionata ed è in buone condizioni prima dell'analisi.
NOTA: Le fibre SPME PDMS/DVB devono essere condizionate nell'ingresso GC a 250 °C per 30 minuti. Le fibre SPME PDMS/DVB devono essere di colore bianco sconto. - Eseguire gc-ms nell'esempio.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
È stato eseguito uno studio sul volume GBL per dimostrare la sensibilità di TV-SPME rispetto allo spazio della testa e all'immersione SPME. Un campione da 100 mv di GBL in acqua è stato preparato e collocato in flaconcini headspace da 20 mL con volumi di 1, 3, 10, 30, 100, 300, 1000, 3000 e 10.000 μL. Il rapporto di fase dei campioni consentito per TV-SPME (1-3 μL), Headspace SPME (10 – 3.000 μL) e Immersion SPME (10.000 μL). Tutti i campioni sono stati analizzati in triplice copia e l'area media di picco è stata tracciata rispetto al volume del campione. Nel complesso, i volumi di campioni consentiti per TV-SPME hanno dimostrato una maggiore sensibilità rispetto all'headspace o all'immersione spme per GBL in acqua, come mostrato nella figura 2. Un confronto dei cromatogrammi per ciascun metodo è illustrato nella figura 3.

Figura 2: Grafico dell'area di picco media rispetto al volume del campione per il GBL nell'acqua. È stato eseguito uno studio sul volume GBL per dimostrare l'efficacia di TV-SPME rispetto allo spazio della testa e all'immersione SPME. Un campione da 100 mv di GBL in acqua è stato preparato e collocato in flaconcini headspace da 20 mL con volumi di 1, 3, 10, 30, 100, 300, 1000, 3000 e 10000 μL. Tutti i campioni sono stati analizzati in triplice copia e le barre di errore corrispondono alla deviazione standard della media. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Cromatogrammi ionici totali per GBL in acqua. (100 ppm) per 3 μL (blu), 300 μL (rosso) e 10.000 μL (verde). Clicca qui per visualizzare una versione più grande di questa figura.
Campioni realistici di vino punte con una dose efficace di GHB e GBL sono mostrati rispettivamente nella figura 4 e nella figura 5. Questi campioni mostrano anche l'interconversione di GBL e GHB. Quando tv-SPME viene eseguito correttamente, si oserà un picco acuto e abbondante, come mostrato nella figura 6. TV-SPME ha una buona sensibilità e quindi dovrebbero essere utilizzate concentrazioni adeguate per non sovraccaricare la colonna. Quando sono presenti concentrazioni elevate, l'asimmetria di picco si tradurrà come mostrato nella figura 5 e nella figura 7. In questi casi, diluire il campione o utilizzare un'iniezione divisa può migliorare la forma del picco.

Figura 4: Campione realistico di GHB nel vino con una concentrazione di 8 mg/mL. Picchi: 1) GBL, 2) acido esanoico-TMS, 3) GHB-TMS2, 4) acido benzoico-TMS, 5) acido ottanoico-TMS, 6) glicerolo-TMS3, * denota un silossano ciclico (sanguinamento fibra/colonna). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Campione realistico di GBL nel vino con una concentrazione di 10 mg/mL. Picchi: 1) GBL, 2) acido esanoico-TMS, 3) Silossano, 4) trimetil(2-feniletossi) silane, 5) GHB-TMS2. TIC mostra la conversione GBL in GHB. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Cromatogramma ionico totale per GBL in acqua con una concentrazione di 0,1 ppm. Risultati che seguono il metodo TV-SPME descritto in precedenza per GBL in acqua. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: Cromatogramma ionico totale per GBL in acqua con una concentrazione di 10 ppm. Risultati che seguono il metodo TV-SPME descritto in precedenza per GBL in acqua. Clicca qui per visualizzare una versione più grande di questa figura.
Durante la derivazione, l'analista deve assicurarsi che il metodo consenta di desorbire completamente gli aliti prima di essere desorbiti nel GC. La derivazione parziale può portare ad un picco che rappresenta l'alita derivata e ad un picco che rappresenta l'alita sottoivarizzato. La derivazione parziale si tradurrà anche in una minore sensibilità per l'alita in quanto meno di esso può adsorbirsi sulla fibra.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
TV-SPME ha alcuni vantaggi rispetto al GC di iniezione di liquidi in quanto grandi dimensioni del campione (ad esempio, 100 μL) possono essere utilizzate senza modifiche dello strumento. TV-SPME ha anche alcuni degli stessi vantaggi di headspace SPME. Headspace SPME non richiede alcuna estrazione o filtrazione perché eventuali composti non volatili rimarranno nella fiala dello spazio della testa e non verranno adsorbiti sulla fibra, producendo un campione pulito. Questo metodo aiuta anche ad eliminare gli effetti della matrice a causa di questo essere un sistema a due fasi (spazio di testa e fibra) rispetto a un sistema trifase (campione, spazio di testa e fibra) come spme standard dello spazio di testa. TV-SPME è come l'immersione SPME in quanto l'immersione SPME è anche un sistema in due fasi. Con l'immersione spme, una fibra viene immersa in un campione liquido (tipicamente acquoso) contenente l'alita invece di estrarre l'alita dal suo vapore. TV-SPME si differenzia dall'immersione SPME perché l'immersione SPME richiede una matrice polare/acquosa al fine di generare una forza motrice sufficiente affinché gli aliti lascino la fase di soluzione e lo sorb al rivestimento in fibra. Inoltre, l'IMMERSIONE SPME richiede volumi di campioni molto più grandi (ad esempio, mL).
Molti solventi possono essere utilizzati con TV-SPME tra cui metanolo, acetone, acqua e acetonitrile. Le fibre SPME non devono essere esposte o immerse nel cloroformio in quanto questi solventi possono danneggiare il rivestimento in fibra. Venti flaconcini headspace in vetro a cappuccio a vite mL hanno le migliori prestazioni con i metodi TV-SPME. Si consiglia di utilizzare un autocampionatore con TV-SPME. Mentre molti parametri del metodo TV-SPME possono essere regolati come desiderato, il volume e la temperatura di estrazione corretti devono essere utilizzati per ogni solvente. Il volume del campione e la temperatura di estrazione sono proporzionali tra loro e devono essere regolati di conseguenza. Ad esempio, la temperatura di estrazione di un metodo può essere ridotta, ma anche il volume del campione deve essere ridotto. Questo volume può essere trovato regolando l'equazione 3.
Possono essere apportate modifiche alla procedura di derivazione. La derivazione può essere eseguita prima o dopo l'estrazione, a temperatura ambiente o riscaldata nell'agitatore, esponendo la fibra al vapore dell'agente di derivazione o mediante immersione diretta della fibra nell'agente di derivazione.
Il metodo TV-SPME è limitazioni, tra cui la necessità che i composti siano solubili, termicamente stabili e volatili. TV-SPME richiede costose fibre SPME che possono avere il loro rivestimento spogliato o rotto durante l'analisi. Queste limitazioni sono superate da vantaggi come grandi volumi di campioni rispetto ai volumi di iniezione gc tipici, alta sensibilità e nessuna necessità di filtrazione. TV-SPME è preferito a headspace SPME perché più del campione viene estratto sulla fibra e gli effetti della matrice sono ridotti. TV-SPME è anche preferito all'immersione SPME perché l'immersione SPME consuma molto più campioni rispetto a TV-SPME. TV-SPME consente la derivazione durante il processo di estrazione che riduce i tempi di analisi rispetto a metodi come l'iniezione di liquido che richiedono che l'alita venga derivatizzato prima dell'iniezione. TV-SPME richiede anche poca o nessuna preparazione del campione. TV-SPME è semplice, efficiente e sensibile per l'analisi di un'ampia varietà di campioni, tra cui farmaci, materiali esplosivi e carburanti da corsa.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Gli autori non hanno nulla da rivelare.
Acknowledgments
Questa ricerca è stata sostenuta dal National Institute of Justice (Premio n. 2015-DN-BX-K058 & 2018-75-CX-0035). Le opinioni, i risultati e le conclusioni qui espressi sono quelli dell'autore e non riflettono necessariamente quelli delle organizzazioni di finanziamento.
Materials
| Name | Company | Catalog Number | Comments |
| 10 µL Syringe | Gerstel | 100111-014-00 | |
| BSTFA + 1% TMCS (10 x 1 GM) | Regis Technologies Inc. | 50442882 | |
| eVol XR Sample Dispensing System Kit | ThermoFisher Scientific | 66002-024 | |
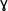 -Butyrolactone (GBL) -Butyrolactone (GBL) |
Sigma-Aldrich | B103608-26G | |
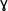 -Hydroxy Butyric Acid (GHB) -Hydroxy Butyric Acid (GHB) |
Cayman Chemicals | 9002506 | |
| Headspace Screw-Thread Vials, 18 mm | Restek | 23083 | |
| Magnetic Screw-Thread Caps, 18 mm | Restek | 23091 | |
| Optima water for HPLC | Fisher Chemical | W71 | |
| SPME Fiber Assembly Polydimethylsiloxane (PDMS) | Supelco | 57341-U | |
| SPME Fiber Assembly Polydimethylsiloxane/Divinylbenzene (PDMS/DVB) | Supelco | 57293-U | |
| Topaz 2.0 mm ID Straight Inlet Liner | Restek | 23313 |
References
- Pawliszyn, J. B. Method and Device for Solid Phase Microextraction and Desorption. United States patent. , (2005).
- Pawliszyn, J. Solid phase microextraction: theory and practice. , John Wiley & Sons. (1997).
- Rainey, C. L., Bors, D. E., Goodpaster, J. V. Design and optimization of a total vaporization technique coupled to solid-phase microextraction. Analytical Chemistry. 86 (22), 11319-11325 (2014).
- Sinnott, R. Chemical Engineering Design: Chemical Engineering. 6, Elsevier. (2005).
- Davis, K. Detection of Illicit Drugs in Various Matrices Via Total Vaporization Solid-Phase Microextraction (TV-SPME). , Indiana University - Purdue University Indianapolis. Master of Science thesis (2019).
- Ash, J., Hickey, L., Goodpaster, J. Formation and identification of novel derivatives of primary amine and zwitterionic drugs. Forensic Chemistry. 10, 37-47 (2018).
- Sauzier, G., Bors, D., Ash, J., Goodpaster, J. V., Lewis, S. W. Optimisation of recovery protocols for double-base smokeless powder residues analysed by total vaporisation (TV) SPME/GC-MS. Talanta. 158, 368-374 (2016).
- Bors, D., Goodpaster, J. Mapping smokeless powder residue on PVC pipe bomb fragments using total vaporization solid phase microextraction. Forensic science international. 276, 71-76 (2017).
- Bors, D., Goodpaster, J. Chemical analysis of racing fuels using total vaporization and gas chromatography mass spectrometry (GC/MS). Analytical Methods. 8 (19), 3899-3902 (2016).
- Beiranvand, M., Ghiasvand, A. Design and optimization of the VA-TV-SPME method for ultrasensitive determination of the PAHs in polluted water. Talanta. 212, 120809 (2020).



