ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Denne protokol demonstrerer robot ultralyd (USA) som et praktisk, omkostningseffektivt og hurtigt alternativ til traditionelle ikke-invasive billedmodaliteter.
Abstract
Almindelige modaliteter til in vivo-billeddannelse af gnavere omfatter positronemissionstomografi (PET), computertomografi (CT), magnetisk resonansbilleddannelse (MRI) og ultralyd (USA). Hver metode har begrænsninger og fordele, herunder tilgængelighed, brugervenlighed, omkostninger, størrelse og brugen af ioniserende stråling eller magnetfelter. Denne protokol beskriver brugen af 3D-robot USA til in vivo-billeddannelse af gnaverens nyrer og hjerte, efterfølgende dataanalyse og mulige forskningsapplikationer. Praktiske anvendelser af robot USA er kvantificering af total nyrevolumen (TKV) samt måling af cyster, tumorer og vaskulatur. Selvom opløsningen ikke er så høj som andre modaliteter, giver robot USA mulighed for mere praktisk dataindsamling med høj gennemstrømning. Desuden kan hjertefunktionen kvantificeres ved hjælp af amerikansk M-mode billeddannelse. Da nyrerne modtager 20% -25% af hjerteproduktionen, er vurdering af hjertefunktionen afgørende for forståelsen af nyrefysiologi og patofysiologi.
Introduction
De mest almindelige modaliteter for in vivo gnaverbilleddannelse omfatter positronemissionstomografi (PET), optisk billeddannelse (OI), computertomografi (CT), magnetisk resonansbilleddannelse (MRI) og ultralyd (USA). Disse teknikker giver in vivo-billeder i høj opløsning, hvilket gør det muligt for efterforskere kvantitativt at vurdere og langsgående følge sygdomsmodeller ikke-invasivt1. Mens hver billeddannelsesmodalitet har begrænsninger, giver de også uvurderlige værktøjer til præklinisk forskning.
Her beskriver undersøgelsen et amerikansk system og præsenterer protokollen til robot- og 3D-gnaverbilleddannelse. Amerikanske bølger produceres af en sonde kaldet en transducer, som typisk holdes håndholdt. Lydbølger reflekteres tilbage, når de interagerer med væv, og ekkoerne rekonstrueres til billeder2. Protokollen beskrevet her vil fokusere på nyre- og hjertebilleddannelse ved hjælp af en robotstyret transducer og ved hjælp af software, der muliggør hurtig 3D-rekonstruktion til kvantitativ vurdering.
Robotic US er en hurtig, pålidelig og ikke-invasiv billeddannelsesmodalitet, der gør det muligt for efterforskere at gennemføre undersøgelser med høj gennemstrømning og langsgående undersøgelser. Sammenlignet med håndholdte amerikanske metoder er den amerikanske robotmetode tidseffektiv, da op til tre dyr kan scannes på få minutter. Høj gennemstrømning til nyremålinger tyder på, at op til 20 mus i timen kan afbildes. Robottransducerne er placeret under de akustiske membraner og bevæger sig uafhængigt af dyret med to frihedsgrader (figur 1A). Dette giver nybegyndere mulighed for at få billeder af høj kvalitet, mens håndholdte amerikanske metoder er mere modtagelige for brugerfejl. Den koblede software muliggør effektiv 3D-nyrerekonstruktion i realtid. Tidligere har magnetisk resonansbilleddannelse (MRI) været en udbredt metode til ikke-invasiv billeddannelse på grund af den fremragende bløddelskontrast, mangel på radioaktivitet og penetrationsdybde. MR kræver dog ofte lange anskaffelsestider og er dyrt at udføre. USA er blevet evalueret som et pålideligt og hurtigere alternativ til MR ved vurdering af total nyrevolumen (TKV)3.
Protocol
Alle trin i denne protokol overholder Mayo Clinic (Rochester, MN) retningslinjer for brug af dyr og er blevet godkendt af Mayo Clinic Institutional Animal Care and Use Committee.
1. Dyremodel
- Få mus fra kommercielle kilder.
BEMÆRK: C57BL/6J (alder = 18 måneder; n = 22 (7 hanner, 15 hunner)) (Materialetabel) og Pkd1(RC/RC) (alder = 18 måneder; n = 9 (3 hanner, 6 hunner))4 blev anvendt til undersøgelsen.
2. Hårfjerning
- Bedøvelse af dyret ved hjælp af fordampet isofluran (2% -3%) i et anæstesikammer. Sørg for, at dyret er tilstrækkeligt anæstesi ved at udføre en tåklemme. Sørg for, at musen trækker vejret med en hastighed på ca. 60-90 vejrtrækninger/min. uden tydelig luftkløftning.
BEMÆRK: Fordampet isofluran blev valgt på grund af evnen til at kontrollere og finjustere dyrets niveau af anæstesi. Isofluran blandet med 100% ilt blev udnyttet. - Brug en elektrisk barbermaskine til at barbere det ønskede hudområde til amerikanske målinger.
BEMÆRK: I denne undersøgelse er fokus på nyre- og hjertemålinger, så dyrets bryst og ryg blev barberet. - Påfør hårfjerningscremen på dyrets barberede hud med en applikator med bomuldsspids. Tør cremen af efter 30-60 s med et tørt køkkenrulle. Fortsæt derefter med at tørre hårfjerningscremerester væk ved hjælp af våde gasbind. Sørg for, at hårfjerningen er afsluttet, inden scanningerne påbegyndes.
BEMÆRK: Eventuelt resterende hår vil forstyrre billedkvaliteten; komplet hårfjerning er afgørende. Det er dog nødvendigt at tørre hårfjerningscremen af inden for et minut for at forhindre skade på dyrets hud. Rester af hårfjerningscreme på dyret kan plette billedmembranen i den amerikanske maskine. Sørg for korrekt rengøring af dyret ved hjælp af våde gasbind.
3. Positionering af dyr
- Tænd for den amerikanske maskine og kontakten til det interne varmeelement til de amerikanske bugter. Tænd for de relevante anæstesiventiler til de tilsvarende amerikanske bugter, der skal bruges.
BEMÆRK: Den amerikanske maskine skal være tændt, før den amerikanske billedbehandlingssoftware startes. - Fyld bugterne med nok vand til at dække membranen. Placer det abethetiserede dyr i næsekeglen.
- Ved hjertemålinger skal dyret placeres i en udsat position og vinkle det ca. 30° til højre.
- Til nyremålinger skal dyret placeres i en lige og liggende stilling. Flad forsigtigt dyrets krop for at minimere luftlommerne mellem dyret og membranen (figur 1B).
BEMÆRK: At køre en finger langs dyrets krop kan fjerne eventuelle luftbobler, der klæber til huden, hvilket vil forstyrre billeddannelsen. Brug vand eller amerikansk saltvandsgel som amerikansk medium; men vand letter den hurtige billeddannelse, der diskuteres her.
4. Ultralydsmålinger
- I den amerikanske billedbehandlingssoftware skal du vælge US Acquisition og lade instrumentet initialisere.
- Nyrebilleddannelse ved hjælp af B-tilstand.
- Angiv et navn til undersøgelsen i den relevante dialogboks.
- Indtast dyre-id'et i den relevante dialogboks.
BEMÆRK: Op til tre dyr kan afbildes sekventielt. - Klik på fanen mærket 3D for at initialisere 3D-scanning.
- Brug live kamerafeedet til at flytte feltet region af interesse (ROI) for at indeholde nyrerne.
BEMÆRK: Størrelsen på investeringsafkastet kan justeres afhængigt af størrelsen på billedmålet. Forøgelse af størrelsen af ROI vil øge scanningstiden lidt (figur 1C). Afhængigt af ROI-størrelsen justerer scanneren automatisk antallet af passager, der kræves for, at transduceren kan scanne hele ROI. - Afhængigt af den ønskede billedtype skal du vælge Linear Array eller Wobbler for at vælge transduceren. Vælg mellem Hurtig scanning eller Optimeret til begge transducere.
BEMÆRK: Lineært array er hurtigere og giver normalt tilstrækkelig billeddannelse. Wobblertransduceren kan bruges, hvis den ikke er i stand til at opnå den ønskede billedkvalitet med det lineære array. Wobblertransduceren bruger en højere frekvensbølgelængde og giver derfor mere definition i billeder. Indstillingen Hurtig scanning erhverver billeder i medium kvalitet uden vejrtrækningskorrektion ved en højere hastighed. Mens indstillingen Optimeret kræver lidt mere tid, giver den bedre billedkvalitet og giver mulighed for vejrtrækningskorrektion. Dette manuskript vil fokusere på at bruge den optimerede lineære array-forudindstilling. - Klik på Live View for at se et live billede af det ønskede visningsområde.
- For at flytte transduceren skal du klikke på den cirkulære Gå til-knap og derefter klikke på det område af musen, der skal afbildes. Brug retningspilene med forudbestemte trinstørrelser til at finjustere transducerpositionen.
- Klik på pilen i siden af vinduet Kontrolpanel for at åbne indstillingsbakken. Klik på Scan Protocol for at åbne scanningsindstillinger.
- Bestem den ideelle brændvidde, og juster skyderne til TGC (time gain compensation) for at ændre billedkontrasten for bedst at se nyrerne. Når du har opnået de ønskede indstillinger, skal du klikke på pilen igen for at lukke indstillingsbakken.
- Tryk på knappen Hent statisk for at starte 3D-scanning.
BEMÆRK: Status for scanningen er angivet via en statuslinje nederst til venstre i softwaren. - Når scanningen er afsluttet, skal du kontrollere billedkvaliteten ved at klikke på den blå downloadpil for at åbne scanningen i Preview-tilstand. Flyt gennem scanningens 3D-rammer ved at trække i den røde pil øverst i vinduet. For at zoome ind eller ud skal du holde Ctrl-tasten nede og bruge rulleknappen på musen.
- Hvis du vil scanne flere dyr, skal du opdatere dialogboksene med dyre-id'et, indtaste de nye id'er og derefter gentage ovenstående trin.
BEMÆRK: Når scanningerne er færdige, skal du tørre dyrene af og returnere dem til deres hjemmebure.
- Hjertebilleddannelse ved hjælp af M-tilstand.
BEMÆRK: M-tilstand er visningen af en ultralydbølge langs en specifik, valgt ultralydslinje.- Klik på fanen M-tilstand for at aktivere hjertebilleddannelse.
BEMÆRK: Der kan kun afbildes ét dyr ad gangen. - Sørg for, at dyret er i den rette position til hjertescanninger (trin 2.2). Flyt ROI til hjertets omtrentlige placering.
- Tryk på knappen Hjertefinder for at finde hjertet. Brug varmekortet til at optimere transducerens placering. Brug den cirkulære Gå til-knap til at flytte transduceren til venstre ventrikel (figur 2A).
- Gå til Live View, og brug pileknapperne til at placere transduceren mellem papillærmusklerne (figur 2B). For at kontrollere, at transduceren er korrekt placeret, skal du se sporingen af den levende M-tilstand (figur 2D).
- Når transduceren er i den rigtige position, skal du klikke på Hent sekvens. Klik på den blå downloadpil for at se den afsluttede scanning.
- Klik på fanen M-tilstand for at aktivere hjertebilleddannelse.
5. Nyreanalyse (analysemekanik)
- Åbn fanen Billedanalyse, og vælg knappen Indlæs lydstyrke (er) for at indtaste billedfilerne / mapperne.
- Segmentering
- Flyt de farvede linjer, der repræsenterer forskellige planer for at finde nyren i alle flyene.
- Klik på Tilføj for at tilføje en ny segmentering. Angiv et markeringsnavn til filen.
- Brug Surface Cut-knappen til at tilføje punkter rundt om den ydre kant af nyrerne i flere planer. Klik på Anvend for at generere segmentering gennem hele nyren (figur 3A).
- Rul gennem de forskellige rammer i hvert plan, og rediger eventuelle unøjagtige regioner ved at klikke på Rediger og trække punkterne til den rigtige placering.
- Alternativt, hvis nyren er uregelmæssig i form, skal du bruge Draw-funktionen til at skabe et uregelmæssigt formet spor omkring nyren. Klik enten på punkter rundt om kanten, eller hold venstre klik nede for at tegne sporet i frihånd.
- For at fuldføre sporet med knappen Draw skal du højreklikke med musen. Rul flere billeder fremad, og gentag sporingsprocessen.
- Gentag, indtil rammerne spores i hele interesseområdet.
- Hvis funktionen Draw bruges, skal du vælge Udfyld mellem udsnit for at kontrollere og justere sporingen. Klik på Initialiser for at se en forhåndsvisning. Hvis forhåndsvisningen er acceptabel, skal du klikke på Anvend. Hvis ikke, skal du klikke på Annuller og ændre sporingerne.
BEMÆRK: Knappen Slet tillader sletning af et område inden for et spor. Knappen Glat udglatter de takkede kanter af et spor. - Når billedanalysen er tilfredsstillende, skal du vælge Gem for at gemme analysen i den oprindelige billedfil.
- Måling
- Brug funktionen Calipers til at måle funktioner i billedet. Klik på knappen Calipers , og venstreklik på de to punkter i den afstand, der skal måles (figur 3B).
- Gem målingen ved at klikke på diskknappen øverst på skærmen.
- Segmentering
6. Hjerteanalyse
- Vælg Indlæs diskenheder for at indtaste den eller de filer, der skal analyseres.
- Vælg indstillingen Tilføj .
- Brug værktøjet Point Placement til at spore systolen og diastolen for hvert lag af hjertevæv. Fortsæt med de andre lag af hjertevæv. Brug funktionen Rediger til at ændre sporene (figur 2C,D).
BEMÆRK: Hvis M-tilstandssporingen er meget tydelig, skal du bruge knappen Tilføj (automatisk) til automatisk at generere sporinger af hvert lag. - Vælg Anvend for at beregne hjerteparametrene. Se fanen Kvantificer, og vælg Eksportér statistik for at eksportere alle data som en *.csv-fil (figur 2E).
Representative Results
Resultater af nyreanalyse
Overfladeareal og volumendata erhverves fra segmenteringen af nyrerne. Disse oplysninger kan bruges til at sammenligne eksperimentelle modeller og kontrolmodeller eller spore ændringer over tid. Kaliperværktøjet er nyttigt til hurtigt at måle abnormiteter (dvs. cyster, tumorer), og hvordan de ændrer sig i længde over tid. Figur 3 antyder, at både segmenterings- og tykkelsesmetoderne kan bruges til at måle cystevolumener nøjagtigt. Figur 4 viser en klar forskel i total nyrevolumen (TKV) mellem aldersmatchet kontrol og eksperimentelle (Pkd1RC/RC) mus. 3D-visualisering af disse volumengengivelser kan udføres i systemet, herunder rotationer inden for 3D-rum (figur 5). Disse 3D-rekonstruktioner bruges derefter til at beregne TKV (mm3; Figur 4) samt individuelt stort cystevolumen.
Resultater af hjerteanalyse
Mange nyttige parametre erhverves fra analysen af M Mode-billeder. Disse data giver et godt øjebliksbillede af den venstre ventrikulære (LV) hjertefunktion på det tidspunkt. Dataudgangen inkluderer LV intern diameter, LV bageste væg, LV forreste vægdiameter, udstødningsfraktion, fraktioneret forkortelse, slagvolumen, puls, hjerteudgang, LV-volumen og LV-masse. Succesen med hjerteanalyse er afhængig af nøjagtig segmentering af lagene på M Mode-billedet. De fleste kardiovaskulære resultater beregnes af de øverste systoliske og diastoliske faser af de bageste og forreste endokardielle lag. Det bageste epikardielag fremstår lyst hvidt og følger et lignende mønster som det bageste endokardielle lag. Sporingen for det bageste endokardielag skal placeres på den laveste kontur. Det forreste endokardielle lag skal spores langs den højeste kontur af dette lag. Det forreste epikardiallag fremstår lineært i bunden af billedet på grund af dyrets tilbøjelige placering (figur 2D). Figur 6 viser et eksempel på en undersøgelse uden signifikant forskel i hjerteudgang mellem forsøgs- og kontrolmus. Som med nyrebilleddannelse er 3D-hjertevisualisering mulig. Ikke desto mindre giver en 4D-visualisering af hjertecyklussen (supplerende figur 1) efterforskeren mulighed for at visualisere og lokalisere både morfologiske og cyklusdynamiske abnormiteter hos det vurderede dyr.
Morfologi vurdering
For hurtig og billig vurdering kan USA effektivt overvåge fysiologiske parametre i længderetningen. Imidlertid ønsker mange undersøgelser yderligere at bestemme finere morfologiske egenskaber, f.eks. Antal og størrelser af cyster, forkalkninger (nyresten), vaskularisering eller grad af fibrose. Figur 7 sammenligner en normal musenyre med en cystisk musenyre med en moderat forkalket musenyre. Ved at øge den amerikanske centerfrekvens (10 MHz med det lineære array) til 35 MHz (wobblerforstærker) kan der opnås billeder med stigende detaljer.

Figur 1: Ultralydssystem og museplacering. (A) Diagram over ultralydssystem og placering af transducere. (B) Visning af mus i liggende stilling på ultralydsplatform. (C) Eksempel på interesseområder (ROI)'er, der er på plads for interesseområde (nyrer) med dyre-id'er. Klik her for at se en større version af denne figur.

Figur 2: Hjerte ultralydsbilleddannelse for at opnå fysiologiske parametre. (A) Brug af Heart Finder heatmap-billedet til at placere transduceren i venstre ventrikel til M-Mode-billeddannelse. Transducerens placering i venstre ventrikel er angivet med den store grønne prikke. (B) Visning af transduceren, når den placeres korrekt over papillære muskler (prikket kasse). (C) Eksempel på visning af lag, der er nødvendige for at måle hjerteparametre. (D) Visning af levende M-Mode-billede med lag, der er angivet som i panel C. (Lag fra top til bund: bageste epikardielle, bageste endokardielle, forreste endokardielle og forreste epikardielle.) (E) Eksempel på output af statistikker genereret fra hjertemålinger. Klik her for at se en større version af denne figur.

Figur 3: Brug af segmenterings- og kaliperværktøjer til måling af nyrer og cyster. (A) Eksempelsegmenteringer (aksial visning) af både nyrer (blå og orange skygge) og en stor cyste (gul) med volumener anført nedenfor. Ikke-segmenterede visninger vises nedenunder, så det ikke-skjulte USA kan ses. (B) Eksempel på brug af kalibre til måling af den samme cyste (sagittal visning) fra figur 3A med målinger nedenfor. Volumenet blev beregnet ved hjælp af formlen for en ellipse (volumen = (4/3) π x a x b x c, hvor a, b, c er relative x, y, z, henholdsvis). Klik her for at se en større version af denne figur.

Figur 4: TKV-fordelinger af WT og cystiske musenyrer. Repræsentation af TGV'er for vildtype (WT) (C57BL/6J) og syge (Pkd1RC/RC) mus. n = 22 (WT) n = 9 (Pkd1RC/RC); Resultater af to-halet t-test: p < 0,0001. Boksen viser 25-75. percentilværdier, og whiskers viser 1,5 gange interkvartilområdet. Klik her for at se en større version af denne figur.

Figur 5: Animeret 3D-rekonstruktion af segmenterede nyrer og cyster. Ved hjælp af softwaren kan 3D-fremspringene af nyrerne og cysten roteres eller vippes i 3D-rummet (blå = venstre nyre; gul = stor cyste; orange = højre nyre). Klik her for at downloade denne figur.

Figur 6: Hjertefysiologiske parametre fra amerikanske målinger. Repræsentation af hjerteudgang (ml/min) for WT og syge (Pkd1RC/RC) mus. n = 22 (WT) n = 9 (Pkd1RC/RC). De lavere tabulerede data viser, at der ikke er nogen signifikant forskel for disse to grupper i udstødningsfraktion, slagvolumen, puls (HR) eller hjerteudgang (CO). Resultater af to-halet t-test: p > 0,05. Boksen viser 25-75. percentilværdier. Klik her for at se en større version af denne figur.

Figur 7: Sammenligning af amerikanske sagittale sektioner af normale og to patologier. (A) Vildtype (C57BL/ 6J stamme) nyre (TKV = 143.202 mm3). (B) Cystisk nyre med øget TKV (Pkd1RC/RC-mus ) (TKV = 333,158 mm3). Cyster er angivet med gule pile. (C) Nyre med vaskulære forkalkninger (Model = Lipoproteinreceptormangel med lav densitet, Apolipoprotein B100-eneste mus fodret med en vestlig diæt i 12 måneder5) (TKV = 127.376 mm3). Renal sten er angivet med grønne pile. Klik her for at se en større version af denne figur.
Supplerende figur 1: 4D hjertecyklusfilm fra amerikanske målinger. Ved hjælp af softwaren fanges en repræsentation af det bankende hjerte i 3D USA og projiceres gennem hjertecyklussen. Den grønne pil angiver aortaklappen. (Model = Lipoproteinreceptormangel med lav densitet, Apolipoprotein B100-eneste mus, fodret med en vestlig diæt i 12 måneder5). Denne model genererer vaskulære forkalkninger, der muliggør lettere visualisering af hjertet og ventilerne på grund af den større akustiske reflektivitet af forkalkningerne i USA. Lignende 4D-rekonstruktioner er mulige med WT-mus; den fangede akustiske kontrast vil dog ikke være så høj. Klik her for at downloade denne fil.
Discussion
Ultralyd bruger lydbølger, og eventuelle barrierer for udbredelse af lydbølger vil forstyrre billedkvaliteten. Således er fuldstændig hårfjerning af det område, der skal afbildes, kritisk. Det er også vigtigt at sikre fuldstændig fjernelse af hårfjerningscreme, da det kan forårsage forbrændinger/irritation af dyrets hud og misfarve scannerens gennemsigtige membran. Tilstrækkelig vandstand i bugterne er nødvendig for optimal lydbølgeudbredelse, hvilket er nødvendigt for at opnå den højeste billedopløsning. Når dyret er i en udsat position, skal du dog sikre, at dyrets snud er over vandstanden, eller at dyret er i fare for vandindånding. Optimering af billedparametre, især brændvidde, er afgørende for at opnå billeder af høj kvalitet. Ændringer af parametre kan være nødvendige for de enkelte dyr.
Robotic US giver mange fordele i forhold til traditionelle håndholdte amerikanske modaliteter. For det første bruger systemet en simpel peg-og-klik-kamerabaseret grænseflade. Denne funktion adresserer kompleksiteten af konventionelle USA og producerer konsistente data, selv når de betjenes af en nybegynderbruger6. For det andet tillader systemet brugen af vand i stedet for traditionel amerikansk gel som et akustisk medium. Tidligere tillod brugen af amerikansk gel dannelsen af bobler, der forstyrrede kvalitetsbilledoptagelse. Også den amerikanske gel er rodet og giver udfordringer til oprydning. Endvidere opvarmes vandet af varmelampen og hjælper med at opretholde dyrets kropstemperatur. For det tredje er robot-USA hurtigere, så artefakter fra åndedrætsbevægelse er ikke problematiske. Den øgede billedhastighed giver mulighed for praktisk gennemførelse af dataindsamling med høj kapacitet. For det fjerde opnår robot-USA 3D-billeder og gør derfor 3D-rekonstruktion af objekter enkel (figur 4). MR og andre modaliteter er dyre, tidskrævende og ikke altid tilgængelige. Det er vigtigt, at det amerikanske robotsystem passer på et bord eller en bænk og er mere omkostningseffektivt. Endelig viste tidligere arbejde, at robot-USA kunne levere sammenlignelige måledata med dyrere modaliteter, såsom MR3.
Mens billedkvaliteten og opløsningen af det amerikanske robotsystem, der er beskrevet i dette arbejde, var tilstrækkelig til den foreslåede applikation (figur 7), er der flere måder, hvorpå billedkvaliteten kan forbedres i fremtiden. For eksempel vil brug af transducere med højere frekvens (f.eks. 50-70 MHz) resultere i billeder med højere opløsning med bedre funktionsdefinition. Mens udnyttelse af højere frekvenser ville resultere i en dårligere dybde af penetration, bør billederne være tilstrækkelige til in vivo-billeddannelse af overfladiske organer, såsom musens nyre. Som med andre billeddannelsesmetoder kan kontrastmidler anvendes til at forbedre specifikke funktioner. For USA betyder det typisk at bruge noget, der i høj grad reflekterer lydbølger. Intravaskulære mikrobobler, hvor lipider omgiver meget små gasbobler, er et sådant middel. Gasboblerne i mikronstørrelse er meget reflekterende og giver således et andet tydeligt signal, der oversættes til en høj opløsning af vaskulatur7. Selvom denne akustiske kontrastteknik kan være ganske nyttig, kan den have flere ulemper. For det første skal mikroboblerne laves friske og kun fortsætte in vivo i 5-10 minutter. For det andet kræver in vivo intravaskulær injektion typisk haleslørkateterisering til injektion, og dette kan være teknisk udfordrende. Under visse omstændigheder og pulserende regimer kan mikroboblebilleddannelse i sig selv føre til skade på nyrevaskulaturen8.
Der er også nogle mere generelle begrænsninger for det særlige amerikanske system, der anvendes. For det første er kun et lineært array (centreret ved 18 MHz) inkluderet i robotchassiset, så det er i øjeblikket ikke muligt at skifte til sonder med højere eller lavere frekvens. Dette kan påvirke bredden af modeller (enten større eller mindre), der kan evalueres med systemet. Fremtidige iterationer af instrumentet bør omfatte flere lineære arrays for at dække hele spektret af prækliniske dyremodeller. For det andet kan transducervinklen i forhold til dyreforsøgspersonen ikke kontrolleres. Derfor kræver udførelse af vinkelafhængige billeddannelsesteknikker, såsom Doppler, eller opnåelse af alternative in-plane visninger af visse organer (f.eks. Langaksevisning af nyre) omplacering af dyret og kan være vanskeligt at opnå. Yderligere frihedsgrader kan føjes til robotbevægelsen for at afhjælpe denne udfordring. For det tredje har vi lejlighedsvis observeret efterklangsartefakter, der stammer fra den akustiske membran, der adskiller dyret fra transduceren, der kan skjule visualisering af overfladiske træk og grænser. I disse tilfælde kan brug af en gel standoff til at hæve dyret væk fra membranen afhjælpe situationen. Endelig er temperaturregulering via varmelampe upræcis, og derfor skal der lægges stor vægt på dyrets kropstemperatur under billeddannelsen. Mere kontrollerede opvarmningsmekanismer, såsom en integreret varmepude, vil sandsynligvis forbedre homeostasestyring og billeddannelsesgennemstrømning.
Brugen af robot-USA kan være anvendelig på forskellige forskningsområder. Denne teknologi muliggør visualisering af bruttovævsstrukturer og kan således bruges til at spore tumorprogression og potentielle terapier6,9 samt nyremorfologi som præsenteret her. Evnen til at segmentere de specifikke træk ved billederne gør det til et attraktivt værktøj til at studere modeller af polycystisk nyresygdom (PKD)3. M-mode billeder giver mulighed for simpel kvantificering af mange vigtige hjerteparametre, der muliggør in vivo-vurdering af hjertefysiologi. Da nyrerne modtager 20%-25% af hjerteproduktionen10, er det vigtigt at forstå hjertefunktionen under den langsgående vurdering af nyrepatologi. Gennem disse amerikanske protokoller har vi forsøgt at illustrere, at amerikansk billeddannelse ikke kun er praktisk til in vivo- og langsgående nyrestudier, men også at amerikanske værktøjer i stigende grad muliggør både morfologisk såvel som fysiologisk vurdering af mus i prækliniske undersøgelser.
Disclosures
Flere forfattere er enten ansat af, har en betydelig økonomisk interesse i eller er medopfindere på patenter licenseret af SonoVol, Inc. (CJM, RCG, TJC).
Acknowledgments
Dette arbejde blev støttet af NIH (R43-DK126607, TJC, TLK, MFR) og Mayo Foundation.
Materials
| Name | Company | Catalog Number | Comments |
| Electric Razor | Braintree Scientific, Inc | CLP-9868 14 | |
| C57bk6j | The Jackson laboratory | https://www.jax.org/ | |
| Cotton gauze pads | Fisher Scientific | ||
| Cotton tipped applicators | Fisher Scientific | ||
| Depilatory cream | N/a | N/a | This study used Nair |
| Heat lamp | Included with SonoVol Vega system | ||
| Robotic Ultrasound System | SonoVol Inc | SonoVol Vega system includes anesthesia system | |
| SonoEQ Software | SonoVol | Included with SonoVol Vega system | |
| TERRELL Isoflurane | Piramal Critical Care, Inc | NDC 66794-019-10 |
References
- Cunha, L., et al. Preclinical imaging: an essential ally in modern biosciences. Molecular Diagnostics & Therapy. 18 (2), 153-173 (2014).
- Ultrasound. NIBIB. , Available from: https://www.nibib.nih.gov/science-education/science-topics/ultrasound#pid-936 (2016).
- Beaumont, N. J., et al. Assessing polycystic kidney disease in rodents: Comparison of robotic 3d ultrasound and magnetic resonance imaging. Kidney360. 1 (10), 1128-1136 (2020).
- Hopp, K., et al. Functional polycystin-1 dosage governs autosomal dominant polycystic kidney disease severity. The Journal of Clinical Investigation. 122 (11), 4257-4273 (2012).
- Weiss, R. M., Ohashi, M., Miller, J. D., Young, S. G., Heistad, D. D. Calcific aortic valve stenosis in old hypercholesterolemic mice. Circulation. 114 (19), 2065-2069 (2006).
- Czernuszewicz, T. J., et al. A new preclinical ultrasound platform for widefield 3D imaging of rodents. Review of Scientific Instruments. 89 (7), 075107 (2018).
- Chong, W. K., Papadopoulou, V., Dayton, P. A. Imaging with ultrasound contrast agents: current status and future. Abdominal Radiology (NY). 43 (4), 762-772 (2018).
- Nyankima, A. G., Kasoji, S., Cianciolo, R., Dayton, P. A., Chang, E. H. Histological and blood chemistry examination of the rodent kidney after exposure to flash-replenishment ultrasound contrast imaging. Ultrasonics. 98, 1-6 (2019).
- Rojas, J. D., et al. Ultrasound measurement of vascular density to evaluate response to anti-angiogenic therapy in renal cell carcinoma. IEEE Transactions on Biomedical Engineering. 66 (3), 873-880 (2019).
- Boron, W. F., Boulpaep, E. L. Medical Physiology. 3rd edn. , Elsevier. (2017).
Tags
Medicin udgave 174Erratum
Formal Correction: Erratum: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys
Posted by JoVE Editors on 10/06/2021.
Citeable Link.
An erratum was issued for: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys. An author name was updated, along with the Protocol and Representative Results sections.
The name of an author was updated from:
Ryan C. Gesser
to:
Ryan C. Gessner
Step 3.1 of the Protocol was updated from:
Turn on the US machine and the heat lamp above the US platforms. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
to:
Turn on the US machine and the switch for the internal heating element for the US bays. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
Figue 1 in the Representative Results was updated from:
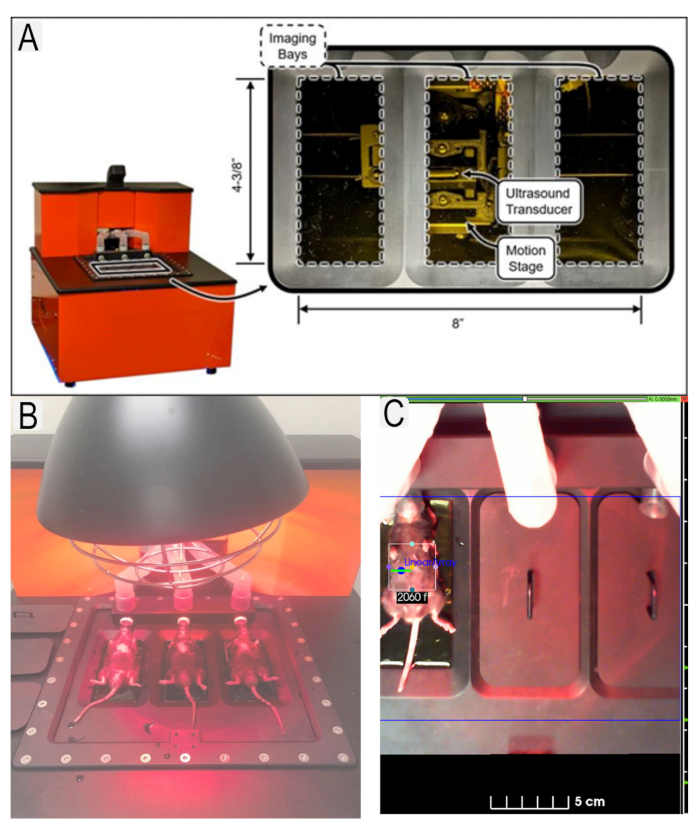
Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform with heat lamp. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.
to:

Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.



