ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
فرط الحساسية التماسية (CHS) هو نموذج تجريبي للفئران لالتهاب الجلد التماسي التحسسي (ACD). يعتمد CHS على التحسس باستخدام hapten التفاعلي عن طريق طلاء الجلد الحليق للصدر والبطن ، مع تحدي جلد الأذن اللاحق باستخدام هابتن مخفف ، مما يسبب رد فعل تورم يتم تقييمه بطرق مختلفة.
Abstract
فرط الحساسية التماسية (CHS) هو نموذج تجريبي لالتهاب الجلد التماسي التحسسي (ACD) يمكن دراسته على الفئران. تهدف هذه الدراسة إلى تقديم طريقة مختبرية موضوعية قد تساعد في دراسة تفاعل CHS في الفئران ، والتي يمكن قياسها وتحديدها كميا من خلال اختبارات مختلفة. وللحث على CHS، في اليوم "0"، تم تحسس الفئران على بقعة كانت محلوقة سابقا عن طريق طلاء جلد البطن باستخدام الهابتن 2،4،6-trinitrochlorobenzene (TNCB) في خليط الأسيتون والإيثانول، في حين تم تحسس الفئران ذات التحكم السلبي بخليط الأسيتون والإيثانول وحده في السيارة. في اليوم "4" ، تم قياس سمك الأذن الأساسي بميكرومتر قبل استنباط CHS (التحدي) عن طريق طلاء كلتا الأذنين ب TNCB المخفف في كل من مجموعات الاختبار والتحكم. بعد 24 ساعة ، تم قياس تورم الأذن باستخدام ميكرومتر. CHS هو مثال على الاستجابة المناعية بوساطة الخلايا التائية التي تسبب تورما في الأنسجة الملتهبة ، وتبلغ ذروتها بعد 24 ساعة من تحدي الجلد بنفس الهابتن. ارتبطت الزيادة في وذمة الأذن بزيادة وزن الأذن ، ونشاط الميلوبيروكسيديز (MPO) ، وتركيز السيتوكين المؤيد للالتهابات في مستخلصات الأذن ، وزيادة سماكة الأدمة الوذمية في الفحص النسيجي ، ونفاذية الأوعية الدموية في الأذن. كانت هناك أيضا زيادة في تركيز الأجسام المضادة IgG1 الخاصة ب TNP في مصال مجموعة الاختبار عند مقارنتها بالفئران الضابطة. وبالإضافة إلى ذلك، يمكن نقل هذه المواد بنجاح باستخدام الخلايا المستجيبة ل CHS التي تم الحصول عليها من الجهات المانحة التي سبق توعيتها باستخدام TNCB. تم إعطاء الخلايا المستجيبة ل CHS عن طريق الوريد في الفئران المتلقية الساذجة ، والتي تم تحديها لاحقا بنفس الهابتن المخفف. تم قياس تورم الأذن مع ميكرومتر 24 ساعة في وقت لاحق.
Introduction
التهاب الجلد التماسي التحسسي (ACD) هو مرض التهابي جلدي شائع في البلدان الصناعية ناجم عن تفاعل فرط الحساسية من النوع الرابع الناتج عن التعرض لمواد كيميائية منخفضة الوزن الجزيئي تسمى haptens. تشمل المواد المسببة للتحسس التماسي لدى البشر أيونات المعادن الثقيلة (الكروم والنيكل والحديد والكوبالت) وزيت التربنتين والعطور والأصباغ والمواد الحافظة الموجودة في مستحضرات التجميل (على سبيل المثال ، p-phenylenediamine) ، وبعض الأدوية (مثل النيومايسين والبنزوكايين) والمضادات الحيوية β-lactam (أي البنسلين) والمواد الكيميائية التي تنتجها النباتات (pentadecacatechol ، وهي مادة موجودة في اللبلاب السام) ، وكذلك الهيدروكينون المستخدم في صناعة التصوير الفوتوغرافي 1,2 . العوامل المسببة ل ACD عالية جدا حيث يتم استخدام أكثر من 100000 مادة كيميائية في الصناعة وحدها ، ويتم تصنيع 2000 مادة كيميائية جديدة كل عام. حتى الآن ، تم تحديد أكثر من 3700 جزيء قد يكون ملامسا للهابتنز / المواد المسببة للحساسية3. تفاعل فرط الحساسية التماسية (CHS) هو نموذج تجريبي ل ACD يمكن دراسته في الفئران والخنازير الغينية والجرذان ويمكن أن يسببه التطبيق الجلدي الموضعي للهابتنز الكيميائي التفاعلي المذاب في المذيبات العضوية 4,5,6. تهدف هذه الدراسة إلى وصف طريقة مختبرية موضوعية قد تساعد في دراسة تفاعل CHS في الفئران ، والتي يمكن قياسها وتحديدها كميا من خلال اختبارات مختلفة.
يتكون CHS من مراحل التوعية (الحث) والمستجيب (التحدي). في النماذج الحيوانية ، ترتبط الهابتنز أولا تساهميا بالبروتينات في الجسم لإنشاء مستضدات جديدة. خلال مرحلة التحسس، تعزز الخلايا الكيراتينية المنشطة هجرة ونضج الخلايا المتغصنة الجلدية (sDCs) عن طريق إنتاج عامل نخر السيتوكينات المؤيد للالتهابات α (TNF-α) والإنترلوكين 1β (IL-1β)7. تقدم خلايا لانجرهانز الجلدية (LCs) مستضدات خلال مراحل الحث والمستجيب CHS8. LCs المعرضة للهابتن أثناء التحسس تعزز تحريض كل من الخلايا التنظيمية والمستجيبة9. تشير الأدلة المتزايدة من العديد من الدراسات إلى أن استجابات CHS يمكن أن تتوسط فيها إما خلايا Th1 المقيدة من الفئة الثانية CD4 + MHC ، والتي تطلق محليا γ الإنترفيرون (IFN-γ) لاستخدام تسلل التهابي مميز ، والخلايا الليمفاوية Tc1 المقيدة من الفئة الأولى CD8 + MHC التي يمكنها أيضا إطلاق γ IFN ولكن في الغالب توسط الضرر السام للخلايا للخلايا الكيراتينية ، والآن أيضا خلايا Th17 المنتجة للإنترلوكين 17 (IL-17)10 ، 11.
تم تطوير العديد من نماذج CHS المختلفة التي تستخدم أنواعا مختلفة 1 2,13,14 و haptens (يتم تلخيص مقارنة مفصلة بين مختلف haptens والمذيبات ووقت التطبيق في الجدول 1). يقدم الفأر ، وهو نوع مختبري يستخدم بشكل متكرر ، بعض المزايا في دراسة CHS. هناك المزيد من السلالات والضربات القاضية (KO) والحيوانات المعدلة وراثيا بين الفئران مقارنة بالأنواع الأخرى ، مما يجعلها حيوانا جذابا للغاية15. بالإضافة إلى ذلك ، يتطلب نموذج CHS العديد من الحيوانات ، والفئران أكثر اقتصادا هنا. النماذج الحيوانية لا تحاكي ACD في جميع الجوانب. على وجه الخصوص ، فإنها تظهر التقشر والتقشر ، وهو أمر غير شائع بالنسبة للبشر16,17. من الصعب إعادة إنتاج ميزات الأمراض المزمنة ، ويرجع ذلك أساسا إلى أن النموذج الموصوف لا يفترض تطبيق hapten لفترة طويلة من الزمن. ومع ذلك، فقد تأكد هنا أن العديد من الجوانب الهامة لحوار التعاون الآسيوي مستنسخة. وقد تبين أيضا أنه ، كما هو الحال في البشر ، ترتبط هذه الميزات بالحساسية المحلية. تم إملاء اختيار hapten ومذيبه وتطبيقه الموضح في هذا البروتوكول من خلال حقيقة أن النتائج قد تم تأكيدها من خلال العديد من الاختبارات في المختبر وأنه تم اختبارها وتعديلها في المختبر لسنوات عديدة حتى تم إنشاء الإصدار الحالي. تسمح نماذج المورين بتحليل المجموعات الفرعية للخلايا أو السيتوكينات التي تشارك في تطوير ACD وهي ضرورية للتقييمات قبل السريرية للعلاجات الجديدة.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
أجريت جميع التجارب المقدمة في هذه المقالة وفقا للمبادئ التوجيهية للجنة الأخلاقية المحلية 1st للتجارب على الحيوانات في كراكوف. تم تنفيذ جميع الإجراءات الموصوفة وفقا للتوصيات المحلية ، خاصة فيما يتعلق باستخدام الكيتامين / الزيلازين كمخدر ، واستخدام جانبي الأذنين لتطبيق المادة / hapten ، وقطع الأذن ، وجمع الدم عن طريق إزالة مقلة العين. تم استخدام BALB/c (النمط الفرداني H-2d) و CBA/J (H-2k) و C57BL/6 (H-2b) من ذكور وإناث الفئران التي يتراوح عمرها بين 6 و 12 أسبوعا في هذه الدراسة (انظر جدول المواد). بالنسبة للدلالة الإحصائية ، من الأفضل أن تتكون كل مجموعة من الفئران من 10-12 حيوانا.
1. إعداد الحيوان
- نظف طاولة العمليات بمحلول إيثانول بنسبة 70٪ قبل وبعد جميع الإجراءات. في حالة استخدام الفئران التي تتطلب ظروفا معقمة ، فقم بإجراء جميع العمليات في خزانة السلامة الأحيائية.
2. وضع علامات على الفئران لتحديد هويتها
- قم بتسمية الفئران عن طريق حلق الجلد بشفرة حلاقة: # 0 - بدون علامة ، # 2 - على المخلب الأمامي الأيمن ، # 3 - على الجانب الأيمن ، # 4 - على المخلب الخلفي الأيمن ، # 5 - في قاعدة الذيل ، # 6 - على المخلب الخلفي الأيسر ، # 7 - على الجانب الأيسر ، # 8 - على المخلب الأمامي الأيسر.
ملاحظة: بسبب التفاعل المستحث، لا يمكن تمييز الفئران بشكل كلاسيكي عن طريق لكم الأذن أو وضع العلامات. لم يتم تخدير الفئران أثناء وضع العلامات.
3. تحريض CHS
ملاحظة: يوضح الشكل 1 هذا الإجراء.
- قم بإجراء التحسس (الحث) باتباع الخطوات أدناه.
- في اليوم "0" ، حلق الفئران على الصدر والبطن (مربع 2 سم × 2 سم) عن طريق تطبيق الصابون الرمادي بالماء والحلاقة بشفرة حلاقة.
ملاحظة: قبل تطبيق hapten ، انتظر لمدة 6 ساعات حتى لا يتهيج الجلد. - تحضير 5٪ هابتن: 2،4،6-ترينيتروكلوروبنزين (TNCB ، انظر جدول المواد) في خليط الأسيتون والإيثانول (نسبة 1: 3) أو السيارة وحدها (الأسيتون - الإيثانول). قم بإعداد المحاليل قبل الاستخدام مباشرة في قارورة زجاجية وحمايتها من الضوء عن طريق تغطية القارورة بورق الألومنيوم.
- في نفس اليوم ، قم بتحسس الفئران عن طريق تطبيق 150 ميكرولتر من 5٪ hapten على البقعة المحلوقة سابقا. في مجموعة الفئران الضابطة ، ضع السيارة وحدها لتقييم التفاعل الالتهابي غير المحدد. قبل وضع الحيوان مرة أخرى في القفص ، انتظر لمدة 30 ثانية ، واترك hapten يجف.
تحذير: استخدام القفازات; يسبب TNCB رد فعل تحسسي شديد لدى معظم الناس.
- في اليوم "0" ، حلق الفئران على الصدر والبطن (مربع 2 سم × 2 سم) عن طريق تطبيق الصابون الرمادي بالماء والحلاقة بشفرة حلاقة.
- إجراء الاستنباط (التحدي) وقياس تورم الأذن.
- في اليوم "4" ، قم بإعداد 0.4٪ hapten: TNCB في خليط الأسيتون والإيثانول (نسبة 1: 1). قم بإعداد المحلول قبل الاستخدام مباشرة في قارورة زجاجية وقم بحمايته من الضوء عن طريق تغطية القارورة بورق الألومنيوم.
- تخدير الفئران عن طريق حقن داخل الصفاق (i.p) من خليط من الكيتامين (90-120 ملغم / كغ) والزيلازين (5-10 ملغ / كغ) (انظر جدول المواد) للتخدير العميق. تأكد من تخدير الماوس بالكامل لمدة 5 دقائق على الأقل عن طريق قرصة إصبع القدم.
- قم بقياس سمك الأذن (قياس 0 ساعة ، خط الأساس) باستخدام ميكرومتر (انظر جدول المواد) من قبل مراقب غير مدرك للمجموعات التجريبية.
- ضع 10 ميكرولتر من 0.4٪ hapten على جانبي الأذنين في كلتا المجموعتين (الاختبار والتحكم). قبل وضع الحيوان مرة أخرى في القفص ، انتظر لمدة 30 ثانية واسمح للهابتن أن يجف.
- في اليوم "5" ، بعد 24 ساعة من تطبيق hapten ، كرر الخطوات 3.2.2-3.2.3 لقياس 24 ساعة.
- قم بتقييم استجابة CHS عن طريق حساب الفرق في سمك الأذن قبل وبعد التحدي باستخدام hapten: سمك الأذن 24 ساعة (ميكرومتر) - 0 ساعة سمك الأذن (ميكرومتر). عد كل أذن كقياس منفصل. بعد ذلك ، عبر عن تورم الأذن بالميكرومتر (μm) ± الخطأ المعياري للمتوسط (SEM) (الجدول 2 ، الشكل 3).
4. خزعات الأذن
- مباشرة بعد قياس 24 ساعة لسمك الأذن (عندما لا يزال الماوس تحت التخدير العميق) ، اقطع الأذنين بالقرب من الجمجمة قدر الإمكان باستخدام مقص. اجمع الخزعات من الجانب البعيد من الأذنين عن طريق عمل لكمة قطرها 6 مم باستخدام لكمة خزعة (انظر جدول المواد).
- قم بقياس وزن الأذن (الخطوة 4.2) بالإضافة إلى إجراء أحد الاختبارات التالية على خزعة الأذن نفسها: فحص الميلوبيروكسيديز (MPO) (الخطوة 4.3) أو القياس المختبري لتركيز السيتوكين في مستخلصات الأذن (على سبيل المثال ، IFN-γ ، IL-17A ، TNF-α [الخطوة 4.4]).
ملاحظة: قطع الأذنين قبل جمع الدم. بعد هذا الإجراء ، يجب قتل الفئران الرحيم (على سبيل المثال ، عن طريق خلع عنق الرحم).
- قم بقياس وزن الأذن (الخطوة 4.2) بالإضافة إلى إجراء أحد الاختبارات التالية على خزعة الأذن نفسها: فحص الميلوبيروكسيديز (MPO) (الخطوة 4.3) أو القياس المختبري لتركيز السيتوكين في مستخلصات الأذن (على سبيل المثال ، IFN-γ ، IL-17A ، TNF-α [الخطوة 4.4]).
- قياس وزن كل خزعة أذن على التوازن التحليلي والتعبير عنها بالملليغرام (ملغ) (الشكل 4).
- قم بإجراء فحص MPO باتباع الخطوات أدناه.
- تحضير المخزن المؤقت للتجانس عن طريق إذابة بروميد الأمونيوم سداسي أديل ثلاثي ميثيل الأمونيوم بنسبة 0.5٪ في مخزن فوسفورات 50 مليمول KH 2 PO 4/ Na2HPO4 وضبط الرقم الهيدروجيني إلى 6.0 (يستخدم في درجة حرارة الغرفة ، RT).
- تجانس الخزعات في أنابيب الطرد المركزي الدقيقة 2 مل مع 500 ميكرولتر من المخزن المؤقت المحضر لمدة 10 دقائق باستخدام مجانس مع حبات الفولاذ المقاوم للصدأ قطرها 5 مم (أضف خرزتين / قارورة) (انظر جدول المواد). بعد ذلك ، قم بتبريد العينة لمدة 15 دقيقة عند 4 درجات مئوية وتجانسها لمدة 10 دقائق إضافية.
ملاحظة: تحتوي أنابيب أجهزة الطرد المركزي الدقيقة على قاع دائري بحيث يمكن للخرز التحرك بسهولة. - تجميد المتجانسات عند -20 درجة مئوية لمدة 30 دقيقة. ذوبان الجليد والدوامة (تأكد من إذابة العينات). كرر هذا الإجراء 3x.
- جهاز الطرد المركزي المتجانسات عند 3000 × g لمدة 30 دقيقة عند 4 درجات مئوية. حصاد supernatants مع ماصة. عبر عن نشاط MPO بالوحدات (U) لكل 1 ملغ من البروتين.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا. العينات مستقرة عند -20 درجة مئوية لمدة 3 أشهر. - لقياس نشاط MPO ، قم بإجراء تفاعل إنزيمي عن طريق خلط 20 ميكرولتر من supernatant و 200 μL من ركيزة MPO (0.167 mg / mL من ortho-dianisine dihydrochloride في 50 مليمول من KH 2 PO 4 / Na 2 HPO 4 المخزن المؤقت مع 5 × 10-4٪ H 2 0 2) وأضف إلى 96 لوحة مسطحة القاع. احتضان اللوحات لمدة 20 دقيقة في RT.
- قم بإعداد المنحنى القياسي باستخدام 20 ميكرولتر من معيار MPO بتركيزات من 0.008 U إلى 0.5 U في 200 ميكرولتر من ركيزة MPO. قم بإعداد العينة الفارغة باستخدام الركيزة MPO وحدها.
تنبيه: استخدم قناعا أثناء العمل مع ثنائي هيدروكلوريد أورثو ديانيسين.
ملاحظة: يجب أن تكون الألواح مصنوعة من مادة البولي بروبيلين ، والتي لديها قدرة ربط أقل حتى لا ترتبط البروتينات أو الحمض النووي. - قياس الكثافة البصرية (OD) عند الطول الموجي λ = 460 نانومتر. التفاعل الأنزيمي مستقر لمدة 10 دقائق. اقرأ نشاط MPO في العينات المختبرة من المنحنى القياسي.
- لقياس تركيز البروتين ، استخدم 20 ميكرولتر من supernatant ، وقم بإجراء اختبار باستخدام مجموعة حمض Bicinchoninic لتحديد البروتين (انظر جدول المواد) ، وقياس OD عند λ = 562 nm (الشكل 5).
- إجراء قياس في المختبر من السيتوكينات في مستخلص الأذن.
- تجانس خزعات الأذن في RT في أنابيب الطرد المركزي الدقيقة 2 مل مع 500 ميكرولتر من كاشف استخراج بروتين الأنسجة (T-PER) لمدة 10 دقائق باستخدام مجانس مع خرز الفولاذ المقاوم للصدأ قطره 5 مم (أضف خرزتين / قارورة). بعد ذلك ، قم بتبريد العينة لمدة 15 دقيقة عند 4 درجات مئوية وتجانسها لمدة 10 دقائق إضافية.
ملاحظة: تحتوي أنابيب أجهزة الطرد المركزي الدقيقة على قاع دائري بحيث يمكن للخرز التحرك بسهولة. - جهاز الطرد المركزي المتجانسات عند 3000 × g لمدة 30 دقيقة عند 4 درجات مئوية.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا. العينات مستقرة عند -80 درجة مئوية لمدة 6 أشهر. - تقييم مستويات السيتوكين باستخدام مجموعة ELISA المتاحة تجاريا (على سبيل المثال، IFN-γ) (انظر جدول المواد) باتباع تعليمات الشركة المصنعة (الشكل 6).
- تجانس خزعات الأذن في RT في أنابيب الطرد المركزي الدقيقة 2 مل مع 500 ميكرولتر من كاشف استخراج بروتين الأنسجة (T-PER) لمدة 10 دقائق باستخدام مجانس مع خرز الفولاذ المقاوم للصدأ قطره 5 مم (أضف خرزتين / قارورة). بعد ذلك ، قم بتبريد العينة لمدة 15 دقيقة عند 4 درجات مئوية وتجانسها لمدة 10 دقائق إضافية.
5. علم الأنسجة من أنسجة الأذن
- مباشرة بعد قياس 24 ساعة لسمك الأذن ، عندما لا يزال الماوس مخدرا بعمق ، اقطع الأذنين بالقرب من الجمجمة قدر الإمكان باستخدام المقص (الخطوة 4.1).
ملاحظة: بعد هذا الإجراء ، يجب قتل الفئران الرحيم (على سبيل المثال ، عن طريق خلع عنق الرحم). - قم بإجراء تضمين البارافين لكتل الأنسجة باتباع الخطوات أدناه.
- مباشرة بعد الإزالة ، ضع الأذن في ~ 10 مل من الفورمالين بنسبة 10٪ لمدة 24 ساعة.
- ضع الأذنين في كاسيت معالجة الأنسجة. ضع الكاسيت في معالج آلي (انظر جدول المواد) لدورات الجفاف (الكحول 70٪ ، 90٪ ، 100٪ ، 30 دقيقة لكل منها في RT) ، دورات التطهير (الزيلين 3x ، 30 دقيقة لكل منها في RT) ، ودورات تسلل الشمع (البارافين 3x ، 30 دقيقة لكل منها عند 56 درجة مئوية).
- قم بإزالة الكاسيت من المعالج الآلي، واحتفظ بلوحة التسخين حتى الحاجة. املأ قالب الشمع بالشمع الدافئ (من الموزع).
- قم بإزالة الأقسام من الكاسيت باستخدام ملقط دافئ ووضعها في القالب ؛ بعد ذلك ، ضع قاعدة الكاسيت في الجزء العلوي من القالب ثم املأها بمزيد من الشمع. ضعه في ماء مبرد على طبق بارد لمدة 30 دقيقة حتى يتصلب البارافين لتشكيل كتلة تحتوي على العينة.
- استخدم ميكروتوم دوار (انظر جدول المواد) لقطع المقاطع بسماكة ~ 5 ميكرومتر. تطفو الأقسام في حمام دافئ لتسطيحها. التقط الأقسام على شريحة مجهر زجاجية. اتركها لتجف في RT لضمان التصاق الأقسام بالشرائح.
ملاحظة: استخدم الشرائح التي تلغي الحاجة إلى تطبيق مواد لاصقة أو طلاءات بروتينية لمنع فقدان أجزاء الأنسجة أثناء التلطيخ.
- أداء تلطيخ الهيماتوكسيلين والإيوسين (H & E).
- قم بإعداد 17 طبقا ملطخا بما يلي: الزيلين (أربعة أطباق) ، الإيثانول 100٪ (الكحول المطلق) (أربعة أطباق) ، 90٪ الإيثانول ، 80٪ الإيثانول ، الإيثانول 70٪ ، الإيثانول 50٪ ، PBS (ثلاثة أطباق) ، محلول الهيماتوكسيلين ، محلول الإيوسين. انقل الشرائح من طبق إلى آخر وفقا للخطوات التالية ، وقم بإجراء كل ذلك في RT.
ملاحظة: يمكن تكرار الإجراء في كل طبق حوالي 10 أضعاف (على سبيل المثال، إذا تم استخدام طبق مكون من 20 طبقة، يمكن عمل 200 بقعة دون تغيير السوائل). - قم بإزالة البارافينات من الأقسام عن طريق الحضانة عند 65 درجة مئوية لمدة 30 دقيقة في الحاضنة. اغمر الشرائح في الزيلين لمدة 30 دقيقة. كرر 1x في الزيلين الجديد لمدة 30 دقيقة.
- اغمر الشرائح في الإيثانول بنسبة 100٪ لمدة 5 دقائق. كرر 1x في الإيثانول الجديد 100٪ لمدة 5 دقائق. اغمر الشرائح في صف الإيثانول ، 90٪ ، 80٪ ، 70٪ ، و 50٪ ، لمدة 2 دقيقة في كل تخفيف.
- اغمر الشرائح في محلول ملحي مخزن بالفوسفات (PBS) لمدة 5 دقائق. امسح السائل الزائد من حول الأنسجة والجانب الخلفي من الشرائح.
- قم بتلطيخ الأقسام في محلول الهيماتوكسيلين (انظر جدول المواد) لمدة 7-8 دقائق. اغسل في الماء الجاري لمدة 30 ثانية من الجانب الخلفي حتى لا تتلف الأقسام. كرر الخطوة 5.3.4.
- قم بتلطيخ الأقسام بمحلول eosin (انظر جدول المواد) لمدة 30 ثانية. اغسل كما هو مذكور في الخطوة 5.3.5 ثم كرر الخطوة 5.3.4.
- اغمر الشرائح في الإيثانول بنسبة 100٪ (الكحول المطلق) لمدة 2 دقيقة. كرر 1x في الإيثانول الجديد 100٪ لمدة 2 دقيقة.
- اغمر الشرائح في الزيلين لمدة 5 دقائق. كرر 1x في الزيلين الجديد لمدة 5 دقائق.
- اترك الأقسام تجف في الهواء لمدة 15 دقيقة في RT. أضف قطرة من وسط التركيب (انظر جدول المواد) على غطاء ثم ضعها في الجزء العلوي من القسم.
- قم بإعداد 17 طبقا ملطخا بما يلي: الزيلين (أربعة أطباق) ، الإيثانول 100٪ (الكحول المطلق) (أربعة أطباق) ، 90٪ الإيثانول ، 80٪ الإيثانول ، الإيثانول 70٪ ، الإيثانول 50٪ ، PBS (ثلاثة أطباق) ، محلول الهيماتوكسيلين ، محلول الإيوسين. انقل الشرائح من طبق إلى آخر وفقا للخطوات التالية ، وقم بإجراء كل ذلك في RT.
- افحص القسم تحت المجهر الضوئي تحت تكبير 20x أو 40x ، والتقط الصور (الشكل 7).
6. اختبار نفاذية الأوعية الدموية
ملاحظة: بالتناوب مع قياس سمك الأذن، يمكن إجراء اختبار نفاذية الأوعية الدموية.
- قم بتحسس الفئران في اليوم "0" (الخطوات 3.1.1-3.1.3) ، ثم في اليوم "4" ، قم بتخدير الفئران (الخطوة 3.2.2) وتطبيق hapten مباشرة على الأذنين (الخطوة 3.2.4) ، مع حذف قياس الأذن لمدة 0 ساعة.
- في الساعة 23 بعد التحدي ، قم بتخدير الفئران (الخطوة 3.2.2).
- حقن عن طريق الوريد (i.v.) 8.3 ميكرولتر / غرام من وزن الجسم من صبغة إيفانز الزرقاء 1٪ (انظر جدول المواد) في دولبيكو الفوسفات الملوحة المخزن مؤقتا (DPBS).
- تخدير الفئران مرة أخرى التخدير العميق (الخطوة 3.2.2) -1 ساعة بعد حقن إيفانز الأزرق.
- جمع خزعات الأذن (الخطوة 4.1).
ملاحظة: بعد هذا الإجراء ، يجب قتل الفئران الرحيم (على سبيل المثال ، عن طريق خلع عنق الرحم). - استخراج الصبغة من الأنسجة ، ووضع لكمات الأذن في الأنابيب التي تحتوي على 1 مل من الفورماميد ، وحضان في 37 درجة مئوية في الغلاف الجوي من 5 ٪ CO2 لمدة 18 ساعة.
- الطرد المركزي للخزعات في 3000 × غرام لمدة 3 دقائق في RT. جمع supernatants مع ماصة.
- قم بقياس OD عند طول موجي λ = 565 نانومتر في لوحات مسطحة القاع ذات 96 بئرا مقابل فورماميد فارغ يحتوي على فورماميد. اللون مستقر لمدة 24 ساعة. اقرأ تركيز عينات الاختبار من المنحنى القياسي (استخدم تركيزات إيفانز الزرقاء التي تتراوح بين 0.2-30 ميكروغرام من فورماميد الصبغة / مل ) (الشكل 8).
ملاحظة: يجب أن تكون الألواح مصنوعة من مادة البولي بروبيلين ، والتي لديها قدرة ربط أقل حتى لا ترتبط البروتينات أو الحمض النووي.
7. جمع المصل وقياس الأجسام المضادة للغلوبولين المناعي المضاد ل TNP (IgG1)
- بعد جمع خزعات الأذن (الخطوة 4.1) ، عندما لا يزال الماوس تحت التخدير العميق ، قم بإزالة مقلة العين باستخدام ملاقط ، ووضع ضغط لطيف على الماوس ، وجمع الدم من الجيوب الأنفية المدارية الرجعية إلى الأنبوب (قارورة مع هلام للحصول على مصل ، انظر جدول المواد). قد تكون الطريقة البديلة لجمع الدم هي ثقب القلب بحقنة وجمع الدم.
ملاحظة: يجب جمع الدم بعد إزالة الأذنين. يجب استخدام نفس طريقة النزيف عبر دراسة كاملة بسبب الاختلافات المحتملة في معلمات الدم18. بعد هذا الإجراء ، يجب قتل الفئران الرحيم (على سبيل المثال ، عن طريق خلع عنق الرحم). - عكس ما لا يقل عن 6x ، وانتظر 30 دقيقة حتى يتجلط الدم ، ثم قم بجهاز طرد مركزي عند 1,300-2,000 x g لمدة 10 دقائق في RT.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا. العينة مستقرة عند -20 درجة مئوية لمدة 6 أشهر. - قم بتغطية صفيحة مسطحة القاع من 96 بئرا مع 50 ميكرولتر من ألبومين مصل البقر المقترن ب 2,4,6-trinitrophenyl (TNP-BSA) المذاب في DPBS عند تنسيق 10 ميكروغرام / مل. بعد ذلك ، قم بتغطية اللوحة الثانية بألبومين مصل البقر (BSA) وحده المذاب في DPBS (الخلفية) بتركيز 10 ميكروغرام / مل. احتضان بين عشية وضحاها في 4 درجات مئوية.
ملاحظة: يحتوي مصل الماوس على أجسام مضادة (ABS) ضد BSA ، لذلك يجب اختبار العينات على كلا اللوحتين ، وبعد ذلك ، يجب إجراء عملية حسابية (OD TNP-BSA - OD BSA). - اغسل الألواح ب 300 ميكرولتر من DPBS تحتوي على 0.05٪ Tween 20. كرر 3x.
- تحضير مخفف المقايسة (AD): DPBS يحتوي على 1٪ BSA. سد الآبار مع AD لمدة 1 ساعة في RT. غسل مرة أخرى (الخطوة 7.4).
- إعداد معيار داخلي (iSTD): توعية الفئران باستخدام TNCB (الخطوات 3.1.1-3.1.3) ، وبعد 10 أيام من التوعية ، جمع واستطلاع المصل من جميع المانحين (الخطوة 7.1 والخطوة 7.2).
- أضف إلى اللوحة 50 ميكرولتر من التركيزات المتدرجة من iSTD المخفف باستخدام AD لصنع المنحنى القياسي (الموضح في الجدول 3). أضف إلى اللوحة 50 ميكرولتر من عينات المصل. اختبر كل عينة ومنحنى قياسي على كلا اللوحتين (TNP-BSA و BSA مغلفة). احتضان لمدة 2 ساعة في RT. اغسل الألواح (الخطوة 7.4).
- أضف 50 ميكرولتر من الجسم المضاد للماوس الحيوي IgG1 أحادي النسيلة (mAb ، انظر جدول المواد) المخفف 1:250 مع AD واحتضنه لمدة ساعة واحدة في RT. اغسل مرة أخرى (الخطوة 7.4).
- أضف 50 ميكرولتر من الفجل بيروكسيديز ستربتافيدين (HRD streptavidin ، انظر جدول المواد) المخفف 1:2000 مع AD ، واحتضن لمدة 30 دقيقة في RT في الظلام. اغسل اللوحة (الخطوة 7.4).
- أضف 50 ميكرولتر من ركيزة TMB (انظر جدول المواد) واحتضنها لمدة 30 دقيقة في RT في الظلام.
- أوقف التفاعل الأنزيمي بإضافة 25 ميكرولتر من 1 M H2SO4 ؛ التفاعل مستقر لمدة 30 دقيقة.
- قم بقياس OD بطول موجي λ = 450 نانومتر وخلفية 570 نانومتر (يجب طرح الخلفية من كل قياس 450 نانومتر). عند عرض النتائج، اطرح قياسات BSA من TNP-BSA للعينات والمنحنى القياسي. ثم احسب الوحدة (U) للأجسام المضادة وفقا للمنحنى القياسي (الشكل 9).
8. النقل بالتبني للخلايا المستجيبة ل CHS
ملاحظة: يبين الشكل 2 هذا الإجراء.
- الجهات المانحة (بنسبة متبرع واحد: متلق واحد): توعية الفئران ب TNCB في اليوم "0" (الخطوات 3-1-1-3-3).
- في اليوم "4" ، قم بتخدير التخدير العميق للفئران (الخطوة 3.2.2).
- عزل الغدد الليمفاوية الإبطية والإربية (ALNs) والطحال (SPLs) باستخدام الملقط. قم بتجميع ALNs معا في قارورة واحدة و SPLs في قارورة أخرى.
ملاحظة: هناك عقدة ليمفاوية إبطية واحدة خلف العضلة الصدرية في كل إبطين. تقع إحدى العقدة الليمفاوية الإربية في منطقة الورك بجوار ثلاثة أوعية دموية. يقع الطحال على الجانب الأيسر من الجسم خلف الأمعاء والمعدة19. العمل باستخدام أدوات معقمة في خزانة السلامة الأحيائية للحفاظ على ظروف معقمة. بعد هذا الإجراء ، يجب قتل الفئران الرحيم (على سبيل المثال ، عن طريق خلع عنق الرحم). - اهرسي الأنسجة بين الأطراف المتجمدة لشريحتين مجهريتين. مرر تعليق الخلية من خلال مصفاة خلية بحجم مسام 70 ميكرومتر (انظر جدول المواد).
- اغسل الخلايا باستخدام DPBS المكمل بمصل بقري جنيني بنسبة 1٪ (FBS). جهاز طرد مركزي عند 300 × جم لمدة 10 دقائق عند 4 درجات مئوية. قم بتزيين السوبرناتانت وإعادة تعليق حبيبات الخلايا المتبقية في 1-5.0 مل من DPBS.
- عد الخلايا الحية باستخدام مقياس الدم20 مع أزرق تريبان ، وامزج 10 ميكرولتر من تعليق الخلية مع 90-990 ميكرولتر (اعتمادا على رقم الخلية) من أزرق تريبان. ضع في اعتبارك التخفيف عند حساب رقم الخلية (10x-100x).
- تحضير خليط من ALNs و SPLs (نسبة 1: 1): 8.0 × 106 حتى 7.0 × 107 / الماوس في 200 ميكرولتر من DPBS.
- المتلقين (الفئران المتجانسة الساذجة): تخدير الفئران المتلقية الساذجة (الخطوة 3.2.2) وحقن i.v. بمزيج محضر من الخلايا المستجيبة ل CHS (الخطوة 8.7). في المجموعة الضابطة من الفئران ، لا تحقن أي خلايا.
- قياس سمك الأذن قبل (0 ساعة) وبعد (24 ساعة) التحدي (الخطوات 3.2.1-3.2.6) (الشكل 10).
- بالإضافة إلى ذلك ، قم بإجراء اختبارات على الخلايا المستجيبة المعزولة ل CHS (على سبيل المثال ، النمط الظاهري للخلية أو قياس السيتوكينات المنتجة بواسطة الخلايا المستجيبة ل CHS عن طريق قياس التدفق الخلوي). يمكن أيضا إنشاء مزارع الخلايا ، ويمكن تقييم قدرة الخلايا المستجيبة ل CHS على التكاثر في وجود المستضد أو كمية السيتوكينات المفرزة في supernatants المستزرعة21,22 (البيانات غير المقدمة).
ملاحظة: يتطلب إجراء اختبارات إضافية المزيد من المتبرعين بالخلايا.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
بالنسبة لتحريض CHS ، تم تحسس الحيوانات عن طريق طلاء الجلد (البطن) مع 150 ميكرولتر من 5٪ TNCB أو تحسس زائف مع السيارة وحدها. في اليوم "4" ، تم تحفيز استجابات تورم الأذن لكلتا الأذنين عن طريق الطلاء بالاتصال (التحدي) مع 10 ميكرولتر من 0.4٪ TNCB في كل من الفئران التي كانت على اتصال سابق مع TNCB (مجموعة اختبار) وفئران المجموعة الضابطة (الوهمية الحساسة). وتبين البيانات المقدمة أن الفئران التي تحسست ب TNCB وتحدت بعد 4 أيام أصيبت بزيادة كبيرة في تورم الأذن مقارنة بالفئران التي تم تحسسها بالخداع (الشكل 3، الجدول 2، الاختبار مقابل المجموعة الضابطة). تم التحقق من صحة نتائج تورم الأذن بالكامل في مزيد من الدراسات ، مما يسلط الضوء على أن الزيادة في وذمة الأذن المحددة باستخدام ميكرومتر متفق عليه مع زيادة وزن الأذن (الشكل 4) ، ونشاط MPO (الشكل 5) ، وتركيز IFN-γ في مستخلصات الأذن (الشكل 6) ، وزيادة سماكة الأدمة الوذمية في الفحص النسيجي (الشكل 7) ، ونفاذية الأوعية الدموية للأذن (الشكل 8) ). كما تم العثور على زيادة في تركيز الأجسام المضادة IgG1 الخاصة ب TNP في أمصال فئران الاختبار عند مقارنتها بالحيوانات الضابطة (الشكل 9).
كمثال على الاستجابة المناعية بوساطة الخلايا التائية ، يمكن أيضا نقل CHS إلى الفئران المتلقية الساذجة. وتم توعية الجهات المانحة عن طريق تطبيق TNCB ، وبعد ذلك ، تم إعطاء الخلايا المستجيبة ل CHS i.v. في الفئران المتلقية الساذجة ، والتي تم تحديها باستخدام hapten واختبارها ل CHS 24 h في وقت لاحق (الشكل 10). أظهرت الحيوانات التي تلقت الخلايا المستجيبة ل CHS من متبرعين تم توعيتهم سابقا باستخدام TNCB زيادة كبيرة في تورم الأذن مقارنة بالحيوانات التي تم تحديها فقط (لم تتلق أي خلايا).
تفاعل CHS له آلية معقدة ويتضمن خلايا مختلفة. يحدث عرض المستضد وتنشيط الخلايا التائية / البائية في الأعضاء الليمفاوية الطرفية (على سبيل المثال ، ALNs و SPL). تم تحديد أن الخلايا المستجيبة ل CHS المستنفدة من خلايا CD4 + ولكن ليس خلايا CD8 + قبل نقل الخلايا بالتبني أدت إلى عدم وجود تفاعل CHS في الفئران المتلقية. ووجد أن هذه الخلايا إيجابية ل IFN-γ (عامل النسخ T-box TBX21 ، Tbet +) و IL-17A (مستقبلات حمض الريتينويك النووية اليتيمة المرتبطة بمستقبلات حمض الريتينويك غاما ، RORγT +) (الشكل التكميلي 1).
تم إجراء النتائج المقدمة من التجارب التمثيلية على C57BL/6 و CBA / J من الذكور والإناث في عمر 8-12 أسبوعا. باتباع قواعد 3R في استخدام الحيوانات23 ، وخاصة الحد ، لأغراض هذه المقالة ، يتم عرض نتائج التجارب على مجموعات صغيرة من الحيوانات. تظهر البيانات الواردة في الرسوم البيانية كمتوسط ± SEM. تم تعيين الدلالة الإحصائية عند p < 0.05. تم رسم الرسوم البيانية باستخدام برنامج Prism (انظر جدول المواد).

الشكل 1: تحريض CHS. التحسس والتحدي وقياس الأذن. الاختصارات: CHS = تفاعل فرط الحساسية الاتصالي; TNCB = 2,4,6-trinitrochlorobenzene. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: النقل بالتبني للخلايا المستجيبة ل CHS. الاختصارات: ALNs = الغدد الليمفاوية الإبطية والأربية. CHS = تفاعل فرط الحساسية الاتصالي; i.v. = عن طريق الوريد; SPLs = الطحال. TNCB = 2,4,6-trinitrochlorobenzene. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: التقييم التمثيلي ل CHS إلى TNCB عن طريق قياس تورم الأذن باستخدام ميكرومتر. وكانت الفئران من الفئة الفنية المتعددة الجنسيات (مجموعة الاختبار) أو الوهمية (المجموعة الضابطة) قد تم توعيتها وتحديها لاحقا. تم قياس سمك الأذن قبل وبعد التحدي ، وتم حساب الاختلافات في تورم الأذن عن طريق طرح سمك الأذن 0 ساعة (μm) من سمك الأذن 24 ساعة (μm). تم التعبير عن تورم الأذن كمتوسط ± SEM ، **** p < 0.0001 ، n = 10 فئران / مجموعة (بيانات من الجدول 2). الاختصارات: CHS = تفاعل فرط الحساسية الاتصالي; SEM = الخطأ المعياري للمتوسط ؛ TNCB = 2,4,6-trinitrochlorobenzene. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: التقييم التمثيلي ل CHS عن طريق قياس وزن الأذن. وزن الأذن هو أحد المعلمات التي تتوافق مع تورم الأذن. وكانت الفئران من الفئة الفنية المتعددة الجنسيات (مجموعة الاختبار) أو الوهمية (المجموعة الضابطة) قد تم توعيتها وتحديها لاحقا. في 24 ساعة بعد التحدي ، تم أخذ لكمات قطرها 6 مم من الأذنين التي تمت إزالتها. تم وزن اللكمات على ميزان مختبر تحليلي. تم التعبير عن وزن الأذن بالملليغرام (ملغ) كمتوسط ± SEM ، ***p < 0.001 ، n = 10 فئران / مجموعة. الاختصارات: CHS = تفاعل فرط الحساسية الاتصالي; SEM = الخطأ المعياري للمتوسط ؛ TNCB = 2,4,6-trinitrochlorobenzene. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: التقييم التمثيلي لنشاط المنظمات البحرية المختلطة. يرتبط نشاط MPO المتزايد في مستخلصات الأنسجة بالتهاب الأذن. وواجهت الفئران الحساسة من قبل TNCB (مجموعة الاختبار) والفئران الحساسة للخداع (المجموعة الضابطة) تحديا. في 24 ساعة بعد التحدي ، تمت إزالة الأذنين ، وتم استخراج ومعالجة لكمات قطرها 6 مم من الأذن. يتم التعبير عن نشاط MPO في U لكل محتوى بروتين (U / g من البروتين). تم عرض النتائج كمتوسط ± SEM ، ** p < 0.01 ، n = 5-6 فئران / مجموعة. الاختصارات: CHS = تفاعل فرط الحساسية الاتصالي; MPO = الميلوبيروكسيديز; SEM = الخطأ المعياري للمتوسط ؛ TNCB = 2,4,6-trinitrochlorobenzene; U = وحدات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: التقييم التمثيلي لإنتاج السيتوكين - IFN-γ التركيز في مستخلصات الأذن. وكانت الفئران من الفئة الفنية المتعددة الجنسيات (مجموعة الاختبار) أو الوهمية (المجموعة الضابطة) قد تم توعيتها وتحديها لاحقا. في 24 ساعة بعد التحدي ، تمت إزالة الأذنين ، وتم أخذ لكمات قطرها 6 مم من الأذن. تم تحديد تركيز IFN-γ في متجانسات الأنسجة بواسطة ELISA. أظهرت النتائج على أنها متوسط ± SEM ، * p < 0.05 ، n = 5 فئران / مجموعة. الاختصارات: CHS = تفاعل فرط الحساسية الاتصالي; IFN-γ = جاما الإنترفيرون ؛ SEM = الخطأ المعياري للمتوسط ؛ TNCB = 2,4,6-trinitrochlorobenzene. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: الأنسجة التمثيلية لأنسجة الأذن. تلطيخ الهيماتوكسيلين والإيوسين. وكانت الفئران من الفئة الفنية المتعددة الجنسيات (مجموعة الاختبار) أو الوهمية (المجموعة الضابطة) قد تم توعيتها وتحديها لاحقا. (أ-ج) يتجلى الفحص النسيجي في مجموعة الاختبار في زيادة كبيرة في تركيز الخلايا الالتهابية (الخلايا أحادية النواة ومتعددة الأشكال) ، خاصة في الأدمة ، مع تكوين الخراج الدقيق في البشرة. كما لوحظ سماكة الأدمة الوذمية والبشرة السميكة المفرطة التنسج. (مد إلى هاء) المجموعة الضابطة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: اختبار نفاذية الأوعية الدموية التمثيلي. وذمة أنسجة الأذن الملحوظة هي نتيجة لزيادة نفاذية الأوعية الدموية. لتحديد التغيرات في نفاذية الأوعية الدموية ، تم توعية الفئران TNCB (مجموعة الاختبار) أو صورية (المجموعة الضابطة) ثم تم تحديها بعد 4 أيام. في 23 ساعة بعد التحدي ، تم حقن إيفانز بلو ، وبعد 1 ساعة من حقن إيفانز الأزرق ، تم قتل الحيوانات الرحيم ، وتم إجراء لكمات قطرها 6 مم من الأذن. أظهرت النتائج على أنها متوسط ± SEM ، ** p < 0.01 ، n = 5 فئران / مجموعة. الاختصارات: CHS = تفاعل فرط الحساسية الاتصالي; SEM = الخطأ المعياري للمتوسط ؛ TNCB = 2,4,6-trinitrochlorobenzene. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 9: قياس الأجسام المضادة التمثيلية المضادة ل TNP IgG1. تم قياس تركيز الأجسام المضادة المضادة ل TNP IgG1 في المصل بعد 24 ساعة من التحدي مع hapten TNCB في الفئران الحساسة (السيطرة) الزائفة (التحكم) وفي الفئران الحساسة من TNCB (مجموعة الاختبار). تم اختبار الأمصال التي تم جمعها لتركيز الأجسام المضادة بواسطة ELISA. أظهرت النتائج على أنها متوسط ± SEM ، ***p < 0.001 ، n = 10 فئران / مجموعة. الاختصارات: CHS = تفاعل فرط الحساسية الاتصالي; IgG1 = الغلوبولين المناعي G الفئة الفرعية 1; SEM = الخطأ المعياري للمتوسط ؛ TNCB = 2,4,6-trinitrochlorobenzene. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 10: النقل التمثيلي بالتبني للخلايا المستجيبة ل CHS. تم الحصول على الخلايا المستجيبة ل CHS من الجهات المانحة التي تم توعيتها مع TNCB. بعد ذلك ، تم حقن الخلايا المناعية التي تم جمعها ، أي في متلقين متلازمين ساذجين ، تم تحديهم لاستنباط مرحلة مستجيب CHS. لم تتلق المجموعة الضابطة من الفئران أي خلايا قبل التحدي. تم قياس سمك الأذن قبل وبعد التحدي. أظهرت النتائج على أنها متوسط ± SEM ، ***p < 0.001 ، n = 7 فئران / مجموعة. الاختصارات: CHS = تفاعل فرط الحساسية الاتصالي; SEM = الخطأ المعياري للمتوسط ؛ TNCB = 2,4,6-trinitrochlorobenzene. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| سلالة الماوس | محلول التحسس (الجرعة) على البطن المحلوق |
محلول الاستنباط (الجرعة) على جانبي الأذن / ثانية |
يوم التوعية / الاستنباط | الحكام | |||||||||||
| BALB/c (H-2d)؛ C57BL/6 (H-2b) TCRδ-/-, β2m-/-, CD1d-/- (B10 PL (H-2 u background) |
25 ميكرولتر من 0.5٪ DNFB في خليط زيت الأسيتون والزيتون (نسبة 4: 1) | 5 ميكرولتر من 0.1٪ DNFB في خليط زيت الأسيتون والزيتون (نسبة 4: 1) | 0 / 5 | 22 | |||||||||||
| C57BL/6 (H-2b) | 50 ميكرولتر من 0.5٪ DNFB في خليط زيت الأسيتون والزيتون (نسبة 4: 1) | 25 ميكرولتر من 0.2٪ DNFB في خليط زيت الأسيتون والزيتون (نسبة 4: 1) | 0 / 5 | 32 | |||||||||||
| C57BL/6 (H2b)؛ IL-17A-/- (خلفية C57BL/6) | 150 ميكرولتر من 5٪ TNCB في خليط الأسيتون والإيثانول (نسبة 1: 3) | 10 ميكرولتر من 0.4 ٪ TNCB في خليط زيت الزيتون والأسيتون (نسبة 1: 1) | 0 / 4 | 33 | |||||||||||
| CBA/J (H-2k); C57BL/6 (H-2b) TLR2-/-، MyD88-/-، IL-17A-/- (خلفية C57BL/ 6) |
150 ميكرولتر من 5٪ TNP-Cl (TNCB) في خليط الأسيتون والإيثانول (نسبة 1: 3) | 10 ميكرولتر من 0.4٪ TNP-Cl (TNCB) في خليط زيت الزيتون والأسيتون (نسبة 1: 1) | 0 / 4 | 21 | |||||||||||
| C57BL/6 (H-2b)؛ بالب / ج (H-2د) | 25 ميكرولتر من 1 ٪ TNCB في الأسيتون | 10 ميكرولتر من 0.1 أو 0.2 ٪ TNCB في الأسيتون (وأعلى حتى 1 ٪) | 0 / 7 | 34 | |||||||||||
| C57BL/6 (H-2b)؛ TLR2-/-/ TLR4-/- (الفئران بالضربة القاضية المزدوجة على خلفية C57BL/6) |
100 ميكرولتر من 3 ٪ TNCB في الأسيتون | 20 ميكرولتر من 1٪ TNCB في الأسيتون (فقط على الجانب الخلفي من الأذنين) | 0 / 5 | 31 | |||||||||||
| C57BL/6 (H-2b) الفئران الناقصة من الفئة الثانية MHC (خلفية C57BL/6) |
100 ميكرولتر من 3٪ TNCB في خليط زيت الأسيتون وزيت الزيتون (نسبة 4: 1) | 20 ميكرولتر من 0.5 أو 1 ٪ TNCB في خليط زيت الأسيتون وزيت الزيتون (نسبة 4: 1) | 0 / 6 | 35 | |||||||||||
| C57BL/6 (H-2b) | 100 ميكرولتر من 7 ٪ TNCB في الأسيتون | 20 ميكرولتر 1٪ TNCB في الأسيتون | 0 / 5 | 36 | |||||||||||
| C57BL/6 (H-2b) | 100 ميكرولتر 3 ٪ OX في الإيثانول | 20 ميكرولتر 1 ٪ OX في الإيثانول | 0 / 5 | ||||||||||||
| C57BL/6 (H-2b)؛ CD4-/-، CD8-/- (خلفية C57BL/ 6) | 25 ميكرولتر من 0.5٪ DNFB في زيت الأسيتون والزيتون (نسبة 4: 1) | 10 ميكرولتر من 0.2٪ DNFB في زيت الأسيتون والزيتون (نسبة 4: 1) | 0 / 5 | 10 | |||||||||||
| C57BL/6 (H-2b)؛ CD4-/-، CD8-/- (خلفية C57BL/ 6) | 150 ميكرولتر من 3٪ OX في الكحول والأسيتون (نسبة 3: 1) | 10 ميكرولتر 1٪ OX في الكحول والأسيتون (نسبة 3: 1) | 0 / 5 | ||||||||||||
| C57BL/6 (H-2b)؛ C3H / HeN (H-2k) ؛ TLR4-/- (خلفية C3H/HeJ)؛ MyD88-/- (خلفية C57BL/6) | 100 ملغ / أذن من 10 ٪ NiCl2 في الفازلين الأبيض على الجانب الظهري من كلتا الأذنين | 10 ٪ NiCl2 في الفازلين الأبيض | 0,1,2 / 23, 24 | 37 | |||||||||||
| NOD (H-2g7) MyD88-/- (خلفية NOD) | 400 ميكرولتر من 0.5 ٪ FITC في الأسيتون وثنائي بوتيل الفثالات | 10 ميكرولتر من 0.1 ٪ FITC في الأسيتون وثنائي بوتيل الفثالات | 0 / 5 | 25 | |||||||||||
الجدول 1: مقارنة نموذج CHS في دراسات مختلفة. الاختصارات: DNFB = 1-فلورو-2,4-دينيتروبنزين; FITC = الفلوريسين إيزوثيوسيانات. NiCl2 = كلوريد النيكل (II) ؛ TNCB = 2,4,6-trinitrochlorobenzene; TNP-Cl = كلوريد ترينيتروفينيل; OX = أوكسازولون. يرجى النقر هنا لتنزيل هذا الجدول.
| المجموعة الضابطة (سلبية) | مجموعة الاختبار (تفاعل CHS) | ||||||
| الماوس # الأذن: L ، R | 0 ساعة سمك الأذن [ميكرومتر] | 24 ساعة سمك الأذن [ميكرومتر] | 24 ساعة – 0 ساعة سمك الأذن [ميكرومتر] | الماوس # الأذن: L ، R | 0 ساعة سمك الأذن [ميكرومتر] | 24 ساعة سمك الأذن [ميكرومتر] | 24 ساعة – 0 ساعة سمك الأذن [ميكرومتر] |
| 1 لتر | 365 | 380 | 15 | 1 لتر | 345 | 427.5 | 82.5 |
| 1 ص | 335 | 380 | 45 | 1 ص | 340 | 455 | 115 |
| 2 لتر | 345 | 355 | 10 | 2 لتر | 355 | 475 | 120 |
| 2 ص | 327.5 | 352.5 | 25 | 2 ص | 342.5 | 457.5 | 115 |
| 3 لتر | 340 | 370 | 30 | 3 لتر | 340 | 460 | 120 |
| 3 ص | 325 | 355 | 30 | 3 ص | 345 | 495 | 150 |
| 4 لتر | 335 | 380 | 45 | 4 لتر | 357.5 | 432.5 | 75 |
| 4 ص | 340 | 350 | 10 | 4 ص | 335 | 402.5 | 67.5 |
| 5 لتر | 350 | 380 | 30 | 5 لتر | 335 | 387.5 | 52.5 |
| 5 ص | 337.5 | 360 | 22.5 | 5 ص | 335 | 425 | 90 |
| 6 لتر | 335 | 365 | 30 | 6 لتر | 350 | 430 | 80 |
| 6 ص | 340 | 375 | 35 | 6 ص | 342.5 | 405 | 62.5 |
| 7 لتر | 345 | 337.5 | 0 | 7 لتر | 340 | 502.5 | 162.5 |
| 7 ص | 345 | 335 | 0 | 7 ص | 327.5 | 447.5 | 120 |
| 8 لتر | 370 | 380 | 10 | 8 لتر | 327.5 | 515 | 187.5 |
| 8 ص | 375 | 355 | 0 | 8 ص | 327.5 | 540 | 212.5 |
| 9 لتر | 385 | 370 | 0 | 9 لتر | 330 | 415 | 85 |
| 9 ص | 342.5 | 362.5 | 20 | 9 ص | 327.5 | 390 | 62.5 |
| 10 لتر | 307.5 | 340 | 32.5 | 10 لتر | 337.5 | 445 | 107.5 |
| 10 ص | 325 | 350 | 25 | 10 ص | 352.5 | 455 | 102.5 |
| دني | 20.75 | دني | 108.5 | ||||
| ± SEM | 3.245 | ± SEM | 9.565 | ||||
الجدول 2: مثال تمثيلي لحساب الفرق في سمك الأذن في مرحلة المستجيب من CHS. حساب الفرق في سمك الأذن قبل وبعد التحدي مع hapten: 24 ساعة سمك الأذن (ميكرومتر) - 0 ساعة سمك الأذن (ميكرومتر). كل أذن تعتبر قياسا منفصلا. تورم الأذن المعبر عنه بالميكرومتر (ميكرومتر) ± SEM ، n = 20. الاختصارات: L = يسار; R = يمين. يرجى النقر هنا لتنزيل هذا الجدول.
| تخفيف iSTD مع AD | مكافحة TNP IgG1 Ab (U / mL) |
| 100x | 250 |
| 200x | 125 |
| 400x | 62.5 |
| 800x | 31.25 |
| 1600x | 15.63 |
| 3200x | 7.8 |
| فقط م | 0 |
الجدول 3: تحضير التركيزات المختلفة من iSTD للمنحنى القياسي لقياس IgG1 Ab المضاد ل TNP. كان من المفترض أن يكون تخفيف iSTD 100x 250 U من مضاد TNP IgG1 Ab. اختصارات: Ab = الأجسام المضادة. AD = مقايسة مخففة; iSTD = المعيار الداخلي; IgG1 = الغلوبولين المناعي G الفئة الفرعية 1; TNP = 2,4,6-ترينيتروفينيل; U = وحدات. يرجى النقر هنا لتنزيل هذا الجدول.
الشكل التكميلي 1: النمط الظاهري للخلايا المستجيبة ل CHS. تم الحصول على الخلايا المستجيبة ل CHS من ALNs و SPLs من الجهات المانحة ، والتي تم توعيتها سابقا مع TNCB. (أ) باستخدام تقنية MACS ، تم استنفاد الخلايا المستجيبة ل CHS (ALNs و SPLs بأكملها) إما من خلايا CD4 + أو CD8 +. في وقت لاحق ، تم إجراء نقل الخلايا بالتبني قبل استنباط مرحلة مستجيب CHS. تم التعبير عن تورم الأذن على أنه متوسط ± SEM. (B-E) باستخدام تقنية قياس التدفق الخلوي ، تم تلطيخ الخلايا المستجيبة ل CHS والساذجة (التي تم الحصول عليها من الفئران الساذجة) ل IFN-γ و Tbet و IL-17A و RORγt قبل التحليل. تم إغلاق الخلايا لسكان TCRβ + CD4 +. أظهرت النتائج على أنها متوسط ± SEM ، ***p < 0.001 ، ** p < 0.01 ، * p < 0.05 ، n = 4-6 فئران / مجموعة. الاختصارات: ALNs = الغدد الليمفاوية الإبطية والأربية. CD4 = مجموعة من التمايز 4 ؛ CHS = تفاعل فرط الحساسية الاتصالي; IFN-γ = جاما الإنترفيرون ؛ IL = إنترلوكين; MACS = فرز الخلايا المنشطة مغناطيسيا ؛ ns = غير معنوي ؛ RORγt = غاما مستقبلات نووية يتيمة مرتبطة بمستقبلات حمض الريتينويك. SEM = الخطأ المعياري للمتوسط ؛ SPLs = الطحال. Tbet = عامل نسخ T-box TBX21; TCRβ = بيتا مستقبلات الخلايا التائية; TNCB = 2,4,6-trinitrochlorobenzene. يرجى النقر هنا لتنزيل هذا الملف.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
يتم تحفيز CHS عن طريق haptens ، والتي ترتبط بمستضدات البروتين الذاتي في الجلد ، مما يخلق مستضدات جديدة. يتم التوسط في CHS من خلال التوظيف المحلي خارج الأوعية الدموية للخلايا التائية المستجيبة ل CHS المستجيبة للمستضد ، مما يؤدي إلى تورم في الأنسجة المتحدية ، ويبلغ ذروته بعد 24 ساعة من تعرض الجلد الثانوي لنفس الهابتن6. يحدث تورم الأنسجة بشكل رئيسي بسبب تسلل الكريات البيض وترسب الفيبرين المعتمد على الكريات البيض24. يمكن الكشف عن هذه التغييرات باستخدام ميكرومتر يقيس تورم الأذن لدى الفئران الحساسة والصعبة مقابل الفئران الحساسة والمليئة بالتحديات.
يمكن أيضا تحديد CHS من خلال مقارنة وزن الأذن. بعد ذلك ، يمكن استخدام لكمات الأذن المستخدمة لتحديد وزن الأذن لإجراء مزيد من الاختبارات. تتكون الخلية التي تتسلل إلى الأذنين الملتتهبتين من الخلايا الليمفاوية التائية المنتجة للسيتوكين والعدلات الإيجابية MPO. في متجانسات أنسجة الأذن ، يمكن قياس معلمات مختلفة ، مثل نشاط MPO أو تركيز السيتوكينات المؤيدة للالتهابات (على سبيل المثال ، TNF-α ، IFN-γ ، IL-17A ، أو غيرها) باستخدام اختبار ELISA أو التعبير عن mRNA السيتوكين في الجلد باستخدام اختبار qPCR25. بالإضافة إلى ذلك ، يمكن تقييم تغييرات نفاذية السفينة باستخدام اختبار إيفانز الأزرق21,26.
في أنسجة الأذن الملتهبة ، يمكن أيضا استكمال التغييرات التي لوحظت باختبارات في المختبر ، مع تسليط الضوء على تكاثر الخلايا التائية وإنتاج السيتوكين. يمكن تحقيق ذلك بسهولة عن طريق زراعة ALNs في وجود مستضدات البروتين المقترنة ب hapten22,27. يوفر تقييم إفراز السيتوكين بواسطة ALNs المعزولة من الفئران الحساسة ولكن غير المتحدية تفاصيل بشأن إنتاج السيتوكين من قبل الخلايا المستجيبة ل CHS في مكان تحريضها.
القيود
يقيس العديد من الميكرومترات تورم الأذن بدقة مختلفة. على سبيل المثال ، يتم ممارسة الضغط الأدنى بواسطة فرجار زنبركي ، لذلك يبدو أن النتائج ستعكس بشكل أفضل قياس سمك الأذن الفعلي. ومع ذلك ، من المرجح أن يضغط الميكرومتر الذي يمارس المزيد من الضغط ، مثل Mitutoyo ، بشكل أكثر إحكاما على السائل الذي يتراكم في الأذنين في المرحلة المبكرة من تكوين الوذمة. يمكن تصور الطبيعة ثنائية الطور ل CHS بشكل أكثر وضوحا باستخدام مثل هذه الميكرومترات لأنه يتم ممارسة المزيد من الضغط. هذا أكثر صعوبة عند استخدام الفرجار الربيعي مع الضغط الخفيف28. ومع ذلك ، في بعض الدراسات ، تم قياس سمك الأذنين باستخدام الفرجار29. أيضا ، تضمن تجربة المراقب قياسات دقيقة ، والتي يمكن أن تتأثر بالمشاعر الذاتية ، حتى لو كان المراقب غير مدرك للمجموعات التجريبية.
تم وصف طرق بديلة هنا يمكن أن تساعد في تأكيد قياسات تورم الأذن باستخدام ميكرومتر ، مما يجعل البيانات المقدمة أكثر موثوقية وأقل ذاتية. ومع ذلك ، لا يمكن استخدام هذه الاستراتيجيات البديلة لتقييم CHS إلا في وقت واحد. يمكن تكرار قياسات الميكرومتر في نقاط زمنية مختلفة ، مما يسمح بدراسة حركية CHS.
التعديلات
يختلف بروتوكول دراسة تفاعل CHS الذي نستخدمه في مختبرنا اختلافا كبيرا عن تلك المستخدمة في المختبرات الأخرى ، بما في ذلك جرعة hapten وتكوين المذيبات المستخدمة لكل من الاستنباط والتحسس ، وكذلك النقطة الزمنية التي يتم فيها تقييم التفاعل. يمكن قياس سمك الأذن في نقاط زمنية مختلفة (على سبيل المثال ، 2 ساعة و 24 ساعة و 48 ساعة و 72 ساعة بعد التحدي) 10,30. يوضح الجدول 1 نماذج تجريبية مختلفة ، لا سيما الاختلافات في سلالة الحيوان ، hapten ، وأوقات التحسس / التحدي المستخدمة في الدراسات المختلفة 10,21,22,26,31,32,33,34,35,36,37 . يمكن أيضا إجراء بروتوكول CHS دون حلاقة سابقة لبطن الفئران.
الفرق التالي يتعلق بتنفيذ الاستنباط (التحدي) نفسه. كما هو معتاد ، يتم التحسس عن طريق طلاء جلد بطن الفئران الحليقة باستخدام الهابتن أو السيارة وحدها. في وقت لاحق ، في كلتا المجموعتين ، يتم تحدي أذن واحدة مع hapten المخفف على كل جانب من جوانب الأذن. كعنصر تحكم ، يتم طلاء الأذن المقابلة بكمية مماثلة من السيارة وحدها10,31.
خطوات حاسمة
اللحظة الأكثر أهمية هي تشغيل CHS ، حيث تعتمد نتائج الاختبار عليها. (1) محلول Hapten متطاير للغاية وحساس للضوء ، لذلك يجب إغلاقه بإحكام وحمايته من الضوء ، وعند استخدامه ، يجب تطبيقه بسرعة على جلد الحيوانات حتى لا يتبخر. (2) بعد تطبيق hapten على جلد البطن ، يجب تجفيفه قبل أن يعود الحيوان إلى القفص لأن الفئران يمكن أن تشوهه على الفراش أو تطبقه على الأذنين بمخالبها (ثم قد يكون قياس سمك الأذن غير كاف). (3) ومن المعروف أيضا طرق مختلفة لوضع العلامات على الحيوانات، مثل وسم ذيول الفئران بعلامة مقاومة للمذيبات. ومع ذلك ، فإن الأصباغ الموجودة في العلامة قد تصبح (غير مدروسة) هابتن وتؤدي إلى CHS. لذلك ، في هذه الدراسة ، تم اختيار طريقة وضع العلامات التي لا تؤثر على التفاعل. (4) اختيار طريقة الحلاقة مهم جدا لأنه يمكن أن يهيج الجلد. في هذا البروتوكول ، تم استخدام صابون رمادي لأنه يحتوي على خصائص مهدئة. يسرع علاج الجروح الطفيفة والجروح المتقيحة ، والتي تساعدها آثاره المضادة للبكتيريا. يهدئ تورم والتهاب الجلد.
هناك حاجة إلى مزيد من التحقيقات وتوحيد الإجراءات التجريبية ، بما في ذلك استخدام الحيوانات (الإجهاد والجنس) ، لمقارنة النتائج من الدراسات المختلفة.
يمكن اختبار العديد من العوامل البيئية المختلفة والمواد الجديدة ذات الوظائف البيولوجية في نموذج CHS. يمكن أن يكون هذا النموذج مفيدا إذا أراد الباحثون إظهار ما إذا كانت العوامل التي تم اختبارها تعدل الاستجابات المناعية المعتمدة على الخلايا التائية.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgments
تم دعم هذه الدراسة من خلال الإعانة SUBZ. A020.22.060 من الجامعة الطبية في فروتسواف ، بولندا ، ومن خلال منح من وزارة العلوم والتعليم العالي N N401 545940 إلى MS و IP2012 0443 72 إلى MMS.
Materials
| Name | Company | Catalog Number | Comments |
| 70% ethanol | Merck KGaA, Darmstadt, Germany | 65350-M | for surface disinfection |
| 96-well flat-bottom plates, polypropylene | Greiner Bio-One GmbH, Kremsmunster, Austria | 655101 | for MPO and Evans blue measurement - plates should be made of polypropylene, that has a lower binding capacity so proteins or DNA will not bind |
| Acetone (ACS reagent, ≥99.5%) | Merck KGaA, Darmstadt, Germany | 179124 | |
| Aluminum foil | Merck KGaA, Darmstadt, Germany | Z185140 | |
| Analytical balance | Sartorius Weighing Technology GmbH, Goettingen, Germany | PRACTUM224-1s, 29105177 | |
| Automated tissue processor | MediMeas Instruments, Sarsehri, Haryana, India | MTP-E-212 | automatically prepare tissue samples by fixing, dehydrating, clearing, and infiltrating them with paraffin |
| BD Vacutainer SST II Advance (tube with gel for obtaining serum) | Becton Dickinson (BD), Franklin Lakes, NJ, USA | BD 366882 | |
| Bicinchoninic acid kit for protein determination | Merck KGaA, Darmstadt, Germany | BCA1-1KT | |
| Biotin Rat Anti-Mouse IgG1 | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 553441 | |
| BSA (bovine serum albumine) | Merck KGaA, Darmstadt, Germany | A9418 | protein assays & analysis, 2 mg/mL |
| Cell strainer, pore size 70 μm | BIOLOGIX, China | 15-1070 | suitable for 50 mL tubes |
| Coverslip | VWR, Radnor, Pennsylvania, United States | 631-1583 | 24 mm, but it possible to use different size |
| Disposable pipettes capacity: 5 mL, 10 mL, 25 mL | Merck KGaA, Darmstadt, Germany | Z740301, Z740302, Z740303 | |
| DPBS (Dulbecco′s phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 14190144 | no calcium, no magnesium, mammalian cell culture |
| DPX Mountant for histology | Merck KGaA, Darmstadt, Germany | 6522 | mounting media for H-E, might be used some other e.g, Canada balsam |
| Dumont 5 tweezers - straight | Animalab, Poznan, Poland | 11251-10FST | surgical instruments for procedures on mice (should be steriled) |
| Dumont 7 tweezers - bent | Animalab, Poznan, Poland | 11272-50FST | surgical instruments for procedures on mice (should be steriled) |
| Eosin Y solution, alcoholic | Merck KGaA, Darmstadt, Germany | HT110116 | |
| Eppendorf Safe-Lock Tubes 1.5 mL | Eppenforf, Germany | 3,01,20,086 | polypropylene |
| Eppendorf Safe-Lock Tubes, 2.0 mL | Eppenforf, Germany | 3,01,20,094 | polypropylene, round bottom (the homogenization beads can easily move) |
| Ethanol 100% (absolute alkohol) | Merck KGaA, Darmstadt, Germany | 1.07017 | |
| Ethanol 96% | Merck KGaA, Darmstadt, Germany | 1.59010 | |
| Evans blue | Merck KGaA, Darmstadt, Germany | E2129 | |
| FBS (fetal bovine serum) | ThermoFisher Scientific, Waltham, Massachusetts, USA | A3160802 | |
| Formalin solution, neutral buffered, 10% | Merck KGaA, Darmstadt, Germany | HT501128 | |
| Formamide 99.5% (GC) | Merck KGaA, Darmstadt, Germany | F7503 | |
| Freezer -20 °C | Bosch, Germany | GSN54AW30 | |
| Fridge +4 °C / freezer -20 °C | Bosch, Germany | KGV36V10 | mammalian Cell Culture, qualified, Brazil, 10 x 50 mL |
| Glass microskope slides, SuperFrost Plus | VWR, Radnor, Pennsylvania, United States | 631-0108, 631-0446, 631-0447, 631-0448, 631-0449 | Slides that eliminates the need to apply adhesive materials or protein coatings, to preventing any tissue sections loss during staining. |
| Graph Pad Prism | GraphPad Software Inc. | v. 9.4.0 | |
| Grey soap | Pollena Ostrzeszów, Producent Chemii Gospodarczej Sp. Z.o.o. , Sp. K., Poland | Bialy jelen soap bar | grey Soap Bar Natural Hypoallergenic. Generally available product |
| H2SO4 (sulfuric acid) 1 mol/l (1 M) | Merck KGaA, Darmstadt, Germany | 1.60313 | |
| Harris hematoxylin solution | Merck KGaA, Darmstadt, Germany | HHS16 | |
| Hemocytometer | VWR, Avantor, U.S.A | 612-5719 | manual counting chamber is recommend, which is more accurate |
| Hexadecyltrimethylammonium bromide | Merck KGaA, Darmstadt, Germany | H5882 | |
| Homogenizer | QIAGEN Hilden, Germany | Tissue Lyser LT, SN 23.1001/05234 | homogenizer with stainless steel beads (diameter 5 mm) for 2 mL centrifuge tubes |
| Horseradish peroxidase streptavidin (HRP streptavidin) | Vector Laboratories, Inc., Burlingame, CA, USA | SA-5004-1 | |
| Hydrogen peroxide solution (H202) | Merck KGaA, Darmstadt, Germany | H1009 | |
| Incubator Heracell 150i | Thermo Electron LED Gmbh, Germany | 41071068 | 37 oC in the atmosphere of 5 % CO2, and 65 0C for deparaffinization the sections for histology |
| Ketamine 100 mg/mL, solution for injection | Biowet Pulawy Sp. z o.o., Pulawy, Poland | cat.# not avaliable | |
| KH2PO4 (potassium dihydrogen phosphate) 99.995% anhydrous basis | Merck KGaA, Darmstadt, Germany | 1.05108 | |
| Laboratory Centrifuge | Heraeus Megafuge 1.0R, Thermo Scientific, Germany | B00013899 | speed to 300 x g, with cooling to 4 0C |
| Laboratory Centrifuge | Heraeus Fresco 21, Thermo Scientific, Germany | 75002425 | speed to 3,000 x g, with cooling to 4 0C |
| Mask (FFP2) | VWR, Radnor, Pennsylvania, United States | 111-0917 | for working with ortho-dianisine dihydrochloride |
| Mice | Breeding unit of the Chair of Biomedical Sciences, Faculty of Health Sciences, Jagiellonian University Medical College, Krakow, Poland | CBA/J, C57BL/6 | |
| Micrometer | Mitutoyo, Tokyo, Japan | 193-111 | digit Outside Micrometer, Ratchet Stop, 0-25mm Range, 0.001mm Graduation, +/-0.002mm Accuracy, https://shop.mitutoyo.pl/web/mitutoyo/pl_PL/all/all/Mikrometr%20analogowy%20/PR/193-111/index.xhtml |
| microplate, 96 well, microlon, high binding (for ELISA test) | Greiner Bio-One GmbH, Kremsmunster, Austria | 655061 | with maxi-sorp binding surfaces for reliable and reproducible results in colormetric assays |
| Microscope with objectives | Leica Microsystems CMS GmbH, Germany | DM1000, 294011-082007 | histology presented in the paper was performed under ThermoFisher Scientific EVOS M5000 Imaging System, with objectives: FL 20X LWDPH, 0.40NA/3.1WD and FL 40X LWDPH 0.65NA/1.79WD |
| Myeloperoxidase from human leukocytes (MPO standard) | Merck KGaA, Darmstadt, Germany | M6908 | |
| Na2HPO4 x 7 H2O (sodium phosphate dibasic heptahydrate) | Merck KGaA, Darmstadt, Germany | S9390 | |
| Olive-oil | Merck KGaA, Darmstadt, Germany | 75343 | pure, natural |
| OptEIA Mouse IFN-γ ELISA Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555138 | |
| Ortho-dianisine dihydrochloride | Merck KGaA, Darmstadt, Germany | D3252 | |
| Paraffin wax | Merck KGaA, Darmstadt, Germany | 76242 | beads, waxy solid |
| PBS (phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 20012027 | pH 7.2, mammalian cell culture |
| ph meter | Elmetron, Poland | CP-401 | |
| Pipettes, variable volume with tips | Merck KGaA, Darmstadt, Germany | EP3123000900-1EA | 3-pack, Option 1, 0.5-10 uL/10-100 uL/100-1000 uL, includes epT.I.P.S. |
| Razor blade | VWR, Radnor, Pennsylvania, United States | PERS94-0462 | scraper and cutter blades, single edge, aluminium spine, 100 blades per box, individually wrapped |
| Rotary microtome | MRC Laboratory-Instruments, Essex, CM20 2HU UK | HIS-202A | |
| Scissors - straight, sharp / sharp | Animalab, Poznan, Poland | 14060-10FST | Surgical instruments for procedures on mice (should be steriled) |
| Screw cap (open top) | Merck KGaA, Darmstadt, Germany | 27056 | black polypropylene hole cap, for use with 22 mL vial with 20-400 thread |
| Spectrophotometer | BioTek Instruments, U.S.A | 201446 | universal microplate spectrophotometer: λ range: 200 - 999 nm, absorbance measurement range: 0.000 - 4.000 Abs |
| Staining dish 20 slides with rack | Merck KGaA, Darmstadt, Germany | S6141 | e.g. 20 slide staining dishes complete with covers, slide rack and handle |
| Sterile Disposable Biopsy Punch 6mm | Integra LifeSciences, Princeton, NJ, USA | 33-36 | |
| Surgical scissors | Animalab, Poznan, Poland | 52138-46 | surgical instruments for procedures on mice (should be steriled) |
| Tissue processing cassettes | Merck KGaA, Darmstadt, Germany | Z672122 | tissue processing/ embedding cassettes with lid |
| TMB Substrate Reagent Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555214 | |
| TNCB (2,4,6-trinitrochlorobenzene) | Tokyo Chemical Industry CO., LTD, Japan | C0307 | |
| TNP-BSA (bovine serum albumin conjugated with 2,4,6-trinitrophenyl) | Biosearch Technologies LGC, Petaluma, CA, USA | T-5050 | |
| T-PER (tissue protein extration reagent) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 78510 | |
| Tubes 15 mL sterile | Merck KGaA, Darmstadt, Germany | CLS430055 (Corning) | polypropylene, conical bottom |
| Tubes 50 mL, sterile | Merck KGaA, Darmstadt, Germany | CLS430290 (Corning) | polypropylene, conical bottom |
| Tween 20 | Merck KGaA, Darmstadt, Germany | P1379 | |
| Vials, screw top, clear glass (vial only) 22 mL | Merck KGaA, Darmstadt, Germany | 27173 | for the preparation of hapten, screwed on so that it does not evaporate |
| Water bath | AJL Electronic, Poland | LW102 | |
| Wax (paraffin) dispenser | VWR, Radnor, Pennsylvania, United States | 114-8737 | |
| Xylazine (xylapan 20 mg/mL) solution for injection | Vetoquinol Biowet Sp. z o.o., Gorzow Wielkopolski, Poland | cat.# not avaliable | |
| Xylene (histological grade) | Merck KGaA, Darmstadt, Germany | 534056 |
References
- Nosbaum, A., Vocanson, M., Rozieres, A., Hennino, A., Nicolas, J. F. Allergic and irritant contact dermatitis. European Journal of Dermatology. 19 (4), 325-332 (2009).
- Hertl, M., et al. Predominance of epidermal CD8+ T lymphocytes in bullous cutaneous reactions caused by beta-lactam antibiotics. The Journal of Investigative Dermatology. 101 (6), 794-799 (1993).
- Martin, S. F. T lymphocyte-mediated immune responses to chemical haptens and metal ions: implications for allergic and autoimmune disease. International Archives of Allergy and Immunology. 134 (3), 186-198 (2004).
- Takeyoshi, M., Iida, K., Suzuki, K., Yamazaki, S. Skin sensitization potency of isoeugenol and its dimers evaluated by a non-radioisotopic modification of the local lymph node assay and guinea pig maximization test. Journal of Applied Toxicology. 28 (4), 530-534 (2008).
- Nakamura, K., Aizawa, M. Studies on the genetic control of picryl chloride contact hypersensitivity reaction in inbred rats. Transplantation Proceedings. 13 (2), 1400-1403 (1981).
- Asherson, G. L., Ptak, W. Contact and delayed hypersensitivity in the mouse. I. Active sensitization and passive transfer. Immunology. 15 (3), 405-416 (1968).
- Honda, T., Egawa, G., Grabbe, S., Kabashima, K. Update of immune events in the murine contact hypersensitivity model: toward the understanding of allergic contact dermatitis. The Journal of Investigative Dermatology. 133 (2), 303-315 (2013).
- Kaplan, D. H., Jenison, M. C., Saeland, S., Shlomchik, W. D., Shlomchik, M. J. Epidermal langerhans cell-deficient mice develop enhanced contact hypersensitivity. Immunity. 23 (6), 611-620 (2005).
- Wang, L., et al. Langerin expressing cells promote skin immune responses under defined conditions. Journal of Immunology. 180 (7), 4722-4727 (2008).
- Wang, B., et al. CD4+ Th1 and CD8+ type 1 cytotoxic T cells both play a crucial role in the full development of contact hypersensitivity. Journal of Immunology. 165 (12), 6783-6790 (2000).
- Mori, T., et al. Cutaneous hypersensitivities to hapten are controlled by IFN-gamma-upregulated keratinocyte Th1 chemokines and IFN-gamma-downregulated langerhans cell Th2 chemokines. The Journal of Investigative Dermatology. 128 (7), 1719-1727 (2008).
- Peszkowski, M. J., Warfvinge, G., Larsson, A. Allergic and irritant contact responses to DNFB in BN and LEW rat strains with different TH1/TH2 profiles. Acta Dermato-Venereologica. 74 (5), 371-374 (1994).
- Henningsen, S. J., Mickell, J., Zachariae, H. Plasma kinins in dinitrochlorobenzene contact dermatitis of guinea-pigs. Acta Allergologica. 25 (5), 327-331 (1970).
- Maibach, H. I., Maguire, H. C. Elicitation of delayed hypersensitivity (DNCB contact dermatitis) in markedly panleukopenic guinea pigs. The Journal of Investigative Dermatology. 41, 123-127 (1963).
- Martel, B. C., Lovato, P., Bäumer, W., Olivry, T. Translational animal models of atopic dermatitis for preclinical studies. The Yale Journal of Biology and Medicine. 90 (3), 389-402 (2017).
- Jin, H., He, R., Oyoshi, M., Geha, R. S. Animal models of atopic dermatitis. The Journal of Investigative Dermatology. 129 (1), 31-40 (2009).
- Li, Y. Z., Lu, X. Y., Jiang, W., Li, L. F. Anti-inflammatory effect of qingpeng ointment in atopic dermatitis-like murine model. Evidence-Based Complementary and Alternative. 2013, 907016 (2013).
- Hoggatt, J., Hoggatt, A. F., Tate, T. A., Fortman, J., Pelus, L. M. Bleeding the laboratory mouse: Not all methods are equal. Experimental Hematology. 44 (2), 132-137 (2016).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and th17 differentiation of naïve CD4 T lymphocytes. Journal of Visualized Experiments. (79), e50765 (2013).
- Vlab, A. Hemocytometer - Counting of Cells. Amrita University. , Available from: https://www.youtube.com/watch?v=MKS0KM3lr90 (2011).
- Majewska-Szczepanik, M., Strzepa, A., Marcińska, K., Wen, L., Szczepanik, M. Epicutaneous immunization with TNP-Ig and Zymosan induces TCRαβ+ CD4+ contrasuppressor cells that reverse skin-induced suppression via IL-17A. International Archives of Allergy and Immunology. 164 (2), 122-136 (2014).
- Majewska-Szczepanik, M., Zemelka-Wiącek, M., Ptak, W., Wen, L., Szczepanik, M. Epicutaneous immunization with DNP-BSA induces CD4+ CD25+ Treg cells that inhibit Tc1-mediated CS. Immunology and Cell Biology. 90 (8), 784-795 (2012).
- Directive 2010/63 / EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union. , Available from: https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2010:276:0033:0079:En:PDF (2010).
- Colvin, R. B., Dvorak, H. F. Role of the clotting system in cell-mediated hypersensitivity. II. Kinetics of fibrinogen/fibrin accumulation and vascular permeability changes in tuberculin and cutaneous basophil hypersensitivity reactions. Journal of Immunology. 114, 377-387 (1975).
- Szczepanik, M., et al. Regulation of contact sensitivity in non-obese diabetic (NOD) mice by innate immunity. Contact Dermatitis. 79 (4), 197-207 (2018).
- Askenase, P. W., Majewska-Szczepanik, M., Kerfoot, S., Szczepanik, M. Participation of iNKT cells in the early and late components of Tc1-mediated DNFB contact sensitivity: Cooperative role of γδ-T cells. Scandinavian Journal of Immunology. 73 (5), 465-477 (2011).
- Zemelka-Wiącek, M., Majewska-Szczepanik, M., Ptak, W., Szczepanik, M. Epicutaneous immunization with protein antigen induces antigen-non-specific suppression of CD8 T cell mediated contact sensitivity. Pharmacological Reports. 64 (6), 1485-1496 (2012).
- Van Loveren, H., et al. Use of micrometers and calipers to measure various components of delayed-type hypersensitivity ear swelling reactions in mice. Journal of Immunological Methods. 67 (2), 311-319 (1984).
- Tsuji, R. F., et al. B cell-dependent T cell responses: IgM antibodies are required to elicit contact sensitivity. The Journal of Experimental Medicine. 196 (10), 1277-1290 (2002).
- Campos, R. A., et al. Cutaneous immunization rapidly activates liver invariant Valpha14 NKT cells stimulating B-1 B cells to initiate T cell recruitment for elicitation of contact sensitivity. The Journal of Experimental Medicine. 198 (12), 1785-1796 (2003).
- Rühl-Muth, A. C., Maler, M. D., Esser, P. R., Martin, S. F. Feeding of a fat-enriched diet causes the loss of resistance to contact hypersensitivity. Contact Dermatitis. 85 (4), 398-406 (2021).
- Bour, H., et al. histocompatibility complex class I-restricted CD8+ T cells and class II-restricted CD4+ T cells, respectively, mediate and regulate contact sensitivity to dinitrofluorobenzene. European Journal of Immunology. 25 (11), 3006-3010 (1995).
- Majewska-Szczepanik, M., et al. Obesity aggravates contact hypersensitivity reaction in mice. Contact Dermatitis. 87 (1), 28-39 (2022).
- Katagiri, K., Arakawa, S., Kurahashi, R., Hatano, Y. Impaired contact hypersensitivity in diet-induced obese mice. Journal of Dermatological Science. 46 (2), 117-126 (2007).
- Bouloc, A., Cavani, A., Katz, S. I. Contact hypersensitivity in MHC class II-deficient mice depends on CD8 T lymphocytes primed by immunostimulating Langerhans cells. The Journal of Investigative Dermatology. 111 (1), 44-49 (1998).
- Martin, S., et al. Peptide immunization indicates that CD8+ T cells are the dominant effector cells in trinitrophenyl-specific contact hypersensitivity. The Journal of Investigative Dermatology. 115 (2), 260-266 (2000).
- Vennegaard, M. T., et al. Epicutaneous exposure to nickel induces nickel allergy in mice via a MyD88-dependent and interleukin-1-dependent pathway. Contact Dermatitis. 71 (4), 224-232 (2014).
Tags
علم المناعة والعدوى، العدد 187، نموذج مورين، التهاب الجلد التماسي التحسسي (ACD)، فرط الحساسية التماسية (CHS)، تورم الأذن، نفاذية الأوعية الدموية، الميلوبيروكسيديز (MPO)، السيتوكينات، 2،4،6-ثلاثي نيكرو كلورو البنزين (TNCB)، هابتنErratum
Formal Correction: Erratum: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis
Posted by JoVE Editors on 01/19/2023.
Citeable Link.
An erratum was issued for: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis. The Protocol and Representative Results sections were updated.
Step 3.2.1 of the Protocol has been updated from:
On day "4", prepare 0.4% hapten: TNCB in an acetone-ethanol mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
to:
On day "4", prepare 0.4% hapten: TNCB in an acetone: olive oil mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
Figure 1 of the Representative Results has been updated from:
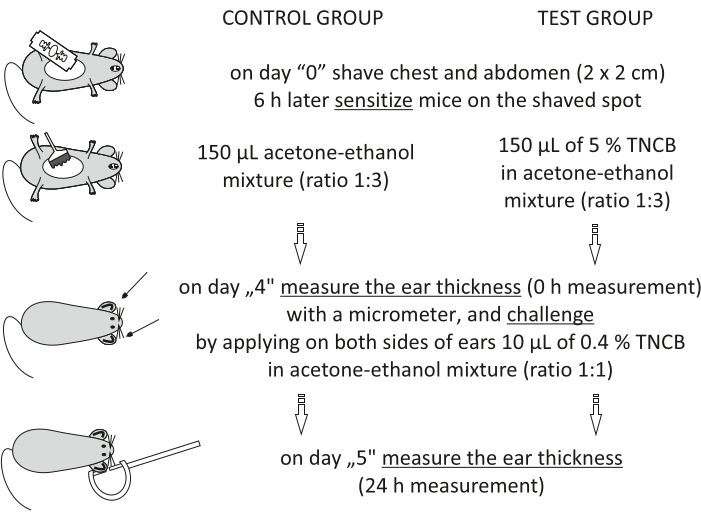
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
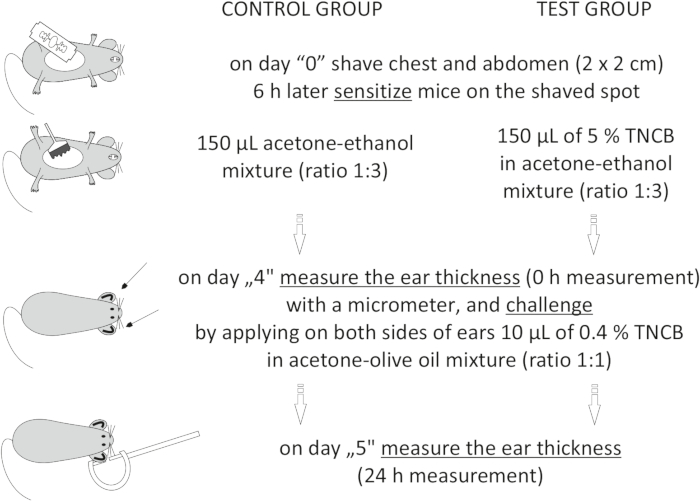
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
Figure 2 of the Representative Results has been updated from:
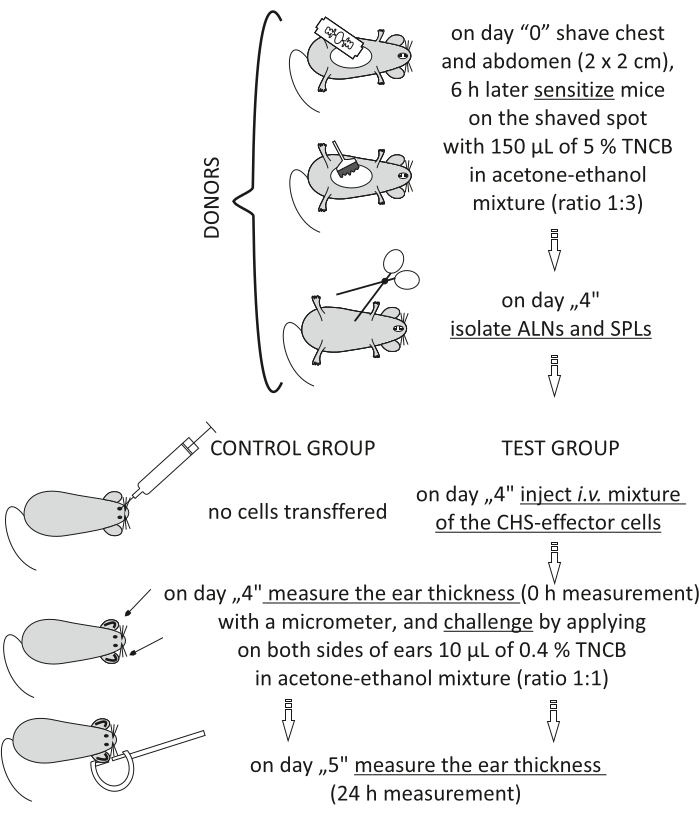
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
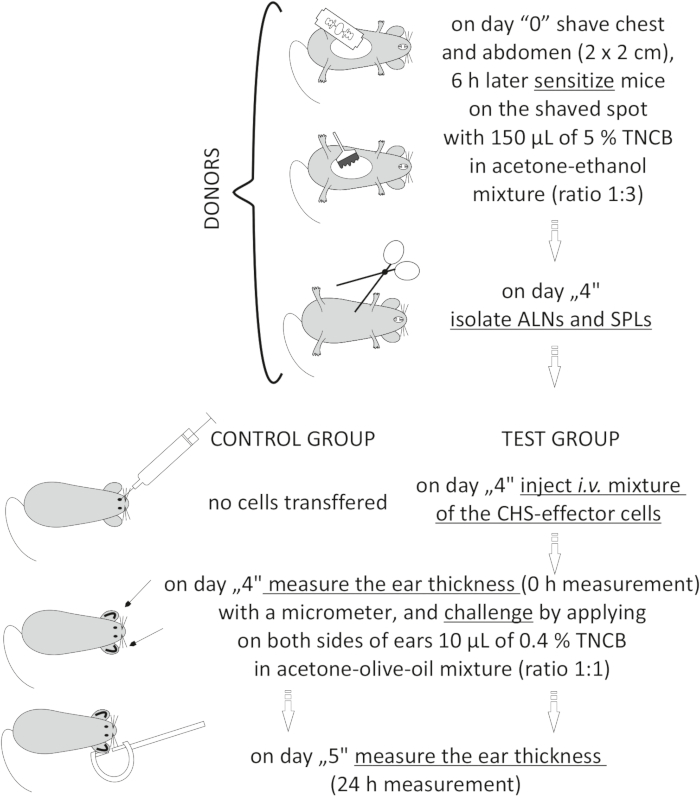
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.



