ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
接触性超敏反应(CHS)是过敏性接触性皮炎(ACD)的小鼠实验模型。CHS基于通过涂上胸部和腹部的剃须皮肤对反应性半抗原的致敏,随后用稀释的半抗原进行耳朵皮肤激发,引起肿胀反应,以各种方式评估。
Abstract
接触超敏反应(CHS)是过敏性接触性皮炎(ACD)的实验模型,可以在小鼠中研究。本研究旨在提出一种客观的实验室方法,该方法可能有助于研究小鼠的CHS反应,该方法可以通过各种测试进行测量和定量。为了诱导CHS,在第“0”天,小鼠通过用丙酮 - 乙醇混合物中的半抗原2,4,6-三硝基氯苯(TNCB)进行腹部皮肤涂漆,使小鼠在先前剃须的斑点上致敏,而阴性对照小鼠则用载体单独 - 丙酮 - 乙醇混合物进行假敏化。在第“4天”,在诱发CHS(激发)之前用千分尺测量基线耳朵厚度,方法是在测试组和对照组中用稀释的TNCB涂上两只耳朵。24小时后,用千分尺测量耳朵肿胀。CHS是T细胞介导的免疫反应的一个例子,它导致发炎组织肿胀,在皮肤挑战后24小时达到峰值,同时出现半抗原。耳水肿的增加与耳朵重量增加、髓过氧化物酶 (MPO) 活性、耳提取物中的促炎细胞因子浓度、组织学检查中水肿真皮增厚增加以及耳血管通透性相关。与对照小鼠相比,测试组血清中TNP特异性IgG1抗体的浓度也有所增加。此外,CHS可以与先前用TNCB致敏的供体获得的CHS效应细胞成功转移。将CHS效应细胞静脉注射到幼稚的受体小鼠中,随后用相同的稀释半抗原挑战。24小时后用千分尺测量耳朵肿胀。
Introduction
过敏性接触性皮炎(ACD)是工业化国家常见的皮肤炎症性疾病,由暴露于称为半抗原的低分子量化学物质引起的IV型超敏反应引起。在人类中引起接触致敏的物质包括重金属离子(铬、镍、铁、钴)、松节油、香料、染料和化妆品中存在的防腐剂(例如,对苯二胺)、一些药物(例如新霉素、苯佐卡因)、β内酰胺类抗生素(即青霉素)、植物产生的化学物质(十五甲苯甲酚,毒藤中存在的物质)以及照相工业中使用的对苯二酚1,2.ACD的病因剂非常高,因为仅在工业中使用了100,000多种化学品,并且每年合成2,000种新的化学品。迄今为止,已经鉴定出3,700多个分子可能是接触性半抗原/过敏原3。接触超敏反应(CHS)是ACD的实验模型,可以在小鼠,豚鼠和大鼠中研究,并且可以通过局部皮肤应用溶解在有机溶剂中的活性化学半抗原4,5,6来诱导。本研究旨在描述一种客观的实验室方法,该方法可能有助于研究小鼠中的CHS反应,该方法可以通过各种测试进行测量和定量。
CHS由致敏(诱导)和效应器(激发)阶段组成。在动物模型中,半抗原首先与体内的蛋白质共价结合以产生新抗原。在致敏阶段,活化的角质形成细胞通过产生促炎细胞因子 - 肿瘤坏死因子α(TNF-α)和白细胞介素1β(IL-1β)7来促进皮肤树突状细胞(sDC)的迁移和成熟。表皮朗格汉斯细胞(LC)在CHS诱导和效应器阶段8期间存在抗原。在致敏过程中暴露于半抗原的LC促进了调节细胞和效应细胞的诱导9。来自几项研究的越来越多的证据表明,CHS反应可以由CD4 + MHC II类限制性Th1细胞介导,局部释放干扰素γ(IFN-γ)以采用特征性炎症浸润,CD8 + MHC I类限制性Tc1淋巴细胞,其也可以释放IFN-γ但主要介导对角质形成细胞的细胞毒性损伤,现在还有白细胞介导素17(IL-17)产生Th17细胞10,11.
已经开发了采用各种物种12,13,14 和半抗原的几种不同的CHS模型(不同半抗原,溶剂和施用时间的详细比较总结在 表1中)。小鼠是一种常用的实验室物种,在研究CHS方面具有一些优势。与其他物种相比,小鼠中有更多的菌株,敲除(KO)和转基因动物,这使它们成为非常有吸引力的动物15。此外,CHS模型需要许多动物,而老鼠在这里更经济。动物模型并非在所有方面都模仿ACD;特别是,它们表现出结痂和脱屑,这在人类中并不常见16,17。慢性病的特征难以重现,主要是因为所描述的模型没有假设半抗原在很长一段时间内的应用。然而,这里已经证实,ACD的许多重要方面都被复制了。还表明,与人类一样,这些特征与局部过敏反应有关。本方案中概述的半抗原,其溶剂及其应用的选择取决于这样一个事实,即结果已被众多 体外 测试证实,并且在实验室中对其进行了多年的测试和修改,直到建立当前版本为止。小鼠模型允许分析参与ACD开发的细胞亚群或细胞因子,并且对于新疗法的临床前评估至关重要。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
本文中介绍的所有实验均根据克拉科夫第一届当地动物试验伦理委员会的指导方针进行。所描述的所有程序都是根据当地的建议进行的,特别是关于使用氯胺酮/甲苯噻嗪作为麻醉剂,使用耳朵的两侧涂抹该物质/半抗原,切断耳朵,并通过去除眼球来收集血液。本研究使用BALB/c(单倍型H-2d)、CBA/J(H-2k)和C57BL/6(H-2b)雄性和雌性小鼠,6-12周龄(见 材料表)。对于统计学意义,最好每组小鼠由10-12只动物组成。
1. 动物准备
- 在所有程序之前和之后用70%乙醇溶液清洁手术台。如果使用需要无菌条件的小鼠,请在生物安全柜中执行所有操作。
2. 标记小鼠以进行识别
- 用剃须刀片剃须来标记小鼠:#0 - 无标记,#2 - 在右前爪,#3 - 在右侧,#4 - 在右后爪,#5 - 在尾巴的底部,#6 - 在左后爪上,#7 - 在左侧,#8 - 在左前爪上。
注意:由于诱导的反应,不能通过打耳或标记来经典地标记小鼠。标记时未对小鼠进行麻醉。
3. 化工原料药的导入
注:此过程如图 1 所示。
- 按照以下步骤进行敏化(诱导)。
- 在“0”天,通过用水涂抹灰色肥皂并用剃须刀片剃须,在胸部和腹部(正方形2 cm x 2 cm)剃除小鼠。
注意:在使用半抗原之前,请等待6小时,以使皮肤不受刺激。 - 在丙酮 - 乙醇混合物(比例为1:3)或单独载体(丙酮 - 乙醇)中制备5%半抗原:2,4,6-三硝基氯苯(TNCB,见 材料表)。在玻璃小瓶中使用之前准备溶液,并通过用铝箔覆盖小瓶来保护其免受光线照射。
- 在同一天,通过在先前剃须的斑点上施用150μL5%半抗原来使小鼠致敏。在对照小鼠组中,单独应用载体以评估非特异性炎症反应。在将动物放回笼子之前,等待30秒,让半抗原干燥。
注意:使用手套;TNCB在大多数人中引起严重的过敏反应。
- 在“0”天,通过用水涂抹灰色肥皂并用剃须刀片剃须,在胸部和腹部(正方形2 cm x 2 cm)剃除小鼠。
- 进行诱发(激发)和耳朵肿胀测量。
- 在第“4”天,在丙酮 - 乙醇混合物中制备0.4%半抗原:TNCB(比例为1:1)。在玻璃小瓶中使用之前准备溶液,并通过用铝箔覆盖小瓶来保护其免受光线照射。
- 用腹膜内(i.p.)注射氯胺酮(90-120mg / kg)和甲苯噻嗪(5-10mg / kg)的混合物(见 材料表)麻醉小鼠进行深度麻醉。通过脚趾捏住确保鼠标完全麻醉至少5分钟。
- 由不知道实验组的观察者用微米测量耳朵厚度(0小时测量,基线)(参见 材料表)。
- 在两组中的耳朵两侧涂抹10μL0.4%半抗原(测试并对照)。在将动物放回笼子里之前,等待30秒,让半抗原干燥。
- 在半抗原施用后24小时的“5”天,重复步骤3.2.2-3.2.3进行24小时测量。
- 通过计算半抗原挑战前后的耳廓厚度差异来评估CHS响应:24小时耳厚度(μm)-0小时耳厚度(μm)。将每只耳朵算作一个单独的测量值。接下来,以微米(μm)表示耳朵肿胀±平均值(SEM)的标准误差(表2, 图3)。
4. 耳部活检
- 在24小时测量耳朵厚度后(当小鼠仍处于深度麻醉状态时),用剪刀剪掉尽可能靠近颅骨的耳朵。通过使用活检笔进行直径为6毫米的打孔,从耳朵远端采集活检(参见 材料表)。
- 测量耳朵重量(步骤4.2)并另外对同一耳活检进行以下测试之一:髓过氧化物酶(MPO)测定(步骤4.3)或耳提取物中细胞因子浓度的 体外 测量(例如,IFN-γ,IL-17A,TNF-α[步骤4.4])。
注意:采血前切耳。在此程序之后,必须对小鼠实施安乐死(例如,通过颈椎脱位)。
- 测量耳朵重量(步骤4.2)并另外对同一耳活检进行以下测试之一:髓过氧化物酶(MPO)测定(步骤4.3)或耳提取物中细胞因子浓度的 体外 测量(例如,IFN-γ,IL-17A,TNF-α[步骤4.4])。
- 测量分析天平上每个耳部活检的重量,并以毫克(mg)表示(图4)。
- 按照以下步骤进行MPO测定。
- 通过将0.5%十六烷基三甲基溴化铵溶解在50mmol磷酸盐缓冲液KH2PO4 / Na2HPO4 中并将pH调节至6.0(在室温,室温下使用)来制备均质缓冲液。
- 使用直径为5mm的不锈钢珠子的均质机(添加两个珠子/小瓶)在2mL微量离心管中用500μL制备的缓冲液均质10分钟将活检物均质化(参见 材料表)。接下来,将样品在4°C下冷却15分钟,并使其再均质化10分钟。
注意:微量离心管具有圆形底部,因此磁珠可以轻松移动。 - 将匀浆物在−20°C下冷冻30分钟。解冻和涡旋(确保样品解冻)。重复此过程 3x。
- 在4°C下以3,000× g 离心匀浆30分钟。 用移液管收获上清液。以单位(U)表示每1毫克蛋白质的MPO活性。
注意:协议可以在此处暂停。样品在−20°C下稳定3个月。 - 为了测量MPO活性,通过将20μL上清液和200μLMPO底物(0.167mg / mL邻位二盐酸盐在50 mmol的KH 2 PO4 / Na2HPO4缓冲液中与5 x 10-4%H202)混合进行酶促反应,并加入到96孔平底板中。将板在室温下孵育20分钟。
- 通过在200μLMP底物中使用浓度从0.008 U到0.5 U的20μLMPO标准品来制备标准曲线。单独使用MPO底物制备空白样品。
注意:使用邻位二苯二胺二盐酸盐时,请使用面罩。
注意:板必须由聚丙烯制成,聚丙烯的结合能力较低,因此蛋白质或DNA不会结合。 - 测量波长为 λ = 460 nm 的光密度 (OD)。酶促反应稳定10分钟。从标准曲线中读取测试样品中的 MPO 活性。
- 为了测量蛋白质浓度,使用20μL上清液,用Bicinchoninic酸试剂盒进行测试以进行蛋白质测定(参见 材料表),并在λ = 562nm处测量OD(图5)。
- 对耳提取物中的细胞因子进行 体外 测量。
- 使用直径为5mm的不锈钢珠子(添加两个珠子/小瓶)的均质机,在2 mL微量离心管中用500μL组织蛋白提取试剂(T-PER)在室温下均质化耳部活检10分钟。接下来,将样品在4°C下冷却15分钟,并使其再均质化10分钟。
注意:微量离心管具有圆形底部,因此磁珠可以轻松移动。 - 在4°C下以3,000× g 离心匀浆30分钟。
注意:协议可以在此处暂停。样品在−80°C下稳定6个月。 - 按照制造商的说明,使用市售的ELISA集(例如IFN-γ)(参见 材料表)评估细胞因子水平(图6)。
- 使用直径为5mm的不锈钢珠子(添加两个珠子/小瓶)的均质机,在2 mL微量离心管中用500μL组织蛋白提取试剂(T-PER)在室温下均质化耳部活检10分钟。接下来,将样品在4°C下冷却15分钟,并使其再均质化10分钟。
5. 耳组织组织学
- 在测量耳朵厚度24小时后,当小鼠仍然被深度麻醉时,用剪刀剪掉尽可能靠近颅骨的耳朵(步骤4.1)。
注意:在此程序之后,必须对小鼠实施安乐死(例如,通过颈椎脱位)。 - 按照以下步骤对组织块进行石蜡包埋。
- 取出后,直接将耳朵放入约10 mL 10%福尔马林中24小时。
- 将耳朵放入组织处理盒中。将盒放入自动处理器(参见 材料表)进行脱水循环(酒精70%,90%,100%,RT时各30分钟),清除循环(二甲苯3x,RT时每个30分钟)和蜡浸润循环(石蜡3x,每个在56°C下30分钟)。
- 从自动处理器上取下盒式磁带,并按住加热板直到需要。用温蜡填充蜡模(来自分配器)。
- 用加热的镊子从盒中取出部分并将其放入模具中;接下来,将盒底放在模具的顶部,然后填充更多的蜡。将其置于冷板上的冷水中30分钟,使石蜡凝固以形成包含标本的块。
- 使用旋转切片机(参见 材料表)切割约5μm厚的切片。将部分漂浮在温水浴中以使其变平。将切片拾取到玻璃显微镜载玻片上。让它们在室温下干燥,以确保切片粘附在载玻片上。
注意:使用无需涂覆粘合剂材料或蛋白质涂层的载玻片,以防止染色过程中组织切片的丢失。
- 进行苏木精和曙红(H&E)染色。
- 用以下物质准备17个染色皿:二甲苯(四个培养皿),100%乙醇(无水酒精)(四个培养皿),90%乙醇,80%乙醇,70%乙醇,50%乙醇,PBS(三个培养皿),苏木精溶液,曙红溶液。按照以下步骤将载玻片从一个培养皿转移到下一个培养皿,并在RT下执行所有操作。
注意:每个培养皿中的程序可以重复约10次(例如,如果使用20玻片的培养皿,可以在不改变液体的情况下制作200个污渍)。 - 通过在培养箱中在65°C下孵育30分钟来脱蜡切片。将载玻片浸入二甲苯中30分钟。在新的二甲苯中重复1次30分钟。
- 将载玻片浸入100%乙醇中5分钟。在新的100%乙醇中重复1次5分钟。将载玻片浸入乙醇排中,每次稀释90%,80%,70%和50%,持续2分钟。
- 将载玻片浸入磷酸盐缓冲盐水(PBS)中5分钟。擦去纸巾周围和载玻片背面多余的液体。
- 在苏木精溶液中染色切片(参见 材料表)7-8分钟。从背面在自来水中洗涤30秒,以免损坏截面。重复步骤 5.3.4。
- 用曙红溶液(参见 材料表)染色切片30秒。按照步骤5.3.5中提到的洗涤,然后重复步骤5.3.4。
- 将载玻片浸入100%乙醇(无水酒精)中2分钟。在新的100%乙醇中重复1x2分钟。
- 将载玻片浸入二甲苯中5分钟。在新的二甲苯中重复1次5分钟。
- 让切片在室温下风干15分钟,在盖玻片上添加一滴安装介质(参见 材料表),然后将其放在部分的顶部。
- 用以下物质准备17个染色皿:二甲苯(四个培养皿),100%乙醇(无水酒精)(四个培养皿),90%乙醇,80%乙醇,70%乙醇,50%乙醇,PBS(三个培养皿),苏木精溶液,曙红溶液。按照以下步骤将载玻片从一个培养皿转移到下一个培养皿,并在RT下执行所有操作。
- 在20x或40x的放大倍率下在光学显微镜下检查切片,并捕获图像(图7)。
6. 血管通透性试验
注意:作为耳部厚度测量的替代方法,可以进行血管通透性测试。
- 在第“0天”(步骤3.1.1-3.1.3)使小鼠致敏,然后在第“4天”麻醉小鼠(步骤3.2.2)并直接在耳朵上施加半抗原(步骤3.2.4),省略0小时耳朵测量。
- 在激发后23小时,麻醉小鼠(步骤3.2.2)。
- 在杜贝科的磷酸盐缓冲盐水(DPBS)中静脉注射(即)8.3μL / g体重的1%埃文斯蓝色染料(参见 材料表)。
- 再次麻醉小鼠 - 深度麻醉(步骤3.2.2)-埃文斯蓝色注射后1小时。
- 收集耳部活检(步骤4.1)。
注意:在此程序之后,必须对小鼠实施安乐死(例如,通过颈椎脱位)。 - 从组织中提取染料,将耳冲头放入含有1mL甲酰胺的管中,并在37°C下在5%CO2 的气氛中孵育18小时。
- 在室温下以3,000× g 离心活检3分钟,用移液管收集上清液。
- 在96孔平底板中以λ = 565nm的波长测量OD,以含有甲酰胺的空白。颜色稳定24小时。从标准曲线中读取测试样品的浓度(使用Evans蓝的浓度范围为0.2-30μg染料/ mL甲酰胺)(图8)。
注意:板必须由聚丙烯制成,聚丙烯的结合能力较低,因此蛋白质或DNA不会结合。
7. 血清采集和抗TNP免疫球蛋白(IgG1)抗体检测
- 收集耳部活检(步骤4.1)后,当小鼠仍处于深度麻醉状态时,用镊子取出眼球,轻轻按压小鼠,并将血液从眶后窦收集到管中(用凝胶小瓶获得血清,见 材料表)。另一种收集血液的方法可能是用注射器刺穿心脏并收集血液。
注意:采血后必须采集血液。由于血液参数的潜在差异,必须在整个研究中使用相同的出血方法18.在此程序之后,必须对小鼠实施安乐死(例如,通过颈椎脱位)。 - 倒置至少6x,等待30分钟让血液凝结,然后在室温下以1,300-2,000× g 离心10分钟。
注意:协议可以在此处暂停。样品在−20°C下稳定6个月。 - 用50μL牛血清白蛋白与溶解在DPBS中的2,4,6-三硝基苯基(TNP-BSA)结合的牛血清白蛋白以10μg/ mL的协同作用涂覆96孔平底板。接下来,用单独溶解在DPBS(背景)中的牛血清白蛋白(BSA)涂覆第二块板,浓度为10μg/ mL。在4°C下孵育过夜。
注意:小鼠血清含有针对BSA的抗体(Abs),因此需要在两个板上测试样品,接下来必须进行计算(OD TNP-BSA - OD BSA)。 - 用含有0.05%吐温20的300μLDPBS洗涤板。重复 3 次。
- 准备测定稀释剂(AD):含有1%BSA的DPBS。用AD在室温下封闭孔1小时,再次洗涤(步骤7.4)。
- 准备内标(iSTD):用TNCB使小鼠致敏(步骤3.1.1-3.1.3),并且在致敏后10天,收集和轮询所有供体的血清(步骤7.1和步骤7.2)。
- 向板中加入50μL用AD稀释的分级浓度的iSTD,以形成标准曲线(如 表3所述)。向平板中加入50μL血清样品。在两块板上测试每个样品和标准曲线(TNP-BSA和BSA涂层)。在室温下孵育2小时,洗涤板(步骤7.4)。
- 加入50μL生物素化的抗小鼠IgG1单克隆抗体(mAb,见 材料表),用AD稀释1:250并在室温下孵育1小时,再次洗涤(步骤7.4)。
- 加入50μL辣根过氧化物酶链霉亲和素(HRD链霉亲和素,参见 材料表),用AD稀释1:2000,并在黑暗中室温孵育30分钟。清洗盘子(步骤7.4)。
- 加入50μLTMB底物(参见 材料表),并在黑暗中室温孵育30分钟。
- 通过加入25μL1 M H2SO4来停止酶促反应;反应稳定30分钟。
- 在 λ = 450 nm 的波长和 570 nm 的背景下测量 OD(必须从每 450 nm 测量中减去背景)。在显示结果时,从样品的TNP-BSA和标准曲线中减去BSA测量值。然后,根据标准曲线计算抗体的单位(U)(图9)。
8. CHS效应细胞的过继转移
注:此过程如图 2 所示。
- 供体(以一个供体:1受体的比例):在第“0”天用TNCB使小鼠敏感(步骤3.1.1-3.1.3)。
- 在“4”天,麻醉小鼠深度麻醉(步骤3.2.2)。
- 用镊子分离腋窝和腹股沟淋巴结(ALNs)和脾脏(SPL)。将一个小瓶中的ALN和另一个小瓶中的SPL汇集在一起。
注意:每个腋窝的胸肌后面有一个腋窝淋巴结。髋部区域的一个腹股沟淋巴结位于三个血管旁边。脾脏位于肠胃后面的身体左侧19。使用生物安全柜中的无菌工具来维持无菌条件。在此程序之后,必须对小鼠实施安乐死(例如,通过颈椎脱位)。 - 在两张显微镜载玻片的磨砂末端之间捣碎组织。将细胞悬浮液通过孔径为70μm的细胞过滤器(参见 材料表)。
- 用补充1%胎牛血清(FBS)的DPBS清洗细胞。在4°C下以300× g 离心10分钟。 倾析上清液并将剩余的细胞沉淀重悬于1-5.0mLDPBS中。
- 使用血细胞计数器20 与台盼蓝计数活细胞,并将10μL细胞悬浮液与90-990μL(取决于细胞数量)台盼蓝混合。在计算细胞数(10x-100x)时考虑稀释度。
- 在200μLDPBS中制备ALN和SPL的混合物(比例为1:1):8.0 x 106 至7.0 x 10 7 /小鼠。
- 受体(幼年同源小鼠):麻醉幼稚的受体小鼠(步骤3.2.2)并用制备的CHS效应细胞混合物注射iv.v.(步骤8.7)。在小鼠对照组中,不要注射任何细胞。
- 在(0小时)和挑战之后(24小时)测量耳朵厚度(步骤3.2.1-3.2.6)(图10)。
- 此外,对分离的CHS效应细胞进行测试(例如,细胞表型或通过流式细胞术通过CHS效应细胞测量产生的细胞因子)。也可以建立细胞培养物,并且可以评估CHS效应细胞在抗原存在下增殖的能力或培养物上清液中分泌的细胞因子的量21,22 (未提供数据)。
注意:进行额外的测试需要相应的更多细胞供体。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
对于CHS诱导, 通过 皮肤涂漆(腹部)用150μL5%TNCB或假用载体敏化动物。在第“4天”,在先前与TNCB接触的小鼠(测试组)和对照组小鼠(假敏化)中,用10μL0.4%TNCB接触绘画(激发)诱导两只耳朵的耳朵肿胀反应。提供的数据表明,与同样受到挑战的假敏小鼠相比,对TNCB敏感并4天后受到挑战的小鼠的耳朵肿胀显着增加(图3, 表2,测试与对照组)。耳部肿胀结果在进一步的研究中得到了完全验证,强调用微米确定的耳水肿增加与增加的耳朵重量(图4),MPO活性(图5),耳朵提取物中的IFN-γ浓度(图6),组织学检查中水肿真皮增厚增加(图7)和耳血管通透性一致(图8).与对照动物相比,在测试小鼠的血清中也发现了TNP特异性IgG1抗体浓度的增加(图9)。
作为T细胞介导的免疫反应的一个例子,CHS也可以转移到幼稚的同源受体小鼠中。通过TNCB施用使供体致敏,随后,将CHS效应细胞静脉施用到幼稚的受体小鼠中,用半抗原激发并在24小时后测试CHS(图10)。与仅接受挑战的动物(未接受任何细胞)相比,从先前对TNCB致敏的供体处接受CHS效应细胞的动物显示出显着增加的耳朵肿胀。
CHS反应具有复杂的机制,涉及各种细胞。抗原呈递和 T/B 细胞活化发生在外周淋巴器官(例如,ALN 和 SPL)中。确定CHS效应细胞在过继细胞转移之前耗尽CD4 + 而不是CD8 + 细胞导致受体小鼠中没有CHS反应。发现这些细胞对IFN-γ(T-box转录因子TBX21,Tbet+)和IL-17A(视黄酸受体相关的孤儿核受体γ,RORγT +)呈阳性(补充图1)。
在8-12周龄的C57BL / 6和CBA / J雄性和雌性小鼠上进行了代表性实验的结果。遵循3R规则在动物23中的使用,特别是减少,为本文的目的,在小群动物上显示实验结果。图中的数据显示为均值±SEM.统计显著性设置为 p <0.05。这些图表是使用棱镜软件绘制的(参见 材料表)。

图 1:CHS 的感应。 致敏、激发和耳朵测量。简称:CHS=接触超敏反应;三氯硝基苯=2,4,6-三硝基氯苯。 请点击此处查看此图的大图。

图2:CHS效应细胞的过继转移。 缩写:ALNs =腋窝和腹股沟淋巴结;CHS = 接触超敏反应;i.v. = 静脉注射;SPL = 脾脏;三氯硝基苯=2,4,6-三硝基氯苯。 请点击此处查看此图的大图。

图3:通过用千分尺测量耳朵肿胀来表征CHS到TNCB的评估。 小鼠被TNCB(测试组)或假(对照组)致敏并随后受到质疑。测量激发前后的耳廓厚度,并通过从24 h耳厚度(μm)中减去0 h耳厚度(μm)来计算耳肿胀的差异。耳朵肿胀表示为平均±SEM,****p <0.0001,n = 10只小鼠/组(数据来自 表2)。简称:CHS=接触超敏反应;SEM = 均值的标准误差;三氯硝基苯=2,4,6-三硝基氯苯。 请点击此处查看此图的大图。

图4:通过测量耳朵重量对CHS进行代表性评估。 耳朵重量是与耳朵肿胀相对应的参数之一。小鼠被TNCB(测试组)或假(对照组)致敏并随后受到质疑。在挑战后24小时,从移除的耳朵中取出直径为6毫米的冲头。在分析实验室天平上称量冲头。耳重以毫克(mg)表示为平均±SEM,***p <0.001,n = 10只小鼠/组。简称:CHS=接触超敏反应;SEM = 均值的标准误差;三氯硝基苯=2,4,6-三硝基氯苯。 请点击此处查看此图的大图。

图5:对MPO活动的代表性评价。 组织提取物中MPO活性的增加与耳部炎症相关。TNCB致敏小鼠(测试组)和假敏小鼠(对照组)受到质疑。在激发后24小时,取出耳朵,提取并处理耳朵直径为6 mm的冲头。MPO活性以U/蛋白质含量(U / g蛋白质)表示。结果显示为平均±SEM,**p <0.01,n = 5-6只小鼠/组。简称:CHS=接触超敏反应;MPO = 髓过氧化物酶;SEM = 均值的标准误差;三氯硝基苯=2,4,6-三硝基氯苯;U = 单位。 请点击此处查看此图的大图。

图6:耳提取物中细胞因子产生- IFN-γ浓度的代表性评估。 小鼠被TNCB(测试组)或假(对照组)致敏并随后受到质疑。在激发后24小时,取出耳朵,并取出直径为6毫米的耳朵。通过ELISA测定组织匀浆中IFN-γ的浓度。结果显示为平均±SEM,*p <0.05,n = 5只小鼠/组。简称:CHS=接触超敏反应;IFN-γ = 干扰素 γ;SEM = 均值的标准误差;三氯硝基苯=2,4,6-三硝基氯苯。 请点击此处查看此图的大图。

图7:耳组织的代表性组织学。苏木精和曙红染色。小鼠被TNCB(测试组)或假(对照组)致敏并随后受到质疑。(自动对照)测试组的组织学检查表现为炎症细胞(单核和多形核细胞)的浓度显着增加,主要在真皮中,表皮中微脓肿形成。还注意到水肿性真皮的增厚和增厚的增生性表皮。(D-E)对照组。请点击此处查看此图的大图。

图8:代表性的血管通透性试验。 观察到的耳组织水肿是血管通透性增加的结果。为了确定血管通透性的变化,小鼠将TNCB(测试组)或假(对照组)致敏,然后在4天后进行激发。在挑战后23小时,注射埃文斯蓝,并且在埃文斯蓝色注射后1小时,动物被安乐死,并制作了直径为6毫米的耳朵。结果显示为平均±SEM,**p <0.01,n = 5只小鼠/组。简称:CHS=接触超敏反应;SEM = 均值的标准误差;三氯硝基苯=2,4,6-三硝基氯苯。 请点击此处查看此图的大图。

图 9:具有代表性的抗 TNP IgG1 抗体测量值。 在假敏化(对照)和TNCB敏化(测试组)小鼠中用半抗NCB激发24小时后,测量血清中抗TNP IgG1抗体的浓度。通过ELISA测试收集的血清的抗体浓度。结果显示为平均±SEM,***p <0.001,n = 10只小鼠/组。简称:CHS=接触超敏反应;IgG1 = 免疫球蛋白G亚类1;SEM = 均值的标准误差;三氯硝基苯=2,4,6-三硝基氯苯。 请点击此处查看此图的大图。

图10:CHS效应细胞的代表性过继转移。 CHS效应细胞是从与TNCB致敏的供体获得的。接下来,将收集的免疫细胞注射到幼稚的同源受体中,这些受体被激发为CHS效应器阶段。对照组小鼠在激发试验前没有接受任何细胞。在挑战之前和之后测量耳廓的厚度。结果显示为平均±SEM,***p <0.001,n = 7只小鼠/组。简称:CHS=接触超敏反应;SEM = 均值的标准误差;三氯硝基苯=2,4,6-三硝基氯苯。 请点击此处查看此图的大图。
| 小鼠应变 | 致敏溶液(剂量) 在剃光的腹部上 |
诱发溶液(剂量) 耳朵两侧 |
敏化/诱导日 | 裁判 | |||||||||||
| 巴布/丙型(H-2d);C57BL/6 (H-2b) TCRδ-/-, β2米/-, CD1d-/- (B10 PL (H-2U 背景) |
25 μL 0.5 % DNFB 在丙酮-橄榄油混合物中(比例为 4:1) | 5 μL 0.1 % DNFB 丙酮-橄榄油混合物(比例 4:1) | 0 / 5 | 22 | |||||||||||
| C57BL/6 (H-2b) | 50 μL 0.5 % DNFB 在丙酮-橄榄油混合物中(比例 4:1) | 25 μL 0.2 % DNFB 丙酮-橄榄油混合物(比例 4:1) | 0 / 5 | 32 | |||||||||||
| C57BL/6 (H2b);伊尔-17A-/- (C57BL/6背景) | 150 μL 5% TNCB 在丙酮-乙醇混合物中(比例为 1:3) | 10 μL 0.4 % TNCB 橄榄油-丙酮混合物(比例 1:1) | 0 / 4 | 33 | |||||||||||
| 中央预算/日本(H-2k);C57BL/6 (H-2b) TLR2-/-, MyD88-/-, 伊尔-17A-/- (C57BL/6 背景) |
150 μL 5 % TNP-Cl (TNCB) 在丙酮-乙醇混合物中(比例为 1:3) | 10 μl 橄榄油-丙酮混合物中的 0.4 % TNP-Cl (TNCB) (比例为 1:1) | 0 / 4 | 21 | |||||||||||
| C57BL/6型客机(H-2b);断续器(H-2d) | 25 μL 1% TNCB 在丙酮中 | 10 μL 0.1 或 0.2 % TNCB 加入丙酮中(最高可达 1%) | 0 / 7 | 34 | |||||||||||
| C57BL/6型客机(H-2b);断续器2-/-/ 断续器4-/- (C57BL/6背景上的双敲除小鼠) |
100 μL 3% TNCB 加入丙酮中 | 20 μL 1% TNCB 在丙酮中(仅在耳朵背面) | 0 / 5 | 31 | |||||||||||
| C57BL/6 (H-2b) MHC II类缺陷小鼠(C57BL / 6背景) |
100 μL 3 % TNCB 在丙酮-橄榄油混合物中(比例为 4:1) | 20 μL 0.5 或 1 % TNCB 在丙酮-橄榄油混合物中(比例为 4:1) | 0 / 6 | 35 | |||||||||||
| C57BL/6 (H-2b) | 100 μL 7% TNCB 在丙酮中 | 20 μL 1 % TNCB 加入丙酮中 | 0 / 5 | 36 | |||||||||||
| C57BL/6 (H-2b) | 100 μL 3 % OX 乙醇溶液 | 20 μL 1 % OX 乙醇溶液 | 0 / 5 | ||||||||||||
| C57BL/6型客机(H-2b);CD4/-、CD8/-( C57BL/6 背景) | 25 μL 0.5 % DNFB 丙酮-橄榄油(比例 4:1) | 10 μL 0.2 % DNFB 丙酮-橄榄油(比例 4:1) | 0 / 5 | 10 | |||||||||||
| C57BL/6型客机(H-2b);CD4/-、CD8/-( C57BL/6 背景) | 150 μL 3 % OX 在醇-丙酮中(比例 3:1) | 10 μL 1% OX 在醇-丙酮中(比例为 3:1) | 0 / 5 | ||||||||||||
| C57BL/6型客机(H-2b);C3H/氦气(H-2千米);(C3H/黑焦背景);我的D88-/- (C57BL/6背景) | 100毫克/耳10%NiCl2 ,双耳背侧白色凡士林 | 10 % 镍氯化2 白色凡士林 | 0,1,2 / 23, 24 | 37 | |||||||||||
| 点头 (H-2g7) MyD88-/- (点头背景) | 400 μL 0.5 % FITC 丙酮和邻苯二甲酸二丁酯 | 10 μL 0.1 % FITC 丙酮和邻苯二甲酸二丁酯 | 0 / 5 | 25 | |||||||||||
表1:CHS模型在各种研究中的比较。 缩写: DNFB = 1-氟-2,4-二硝基苯;FITC = 异硫氰酸荧光素;镍镉2 = 氯化镍;三氯硝基苯=2,4,6-三硝基氯苯;TNP-Cl = 三硝基苯基氯化物;OX = 恶唑啉酮。 请按此下载此表格。
| 对照组(阴性) | 测试组(化学气相色谱反应) | ||||||
| 鼠标 # 耳朵: L, R | 0 小时 耳朵厚度 [微米] | 24 小时耳朵厚度 [μm] | 24 小时 – 0 小时耳朵厚度 [μm] | 鼠标 # 耳朵: L, R | 0 小时 耳朵厚度 [微米] | 24 小时耳朵厚度 [μm] | 24 小时 – 0 小时耳朵厚度 [μm] |
| 1 L | 365 | 380 | 15 | 1 L | 345 | 427.5 | 82.5 |
| 1 R | 335 | 380 | 45 | 1 R | 340 | 455 | 115 |
| 2 L | 345 | 355 | 10 | 2 L | 355 | 475 | 120 |
| 2 R | 327.5 | 352.5 | 25 | 2 R | 342.5 | 457.5 | 115 |
| 3 L | 340 | 370 | 30 | 3 L | 340 | 460 | 120 |
| 3 R | 325 | 355 | 30 | 3 R | 345 | 495 | 150 |
| 4 L | 335 | 380 | 45 | 4 L | 357.5 | 432.5 | 75 |
| 4 R | 340 | 350 | 10 | 4 R | 335 | 402.5 | 67.5 |
| 5 公升 | 350 | 380 | 30 | 5 公升 | 335 | 387.5 | 52.5 |
| 5 R | 337.5 | 360 | 22.5 | 5 R | 335 | 425 | 90 |
| 6 L | 335 | 365 | 30 | 6 L | 350 | 430 | 80 |
| 6 R | 340 | 375 | 35 | 6 R | 342.5 | 405 | 62.5 |
| 7 L | 345 | 337.5 | 0 | 7 L | 340 | 502.5 | 162.5 |
| 7 R | 345 | 335 | 0 | 7 R | 327.5 | 447.5 | 120 |
| 8 L | 370 | 380 | 10 | 8 L | 327.5 | 515 | 187.5 |
| 8 R | 375 | 355 | 0 | 8 R | 327.5 | 540 | 212.5 |
| 9 公升 | 385 | 370 | 0 | 9 公升 | 330 | 415 | 85 |
| 9 R | 342.5 | 362.5 | 20 | 9 R | 327.5 | 390 | 62.5 |
| 10 公升 | 307.5 | 340 | 32.5 | 10 公升 | 337.5 | 445 | 107.5 |
| 10 R | 325 | 350 | 25 | 10 R | 352.5 | 455 | 102.5 |
| 意味 着 | 20.75 | 意味 着 | 108.5 | ||||
| ±扫描电镜 | 3.245 | ±扫描电镜 | 9.565 | ||||
表2:计算CHS效应器阶段耳朵厚度差异的代表性示例。 用半抗原计算挑战前后耳廓厚度的差异:24小时耳厚度(μm) - 0小时耳厚度(μm)。每只耳朵都算作一个单独的测量值。耳肿胀以微米(μm)±SEM表示,n = 20。缩写:L = 左;R = 对。 请按此下载此表格。
| 用反倾销稀释 | 抗肿瘤坏血酸 IgG1 抗体 (U/毫升) |
| 100 倍 | 250 |
| 200 倍 | 125 |
| 400 倍 | 62.5 |
| 800 倍 | 31.25 |
| 1600 倍 | 15.63 |
| 3200 倍 | 7.8 |
| 仅广告 | 0 |
表3:针对抗TNP IgG1 Ab测量标准曲线的不同浓度iSTD的制备。 假设100倍iSTD稀释度为250 U抗TNP IgG1 Ab. 缩写:Ab = 抗体;AD = 测定稀释剂;iSTD = 内部标准;IgG1 = 免疫球蛋白G亚类1;TNP = 2,4,6-三硝基苯基;U = 单位。 请按此下载此表格。
补充图1:CHS效应细胞的表型。CHS效应细胞是从供体的ALN和SPL中获得的,它们以前与TNCB敏感。(A)采用MACS技术,CHS效应细胞(全ALN和SPL)耗尽CD4 +或CD8 +细胞。随后,在CHS效应器期诱导之前进行过亲细胞转移。± (B-E)使用流式细胞术技术,将CHS效应子和幼天(从幼稚小鼠获得)细胞染色为IFN-γ,Tbet,IL-17A和RORγt的平均值(B-E)。细胞被门控为TCRβ + CD4 +群体。结果显示为平均±SEM,***p<0.001,**p<0.01,*p<0.05,n = 4-6只小鼠/组。缩写:ALNs =腋窝和腹股沟淋巴结;CD4 = 分化簇 4;CHS = 接触超敏反应;IFN-γ = 干扰素 γ;IL = 白细胞介素;MACS = 磁活化细胞分选;ns = 不显著;RORγt = 视黄酸受体相关的孤儿核受体γ;SEM = 均值的标准误差;SPL = 脾脏;Tbet = T型盒转录因子TBX21;TCRβ = T 细胞受体 β;三氯硝基苯=2,4,6-三硝基氯苯。请按此下载此档案。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
CHS 通过 半抗原诱导,半抗原与皮肤中的自身蛋白抗原结合,产生新抗原。CHS由循环抗原特异性CHS效应T细胞的局部血管外募集介导,这导致受攻击组织肿胀,在次级皮肤暴露于同一半抗原6后24小时达到峰值。组织的肿胀主要是由白细胞浸润和白细胞依赖性纤维蛋白沉积24引起的。这些变化可以用一个千分尺测量半抗原致敏和激发小鼠与假敏和激发小鼠的耳朵肿胀来检测。
CHS也可以通过耳朵重量的比较来确定。然后,用于确定耳朵重量的耳冲头可用于进一步的测试。在发炎的耳朵中浸润的细胞由产生细胞因子的T淋巴细胞和MPO阳性中性粒细胞组成。在耳组织中匀浆,可以使用ELISA试验测量各种参数,例如MPO活性或促炎细胞因子(例如,TNF-α,IFN-γ,IL-17A等)的浓度或使用qPCR试验25测量皮肤中细胞因子mRNA的表达。此外,可以使用Evans蓝色测试21,26评估容器渗透率变化。
在发炎的耳组织中,观察到的变化也可以与 体外 试验相辅相成,突出T细胞增殖和细胞因子产生。这可以通过在半抗原偶联蛋白抗原22,27存在下培养ALN来轻松实现。通过从致敏但未受到质疑的小鼠中分离的ALNs对细胞因子分泌的评估提供了有关CHS效应细胞在其诱导位置产生细胞因子的详细信息。
局限性
许多千分尺以不同的精度测量耳朵肿胀。例如,最低压力由弹簧卡钳施加,因此结果似乎最能反映实际的耳朵厚度测量值。然而,施加更大压力的千分尺,如Mitutoyo,可能会在水肿形成的早期阶段更紧密地压缩积聚在耳朵中的液体。使用这种千分尺可以更清楚地可视化CHS的双相性质,因为施加了更大的压力。当使用压力为28的弹簧卡钳时,这更加困难。然而,在一些研究中,耳朵的厚度是用卡尺29测量的。此外,观察者的经验确保了准确的测量,即使观察者不知道实验组,也会受到主观感受的影响。
这里已经描述了替代方法,这些方法可以帮助用千分尺确认耳朵肿胀的测量值,使呈现的数据更可靠,主观性更小。但是,这些用于评估CHS的替代策略只能在一个时间点使用。千分尺测量可以在不同的时间点重复进行,从而可以研究CHS动力学。
修改
我们在实验室中使用的CHS反应的研究方案与其他实验室中使用的方案有很大不同,包括半抗原的剂量和用于诱发和致敏的溶剂组成,以及评估反应的时间点。耳朵厚度可以在不同的时间点(例如,激发后2小时,24小时,48小时和72小时)测量10,30。 表1显示了不同的实验模型,特别是动物品系,半抗原和各种研究中使用的致敏/激发时间的差异10,21,22,26,31,32,33,34,35,36,37.CHS方案也可以在没有事先剃除小鼠腹部的情况下进行。
下一个区别涉及诱导(挑战)本身的执行。与典型情况一样,敏化是通过单独用半抗原或载体涂覆剃须小鼠的腹部皮肤来完成的。随后,在两组中,每只耳朵侧都有稀释的半抗原挑战一只耳朵。作为对照,对面的耳朵涂有相同数量的车辆单独10,31。
关键步骤
最关键的时刻是触发CHS,因为测试结果取决于它。(1)Hapten溶液非常易挥发且对光敏感,因此必须密闭并避光,并且在使用时必须迅速涂抹在动物的皮肤上,以免蒸发。(2)将半抗原涂在腹部皮肤上后,必须在动物返回笼子之前将其干燥,因为小鼠可以将其涂抹在垫料上或用爪子将其涂抹在耳朵上(那么耳廓厚度的测量可能不足)。(3)标记动物的各种方法,例如用耐溶剂标记标记小鼠尾巴,也是已知的。然而,标记物中存在的染料可能(未研究)成为半抗原并触发CHS。因此,在本研究中,选择了不影响反应的标记方法。(4)选择剃须方法非常重要,因为它会刺激皮肤。在该协议中,使用了灰色肥皂,因为它具有舒缓特性;它加速了轻微割伤和溃烂伤口的治疗,这得益于其抗菌作用。它可以舒缓皮肤的肿胀和炎症。
需要进一步调查和标准化实验程序,包括动物使用(菌株和性别),以比较不同研究的结果。
许多不同的环境因素和具有生物功能的新物质可以在CHS模型中进行测试。如果研究人员想要证明测试因子是否调节T细胞依赖性免疫反应,则该模型可能很有用。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者没有什么可透露的。
Acknowledgments
这项研究得到了亚必胜区补助金的支持。波兰弗罗茨瓦夫医科大学的A020.22.060,以及科学和高等教育部N N401 545940至MS和IP2012 0443 72至MMS的赠款。
Materials
| Name | Company | Catalog Number | Comments |
| 70% ethanol | Merck KGaA, Darmstadt, Germany | 65350-M | for surface disinfection |
| 96-well flat-bottom plates, polypropylene | Greiner Bio-One GmbH, Kremsmunster, Austria | 655101 | for MPO and Evans blue measurement - plates should be made of polypropylene, that has a lower binding capacity so proteins or DNA will not bind |
| Acetone (ACS reagent, ≥99.5%) | Merck KGaA, Darmstadt, Germany | 179124 | |
| Aluminum foil | Merck KGaA, Darmstadt, Germany | Z185140 | |
| Analytical balance | Sartorius Weighing Technology GmbH, Goettingen, Germany | PRACTUM224-1s, 29105177 | |
| Automated tissue processor | MediMeas Instruments, Sarsehri, Haryana, India | MTP-E-212 | automatically prepare tissue samples by fixing, dehydrating, clearing, and infiltrating them with paraffin |
| BD Vacutainer SST II Advance (tube with gel for obtaining serum) | Becton Dickinson (BD), Franklin Lakes, NJ, USA | BD 366882 | |
| Bicinchoninic acid kit for protein determination | Merck KGaA, Darmstadt, Germany | BCA1-1KT | |
| Biotin Rat Anti-Mouse IgG1 | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 553441 | |
| BSA (bovine serum albumine) | Merck KGaA, Darmstadt, Germany | A9418 | protein assays & analysis, 2 mg/mL |
| Cell strainer, pore size 70 μm | BIOLOGIX, China | 15-1070 | suitable for 50 mL tubes |
| Coverslip | VWR, Radnor, Pennsylvania, United States | 631-1583 | 24 mm, but it possible to use different size |
| Disposable pipettes capacity: 5 mL, 10 mL, 25 mL | Merck KGaA, Darmstadt, Germany | Z740301, Z740302, Z740303 | |
| DPBS (Dulbecco′s phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 14190144 | no calcium, no magnesium, mammalian cell culture |
| DPX Mountant for histology | Merck KGaA, Darmstadt, Germany | 6522 | mounting media for H-E, might be used some other e.g, Canada balsam |
| Dumont 5 tweezers - straight | Animalab, Poznan, Poland | 11251-10FST | surgical instruments for procedures on mice (should be steriled) |
| Dumont 7 tweezers - bent | Animalab, Poznan, Poland | 11272-50FST | surgical instruments for procedures on mice (should be steriled) |
| Eosin Y solution, alcoholic | Merck KGaA, Darmstadt, Germany | HT110116 | |
| Eppendorf Safe-Lock Tubes 1.5 mL | Eppenforf, Germany | 3,01,20,086 | polypropylene |
| Eppendorf Safe-Lock Tubes, 2.0 mL | Eppenforf, Germany | 3,01,20,094 | polypropylene, round bottom (the homogenization beads can easily move) |
| Ethanol 100% (absolute alkohol) | Merck KGaA, Darmstadt, Germany | 1.07017 | |
| Ethanol 96% | Merck KGaA, Darmstadt, Germany | 1.59010 | |
| Evans blue | Merck KGaA, Darmstadt, Germany | E2129 | |
| FBS (fetal bovine serum) | ThermoFisher Scientific, Waltham, Massachusetts, USA | A3160802 | |
| Formalin solution, neutral buffered, 10% | Merck KGaA, Darmstadt, Germany | HT501128 | |
| Formamide 99.5% (GC) | Merck KGaA, Darmstadt, Germany | F7503 | |
| Freezer -20 °C | Bosch, Germany | GSN54AW30 | |
| Fridge +4 °C / freezer -20 °C | Bosch, Germany | KGV36V10 | mammalian Cell Culture, qualified, Brazil, 10 x 50 mL |
| Glass microskope slides, SuperFrost Plus | VWR, Radnor, Pennsylvania, United States | 631-0108, 631-0446, 631-0447, 631-0448, 631-0449 | Slides that eliminates the need to apply adhesive materials or protein coatings, to preventing any tissue sections loss during staining. |
| Graph Pad Prism | GraphPad Software Inc. | v. 9.4.0 | |
| Grey soap | Pollena Ostrzeszów, Producent Chemii Gospodarczej Sp. Z.o.o. , Sp. K., Poland | Bialy jelen soap bar | grey Soap Bar Natural Hypoallergenic. Generally available product |
| H2SO4 (sulfuric acid) 1 mol/l (1 M) | Merck KGaA, Darmstadt, Germany | 1.60313 | |
| Harris hematoxylin solution | Merck KGaA, Darmstadt, Germany | HHS16 | |
| Hemocytometer | VWR, Avantor, U.S.A | 612-5719 | manual counting chamber is recommend, which is more accurate |
| Hexadecyltrimethylammonium bromide | Merck KGaA, Darmstadt, Germany | H5882 | |
| Homogenizer | QIAGEN Hilden, Germany | Tissue Lyser LT, SN 23.1001/05234 | homogenizer with stainless steel beads (diameter 5 mm) for 2 mL centrifuge tubes |
| Horseradish peroxidase streptavidin (HRP streptavidin) | Vector Laboratories, Inc., Burlingame, CA, USA | SA-5004-1 | |
| Hydrogen peroxide solution (H202) | Merck KGaA, Darmstadt, Germany | H1009 | |
| Incubator Heracell 150i | Thermo Electron LED Gmbh, Germany | 41071068 | 37 oC in the atmosphere of 5 % CO2, and 65 0C for deparaffinization the sections for histology |
| Ketamine 100 mg/mL, solution for injection | Biowet Pulawy Sp. z o.o., Pulawy, Poland | cat.# not avaliable | |
| KH2PO4 (potassium dihydrogen phosphate) 99.995% anhydrous basis | Merck KGaA, Darmstadt, Germany | 1.05108 | |
| Laboratory Centrifuge | Heraeus Megafuge 1.0R, Thermo Scientific, Germany | B00013899 | speed to 300 x g, with cooling to 4 0C |
| Laboratory Centrifuge | Heraeus Fresco 21, Thermo Scientific, Germany | 75002425 | speed to 3,000 x g, with cooling to 4 0C |
| Mask (FFP2) | VWR, Radnor, Pennsylvania, United States | 111-0917 | for working with ortho-dianisine dihydrochloride |
| Mice | Breeding unit of the Chair of Biomedical Sciences, Faculty of Health Sciences, Jagiellonian University Medical College, Krakow, Poland | CBA/J, C57BL/6 | |
| Micrometer | Mitutoyo, Tokyo, Japan | 193-111 | digit Outside Micrometer, Ratchet Stop, 0-25mm Range, 0.001mm Graduation, +/-0.002mm Accuracy, https://shop.mitutoyo.pl/web/mitutoyo/pl_PL/all/all/Mikrometr%20analogowy%20/PR/193-111/index.xhtml |
| microplate, 96 well, microlon, high binding (for ELISA test) | Greiner Bio-One GmbH, Kremsmunster, Austria | 655061 | with maxi-sorp binding surfaces for reliable and reproducible results in colormetric assays |
| Microscope with objectives | Leica Microsystems CMS GmbH, Germany | DM1000, 294011-082007 | histology presented in the paper was performed under ThermoFisher Scientific EVOS M5000 Imaging System, with objectives: FL 20X LWDPH, 0.40NA/3.1WD and FL 40X LWDPH 0.65NA/1.79WD |
| Myeloperoxidase from human leukocytes (MPO standard) | Merck KGaA, Darmstadt, Germany | M6908 | |
| Na2HPO4 x 7 H2O (sodium phosphate dibasic heptahydrate) | Merck KGaA, Darmstadt, Germany | S9390 | |
| Olive-oil | Merck KGaA, Darmstadt, Germany | 75343 | pure, natural |
| OptEIA Mouse IFN-γ ELISA Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555138 | |
| Ortho-dianisine dihydrochloride | Merck KGaA, Darmstadt, Germany | D3252 | |
| Paraffin wax | Merck KGaA, Darmstadt, Germany | 76242 | beads, waxy solid |
| PBS (phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 20012027 | pH 7.2, mammalian cell culture |
| ph meter | Elmetron, Poland | CP-401 | |
| Pipettes, variable volume with tips | Merck KGaA, Darmstadt, Germany | EP3123000900-1EA | 3-pack, Option 1, 0.5-10 uL/10-100 uL/100-1000 uL, includes epT.I.P.S. |
| Razor blade | VWR, Radnor, Pennsylvania, United States | PERS94-0462 | scraper and cutter blades, single edge, aluminium spine, 100 blades per box, individually wrapped |
| Rotary microtome | MRC Laboratory-Instruments, Essex, CM20 2HU UK | HIS-202A | |
| Scissors - straight, sharp / sharp | Animalab, Poznan, Poland | 14060-10FST | Surgical instruments for procedures on mice (should be steriled) |
| Screw cap (open top) | Merck KGaA, Darmstadt, Germany | 27056 | black polypropylene hole cap, for use with 22 mL vial with 20-400 thread |
| Spectrophotometer | BioTek Instruments, U.S.A | 201446 | universal microplate spectrophotometer: λ range: 200 - 999 nm, absorbance measurement range: 0.000 - 4.000 Abs |
| Staining dish 20 slides with rack | Merck KGaA, Darmstadt, Germany | S6141 | e.g. 20 slide staining dishes complete with covers, slide rack and handle |
| Sterile Disposable Biopsy Punch 6mm | Integra LifeSciences, Princeton, NJ, USA | 33-36 | |
| Surgical scissors | Animalab, Poznan, Poland | 52138-46 | surgical instruments for procedures on mice (should be steriled) |
| Tissue processing cassettes | Merck KGaA, Darmstadt, Germany | Z672122 | tissue processing/ embedding cassettes with lid |
| TMB Substrate Reagent Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555214 | |
| TNCB (2,4,6-trinitrochlorobenzene) | Tokyo Chemical Industry CO., LTD, Japan | C0307 | |
| TNP-BSA (bovine serum albumin conjugated with 2,4,6-trinitrophenyl) | Biosearch Technologies LGC, Petaluma, CA, USA | T-5050 | |
| T-PER (tissue protein extration reagent) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 78510 | |
| Tubes 15 mL sterile | Merck KGaA, Darmstadt, Germany | CLS430055 (Corning) | polypropylene, conical bottom |
| Tubes 50 mL, sterile | Merck KGaA, Darmstadt, Germany | CLS430290 (Corning) | polypropylene, conical bottom |
| Tween 20 | Merck KGaA, Darmstadt, Germany | P1379 | |
| Vials, screw top, clear glass (vial only) 22 mL | Merck KGaA, Darmstadt, Germany | 27173 | for the preparation of hapten, screwed on so that it does not evaporate |
| Water bath | AJL Electronic, Poland | LW102 | |
| Wax (paraffin) dispenser | VWR, Radnor, Pennsylvania, United States | 114-8737 | |
| Xylazine (xylapan 20 mg/mL) solution for injection | Vetoquinol Biowet Sp. z o.o., Gorzow Wielkopolski, Poland | cat.# not avaliable | |
| Xylene (histological grade) | Merck KGaA, Darmstadt, Germany | 534056 |
References
- Nosbaum, A., Vocanson, M., Rozieres, A., Hennino, A., Nicolas, J. F. Allergic and irritant contact dermatitis. European Journal of Dermatology. 19 (4), 325-332 (2009).
- Hertl, M., et al. Predominance of epidermal CD8+ T lymphocytes in bullous cutaneous reactions caused by beta-lactam antibiotics. The Journal of Investigative Dermatology. 101 (6), 794-799 (1993).
- Martin, S. F. T lymphocyte-mediated immune responses to chemical haptens and metal ions: implications for allergic and autoimmune disease. International Archives of Allergy and Immunology. 134 (3), 186-198 (2004).
- Takeyoshi, M., Iida, K., Suzuki, K., Yamazaki, S. Skin sensitization potency of isoeugenol and its dimers evaluated by a non-radioisotopic modification of the local lymph node assay and guinea pig maximization test. Journal of Applied Toxicology. 28 (4), 530-534 (2008).
- Nakamura, K., Aizawa, M. Studies on the genetic control of picryl chloride contact hypersensitivity reaction in inbred rats. Transplantation Proceedings. 13 (2), 1400-1403 (1981).
- Asherson, G. L., Ptak, W. Contact and delayed hypersensitivity in the mouse. I. Active sensitization and passive transfer. Immunology. 15 (3), 405-416 (1968).
- Honda, T., Egawa, G., Grabbe, S., Kabashima, K. Update of immune events in the murine contact hypersensitivity model: toward the understanding of allergic contact dermatitis. The Journal of Investigative Dermatology. 133 (2), 303-315 (2013).
- Kaplan, D. H., Jenison, M. C., Saeland, S., Shlomchik, W. D., Shlomchik, M. J. Epidermal langerhans cell-deficient mice develop enhanced contact hypersensitivity. Immunity. 23 (6), 611-620 (2005).
- Wang, L., et al. Langerin expressing cells promote skin immune responses under defined conditions. Journal of Immunology. 180 (7), 4722-4727 (2008).
- Wang, B., et al. CD4+ Th1 and CD8+ type 1 cytotoxic T cells both play a crucial role in the full development of contact hypersensitivity. Journal of Immunology. 165 (12), 6783-6790 (2000).
- Mori, T., et al. Cutaneous hypersensitivities to hapten are controlled by IFN-gamma-upregulated keratinocyte Th1 chemokines and IFN-gamma-downregulated langerhans cell Th2 chemokines. The Journal of Investigative Dermatology. 128 (7), 1719-1727 (2008).
- Peszkowski, M. J., Warfvinge, G., Larsson, A. Allergic and irritant contact responses to DNFB in BN and LEW rat strains with different TH1/TH2 profiles. Acta Dermato-Venereologica. 74 (5), 371-374 (1994).
- Henningsen, S. J., Mickell, J., Zachariae, H. Plasma kinins in dinitrochlorobenzene contact dermatitis of guinea-pigs. Acta Allergologica. 25 (5), 327-331 (1970).
- Maibach, H. I., Maguire, H. C. Elicitation of delayed hypersensitivity (DNCB contact dermatitis) in markedly panleukopenic guinea pigs. The Journal of Investigative Dermatology. 41, 123-127 (1963).
- Martel, B. C., Lovato, P., Bäumer, W., Olivry, T. Translational animal models of atopic dermatitis for preclinical studies. The Yale Journal of Biology and Medicine. 90 (3), 389-402 (2017).
- Jin, H., He, R., Oyoshi, M., Geha, R. S. Animal models of atopic dermatitis. The Journal of Investigative Dermatology. 129 (1), 31-40 (2009).
- Li, Y. Z., Lu, X. Y., Jiang, W., Li, L. F. Anti-inflammatory effect of qingpeng ointment in atopic dermatitis-like murine model. Evidence-Based Complementary and Alternative. 2013, 907016 (2013).
- Hoggatt, J., Hoggatt, A. F., Tate, T. A., Fortman, J., Pelus, L. M. Bleeding the laboratory mouse: Not all methods are equal. Experimental Hematology. 44 (2), 132-137 (2016).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and th17 differentiation of naïve CD4 T lymphocytes. Journal of Visualized Experiments. (79), e50765 (2013).
- Vlab, A. Hemocytometer - Counting of Cells. Amrita University. , Available from: https://www.youtube.com/watch?v=MKS0KM3lr90 (2011).
- Majewska-Szczepanik, M., Strzepa, A., Marcińska, K., Wen, L., Szczepanik, M. Epicutaneous immunization with TNP-Ig and Zymosan induces TCRαβ+ CD4+ contrasuppressor cells that reverse skin-induced suppression via IL-17A. International Archives of Allergy and Immunology. 164 (2), 122-136 (2014).
- Majewska-Szczepanik, M., Zemelka-Wiącek, M., Ptak, W., Wen, L., Szczepanik, M. Epicutaneous immunization with DNP-BSA induces CD4+ CD25+ Treg cells that inhibit Tc1-mediated CS. Immunology and Cell Biology. 90 (8), 784-795 (2012).
- Directive 2010/63 / EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union. , Available from: https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2010:276:0033:0079:En:PDF (2010).
- Colvin, R. B., Dvorak, H. F. Role of the clotting system in cell-mediated hypersensitivity. II. Kinetics of fibrinogen/fibrin accumulation and vascular permeability changes in tuberculin and cutaneous basophil hypersensitivity reactions. Journal of Immunology. 114, 377-387 (1975).
- Szczepanik, M., et al. Regulation of contact sensitivity in non-obese diabetic (NOD) mice by innate immunity. Contact Dermatitis. 79 (4), 197-207 (2018).
- Askenase, P. W., Majewska-Szczepanik, M., Kerfoot, S., Szczepanik, M. Participation of iNKT cells in the early and late components of Tc1-mediated DNFB contact sensitivity: Cooperative role of γδ-T cells. Scandinavian Journal of Immunology. 73 (5), 465-477 (2011).
- Zemelka-Wiącek, M., Majewska-Szczepanik, M., Ptak, W., Szczepanik, M. Epicutaneous immunization with protein antigen induces antigen-non-specific suppression of CD8 T cell mediated contact sensitivity. Pharmacological Reports. 64 (6), 1485-1496 (2012).
- Van Loveren, H., et al. Use of micrometers and calipers to measure various components of delayed-type hypersensitivity ear swelling reactions in mice. Journal of Immunological Methods. 67 (2), 311-319 (1984).
- Tsuji, R. F., et al. B cell-dependent T cell responses: IgM antibodies are required to elicit contact sensitivity. The Journal of Experimental Medicine. 196 (10), 1277-1290 (2002).
- Campos, R. A., et al. Cutaneous immunization rapidly activates liver invariant Valpha14 NKT cells stimulating B-1 B cells to initiate T cell recruitment for elicitation of contact sensitivity. The Journal of Experimental Medicine. 198 (12), 1785-1796 (2003).
- Rühl-Muth, A. C., Maler, M. D., Esser, P. R., Martin, S. F. Feeding of a fat-enriched diet causes the loss of resistance to contact hypersensitivity. Contact Dermatitis. 85 (4), 398-406 (2021).
- Bour, H., et al. histocompatibility complex class I-restricted CD8+ T cells and class II-restricted CD4+ T cells, respectively, mediate and regulate contact sensitivity to dinitrofluorobenzene. European Journal of Immunology. 25 (11), 3006-3010 (1995).
- Majewska-Szczepanik, M., et al. Obesity aggravates contact hypersensitivity reaction in mice. Contact Dermatitis. 87 (1), 28-39 (2022).
- Katagiri, K., Arakawa, S., Kurahashi, R., Hatano, Y. Impaired contact hypersensitivity in diet-induced obese mice. Journal of Dermatological Science. 46 (2), 117-126 (2007).
- Bouloc, A., Cavani, A., Katz, S. I. Contact hypersensitivity in MHC class II-deficient mice depends on CD8 T lymphocytes primed by immunostimulating Langerhans cells. The Journal of Investigative Dermatology. 111 (1), 44-49 (1998).
- Martin, S., et al. Peptide immunization indicates that CD8+ T cells are the dominant effector cells in trinitrophenyl-specific contact hypersensitivity. The Journal of Investigative Dermatology. 115 (2), 260-266 (2000).
- Vennegaard, M. T., et al. Epicutaneous exposure to nickel induces nickel allergy in mice via a MyD88-dependent and interleukin-1-dependent pathway. Contact Dermatitis. 71 (4), 224-232 (2014).
Tags
免疫学和感染,第187期,小鼠模型,过敏性接触性皮炎(ACD),接触性超敏反应(CHS),耳肿胀,血管通透性,髓过氧化物酶(MPO),细胞因子,2,4,6-三硝基氯苯(TNCB),半抗原Erratum
Formal Correction: Erratum: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis
Posted by JoVE Editors on 01/19/2023.
Citeable Link.
An erratum was issued for: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis. The Protocol and Representative Results sections were updated.
Step 3.2.1 of the Protocol has been updated from:
On day "4", prepare 0.4% hapten: TNCB in an acetone-ethanol mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
to:
On day "4", prepare 0.4% hapten: TNCB in an acetone: olive oil mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
Figure 1 of the Representative Results has been updated from:
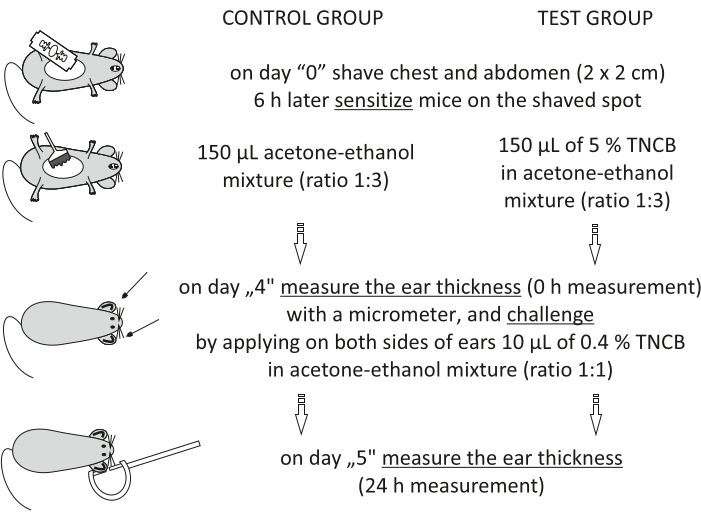
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
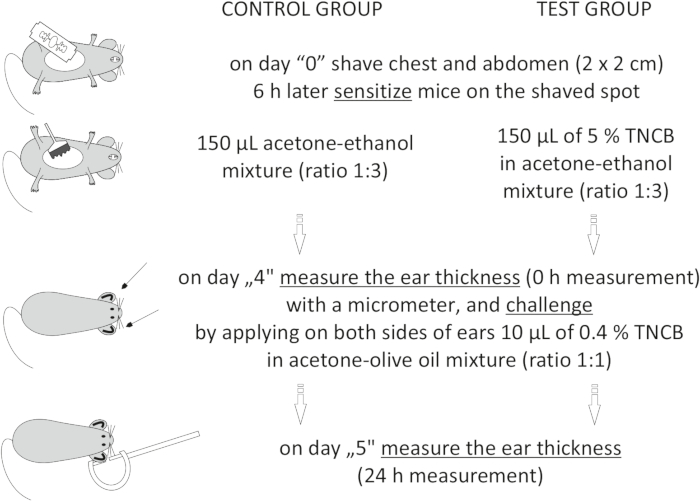
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
Figure 2 of the Representative Results has been updated from:
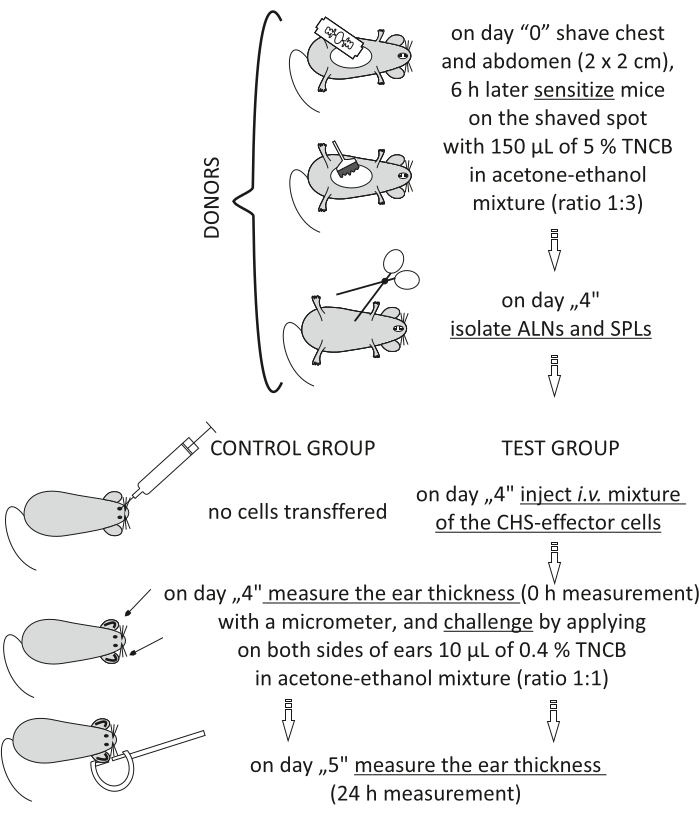
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
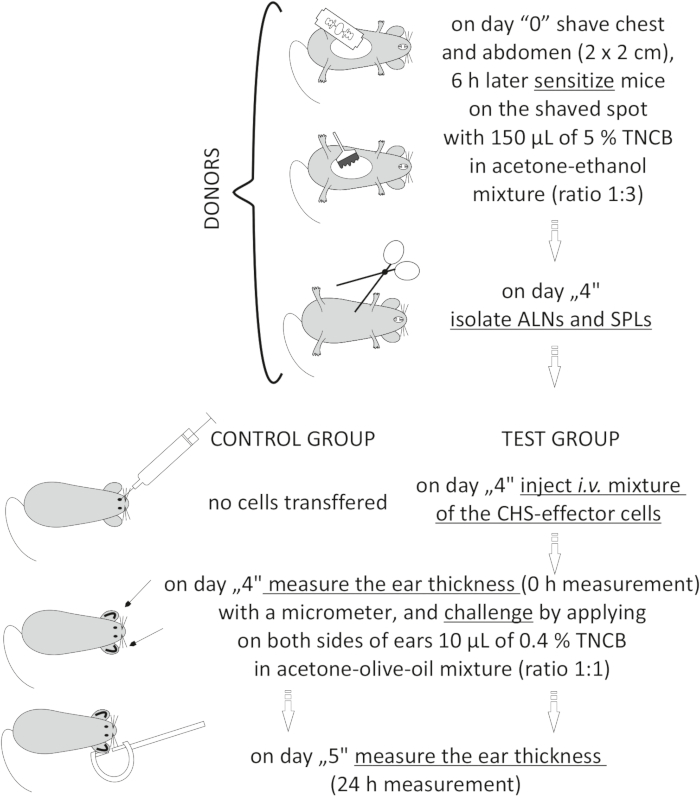
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.



