ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
L’hypersensibilité de contact (SHC) est un modèle expérimental murin de dermatite de contact allergique (DCA). Le SHC est basé sur la sensibilisation à l’haptène réactif en peignant la peau rasée de la poitrine et de l’abdomen, avec un défi cutané ultérieur de l’oreille avec un haptène dilué, provoquant une réaction de gonflement qui est évaluée de diverses manières.
Abstract
L’hypersensibilité de contact (CHS) est un modèle expérimental de dermatite de contact allergique (DCA) qui peut être étudié chez la souris. Cette étude vise à présenter une méthode de laboratoire objective qui peut aider à étudier la réaction CHS chez la souris, qui peut être mesurée et quantifiée par divers tests. Pour induire le SHC, le jour « 0 », les souris ont été sensibilisées sur une tache précédemment rasée par peinture de la peau abdominale avec le 2,4,6-trinitrochlorobenzène (TNCB) haptène dans un mélange acétone-éthanol, tandis que les souris témoins négatives ont été sensibilisées avec un mélange véhicule seul-acétone-éthanol. Le jour « 4 », l’épaisseur de base de l’oreille a été mesurée avec un micromètre avant l’élicitation du SHC (défi) en peignant les deux oreilles avec de la TNCB diluée à la fois dans les groupes d’essai et témoin. Après 24 h, le gonflement de l’oreille a été mesuré avec un micromètre. Le SHC est un exemple de réponse immunitaire médiée par les lymphocytes T qui provoque un gonflement des tissus enflammés, culminant 24 heures après le défi cutané avec le même haptène. Une augmentation de l’œdème de l’oreille était corrélée à une augmentation du poids de l’oreille, à l’activité de la myéloperoxydase (MPO), à la concentration de cytokines pro-inflammatoires dans les extraits de l’oreille, à l’augmentation de l’épaississement du derme œdémateux lors de l’examen histologique et à la perméabilité vasculaire de l’oreille. Il y avait également une augmentation de la concentration d’anticorps IgG1 spécifiques du TNP dans le sérum du groupe test par rapport aux souris témoins. De plus, le SHC peut être transféré avec succès avec les cellules effectrices du SHC obtenues auprès de donneurs préalablement sensibilisés à la BNTN. Les cellules effectrices du SHC ont été administrées par voie intraveineuse à des souris receveuses naïves, qui ont ensuite été confrontées au même haptène dilué. L’enflure de l’oreille a été mesurée avec un micromètre 24 heures plus tard.
Introduction
La dermatite de contact allergique (DCA) est une maladie inflammatoire cutanée courante dans les pays industrialisés causée par une réaction d’hypersensibilité de type IV résultant de l’exposition à des produits chimiques de faible poids moléculaire appelés haptènes. Les substances qui provoquent la sensibilisation au contact chez l’homme comprennent les ions de métaux lourds (chrome, nickel, fer, cobalt), la térébenthine, les parfums, les colorants et les agents de conservation présents dans les cosmétiques (p. ex., p-phénylènediamine), certains médicaments (p. ex., néomycine, benzocaïne), les antibiotiques β-lactamine (p. ex., pénicilline), les produits chimiques produits par les plantes (pentadécacatéchol, une substance présente dans l’herbe à puce), ainsi que l’hydroquinone utilisée dans l’industrie photographique 1,2 . Les agents étiologiques ACD sont très élevés car plus de 100 000 produits chimiques sont utilisés dans l’industrie seulement, et 2 000 nouveaux sont synthétisés chaque année. À ce jour, plus de 3 700 molécules pouvant être des haptènes/allergènes de contact ont été identifiées3. La réaction d’hypersensibilité de contact (CHS) est un modèle expérimental de DCA qui peut être étudié chez la souris, les cobayes et les rats et peut être induit par l’application cutanée topique d’haptènes chimiques réactifs dissous dans des solvants organiques 4,5,6. Cette étude vise à décrire une méthode de laboratoire objective qui peut aider à étudier la réaction CHS chez la souris, qui peut être mesurée et quantifiée par divers tests.
Le SHC comprend des phases de sensibilisation (induction) et d’effecteur (défi). Dans les modèles animaux, les haptènes se lient d’abord de manière covalente aux protéines du corps pour créer des néoantigènes. Pendant la phase de sensibilisation, les kératinocytes activés favorisent la migration et la maturation des cellules dendritiques cutanées (SDC) en produisant des cytokines pro-inflammatoires-facteur de nécrose tumorale α (TNF-α) et de l’interleukine 1β (IL-1β)7. Les cellules de Langerhans épidermiques (LC) présentent des antigènes lors des phases d’induction et d’effecteurdu SHC 8. Les LC exposées à l’haptène pendant la sensibilisation favorisent l’induction des cellules régulatrices et effectrices9. De plus en plus de preuves provenant de plusieurs études suggèrent que les réponses au SHC peuvent être médiées par des cellules Th1 restreintes au CMH CD4+ de classe II, libérant localement de l’interféron γ (IFN-γ) pour utiliser un infiltrat inflammatoire caractéristique, des lymphocytes Tc1 restreints au CMH CD8+ de classe I qui peuvent également libérer des γ d’IFN, mais surtout médier les dommages cytotoxiques aux kératinocytes, et maintenant aussi des cellules Th17 productrices d’interleukine17 (IL-17) 10, 11.
Plusieurs modèles de SHC différents utilisant diverses espèces1 2,13,14 et haptènes ont été développés (une comparaison détaillée des différents haptènes, solvants et moments d’application est résumée dans le tableau 1). La souris, une espèce de laboratoire fréquemment utilisée, offre quelques avantages dans l’étude du SHC. Il y a plus de souches, de knockouts (KO) et d’animaux transgéniques chez les souris par rapport aux autres espèces, ce qui en fait un animal très attrayant15. De plus, le modèle CHS nécessite de nombreux animaux, et les souris sont plus économiques ici. Les modèles animaux n’imitent pas l’ACD dans tous les aspects; en particulier, ils présentent des croûtes et desquamations, ce qui n’est pas courant chez l’homme16,17. Les caractéristiques de la maladie chronique sont difficiles à reproduire, principalement parce que le modèle décrit ne suppose pas l’application de l’haptène pendant une longue période de temps. Cependant, il a été confirmé ici que de nombreux aspects importants de l’ACD sont reproduits. Il a également été démontré que, comme chez l’homme, ces caractéristiques sont associées à des réactions allergiques locales. Le choix de l’haptène, son solvant et son application décrits dans ce protocole ont été dictés par le fait que les résultats ont été confirmés par de nombreux tests in vitro et qu’il a été testé et modifié en laboratoire pendant de nombreuses années jusqu’à ce que la version actuelle soit établie. Les modèles murins permettent l’analyse des sous-ensembles cellulaires ou des cytokines qui sont impliqués dans le développement de la DCA et sont essentiels pour les évaluations précliniques de nouveaux traitements.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Toutes les expériences présentées dans cet article ont été menées selon les directives du 1er Comité local d’éthique sur l’expérimentation animale à Cracovie. Toutes les procédures décrites ont été effectuées conformément aux recommandations locales, en particulier en ce qui concerne l’utilisation de la kétamine / xylazine comme anesthésique, l’utilisation des deux côtés des oreilles pour appliquer la substance / haptène, couper l’oreille et prélever le sang par l’ablation du globe oculaire. BalB/c (haplotype H-2d), CBA/J (H-2k) et C57BL/6 (H-2b) souris mâles et femelles, âgées de 6 à 12 semaines, ont été utilisés pour la présente étude (voir tableau des matériaux). Pour la signification statistique, il est préférable que chaque groupe de souris se compose de 10 à 12 animaux.
1. Préparation des animaux
- Nettoyez la table d’opération avec une solution d’éthanol à 70% avant et après toutes les procédures. Si vous utilisez des souris qui nécessitent des conditions stériles, effectuez toutes les opérations dans une armoire de biosécurité.
2. Marquage des souris pour identification
- Étiquetez les souris en rasant la peau avec une lame de rasoir: #0 - non marqué, #2 - sur la patte avant droite, #3 - sur le côté droit, #4 - sur la patte arrière droite, #5 - à la base de la queue, #6 - sur la patte arrière gauche, #7 - sur le côté gauche, #8 - sur la patte avant gauche.
REMARQUE: En raison de la réaction induite, les souris ne peuvent pas être marquées classiquement par un coup de poing ou un marquage à l’oreille. Les souris n’ont pas été anesthésiées lors de l’étiquetage.
3. Induction de la SHC
REMARQUE : Cette procédure est illustrée à la figure 1.
- Effectuez la sensibilisation (induction) en suivant les étapes ci-dessous.
- Le jour « 0 », rasez les souris sur la poitrine et l’abdomen (carré 2 cm x 2 cm) en appliquant du savon gris avec de l’eau et en les rasant avec une lame de rasoir.
REMARQUE: Avant d’appliquer hapten, attendez 6 h pour que la peau ne soit pas irritée. - Préparer 5% haptène: 2,4,6-trinitrochlorobenzène (TNCB, voir Tableau des matériaux) dans un mélange acétone-éthanol (rapport 1:3) ou véhicule seul (acétone-éthanol). Préparez les solutions juste avant utilisation dans un flacon en verre et protégez-le de la lumière en recouvrant le flacon de papier d’aluminium.
- Le même jour, sensibilisez les souris en appliquant 150 μL d’haptène à 5% sur la tache préalablement rasée. Dans le groupe de souris témoins, appliquez le véhicule seul pour évaluer la réaction inflammatoire non spécifique. Avant de remettre l’animal dans la cage, attendez 30 s en laissant sécher l’haptène.
ATTENTION : Utilisez des gants; La TNCB provoque une réaction allergique grave chez la plupart des gens.
- Le jour « 0 », rasez les souris sur la poitrine et l’abdomen (carré 2 cm x 2 cm) en appliquant du savon gris avec de l’eau et en les rasant avec une lame de rasoir.
- Effectuer une mesure de l’élicitation (défi) et de l’enflure de l’oreille.
- Le jour « 4 », préparer 0,4 % haptène : TNCB dans un mélange acétone-éthanol (rapport 1:1). Préparez la solution juste avant utilisation dans un flacon en verre et protégez-la de la lumière en recouvrant le flacon de papier d’aluminium.
- Anesthésier les souris avec une injection intrapéritonéale (i.p.) d’un mélange de kétamine (90-120 mg/kg) et de xylazine (5-10 mg/kg) (voir tableau des matériaux) pour une anesthésie profonde. Assurez-vous que la souris est entièrement anesthésiée pendant au moins 5 minutes par pincement des orteils.
- Mesurer l’épaisseur de l’oreille (mesure de 0 h, ligne de base) avec un micromètre (voir Tableau des matériaux) par un observateur ignorant les groupes expérimentaux.
- Appliquer 10 μL de 0,4 % d’haptène des deux côtés des oreilles dans les deux groupes (essai et contrôle). Avant de remettre l’animal dans la cage, attendez 30 s et laissez sécher l’haptène.
- Le jour « 5 », 24 h après l’application haptène, répétez les étapes 3.2.2-3.2.3 pour la mesure de 24 heures.
- Évaluer la réponse au SHC en calculant la différence d’épaisseur de l’oreille avant et après le défi avec l’haptène: 24 h d’épaisseur d’oreille (μm) - 0 h d’épaisseur d’oreille (μm). Comptez chaque oreille comme une mesure distincte. Ensuite, exprimez le gonflement de l’oreille en micromètres (μm) ± erreur-type de la moyenne (MEB) (tableau 2, figure 3).
4. Biopsies de l’oreille
- Directement après la mesure de 24 h de l’épaisseur de l’oreille (lorsque la souris est encore sous anesthésie profonde), coupez les oreilles le plus près possible du crâne avec des ciseaux. Prélever les biopsies du côté distal des oreilles en faisant un poinçon de 6 mm de diamètre à l’aide d’un poinçon de biopsie (voir tableau des matériaux).
- Mesurer le poids de l’oreille (étape 4.2) et effectuer en outre l’un des tests suivants sur la même biopsie de l’oreille : test de myéloperoxydase (MPO) (étape 4.3) ou mesure in vitro de la concentration de cytokines dans les extraits de l’oreille (p. ex. IFN-γ, IL-17A, TNF-α [étape 4.4]).
REMARQUE: Coupez les oreilles avant la collecte de sang. Après cette procédure, les souris doivent être euthanasiées (par exemple, par luxation cervicale).
- Mesurer le poids de l’oreille (étape 4.2) et effectuer en outre l’un des tests suivants sur la même biopsie de l’oreille : test de myéloperoxydase (MPO) (étape 4.3) ou mesure in vitro de la concentration de cytokines dans les extraits de l’oreille (p. ex. IFN-γ, IL-17A, TNF-α [étape 4.4]).
- Mesurer le poids de chaque biopsie de l’oreille sur la balance analytique et l’exprimer en milligrammes (mg) (Figure 4).
- Effectuez un test MPO en suivant les étapes ci-dessous.
- Préparer un tampon d’homogénéisation en dissolvant 0,5% de bromure d’hexadécyltriméthylammonium dans un tampon de phosphorate de 50 mmol KH2PO4/Na2HPO4 et en ajustant le pH à 6,0 (utilisation à température ambiante, RT).
- Homogénéiser les biopsies dans des tubes de microcentrifugation de 2 mL avec 500 μL de tampon préparé pendant 10 min à l’aide d’un homogénéisateur avec des billes d’acier inoxydable de 5 mm de diamètre (ajouter deux perles/flacon) (voir Tableau des matériaux). Ensuite, refroidissez l’échantillon pendant 15 min à 4 °C et homogénéisez-le pendant 10 min supplémentaires.
REMARQUE: Les tubes de microcentrifugation ont un fond rond afin que les perles puissent facilement se déplacer. - Congeler les homogénats à −20 °C pendant 30 min. Dégel et vortex (s’assurer que les échantillons sont décongelés). Répétez cette procédure 3x.
- Centrifuger les homogénats à 3 000 x g pendant 30 min à 4 °C. Récoltez les surnageants avec une pipette. Exprimer l’activité du MPO en unités (U) par 1 mg de protéines.
REMARQUE: Le protocole peut être mis en pause ici. Les échantillons sont stables à −20 °C pendant 3 mois. - Pour mesurer l’activité du MPO, effectuer une réaction enzymatique en mélangeant 20 μL de surnageant et 200 μL de substrat MPO (0,167 mg/mL de dichlorhydrate d’orthodianisine dans 50 mmol de tampon KH2PO4/Na2HPO4 avec 5 x 10−4 % H202) et ajouter dans des plaques à fond plat de 96 puits. Incuber les plaques pendant 20 min à RT.
- Préparer la courbe standard en utilisant 20 μL de l’étalon MPO à des concentrations allant de 0,008 U à 0,5 U dans 200 μL du substrat MPO. Préparez l’échantillon vierge avec le substrat MPO seul.
ATTENTION : Utilisez un masque lorsque vous travaillez avec du dichlorhydrate d’orthodianisine.
REMARQUE: Les plaques doivent être en polypropylène, qui a une capacité de liaison inférieure afin que les protéines ou l’ADN ne se lient pas. - Mesurer la densité optique (OD) à une longueur d’onde de λ = 460 nm. La réaction enzymatique est stable pendant 10 min. Lisez l’activité MPO dans les échantillons testés à partir de la courbe standard.
- Pour mesurer la concentration en protéines, utilisez 20 μL du surnageant, effectuez un test avec un kit d’acide bicinchoninique pour la détermination des protéines (voir tableau des matériaux) et mesurez la DO à λ = 562 nm (figure 5).
- Effectuer une mesure in vitro des cytokines dans l’extrait d’oreille.
- Homogénéiser les biopsies de l’oreille à RT dans des tubes de microcentrifugation de 2 mL avec 500 μL de réactif d’extraction des protéines tissulaires (T-PER) pendant 10 min à l’aide d’un homogénéisateur avec des billes en acier inoxydable de 5 mm de diamètre (ajouter deux perles/flacon). Ensuite, refroidissez l’échantillon pendant 15 min à 4 °C et homogénéisez-le pendant 10 min supplémentaires.
REMARQUE: Les tubes de microcentrifugation ont un fond rond afin que les perles puissent facilement se déplacer. - Centrifuger les homogénats à 3 000 x g pendant 30 min à 4 °C.
REMARQUE: Le protocole peut être mis en pause ici. Les échantillons sont stables à −80 °C pendant 6 mois. - Évaluer les niveaux de cytokines à l’aide d’un ensemble ELISA disponible dans le commerce (p. ex., IFN-γ) (voir la table des matériaux) en suivant les instructions du fabricant (figure 6).
- Homogénéiser les biopsies de l’oreille à RT dans des tubes de microcentrifugation de 2 mL avec 500 μL de réactif d’extraction des protéines tissulaires (T-PER) pendant 10 min à l’aide d’un homogénéisateur avec des billes en acier inoxydable de 5 mm de diamètre (ajouter deux perles/flacon). Ensuite, refroidissez l’échantillon pendant 15 min à 4 °C et homogénéisez-le pendant 10 min supplémentaires.
5. Histologie du tissu auriculaire
- Directement après la mesure de 24 h de l’épaisseur de l’oreille, lorsque la souris est encore profondément anesthésiée, coupez les oreilles le plus près possible du crâne avec les ciseaux (étape 4.1).
REMARQUE: Après cette procédure, les souris doivent être euthanasiées (par exemple, par luxation cervicale). - Effectuez l’incorporation de paraffine des blocs de tissu en suivant les étapes ci-dessous.
- Directement après le retrait, placez l’oreille dans ~ 10 mL de formol à 10% pendant 24 h.
- Placez les oreilles dans une cassette de traitement des tissus. Mettez les cassettes dans un processeur automatisé (voir Tableau des matériaux) pour les cycles de déshydratation (alcool 70%, 90%, 100%, 30 min chacun à RT), les cycles de nettoyage (xylène 3x, 30 min chacun à RT) et les cycles d’infiltration de cire (paraffine 3x, 30 min chacun à 56 °C).
- Retirez les cassettes du processeur automatisé et maintenez la plaque chauffante jusqu’à ce que cela soit nécessaire. Remplissez le moule à cire avec de la cire chaude (du distributeur).
- Retirez les sections de la cassette avec des pinces chauffées et placez-les dans le moule; Ensuite, placez la base de la cassette sur le dessus du moule, puis remplissez-la avec plus de cire. Placez-le dans de l’eau glacée sur une plaque froide pendant 30 min afin que la paraffine se solidifie pour former un bloc contenant l’échantillon.
- Utilisez un microtome rotatif (voir Tableau des matériaux) pour couper des sections d’environ 5 μm d’épaisseur. Faites flotter les sections dans un bain chaud pour les aplatir. Ramassez les sections sur une lame de microscope en verre. Laissez-les sécher à RT pour vous assurer que les sections adhèrent à la glissière.
REMARQUE: Utilisez des lames qui éliminent le besoin d’appliquer des matériaux adhésifs ou des revêtements protéiques pour éviter la perte de sections de tissus pendant la coloration.
- Effectuer une coloration à l’hématoxyline et à l’éosine (H & E).
- Préparez 17 plats de coloration avec les éléments suivants: xylène (quatre plats), 100% éthanol (alcool absolu) (quatre plats), 90% d’éthanol, 80% d’éthanol, 70% d’éthanol, 50% d’éthanol, PBS (trois plats), solution d’hématoxyline, solution d’éosine. Transférez les diapositives d’un plat à l’autre selon les étapes ci-dessous et effectuez le tout à RT.
REMARQUE: La procédure dans chaque plat peut être répétée environ 10x (par exemple, si un plat de 20 lames est utilisé, 200 taches peuvent être faites sans changer les fluides). - Déparaffiniser les sections par incubation à 65 °C pendant 30 min dans l’incubateur. Immergez les lames dans du xylène pendant 30 min. Répétez 1x dans du xylène neuf pendant 30 min.
- Immergez les lames dans de l’éthanol à 100% pendant 5 min. Répétez 1x dans de l’éthanol neuf à 100% pendant 5 min. Immerger les lames dans la rangée d’éthanol, à 90%, 80%, 70% et 50%, pendant 2 min dans chaque dilution.
- Immergez les lames dans une solution saline tamponnée au phosphate (PBS) pendant 5 min. Essuyez l’excès de liquide autour du tissu et de l’arrière des lames.
- Tacher les sections dans une solution d’hématoxyline (voir tableau des matériaux) pendant 7-8 min. Laver à l’eau courante pendant 30 s par l’arrière afin de ne pas endommager les sections. Répétez l’étape 5.3.4.
- Tacher les sections avec une solution d’éosine (voir tableau des matériaux) pendant 30 s. Lavez comme mentionné à l’étape 5.3.5, puis répétez l’étape 5.3.4.
- Immerger les lames dans de l’éthanol à 100 % (alcool absolu) pendant 2 min. Répétez 1x dans de l’éthanol neuf à 100% pendant 2 min.
- Immergez les lames dans du xylène pendant 5 min. Répétez 1x dans du xylène neuf pendant 5 min.
- Laissez sécher les sections à l’air libre pendant 15 min à RT. Ajoutez une goutte de support de montage (voir Tableau des matériaux) sur un couvercle, puis placez-le en haut de la section.
- Préparez 17 plats de coloration avec les éléments suivants: xylène (quatre plats), 100% éthanol (alcool absolu) (quatre plats), 90% d’éthanol, 80% d’éthanol, 70% d’éthanol, 50% d’éthanol, PBS (trois plats), solution d’hématoxyline, solution d’éosine. Transférez les diapositives d’un plat à l’autre selon les étapes ci-dessous et effectuez le tout à RT.
- Examinez la section au microscope optique sous un grossissement de 20x ou 40x et capturez des images (Figure 7).
6. Test de perméabilité vasculaire
REMARQUE: Alternativement à la mesure de l’épaisseur de l’oreille, un test de perméabilité vasculaire peut être effectué.
- Sensibilisez les souris le jour « 0 » (étapes 3.1.1 à 3.1.3), puis, le jour « 4 », anesthésiez les souris (étape 3.2.2) et appliquez directement l’haptène sur les oreilles (étape 3.2.4), en omettant la mesure de l’oreille de 0 h.
- À 23 h après le défi, anesthésiez les souris (étape 3.2.2).
- Injecter par voie intraveineuse (i.v.) 8,3 μL/g de poids corporel de colorant bleu Evans à 1 % (voir tableau des matériaux) dans la solution saline tamponnée au phosphate (DPBS) de Dulbecco.
- Anesthésier à nouveau les souris sous anesthésie profonde (étape 3.2.2)-1 h après l’injection de bleu d’Evans.
- Prélever des biopsies de l’oreille (étape 4.1).
REMARQUE: Après cette procédure, les souris doivent être euthanasiées (par exemple, par luxation cervicale). - Extraire le colorant du tissu, placer des poinçons d’oreille dans les tubes contenant 1 mL de formamide et incuber à 37 °C dans une atmosphère de 5 % de CO2 pendant 18 h.
- Centrifuger les biopsies à 3 000 x g pendant 3 min à RT. Prélever les surnageants avec une pipette.
- Mesurer la DO à une longueur d’onde de λ = 565 nm dans des plaques à fond plat de 96 puits contre un blanc contenant du formamide. La couleur est stable pendant 24 h. Lire la concentration des échantillons d’essai à partir de la courbe standard (utilisez les concentrations de bleu d’Evans allant de 0,2 à 30 μg de colorant/mL formamide) (Figure 8).
REMARQUE: Les plaques doivent être en polypropylène, qui a une capacité de liaison inférieure afin que les protéines ou l’ADN ne se lient pas.
7. Collecte de sérum et mesure des anticorps anti-TNP immunoglobulines (IgG1)
- Après avoir prélevé des biopsies de l’oreille (étape 4.1), lorsque la souris est encore sous anesthésie profonde, retirez le globe oculaire avec une pince à épiler, exercez une légère pression sur la souris et collectez le sang du sinus rétro-orbitaire dans le tube (flacon avec gel pour obtenir du sérum, voir Tableau des matériaux). Une autre méthode de collecte de sang pourrait être de percer le cœur avec une seringue et de recueillir le sang.
REMARQUE: Le sang doit être recueilli après avoir retiré les oreilles. La même méthode de saignement doit être utilisée dans toute une étude en raison de différences potentielles dans les paramètres sanguins18. Après cette procédure, les souris doivent être euthanasiées (par exemple, par luxation cervicale). - Inverser un minimum de 6x, attendre 30 min pour que le sang coagule, puis centrifuger à 1 300-2 000 x g pendant 10 min à TA.
REMARQUE: Le protocole peut être mis en pause ici. L’échantillon est stable à −20 °C pendant 6 mois. - Enduire une plaque à fond plat de 96 puits avec 50 μL d’albumine sérique bovine conjuguée avec du 2,4,6-trinitrophényle (TNP-BSA) dissous dans du DPBS à une concertation de 10 μg/mL. Ensuite, enduire la deuxième plaque d’albumine sérique bovine (BSA) seule dissoute dans du DPBS (fond) à une concentration de 10 μg/mL. Incuber toute la nuit à 4 °C.
REMARQUE: Le sérum de souris contient des anticorps (Abs) contre BSA, de sorte que les échantillons doivent être testés sur les deux plaques, et ensuite, un calcul doit être effectué (OD TNP-BSA - OD BSA). - Laver les plaques avec 300 μL de DPBS contenant 0,05% Tween 20. Répétez 3x.
- Préparer le diluant d dosage (AD) : DPBS contenant 1 % de BSA. Bloquer les puits avec AD pendant 1 h à RT. Laver à nouveau (étape 7.4).
- Préparer un étalon interne (iSTD) : sensibiliser les souris à la TNCB (étapes 3.1.1-3.1.3) et, 10 jours après la sensibilisation, prélever et interroger le sérum de tous les donneurs (étapes 7.1 et 7.2).
- Ajouter à la plaque 50 μL de concentrations graduées d’iSTD diluées avec AD pour obtenir la courbe standard (décrite dans le tableau 3). Ajouter à la plaque 50 μL d’échantillons de sérum. Tester chaque échantillon et courbe standard sur les deux plaques (revêtues de TNP-BSA et de BSA). Incuber pendant 2 h à RT. Laver les plaques (étape 7.4).
- Ajouter 50 μL d’anticorps monoclonal IgG1 anti-souris biotinylé (mAb, voir Tableau des matériaux) dilué à 1:250 avec AD et incuber pendant 1 h à RT. Laver à nouveau (étape 7.4).
- Ajouter 50 μL de peroxydase streptavidine de raifort (streptavidine HRD, voir Tableau des matières) diluée 1:2000 avec AD, et incuber pendant 30 min à RT dans l’obscurité. Lavez la plaque (étape 7.4).
- Ajouter 50 μL de substrat TMB (voir Tableau des matériaux) et incuber pendant 30 min à RT dans l’obscurité.
- Arrêter la réaction enzymatique en ajoutant 25 μL de 1 MH2SO4; la réaction est stable pendant 30 min.
- Mesurer la DO à une longueur d’onde de λ = 450 nm et un fond de 570 nm (l’arrière-plan doit être soustrait de chaque mesure de 450 nm). Lors de la présentation des résultats, soustrayez les mesures BSA du TNP-BSA pour les échantillons et la courbe standard. Ensuite, calculez l’unité (U) des anticorps selon la courbe standard (Figure 9).
8. Transfert adoptif des cellules effectrices du CHS
REMARQUE : Cette procédure est illustrée à la figure 2.
- Donneurs (au ratio d’un donneur:1 receveur) : sensibiliser les souris à la TNCB le jour « 0 » (étapes 3.1.1 à 3.1.3).
- Le jour « 4 », anesthésiez l’anesthésie profonde des souris (étape 3.2.2).
- Isoler avec une pince les ganglions lymphatiques axillaires et inguinaux (ALN) et la rate (SPL). Regrouper les ALN dans un flacon et les SPL dans un autre.
REMARQUE: Il y a un ganglion lymphatique axillaire derrière le muscle pectoral dans chaque aisselle. Un ganglion lymphatique inguinal dans la région de la hanche est situé à côté de trois vaisseaux sanguins. La rate est située sur le côté gauche du corps derrière l’intestin et l’estomac19. Travaillez avec des outils stériles dans une armoire de biosécurité pour maintenir des conditions stériles. Après cette procédure, les souris doivent être euthanasiées (par exemple, par luxation cervicale). - Écraser du tissu entre les extrémités givrées de deux lames de microscope. Passer la suspension cellulaire à travers une passoire cellulaire d’une taille de pores de 70 μm (voir Tableau des matériaux).
- Lavez les cellules avec du DPBS complété par 1% de sérum fœtal bovin (FBS). Centrifuger à 300 x g pendant 10 min à 4 °C. Décantez le surnageant et remettez en suspension la pastille cellulaire restante dans 1 à 5,0 mL de DPBS.
- Comptez les cellules vivantes à l’aide d’un hémocytomètre20 avec du bleu de Trypan et mélangez 10 μL de la suspension cellulaire avec 90-990 μL (selon le nombre de cellules) de bleu de Trypan. Tenez compte de la dilution lors du calcul du nombre de cellules (10x-100x).
- Préparer un mélange d’ALN et de SPL (rapport 1:1) : 8,0 x 106 jusqu’à 7,0 x 107/souris dans 200 μL de DPBS.
- Receveurs (souris syngéniques naïves) : anesthésier des souris receveuses naïves (étape 3.2.2) et injecter par voie intraveineuse un mélange préparé de cellules effectrices du CHS (étape 8.7). Dans le groupe témoin de souris, n’injectez aucune cellule.
- Mesurer l’épaisseur de l’oreille avant (0 h) et après (24 h) le défi (étapes 3.2.1 à 3.2.6) (figure 10).
- De plus, effectuer des tests sur des cellules effectrices CHS isolées (par exemple, phénotypage cellulaire ou mesure des cytokines produites par les cellules effectrices CHS par cytométrie en flux). Des cultures cellulaires peuvent également être établies, et la capacité des cellules effectrices du SHC à proliférer en présence de l’antigène ou de la quantité de cytokines sécrétées dans les surnageants de culture peut être évaluée21,22 (données non présentées).
REMARQUE: L’exécution de tests supplémentaires nécessite en conséquence plus de donneurs de cellules.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Pour l’induction du SHC, les animaux ont été sensibilisés par peinture cutanée (abdominale) avec 150 μL de TNCB à 5 % ou simulés sensibilisés avec le véhicule seul. Le jour « 4 », les réponses de gonflement de l’oreille des deux oreilles ont été induites par peinture de contact (défi) avec 10 μL de 0,4 % de TNCB chez les souris précédemment sensibilisées au TNCB (groupe test) et les souris du groupe témoin (simulacre sensibilisées). Les données présentées montrent que les souris sensibilisées à la TNCB et défiées 4 jours plus tard ont développé une augmentation significative de l’enflure de l’oreille par rapport aux souris simulées sensibilisées de la même manière (Figure 3, Tableau 2, test vs groupe témoin). Les résultats de l’enflure de l’oreille ont été complètement validés dans d’autres études, soulignant qu’une augmentation de l’œdème auriculaire déterminée avec un micromètre en accord avec un poids auriculaire augmenté (Figure 4), une activité MPO (Figure 5), une concentration de γ d’IFN dans les extraits d’oreille (Figure 6), une augmentation de l’épaississement du derme œdémateux lors de l’examen histologique (Figure 7) et une perméabilité vasculaire de l’oreille (Figure 8 ). Une augmentation de la concentration d’anticorps IgG1 spécifiques du TNP a également été observée dans le sérum des souris testées par rapport aux animaux témoins (Figure 9).
À titre d’exemple de réponse immunitaire médiée par les lymphocytes T, le SHC peut également être transféré chez des souris receveuses syngéniques naïves. Les donneurs ont été sensibilisés par l’application de la CNTN et, par la suite, les cellules effectrices du SHC ont été administrées par voie intraveineuse à des souris receveuses naïves, qui ont été confrontées à l’haptène et testées pour le SHC 24 heures plus tard (figure 10). Les animaux qui ont reçu les cellules effectrices du CHS de donneurs précédemment sensibilisés à la TNCB ont montré une augmentation significative de l’enflure de l’oreille par rapport aux animaux qui n’ont été mis au défi que (n’ont reçu aucune cellule).
La réaction CHS a un mécanisme complexe et implique diverses cellules. La présentation de l’antigène et l’activation des lymphocytes T/B se produisent dans les organes lymphatiques périphériques (p. ex., ALN et SPL). Il a été déterminé que les cellules effectrices du SHC appauvries en cellules CD4+ mais pas en cellules CD8+ avant le transfert cellulaire adoptif ont entraîné l’absence de réaction du SHC chez les souris receveuses. Ces cellules se sont révélées positives pour l’IFN-γ (facteur de transcription T-box TBX21, Tbet+) et l’IL-17A (récepteur nucléaire orphelin gamma lié aux récepteurs de l’acide rétinoïque, RORγT+) (figure supplémentaire 1).
Les résultats présentés des expériences représentatives ont été réalisés sur des souris mâles et femelles C57BL/6 et CBA/J âgées de 8 à 12 semaines. Suivant les règles 3R dans l’utilisation des animaux23, en particulier la réduction, aux fins de cet article, les résultats des expériences sont montrés sur de petits groupes d’animaux. Les données des graphiques sont présentées comme moyenne ± SEM. La signification statistique a été fixée à p < 0,05. Les graphiques ont été dessinés à l’aide du logiciel Prism (voir Tableau des matériaux).

Figure 1 : Induction du SHC. Sensibilisation, défi et mesure de l’oreille. Abréviations : CHS = réaction d’hypersensibilité de contact; TNCB = 2,4,6-trinitrochlorobenzène. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Transfert adoptif des cellules effectrices du SHC. Abréviations : ALN = ganglions lymphatiques axillaires et inguinaux; CHS = réaction d’hypersensibilité de contact; i.v. = par voie intraveineuse; SPL = rate; TNCB = 2,4,6-trinitrochlorobenzène. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Évaluation représentative du SHC à la TNCB par la mesure de l’enflure de l’oreille au micromètre. Les souris ont été sensibilisées par la TNCB (groupe test) ou simulées (groupe témoin) et ont ensuite été mises au défi. L’épaisseur de l’oreillette a été mesurée avant et après le défi, et les différences de gonflement de l’oreille ont été calculées en soustrayant l’épaisseur de l’oreille de 0 h (μm) de l’épaisseur de l’oreille de 24 h (μm). L’enflure de l’oreille a été exprimée en moyenne ± SEM, ****p < 0,0001, n = 10 souris/groupe (données du tableau 2). Abréviations : CHS = réaction d’hypersensibilité de contact; SEM = erreur-type de la moyenne; TNCB = 2,4,6-trinitrochlorobenzène. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Évaluation représentative du SHC par la mesure du poids de l’oreille. Le poids de l’oreille est l’un des paramètres qui correspond à l’enflure de l’oreille. Les souris ont été sensibilisées par la TNCB (groupe test) ou simulées (groupe témoin) et ont ensuite été mises au défi. 24 heures après le défi, des poinçons de 6 mm de diamètre ont été prélevés sur les oreilles enlevées. Les poinçons ont été pesés sur une balance de laboratoire analytique. Le poids de l’oreille a été exprimé en milligrammes (mg) en moyenne ± SEM, ***p < 0,001, n = 10 souris / groupe. Abréviations : CHS = réaction d’hypersensibilité de contact; SEM = erreur-type de la moyenne; TNCB = 2,4,6-trinitrochlorobenzène. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Évaluation représentative de l’activité du MPO. L’augmentation de l’activité du MPO dans les extraits de tissus est en corrélation avec l’inflammation de l’oreille. Les souris sensibilisées à la TNCB (groupe d’essai) et les souris simulées sensibilisées (groupe témoin) ont été mises au défi. 24 heures après le défi, les oreilles ont été enlevées et des poinçons de 6 mm de diamètre de l’oreille ont été extraits et traités. L’activité du MPO est exprimée en U par teneur en protéines (U/g de protéines). Résultats affichés en moyenne ± SEM, **p < 0,01, n = 5-6 souris/ groupe. Abréviations : CHS = réaction d’hypersensibilité de contact; MPO = myéloperoxydase; SEM = erreur-type de la moyenne; TNCB = 2,4,6-trinitrochlorobenzène; U = unités. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Évaluation représentative de la production de cytokines - CONCENTRATION DE γ d’IFN dans les extraits d’oreille. Les souris ont été sensibilisées par la TNCB (groupe test) ou simulées (groupe témoin) et ont ensuite été mises au défi. 24 heures après le défi, les oreilles ont été enlevées et des poinçons de 6 mm de diamètre de l’oreille ont été pris. La concentration d’IFN-γ a été déterminée dans les homogénats tissulaires par ELISA. Résultats présentés comme moyenne ± SEM, *p < 0,05, n = 5 souris/groupe. Abréviations : CHS = réaction d’hypersensibilité de contact; IFN-γ = interféron gamma; SEM = erreur-type de la moyenne; TNCB = 2,4,6-trinitrochlorobenzène. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Histologie représentative du tissu auriculaire. Coloration à l’hématoxyline et à l’éosine. Les souris ont été sensibilisées par la TNCB (groupe test) ou simulées (groupe témoin) et ont ensuite été mises au défi. (A-C) L’examen histologique dans le groupe test s’est manifesté par une concentration significativement accrue de cellules inflammatoires (cellules mononucléaires et polymorphonucléaires), principalement dans le derme, avec formation de microabscess dans l’épiderme. Un épaississement du derme œdémateux et un épiderme hyperplasique épaissi ont également été remarqués. (D-E) Groupe témoin. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Test représentatif de perméabilité vasculaire. L’œdème du tissu auriculaire observé est le résultat d’une perméabilité vasculaire accrue. Pour déterminer les changements dans la perméabilité vasculaire, les souris ont été sensibilisées par la TNCB (groupe test) ou simulées (groupe témoin) puis mises au défi 4 jours plus tard. À 23 h après le défi, le bleu Evans a été injecté et, 1 h après l’injection du bleu Evans, les animaux ont été euthanasiés et des poinçons de l’oreille de 6 mm de diamètre ont été effectués. Résultats présentés comme moyenne ± SEM, **p < 0,01, n = 5 souris/groupe. Abréviations : CHS = réaction d’hypersensibilité de contact; SEM = erreur-type de la moyenne; TNCB = 2,4,6-trinitrochlorobenzène. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 9 : Mesure représentative des anticorps anti-TNP IgG1. La concentration d’anticorps anti-TNP IgG1 dans le sérum a été mesurée 24 heures après le défi avec la TNCB haptène chez des souris simulées sensibilisées (témoins) et chez des souris sensibilisées à la TNCB (groupe test). Les sérums collectés ont été testés pour la concentration d’anticorps par ELISA. Résultats présentés comme moyenne ± SEM, ***p < 0,001, n = 10 souris/groupe. Abréviations : CHS = réaction d’hypersensibilité de contact; IgG1 = immunoglobuline G sous-classe 1; SEM = erreur-type de la moyenne; TNCB = 2,4,6-trinitrochlorobenzène. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 10 : Transfert adoptif représentatif des cellules effectrices du SHC. Les cellules effectrices du SHC ont été obtenues auprès de donneurs sensibilisés à la TNCB. Ensuite, les cellules immunitaires collectées ont été injectées, par voie intraveineuse, à des receveurs syngéniques naïfs, qui ont été mis au défi de provoquer la phase effectrice du SHC. Le groupe témoin de souris n’a reçu aucune cellule avant le défi. L’épaisseur de l’oreillette a été mesurée avant et après le défi. Résultats présentés comme moyenne ± SEM, ***p < 0,001, n = 7 souris/groupe. Abréviations : CHS = réaction d’hypersensibilité de contact; SEM = erreur-type de la moyenne; TNCB = 2,4,6-trinitrochlorobenzène. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Souche de souris | Solution de sensibilisation (dose) sur l’abdomen rasé |
Solution d’élicitation (dose) des deux côtés de l’oreille/s |
Journée de sensibilisation / élicitation | Refs | |||||||||||
| BALB/c (H-2d); C57BL/6 (H-2b) TCRδ-/-, β2m-/-, CD1d-/- (B10 PL (fond H-2u ) |
25 μL de 0,5 % de DNFB dans un mélange acétone-huile d’olive (rapport 4:1) | 5 μL de 0,1 % de DNFB dans un mélange acétone-huile d’olive (rapport 4:1) | 0 / 5 | 22 | |||||||||||
| C57BL/6 (H-2b) | 50 μL de 0,5 % de DNFB dans un mélange acétone-huile d’olive (rapport 4:1) | 25 μL de 0,2 % de DNFB dans un mélange acétone-huile d’olive (rapport 4:1) | 0 / 5 | 32 | |||||||||||
| C57BL/6 (H2b); IL-17A-/- (C57BL/6 arrière-plan) | 150 μL de TNCB à 5 % dans un mélange acétone-éthanol (rapport 1:3) | 10 μL de 0,4 % de TNCB dans un mélange huile d’olive-acétone (rapport 1:1) | 0 / 4 | 33 | |||||||||||
| CBA/J (H-2k); C57BL/6 (H-2b) TLR2-/-, MyD88-/-, IL-17A-/- (C57BL/6 arrière-plan) |
150 μL de 5 % de TNP-Cl (TNCB) dans un mélange acétone-éthanol (rapport 1:3) | 10 μl de 0,4 % de TNP-Cl (TNCB) dans un mélange huile d’olive-acétone (rapport 1:1) | 0 / 4 | 21 | |||||||||||
| C57BL/6 (H-2b); BALB/c (H-2d) | 25 μL de 1 % de TNCB dans une acétone | 10 μL de 0,1 ou 0,2 % de TNCB dans une acétone (et plus jusqu’à 1 %) | 0 / 7 | 34 | |||||||||||
| C57BL/6 (H-2b); TLR2-/-/ TLR4-/- (souris à double knockout sur fond C57BL/6) |
100 μL de 3 % de TNCB dans une acétone | 20 μL de 1 % de TNCB dans une acétone (juste à l’arrière des oreilles) | 0 / 5 | 31 | |||||||||||
| C57BL/6 (H-2b) Souris déficientes en CMH de classe II (fond C57BL/6) |
100 μL de 3 % de TNCB dans un mélange acétone-huile d’olive (rapport 4:1) | 20 μL de 0,5 ou 1 % de TNCB dans un mélange acétone-huile d’olive (rapport 4:1) | 0 / 6 | 35 | |||||||||||
| C57BL/6 (H-2b) | 100 μL de 7 % de TNCB dans une acétone | 20 μL 1 % TNCB dans une acétone | 0 / 5 | 36 | |||||||||||
| C57BL/6 (H-2b) | 100 μL 3 % OX dans l’éthanol | 20 μL 1 % OX dans un éthanol | 0 / 5 | ||||||||||||
| C57BL/6 (H-2b); CD4-/-, CD8-/- (C57BL/6 arrière-plan) | 25 μL de 0,5 % de DNFB dans l’huile d’acétone-olive (rapport 4:1) | 10 μL de 0,2 % de DNFB dans l’huile d’olive acétone (rapport 4:1) | 0 / 5 | 10 | |||||||||||
| C57BL/6 (H-2b); CD4-/-, CD8-/- (C57BL/6 arrière-plan) | 150 μL de 3 % d’OX dans l’alcool-acétone (rapport 3:1) | 10 μL 1% OX dans l’alcool-acétone (rapport 3:1) | 0 / 5 | ||||||||||||
| C57BL/6 (H-2b); C3H/HeN (H-2k); TLR4-/- (contexte C3H/HeJ); MyD88-/- (arrière-plan C57BL/6) | 100 mg/oreille de 10 % deNiCl2 dans de la vaseline blanche sur la face dorsale des deux oreilles | 10 % de NiCl2 dans la vaseline blanche | 0,1,2 / 23, 24 | 37 | |||||||||||
| NOD (H-2g7) MyD88-/- (fond NOD) | 400 μL de FITC à 0,5 % dans l’acétone et le phtalate de dibutyle | 10 μL de 0,1 % de FITC dans l’acétone et le phtalate de dibutyle | 0 / 5 | 25 | |||||||||||
Tableau 1 : Comparaison du modèle de la SCO dans diverses études. Abréviations : DNFB = 1-fluoro-2,4-dinitrobenzène ; FITC = isothiocyanate de fluorescéine; NiCl2 = chlorure de nickel (II); TNCB = 2,4,6-trinitrochlorobenzène; TNP-Cl = chlorure de trinitrophényle; OX = oxazolone. Veuillez cliquer ici pour télécharger ce tableau.
| Groupe témoin (négatif) | Groupe d’essai (réaction CHS) | ||||||
| Souris # oreille: L, R | 0 h d’épaisseur d’oreille [μm] | 24 h d’épaisseur de l’oreille [μm] | 24 h – 0 h d’épaisseur de l’oreille [μm] | Souris # oreille: L, R | 0 h d’épaisseur d’oreille [μm] | 24 h d’épaisseur de l’oreille [μm] | 24 h – 0 h d’épaisseur de l’oreille [μm] |
| 1 L | 365 | 380 | 15 | 1 L | 345 | 427.5 | 82.5 |
| 1 R | 335 | 380 | 45 | 1 R | 340 | 455 | 115 |
| 2 L | 345 | 355 | 10 | 2 L | 355 | 475 | 120 |
| 2 R | 327.5 | 352.5 | 25 | 2 R | 342.5 | 457.5 | 115 |
| 3 L | 340 | 370 | 30 | 3 L | 340 | 460 | 120 |
| 3 R | 325 | 355 | 30 | 3 R | 345 | 495 | 150 |
| 4 L | 335 | 380 | 45 | 4 L | 357.5 | 432.5 | 75 |
| 4 R | 340 | 350 | 10 | 4 R | 335 | 402.5 | 67.5 |
| 5 L | 350 | 380 | 30 | 5 L | 335 | 387.5 | 52.5 |
| 5 R | 337.5 | 360 | 22.5 | 5 R | 335 | 425 | 90 |
| 6 L | 335 | 365 | 30 | 6 L | 350 | 430 | 80 |
| 6 R | 340 | 375 | 35 | 6 R | 342.5 | 405 | 62.5 |
| 7 L | 345 | 337.5 | 0 | 7 L | 340 | 502.5 | 162.5 |
| 7 R | 345 | 335 | 0 | 7 R | 327.5 | 447.5 | 120 |
| 8 L | 370 | 380 | 10 | 8 L | 327.5 | 515 | 187.5 |
| 8 R | 375 | 355 | 0 | 8 R | 327.5 | 540 | 212.5 |
| 9 L | 385 | 370 | 0 | 9 L | 330 | 415 | 85 |
| 9 R | 342.5 | 362.5 | 20 | 9 R | 327.5 | 390 | 62.5 |
| 10 L | 307.5 | 340 | 32.5 | 10 L | 337.5 | 445 | 107.5 |
| 10 R | 325 | 350 | 25 | 10 R | 352.5 | 455 | 102.5 |
| Méchant | 20.75 | Méchant | 108.5 | ||||
| ± SEM | 3.245 | ± SEM | 9.565 | ||||
Tableau 2 : Exemple représentatif de calcul de la différence d’épaisseur de l’oreille dans la phase effectrice du SHC. Calcul de la différence d’épaisseur de l’oreille avant et après le défi avec l’haptène: 24 h d’épaisseur d’oreille (μm) - 0 h d’épaisseur d’oreille (μm). Chaque oreille compte comme une mesure distincte. Gonflement de l’oreille exprimé en micromètres (μm) ± SEM, n = 20. Abréviations : L = gauche ; R = droite. Veuillez cliquer ici pour télécharger ce tableau.
| Dilution iSTD avec AD | anti-TNP IgG1 Ab (U/mL) |
| 100x | 250 |
| 200x | 125 |
| 400x | 62.5 |
| 800x | 31.25 |
| 1600x | 15.63 |
| 3200x | 7.8 |
| uniquement AD | 0 |
Tableau 3 : Préparation des différentes concentrations d’iSTD pour la courbe standard pour la mesure anti-TNP IgG1 Ab. La dilution iSTD de 100x a été supposée être de 250 U d’IgG1 anti-TNP Ab. Abréviations: Ab = anticorps; AD = diluant d’essai; iSTD = norme interne; IgG1 = immunoglobuline G sous-classe 1; TNP = 2,4,6-trinitrophényle; U = unités. Veuillez cliquer ici pour télécharger ce tableau.
Figure supplémentaire 1 : Phénotype des cellules effectrices du SHC. Les cellules effectrices du CHS ont été obtenues à partir des ALN et des SPL des donneurs, qui étaient auparavant sensibilisés à la TNCB. (A) En utilisant la technique MACS, les cellules effectrices CHS (ALN et SPL entiers) ont été épuisées en cellules CD4+ ou CD8+. Par la suite, le transfert de cellules adoptives a été effectué avant l’élicitation de la phase effectrice du SHC. Le gonflement de l’oreille a été exprimé en moyenne ± SEM. (B-E) En utilisant une technique de cytométrie en flux, les cellules CHS-effectrices et naïves (obtenues à partir de souris naïves) ont été colorées pour IFN-γ, Tbet, IL-17A et RORγt avant l’analyse. Les cellules ont été fermées pour la population TCRβ+CD4+. Résultats présentés comme moyennes ± SEM, ***p < 0,001, **p < 0,01, * p < 0,05, n = 4-6 souris/groupe. Abréviations : ALN = ganglions lymphatiques axillaires et inguinaux; CD4 = groupe de différenciation 4; CHS = réaction d’hypersensibilité de contact; IFN-γ = interféron gamma; IL = interleukine; MACS = tri des cellules activées magnétiquement; ns = non significatif; RORγt = récepteur nucléaire orphelin lié au récepteur de l’acide rétinoïque gamma; SEM = erreur-type de la moyenne; SPL = rate; Tbet = facteur de transcription T-box TBX21; TCRβ = récepteur des lymphocytes T bêta; TNCB = 2,4,6-trinitrochlorobenzène. Veuillez cliquer ici pour télécharger ce fichier.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Le SHC est induit par des haptènes, qui se lient aux antigènes auto-protéiques de la peau, créant des néoantigènes. Le SHC est médié par le recrutement extravasculaire local de lymphocytes T effecteurs CHS spécifiques de l’antigène circulant, ce qui entraîne un gonflement du tissu déficient, culminant 24 heures après l’exposition de la peau secondaire au même haptène6. Le gonflement du tissu est principalement causé par l’infiltration de leucocytes et le dépôt de fibrine dépendant des leucocytes24. Ces changements peuvent être détectés avec un micromètre mesurant le gonflement de l’oreille des souris sensibilisées et défiées aux haptènes par rapport aux souris simulées sensibilisées et défiées.
Le SHC peut également être déterminé par la comparaison du poids de l’oreille. Ensuite, les poinçons d’oreille utilisés pour la détermination du poids de l’oreille peuvent être utilisés pour d’autres tests. Les infiltrats cellulaires dans les oreilles enflammées sont constitués de lymphocytes T producteurs de cytokines et de neutrophiles MPO positifs. Dans les homogénats du tissu auriculaire, divers paramètres peuvent être mesurés, tels que l’activité MPO ou la concentration de cytokines pro-inflammatoires (par exemple, TNF-α, IFN-γ, IL-17A ou autres) à l’aide du test ELISA ou l’expression de l’ARNm cytokine dans la peau à l’aide du test qPCR25. De plus, les changements de perméabilité des vaisseaux peuvent être évalués à l’aide du test bleu Evans21,26.
Dans le tissu auriculaire enflammé, les changements observés peuvent également être complétés par des tests in vitro, mettant en évidence la prolifération des lymphocytes T et la production de cytokines. Cela peut être facilement accompli en cultivant des ALN en présence d’antigènes protéiques conjugués haptènes22,27. L’évaluation de la sécrétion de cytokines par des ALN isolés de souris sensibilisées mais non contestées fournit des détails concernant la production de cytokines par les cellules effectrices chS au lieu de leur induction.
Limitations
De nombreux micromètres mesurent le gonflement de l’oreille avec une précision différente. Par exemple, la pression la plus basse est exercée par un étrier à ressort, il semble donc que les résultats refléteront le mieux la mesure réelle de l’épaisseur de l’oreille. Cependant, les micromètres qui exercent plus de pression, comme Mitutoyo, sont susceptibles de comprimer plus étroitement le liquide qui s’accumule dans les oreilles dans la phase précoce de la formation de l’œdème. La nature biphasique du SHC peut être visualisée plus clairement à l’aide de tels micromètres, car plus de pression est exercée. Ceci est plus difficile lors de l’utilisation d’un étrier à ressort avec une légère pression28. Néanmoins, dans certaines études, l’épaisseur des oreilles a été mesurée avec unétrier 29. En outre, l’expérience de l’observateur assure des mesures précises, qui peuvent être influencées par des sentiments subjectifs, même si l’observateur n’est pas conscient des groupes expérimentaux.
Des méthodes alternatives ont été décrites ici qui peuvent aider à confirmer les mesures de gonflement de l’oreille avec un micromètre, rendant les données présentées plus fiables et moins subjectives. Cependant, ces stratégies alternatives pour évaluer la SHC ne peuvent être utilisées qu’à un moment donné. Les mesures micrométriques peuvent être répétées à différents moments, ce qui permet d’étudier la cinétique du SHC.
Modifications
Le protocole d’étude de la réaction chS que nous utilisons dans notre laboratoire diffère considérablement de ceux utilisés dans d’autres laboratoires, y compris la dose d’haptène et la composition du solvant utilisés pour l’élicitation et la sensibilisation, ainsi que le moment où la réaction est évaluée. L’épaisseur de l’oreille peut être mesurée à différents moments (par exemple, 2 h, 24 h, 48 h et 72 h après le défi)10,30. Le tableau 1 montre différents modèles expérimentaux, en particulier les différences dans la souche animale, l’haptène et les temps de sensibilisation/ provocation utilisés dans diverses études 10,21,22,26,31,32,33,34,35,36,37 . Le protocole CHS peut également être effectué sans rasage préalable de l’abdomen des souris.
La différence suivante concerne l’exécution de l’élicitation (défi) elle-même. Comme d’habitude, la sensibilisation se fait en peignant la peau de l’abdomen de souris rasées avec l’haptène ou le véhicule seul. Par la suite, dans les deux groupes, une oreille est confrontée à des haptènes dilués de chaque côté de l’oreille. En tant que contrôle, l’oreille opposée est peinte avec une quantité identique de véhicule seul10,31.
Étapes critiques
Le moment le plus critique est de déclencher le CHS, car les résultats des tests en dépendent. (1) La solution haptène est très volatile et sensible à la lumière, elle doit donc être hermétiquement fermée et protégée de la lumière et, lorsqu’elle est utilisée, elle doit être rapidement appliquée sur la peau des animaux afin de ne pas s’évaporer. (2) Après avoir appliqué l’haptène sur la peau de l’abdomen, il doit être séché avant que l’animal ne retourne dans la cage, car les souris peuvent l’étaler contre la litière ou l’appliquer sur les oreilles avec leurs pattes (alors la mesure de l’épaisseur de l’oreillette peut être inadéquate). (3) Diverses méthodes d’étiquetage des animaux, telles que le marquage des queues de souris avec un marqueur résistant aux solvants, sont également connues. Cependant, les colorants présents dans le marqueur peuvent (non étudiés) devenir un haptène et déclencher le SHC. Par conséquent, dans cette étude, une méthode de marquage a été choisie qui n’affecte pas la réaction. (4) Choisir une méthode de rasage est très important car elle peut irriter la peau. Dans ce protocole, un savon gris a été utilisé car il a des propriétés apaisantes; il accélère le traitement des coupures mineures et des plaies purulentes, ce qui est aidé par ses effets antibactériens. Il apaise l’enflure et l’inflammation de la peau.
D’autres recherches et normalisation des procédures expérimentales, y compris l’utilisation d’animaux (souche et sexe), sont nécessaires pour comparer les résultats de différentes études.
De nombreux facteurs environnementaux différents et de nouvelles substances ayant des fonctions biologiques peuvent être testés dans le modèle CHS. Ce modèle peut être utile si les chercheurs veulent montrer si les facteurs testés modulent les réponses immunitaires dépendantes des lymphocytes T.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Les auteurs n’ont rien à divulguer.
Acknowledgments
Cette étude a été soutenue par la subvention SUBZ. A020.22.060 de l’Université de médecine de Wroclaw, en Pologne, et par des subventions du ministère des Sciences et de l’Enseignement supérieur N N401 545940 à MS et IP2012 0443 72 à MMS.
Materials
| Name | Company | Catalog Number | Comments |
| 70% ethanol | Merck KGaA, Darmstadt, Germany | 65350-M | for surface disinfection |
| 96-well flat-bottom plates, polypropylene | Greiner Bio-One GmbH, Kremsmunster, Austria | 655101 | for MPO and Evans blue measurement - plates should be made of polypropylene, that has a lower binding capacity so proteins or DNA will not bind |
| Acetone (ACS reagent, ≥99.5%) | Merck KGaA, Darmstadt, Germany | 179124 | |
| Aluminum foil | Merck KGaA, Darmstadt, Germany | Z185140 | |
| Analytical balance | Sartorius Weighing Technology GmbH, Goettingen, Germany | PRACTUM224-1s, 29105177 | |
| Automated tissue processor | MediMeas Instruments, Sarsehri, Haryana, India | MTP-E-212 | automatically prepare tissue samples by fixing, dehydrating, clearing, and infiltrating them with paraffin |
| BD Vacutainer SST II Advance (tube with gel for obtaining serum) | Becton Dickinson (BD), Franklin Lakes, NJ, USA | BD 366882 | |
| Bicinchoninic acid kit for protein determination | Merck KGaA, Darmstadt, Germany | BCA1-1KT | |
| Biotin Rat Anti-Mouse IgG1 | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 553441 | |
| BSA (bovine serum albumine) | Merck KGaA, Darmstadt, Germany | A9418 | protein assays & analysis, 2 mg/mL |
| Cell strainer, pore size 70 μm | BIOLOGIX, China | 15-1070 | suitable for 50 mL tubes |
| Coverslip | VWR, Radnor, Pennsylvania, United States | 631-1583 | 24 mm, but it possible to use different size |
| Disposable pipettes capacity: 5 mL, 10 mL, 25 mL | Merck KGaA, Darmstadt, Germany | Z740301, Z740302, Z740303 | |
| DPBS (Dulbecco′s phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 14190144 | no calcium, no magnesium, mammalian cell culture |
| DPX Mountant for histology | Merck KGaA, Darmstadt, Germany | 6522 | mounting media for H-E, might be used some other e.g, Canada balsam |
| Dumont 5 tweezers - straight | Animalab, Poznan, Poland | 11251-10FST | surgical instruments for procedures on mice (should be steriled) |
| Dumont 7 tweezers - bent | Animalab, Poznan, Poland | 11272-50FST | surgical instruments for procedures on mice (should be steriled) |
| Eosin Y solution, alcoholic | Merck KGaA, Darmstadt, Germany | HT110116 | |
| Eppendorf Safe-Lock Tubes 1.5 mL | Eppenforf, Germany | 3,01,20,086 | polypropylene |
| Eppendorf Safe-Lock Tubes, 2.0 mL | Eppenforf, Germany | 3,01,20,094 | polypropylene, round bottom (the homogenization beads can easily move) |
| Ethanol 100% (absolute alkohol) | Merck KGaA, Darmstadt, Germany | 1.07017 | |
| Ethanol 96% | Merck KGaA, Darmstadt, Germany | 1.59010 | |
| Evans blue | Merck KGaA, Darmstadt, Germany | E2129 | |
| FBS (fetal bovine serum) | ThermoFisher Scientific, Waltham, Massachusetts, USA | A3160802 | |
| Formalin solution, neutral buffered, 10% | Merck KGaA, Darmstadt, Germany | HT501128 | |
| Formamide 99.5% (GC) | Merck KGaA, Darmstadt, Germany | F7503 | |
| Freezer -20 °C | Bosch, Germany | GSN54AW30 | |
| Fridge +4 °C / freezer -20 °C | Bosch, Germany | KGV36V10 | mammalian Cell Culture, qualified, Brazil, 10 x 50 mL |
| Glass microskope slides, SuperFrost Plus | VWR, Radnor, Pennsylvania, United States | 631-0108, 631-0446, 631-0447, 631-0448, 631-0449 | Slides that eliminates the need to apply adhesive materials or protein coatings, to preventing any tissue sections loss during staining. |
| Graph Pad Prism | GraphPad Software Inc. | v. 9.4.0 | |
| Grey soap | Pollena Ostrzeszów, Producent Chemii Gospodarczej Sp. Z.o.o. , Sp. K., Poland | Bialy jelen soap bar | grey Soap Bar Natural Hypoallergenic. Generally available product |
| H2SO4 (sulfuric acid) 1 mol/l (1 M) | Merck KGaA, Darmstadt, Germany | 1.60313 | |
| Harris hematoxylin solution | Merck KGaA, Darmstadt, Germany | HHS16 | |
| Hemocytometer | VWR, Avantor, U.S.A | 612-5719 | manual counting chamber is recommend, which is more accurate |
| Hexadecyltrimethylammonium bromide | Merck KGaA, Darmstadt, Germany | H5882 | |
| Homogenizer | QIAGEN Hilden, Germany | Tissue Lyser LT, SN 23.1001/05234 | homogenizer with stainless steel beads (diameter 5 mm) for 2 mL centrifuge tubes |
| Horseradish peroxidase streptavidin (HRP streptavidin) | Vector Laboratories, Inc., Burlingame, CA, USA | SA-5004-1 | |
| Hydrogen peroxide solution (H202) | Merck KGaA, Darmstadt, Germany | H1009 | |
| Incubator Heracell 150i | Thermo Electron LED Gmbh, Germany | 41071068 | 37 oC in the atmosphere of 5 % CO2, and 65 0C for deparaffinization the sections for histology |
| Ketamine 100 mg/mL, solution for injection | Biowet Pulawy Sp. z o.o., Pulawy, Poland | cat.# not avaliable | |
| KH2PO4 (potassium dihydrogen phosphate) 99.995% anhydrous basis | Merck KGaA, Darmstadt, Germany | 1.05108 | |
| Laboratory Centrifuge | Heraeus Megafuge 1.0R, Thermo Scientific, Germany | B00013899 | speed to 300 x g, with cooling to 4 0C |
| Laboratory Centrifuge | Heraeus Fresco 21, Thermo Scientific, Germany | 75002425 | speed to 3,000 x g, with cooling to 4 0C |
| Mask (FFP2) | VWR, Radnor, Pennsylvania, United States | 111-0917 | for working with ortho-dianisine dihydrochloride |
| Mice | Breeding unit of the Chair of Biomedical Sciences, Faculty of Health Sciences, Jagiellonian University Medical College, Krakow, Poland | CBA/J, C57BL/6 | |
| Micrometer | Mitutoyo, Tokyo, Japan | 193-111 | digit Outside Micrometer, Ratchet Stop, 0-25mm Range, 0.001mm Graduation, +/-0.002mm Accuracy, https://shop.mitutoyo.pl/web/mitutoyo/pl_PL/all/all/Mikrometr%20analogowy%20/PR/193-111/index.xhtml |
| microplate, 96 well, microlon, high binding (for ELISA test) | Greiner Bio-One GmbH, Kremsmunster, Austria | 655061 | with maxi-sorp binding surfaces for reliable and reproducible results in colormetric assays |
| Microscope with objectives | Leica Microsystems CMS GmbH, Germany | DM1000, 294011-082007 | histology presented in the paper was performed under ThermoFisher Scientific EVOS M5000 Imaging System, with objectives: FL 20X LWDPH, 0.40NA/3.1WD and FL 40X LWDPH 0.65NA/1.79WD |
| Myeloperoxidase from human leukocytes (MPO standard) | Merck KGaA, Darmstadt, Germany | M6908 | |
| Na2HPO4 x 7 H2O (sodium phosphate dibasic heptahydrate) | Merck KGaA, Darmstadt, Germany | S9390 | |
| Olive-oil | Merck KGaA, Darmstadt, Germany | 75343 | pure, natural |
| OptEIA Mouse IFN-γ ELISA Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555138 | |
| Ortho-dianisine dihydrochloride | Merck KGaA, Darmstadt, Germany | D3252 | |
| Paraffin wax | Merck KGaA, Darmstadt, Germany | 76242 | beads, waxy solid |
| PBS (phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 20012027 | pH 7.2, mammalian cell culture |
| ph meter | Elmetron, Poland | CP-401 | |
| Pipettes, variable volume with tips | Merck KGaA, Darmstadt, Germany | EP3123000900-1EA | 3-pack, Option 1, 0.5-10 uL/10-100 uL/100-1000 uL, includes epT.I.P.S. |
| Razor blade | VWR, Radnor, Pennsylvania, United States | PERS94-0462 | scraper and cutter blades, single edge, aluminium spine, 100 blades per box, individually wrapped |
| Rotary microtome | MRC Laboratory-Instruments, Essex, CM20 2HU UK | HIS-202A | |
| Scissors - straight, sharp / sharp | Animalab, Poznan, Poland | 14060-10FST | Surgical instruments for procedures on mice (should be steriled) |
| Screw cap (open top) | Merck KGaA, Darmstadt, Germany | 27056 | black polypropylene hole cap, for use with 22 mL vial with 20-400 thread |
| Spectrophotometer | BioTek Instruments, U.S.A | 201446 | universal microplate spectrophotometer: λ range: 200 - 999 nm, absorbance measurement range: 0.000 - 4.000 Abs |
| Staining dish 20 slides with rack | Merck KGaA, Darmstadt, Germany | S6141 | e.g. 20 slide staining dishes complete with covers, slide rack and handle |
| Sterile Disposable Biopsy Punch 6mm | Integra LifeSciences, Princeton, NJ, USA | 33-36 | |
| Surgical scissors | Animalab, Poznan, Poland | 52138-46 | surgical instruments for procedures on mice (should be steriled) |
| Tissue processing cassettes | Merck KGaA, Darmstadt, Germany | Z672122 | tissue processing/ embedding cassettes with lid |
| TMB Substrate Reagent Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555214 | |
| TNCB (2,4,6-trinitrochlorobenzene) | Tokyo Chemical Industry CO., LTD, Japan | C0307 | |
| TNP-BSA (bovine serum albumin conjugated with 2,4,6-trinitrophenyl) | Biosearch Technologies LGC, Petaluma, CA, USA | T-5050 | |
| T-PER (tissue protein extration reagent) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 78510 | |
| Tubes 15 mL sterile | Merck KGaA, Darmstadt, Germany | CLS430055 (Corning) | polypropylene, conical bottom |
| Tubes 50 mL, sterile | Merck KGaA, Darmstadt, Germany | CLS430290 (Corning) | polypropylene, conical bottom |
| Tween 20 | Merck KGaA, Darmstadt, Germany | P1379 | |
| Vials, screw top, clear glass (vial only) 22 mL | Merck KGaA, Darmstadt, Germany | 27173 | for the preparation of hapten, screwed on so that it does not evaporate |
| Water bath | AJL Electronic, Poland | LW102 | |
| Wax (paraffin) dispenser | VWR, Radnor, Pennsylvania, United States | 114-8737 | |
| Xylazine (xylapan 20 mg/mL) solution for injection | Vetoquinol Biowet Sp. z o.o., Gorzow Wielkopolski, Poland | cat.# not avaliable | |
| Xylene (histological grade) | Merck KGaA, Darmstadt, Germany | 534056 |
References
- Nosbaum, A., Vocanson, M., Rozieres, A., Hennino, A., Nicolas, J. F. Allergic and irritant contact dermatitis. European Journal of Dermatology. 19 (4), 325-332 (2009).
- Hertl, M., et al. Predominance of epidermal CD8+ T lymphocytes in bullous cutaneous reactions caused by beta-lactam antibiotics. The Journal of Investigative Dermatology. 101 (6), 794-799 (1993).
- Martin, S. F. T lymphocyte-mediated immune responses to chemical haptens and metal ions: implications for allergic and autoimmune disease. International Archives of Allergy and Immunology. 134 (3), 186-198 (2004).
- Takeyoshi, M., Iida, K., Suzuki, K., Yamazaki, S. Skin sensitization potency of isoeugenol and its dimers evaluated by a non-radioisotopic modification of the local lymph node assay and guinea pig maximization test. Journal of Applied Toxicology. 28 (4), 530-534 (2008).
- Nakamura, K., Aizawa, M. Studies on the genetic control of picryl chloride contact hypersensitivity reaction in inbred rats. Transplantation Proceedings. 13 (2), 1400-1403 (1981).
- Asherson, G. L., Ptak, W. Contact and delayed hypersensitivity in the mouse. I. Active sensitization and passive transfer. Immunology. 15 (3), 405-416 (1968).
- Honda, T., Egawa, G., Grabbe, S., Kabashima, K. Update of immune events in the murine contact hypersensitivity model: toward the understanding of allergic contact dermatitis. The Journal of Investigative Dermatology. 133 (2), 303-315 (2013).
- Kaplan, D. H., Jenison, M. C., Saeland, S., Shlomchik, W. D., Shlomchik, M. J. Epidermal langerhans cell-deficient mice develop enhanced contact hypersensitivity. Immunity. 23 (6), 611-620 (2005).
- Wang, L., et al. Langerin expressing cells promote skin immune responses under defined conditions. Journal of Immunology. 180 (7), 4722-4727 (2008).
- Wang, B., et al. CD4+ Th1 and CD8+ type 1 cytotoxic T cells both play a crucial role in the full development of contact hypersensitivity. Journal of Immunology. 165 (12), 6783-6790 (2000).
- Mori, T., et al. Cutaneous hypersensitivities to hapten are controlled by IFN-gamma-upregulated keratinocyte Th1 chemokines and IFN-gamma-downregulated langerhans cell Th2 chemokines. The Journal of Investigative Dermatology. 128 (7), 1719-1727 (2008).
- Peszkowski, M. J., Warfvinge, G., Larsson, A. Allergic and irritant contact responses to DNFB in BN and LEW rat strains with different TH1/TH2 profiles. Acta Dermato-Venereologica. 74 (5), 371-374 (1994).
- Henningsen, S. J., Mickell, J., Zachariae, H. Plasma kinins in dinitrochlorobenzene contact dermatitis of guinea-pigs. Acta Allergologica. 25 (5), 327-331 (1970).
- Maibach, H. I., Maguire, H. C. Elicitation of delayed hypersensitivity (DNCB contact dermatitis) in markedly panleukopenic guinea pigs. The Journal of Investigative Dermatology. 41, 123-127 (1963).
- Martel, B. C., Lovato, P., Bäumer, W., Olivry, T. Translational animal models of atopic dermatitis for preclinical studies. The Yale Journal of Biology and Medicine. 90 (3), 389-402 (2017).
- Jin, H., He, R., Oyoshi, M., Geha, R. S. Animal models of atopic dermatitis. The Journal of Investigative Dermatology. 129 (1), 31-40 (2009).
- Li, Y. Z., Lu, X. Y., Jiang, W., Li, L. F. Anti-inflammatory effect of qingpeng ointment in atopic dermatitis-like murine model. Evidence-Based Complementary and Alternative. 2013, 907016 (2013).
- Hoggatt, J., Hoggatt, A. F., Tate, T. A., Fortman, J., Pelus, L. M. Bleeding the laboratory mouse: Not all methods are equal. Experimental Hematology. 44 (2), 132-137 (2016).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and th17 differentiation of naïve CD4 T lymphocytes. Journal of Visualized Experiments. (79), e50765 (2013).
- Vlab, A. Hemocytometer - Counting of Cells. Amrita University. , Available from: https://www.youtube.com/watch?v=MKS0KM3lr90 (2011).
- Majewska-Szczepanik, M., Strzepa, A., Marcińska, K., Wen, L., Szczepanik, M. Epicutaneous immunization with TNP-Ig and Zymosan induces TCRαβ+ CD4+ contrasuppressor cells that reverse skin-induced suppression via IL-17A. International Archives of Allergy and Immunology. 164 (2), 122-136 (2014).
- Majewska-Szczepanik, M., Zemelka-Wiącek, M., Ptak, W., Wen, L., Szczepanik, M. Epicutaneous immunization with DNP-BSA induces CD4+ CD25+ Treg cells that inhibit Tc1-mediated CS. Immunology and Cell Biology. 90 (8), 784-795 (2012).
- Directive 2010/63 / EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union. , Available from: https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2010:276:0033:0079:En:PDF (2010).
- Colvin, R. B., Dvorak, H. F. Role of the clotting system in cell-mediated hypersensitivity. II. Kinetics of fibrinogen/fibrin accumulation and vascular permeability changes in tuberculin and cutaneous basophil hypersensitivity reactions. Journal of Immunology. 114, 377-387 (1975).
- Szczepanik, M., et al. Regulation of contact sensitivity in non-obese diabetic (NOD) mice by innate immunity. Contact Dermatitis. 79 (4), 197-207 (2018).
- Askenase, P. W., Majewska-Szczepanik, M., Kerfoot, S., Szczepanik, M. Participation of iNKT cells in the early and late components of Tc1-mediated DNFB contact sensitivity: Cooperative role of γδ-T cells. Scandinavian Journal of Immunology. 73 (5), 465-477 (2011).
- Zemelka-Wiącek, M., Majewska-Szczepanik, M., Ptak, W., Szczepanik, M. Epicutaneous immunization with protein antigen induces antigen-non-specific suppression of CD8 T cell mediated contact sensitivity. Pharmacological Reports. 64 (6), 1485-1496 (2012).
- Van Loveren, H., et al. Use of micrometers and calipers to measure various components of delayed-type hypersensitivity ear swelling reactions in mice. Journal of Immunological Methods. 67 (2), 311-319 (1984).
- Tsuji, R. F., et al. B cell-dependent T cell responses: IgM antibodies are required to elicit contact sensitivity. The Journal of Experimental Medicine. 196 (10), 1277-1290 (2002).
- Campos, R. A., et al. Cutaneous immunization rapidly activates liver invariant Valpha14 NKT cells stimulating B-1 B cells to initiate T cell recruitment for elicitation of contact sensitivity. The Journal of Experimental Medicine. 198 (12), 1785-1796 (2003).
- Rühl-Muth, A. C., Maler, M. D., Esser, P. R., Martin, S. F. Feeding of a fat-enriched diet causes the loss of resistance to contact hypersensitivity. Contact Dermatitis. 85 (4), 398-406 (2021).
- Bour, H., et al. histocompatibility complex class I-restricted CD8+ T cells and class II-restricted CD4+ T cells, respectively, mediate and regulate contact sensitivity to dinitrofluorobenzene. European Journal of Immunology. 25 (11), 3006-3010 (1995).
- Majewska-Szczepanik, M., et al. Obesity aggravates contact hypersensitivity reaction in mice. Contact Dermatitis. 87 (1), 28-39 (2022).
- Katagiri, K., Arakawa, S., Kurahashi, R., Hatano, Y. Impaired contact hypersensitivity in diet-induced obese mice. Journal of Dermatological Science. 46 (2), 117-126 (2007).
- Bouloc, A., Cavani, A., Katz, S. I. Contact hypersensitivity in MHC class II-deficient mice depends on CD8 T lymphocytes primed by immunostimulating Langerhans cells. The Journal of Investigative Dermatology. 111 (1), 44-49 (1998).
- Martin, S., et al. Peptide immunization indicates that CD8+ T cells are the dominant effector cells in trinitrophenyl-specific contact hypersensitivity. The Journal of Investigative Dermatology. 115 (2), 260-266 (2000).
- Vennegaard, M. T., et al. Epicutaneous exposure to nickel induces nickel allergy in mice via a MyD88-dependent and interleukin-1-dependent pathway. Contact Dermatitis. 71 (4), 224-232 (2014).
Tags
Immunologie et infection numéro 187 modèle murin dermatite de contact allergique (DCA) hypersensibilité de contact (SHC) gonflement de l’oreille perméabilité vasculaire myéloperoxydase (MPO) cytokines 2,4,6-trinitrochlorobenzène (TNCB) haptèneErratum
Formal Correction: Erratum: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis
Posted by JoVE Editors on 01/19/2023.
Citeable Link.
An erratum was issued for: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis. The Protocol and Representative Results sections were updated.
Step 3.2.1 of the Protocol has been updated from:
On day "4", prepare 0.4% hapten: TNCB in an acetone-ethanol mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
to:
On day "4", prepare 0.4% hapten: TNCB in an acetone: olive oil mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
Figure 1 of the Representative Results has been updated from:
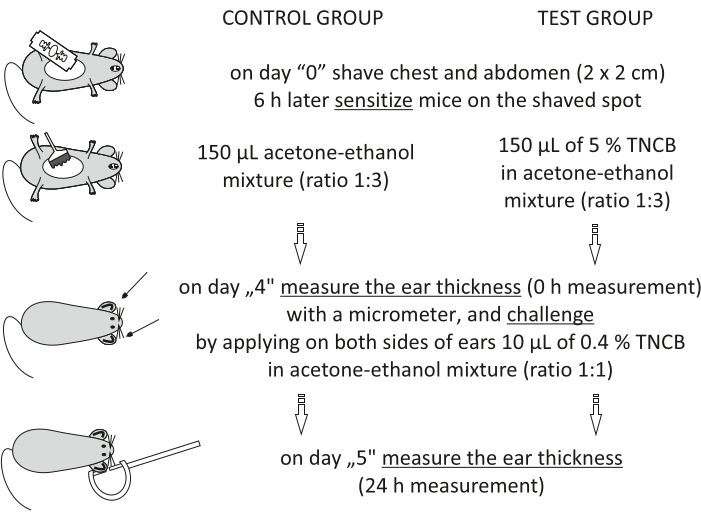
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
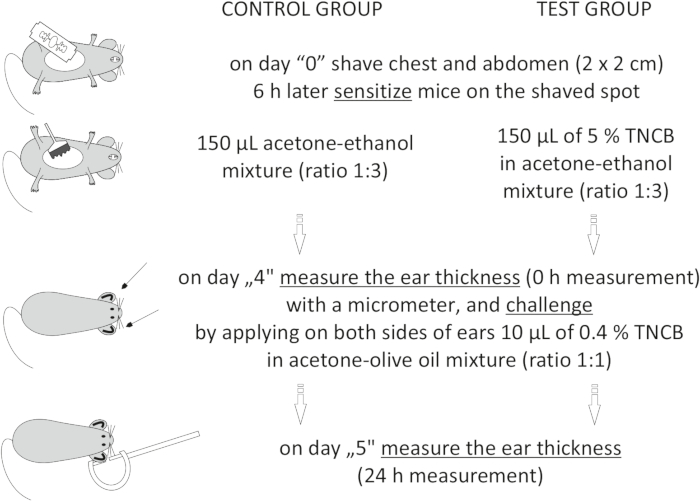
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
Figure 2 of the Representative Results has been updated from:
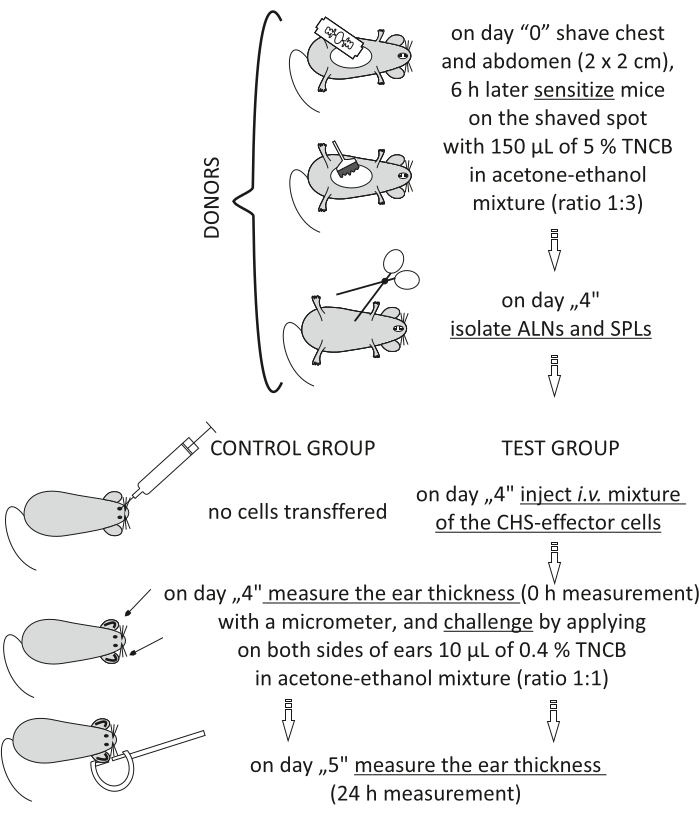
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
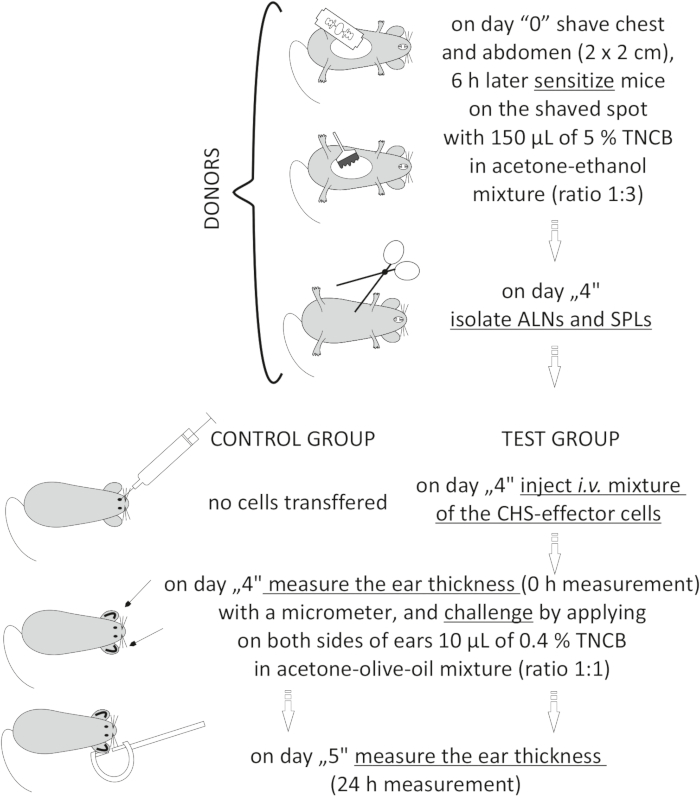
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.



