ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
L'ipersensibilità da contatto (CHS) è un modello sperimentale murino di dermatite allergica da contatto (ACD). ChS si basa sulla sensibilizzazione con hapten reattivo dipingendo la pelle rasata del torace e dell'addome, con una successiva sfida della pelle dell'orecchio con un hapten diluito, causando una reazione di gonfiore che viene valutata in vari modi.
Abstract
L'ipersensibilità da contatto (CHS) è un modello sperimentale di dermatite allergica da contatto (ACD) che può essere studiato nei topi. Questo studio mira a presentare un metodo di laboratorio oggettivo che può aiutare a studiare la reazione CHS nei topi, che può essere misurata e quantificata da vari test. Per indurre CHS, il giorno "0", i topi sono stati sensibilizzati su un punto precedentemente rasato dipingendo la pelle addominale con l'apteten 2,4,6-trinitroclorobenzene (TNCB) in una miscela acetone-etanolo, mentre i topi a controllo negativo sono stati sensibilizzati fintamente con la miscela veicolo da solo-acetone-etanolo. Il giorno "4", lo spessore dell'orecchio di base è stato misurato con un micrometro prima dell'elicitazione di CHS (sfida) dipingendo entrambe le orecchie con TNCB diluito sia nel gruppo di prova che in quello di controllo. Dopo 24 ore, il gonfiore dell'orecchio è stato misurato con un micrometro. CHS è un esempio di una risposta immunitaria mediata da cellule T che provoca gonfiore nel tessuto infiammato, con un picco di 24 ore dopo la sfida cutanea con lo stesso apteno. Un aumento dell'edema dell'orecchio correlato all'aumento del peso dell'orecchio, all'attività della mieloperossidasi (MPO), alla concentrazione di citochine pro-infiammatorie negli estratti dell'orecchio, all'aumento dell'ispessimento del derma edematoso nell'esame istologico e alla permeabilità vascolare dell'orecchio. C'è stato anche un aumento della concentrazione di anticorpi IgG1 specifici del TNP nei sieri del gruppo di test rispetto ai topi di controllo. Inoltre, chs può essere trasferito con successo con le cellule effettrici CHS ottenute da donatori precedentemente sensibilizzati con TNCB. Le cellule effettrici CHS sono state somministrate per via endovenosa in topi riceventi naïve, che sono stati successivamente sfidati con lo stesso apteno diluito. Il gonfiore dell'orecchio è stato misurato con un micrometro 24 ore dopo.
Introduction
La dermatite allergica da contatto (ACD) è una comune malattia infiammatoria della pelle nei paesi industrializzati causata da una reazione di ipersensibilità di tipo IV derivante dall'esposizione a sostanze chimiche a basso peso molecolare chiamate apteni. Le sostanze che causano sensibilizzazione al contatto nell'uomo includono ioni di metalli pesanti (cromo, nichel, ferro, cobalto), trementina, profumi, coloranti e conservanti presenti nei cosmetici (ad esempio, p-fenilendiammina), alcuni farmaci (ad esempio, neomicina, benzocaina), antibiotici β-lattamici (cioè penicillina), sostanze chimiche prodotte dalle piante (pentadecacatecolo, una sostanza presente nell'edera velenosa), nonché idrochinone-utilizzato nell'industria fotografica 1,2 . Gli agenti eziologici ACD sono molto alti in quanto oltre 100.000 sostanze chimiche sono utilizzate solo nell'industria e 2.000 nuove vengono sintetizzate ogni anno. Ad oggi, sono state identificate più di 3.700 molecole che possono essere apteni/allergeni da contatto3. La reazione di ipersensibilità al contatto (CHS) è un modello sperimentale di ACD che può essere studiato in topi, porcellini d'India e ratti e può essere indotto dall'applicazione topica cutanea di apteni chimici reattivi disciolti in solventi organici 4,5,6. Questo studio mira a descrivere un metodo di laboratorio oggettivo che può aiutare a studiare la reazione CHS nei topi, che può essere misurata e quantificata da vari test.
Il CHS è costituito da fasi di sensibilizzazione (induzione) ed effettore (sfida). Nei modelli animali, gli apteni si legano prima covalentemente alle proteine del corpo per creare neoantigeni. Durante la fase di sensibilizzazione, i cheratinociti attivati favoriscono la migrazione e la maturazione delle cellule dendritiche cutanee (sDC) producendo citochine pro-infiammatorie-fattore di necrosi tumorale α (TNF-α) e interleuchina 1β (IL-1β)7. Le cellule epidermiche di Langerhans (LCs) presentano antigeni durante l'induzione chs e le fasi effettrici8. Le LC esposte all'aptene durante la sensibilizzazione promuovono l'induzione delle cellule regolatorie ed effettrici9. Prove crescenti da diversi studi suggeriscono che le risposte CHS possono essere mediate da cellule Th1 cd4 + MHC di classe II limitate, rilasciando localmente interferone-γ (IFN-γ) per impiegare un caratteristico infiltrato infiammatorio, linfociti Tc1 CD8 + MHC di classe I che possono anche rilasciare IFN-γ ma soprattutto mediare danni citotossici ai cheratinociti, e ora anche le cellule Th17 che producono interleuchina 17 (IL-17)10, 11.
Sono stati sviluppati diversi modelli CHS che impiegano varie specie1 2,13,14 e apteni (un confronto dettagliato di diversi apteni, solventi e tempo di applicazione è riassunto nella Tabella 1). Il topo, una specie di laboratorio frequentemente utilizzata, offre alcuni vantaggi nello studio della CHS. Ci sono più ceppi, knockout (KO) e animali transgenici tra i topi rispetto ad altre specie, il che li rende un animale molto attraente15. Inoltre, il modello CHS richiede molti animali e i topi sono più economici qui. I modelli animali non imitano l'ACD in tutti gli aspetti; in particolare, mostrano croste e desquamazione, che non è comune perl'uomo 16,17. Le caratteristiche della malattia cronica sono difficili da riprodurre, principalmente perché il modello descritto non presuppone l'applicazione dell'apteno per un lungo periodo di tempo. Tuttavia, è stato confermato qui che molti degli aspetti significativi dell'ACD sono riprodotti. È stato anche dimostrato che, come negli esseri umani, queste caratteristiche sono associate a reazioni allergiche locali. La scelta dell'apteno, il suo solvente e la sua applicazione delineati in questo protocollo sono stati dettati dal fatto che i risultati sono stati confermati da numerosi test in vitro e che è stato testato e modificato in laboratorio per molti anni fino a quando non è stata stabilita la versione attuale. I modelli murini consentono l'analisi dei sottoinsiemi cellulari o delle citochine che sono coinvolti nello sviluppo dell'ACD e sono essenziali per le valutazioni precliniche di nuovi trattamenti.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Tutti gli esperimenti presentati in questo articolo sono stati condotti secondo le linee guida del 1 ° Comitato etico locale sulla sperimentazione animale a Cracovia. Tutte le procedure descritte sono state eseguite secondo le raccomandazioni locali, in particolare per quanto riguarda l'uso di ketamina / xilazina come anestetico, utilizzando entrambi i lati delle orecchie per applicare la sostanza / aptena, tagliando l'orecchio e raccogliendo sangue mediante rimozione del bulbo oculare. Per il presente studio sono stati utilizzati BALB/c (aplotipo H-2d), CBA/J (H-2k) e C57BL/6 (H-2b) di età maschile e femminile, di 6-12 settimane di età (vedere Tabella dei materiali). Per la significatività statistica, è meglio se ogni gruppo di topi è composto da 10-12 animali.
1. Preparazione animale
- Pulire il tavolo operatorio con una soluzione di etanolo al 70% prima e dopo tutte le procedure. Se si utilizzano topi che richiedono condizioni sterili, eseguire tutte le operazioni in un armadio di biosicurezza.
2. Marcatura dei topi per l'identificazione
- Etichetta i topi radendo la pelle con una lama di rasoio: #0 - non marcata, #2 - sulla zampa anteriore destra, #3 - sul lato destro, #4 - sulla zampa posteriore destra, #5 - alla base della coda, #6 - sulla zampa posteriore sinistra, #7 - sul lato sinistro, #8 - sulla zampa anteriore sinistra.
NOTA: A causa della reazione indotta, i topi non possono essere contrassegnati classicamente da punzonatura o etichettatura dell'orecchio. I topi non sono stati anestetizzati durante l'etichettatura.
3. Induzione di CHS
NOTA: questa procedura è illustrata nella Figura 1.
- Eseguire la sensibilizzazione (induzione) seguendo i passaggi seguenti.
- Il giorno "0", radere i topi sul petto e sull'addome (quadrato 2 cm x 2 cm) applicando sapone grigio con acqua e radendosi con una lama di rasoio.
NOTA: Prima di applicare hapten, attendere 6 ore in modo che la pelle non sia irritata. - Preparare il 5% di hapten: 2,4,6-trinitroclorobenzene (TNCB, vedi Tabella dei materiali) in una miscela acetone-etanolo (rapporto 1:3) o da solo (acetone-etanolo). Preparare le soluzioni appena prima dell'uso in un flaconcino di vetro e proteggerlo dalla luce coprendo il flaconcino con un foglio di alluminio.
- Lo stesso giorno, sensibilizzare i topi applicando 150 μL di hapten al 5% sul punto precedentemente rasato. Nel gruppo di topi di controllo, applicare il veicolo da solo per valutare la reazione infiammatoria non specifica. Prima di rimettere l'animale nella gabbia, attendere 30 s, lasciando asciugare l'hapten.
ATTENZIONE: Utilizzare guanti; TNCB provoca una grave reazione allergica nella maggior parte delle persone.
- Il giorno "0", radere i topi sul petto e sull'addome (quadrato 2 cm x 2 cm) applicando sapone grigio con acqua e radendosi con una lama di rasoio.
- Eseguire la misurazione dell'elicitazione (sfida) e del gonfiore dell'orecchio.
- Il giorno "4", preparare lo 0,4% di hapten: TNCB in una miscela acetone-etanolo (rapporto 1:1). Preparare la soluzione appena prima dell'uso in un flaconcino di vetro e proteggerla dalla luce coprendo il flaconcino con un foglio di alluminio.
- Anestetizzare i topi con un'iniezione intraperitoneale (i.p.) di una miscela di ketamina (90-120 mg/kg) e xilazina (5-10 mg/kg) (vedere Tabella dei materiali) per l'anestesia profonda. Assicurarsi che il mouse sia completamente anestetizzato per almeno 5 minuti con un pizzico di punta.
- Misurare lo spessore dell'orecchio (misurazione di 0 ore, baseline) con un micrometro (vedi Tabella dei materiali) da un osservatore ignaro dei gruppi sperimentali.
- Applicare 10 μL di 0,4% di hapten su entrambi i lati delle orecchie in entrambi i gruppi (test e controllo). Prima di rimettere l'animale nella gabbia, attendere 30 s e lasciare asciugare l'hapten.
- Il giorno "5", 24 ore dopo l'applicazione, ripetere i passaggi 3.2.2-3.2.3 per la misurazione di 24 ore.
- Valutare la risposta CHS calcolando la differenza di spessore del padiglione auricolare prima e dopo la sfida con l'hapten: 24 h di spessore dell'orecchio (μm) - 0 h di spessore dell'orecchio (μm). Conta ogni orecchio come misura separata. Quindi, esprimere il gonfiore dell'orecchio in micrometri (μm) ± errore standard della media (SEM) (Tabella 2, Figura 3).
4. Biopsie dell'orecchio
- Subito dopo la misurazione di 24 ore dello spessore dell'orecchio (quando il topo è ancora in anestesia profonda), tagliare le orecchie il più vicino possibile al cranio con le forbici. Raccogliere le biopsie dal lato distale delle orecchie facendo un pugno di 6 mm di diametro usando un pugno bioptico (vedi Tabella dei materiali).
- Misurare il peso dell'orecchio (fase 4.2) ed eseguire inoltre uno dei seguenti test sulla stessa biopsia dell'orecchio: saggio della mieloperossidasi (MPO) (fase 4.3) o misurazione in vitro della concentrazione di citochine negli estratti dell'orecchio (ad esempio, IFN-γ, IL-17A, TNF-α [fase 4.4]).
NOTA: Tagliare le orecchie prima della raccolta del sangue. Dopo questa procedura, i topi devono essere eutanasizzati (ad esempio, per lussazione cervicale).
- Misurare il peso dell'orecchio (fase 4.2) ed eseguire inoltre uno dei seguenti test sulla stessa biopsia dell'orecchio: saggio della mieloperossidasi (MPO) (fase 4.3) o misurazione in vitro della concentrazione di citochine negli estratti dell'orecchio (ad esempio, IFN-γ, IL-17A, TNF-α [fase 4.4]).
- Misurare il peso di ciascuna biopsia dell'orecchio sulla bilancia analitica ed esprimerlo in milligrammi (mg) (Figura 4).
- Eseguire un test MPO seguendo i passaggi seguenti.
- Preparare il tampone di omogeneizzazione sciogliendo il bromuro di esadeciltrimetilammonio allo 0,5% in tampone fosforato da 50 mmol KH2PO4/Na2HPO4 e regolando il pH a 6,0 (utilizzare a temperatura ambiente, RT).
- Omogeneizzare le biopsie in tubi microcentrifuga da 2 mL con 500 μL di tampone preparato per 10 minuti utilizzando un omogeneizzatore con perline di acciaio inossidabile di diametro 5 mm (aggiungere due perline / fiala) (vedi Tabella dei materiali). Quindi, raffreddare il campione per 15 minuti a 4 °C e omogeneizzarlo per altri 10 minuti.
NOTA: i tubi microcentrifuga hanno un fondo rotondo in modo che le perline possano muoversi facilmente. - Congelare gli omogeneizzati a -20 °C per 30 min. Scongelamento e vortice (assicurarsi che i campioni siano scongelati). Ripetere questa procedura 3x.
- Centrifugare gli omogeneizzati a 3.000 x g per 30 min a 4 °C. Raccogli i supernatanti con una pipetta. Esprimere l'attività MPO in unità (U) per 1 mg di proteina.
NOTA: il protocollo può essere messo in pausa qui. I campioni sono stabili a -20 °C per 3 mesi. - Per misurare l'attività MPO, eseguire una reazione enzimatica mescolando 20 μL di surnatante e 200 μL di substrato MPO (0,167 mg/mL di orto-dianisina dicloridrato in 50 mmol di KH2PO4/Na2HPO4 tampone con 5 x 10−4% H202) e aggiungere in piastre a fondo piatto a 96 pozzetti. Incubare le piastre per 20 minuti a RT.
- Preparare la curva standard utilizzando 20 μL dello standard MPO a concentrazioni da 0,008 U fino a 0,5 U in 200 μL del substrato MPO. Preparare il campione in bianco con il solo substrato MPO.
ATTENZIONE: Utilizzare una maschera mentre si lavora con orto-dianisina dicloridrato.
NOTA: Le piastre devono essere fatte di polipropilene, che ha una capacità di legame inferiore in modo che le proteine o il DNA non si leghino. - Misurare la densità ottica (OD) ad una lunghezza d'onda di λ = 460 nm. La reazione enzimatica è stabile per 10 min. Leggere l'attività MPO nei campioni testati dalla curva standard.
- Per misurare la concentrazione proteica, utilizzare 20 μL del surnatante, eseguire un test con un kit di acido bicinconinico per la determinazione delle proteine (vedere Tabella dei materiali) e misurare l'OD a λ = 562 nm (Figura 5).
- Eseguire la misurazione in vitro delle citochine nell'estratto dell'orecchio.
- Omogeneizzare le biopsie dell'orecchio a RT in tubi microcentrifuga da 2 mL con 500 μL di reagente di estrazione delle proteine tissutali (T-PER) per 10 minuti utilizzando un omogeneizzatore con perle di acciaio inossidabile di diametro 5 mm (aggiungere due perline / fiala). Quindi, raffreddare il campione per 15 minuti a 4 °C e omogeneizzarlo per altri 10 minuti.
NOTA: i tubi microcentrifuga hanno un fondo rotondo in modo che le perline possano muoversi facilmente. - Centrifugare gli omogeneizzati a 3.000 x g per 30 min a 4 °C.
NOTA: il protocollo può essere messo in pausa qui. I campioni sono stabili a -80 °C per 6 mesi. - Valutare i livelli di citochine utilizzando un set ELISA disponibile in commercio (ad esempio, IFN-γ) (vedere Tabella dei materiali) seguendo le istruzioni del produttore (Figura 6).
- Omogeneizzare le biopsie dell'orecchio a RT in tubi microcentrifuga da 2 mL con 500 μL di reagente di estrazione delle proteine tissutali (T-PER) per 10 minuti utilizzando un omogeneizzatore con perle di acciaio inossidabile di diametro 5 mm (aggiungere due perline / fiala). Quindi, raffreddare il campione per 15 minuti a 4 °C e omogeneizzarlo per altri 10 minuti.
5. Istologia del tessuto auricolare
- Subito dopo la misurazione di 24 ore dello spessore dell'orecchio, quando il mouse è ancora profondamente anestetizzato, tagliare le orecchie il più vicino possibile al cranio con le forbici (passo 4.1).
NOTA: Dopo questa procedura, i topi devono essere sottoposti a eutanasia (ad esempio, per lussazione cervicale). - Eseguire l'incorporamento di paraffina dei blocchi di tessuto seguendo i passaggi seguenti.
- Subito dopo la rimozione, posizionare l'orecchio in ~ 10 ml di formalina al 10% per 24 ore.
- Posizionare le orecchie in una cassetta di lavorazione dei tessuti. Mettere le cassette in un processore automatizzato (vedi Tabella dei materiali) per i cicli di disidratazione (alcol 70%, 90%, 100%, 30 min ciascuno a RT), cicli di pulizia (xilene 3x, 30 min ciascuno a RT) e cicli di infiltrazione di cera (paraffina 3x, 30 min ciascuno a 56 °C).
- Rimuovere le cassette dal processore automatico e tenere premuta la piastra di riscaldamento fino a quando non è necessario. Riempire lo stampo di cera con cera calda (dal distributore).
- Rimuovere le sezioni dalla cassetta con pinza riscaldata e metterle nello stampo; quindi, posizionare la base della cassetta sulla parte superiore dello stampo e quindi riempire con altra cera. Metterlo in acqua refrigerata su una piastra fredda per 30 minuti in modo che la paraffina si solidifichi per formare un blocco contenente il campione.
- Utilizzare un microtomo rotante (vedere Tabella dei materiali) per tagliare sezioni di circa 5 μm di spessore. Far galleggiare le sezioni in un bagno caldo per appiattirle. Raccogli le sezioni su un vetrino per microscopio. Lasciarli asciugare a RT per assicurarsi che le sezioni aderiscano alla diapositiva.
NOTA: utilizzare vetrini che eliminano la necessità di applicare materiali adesivi o rivestimenti proteici per prevenire la perdita di sezioni di tessuto durante la colorazione.
- Eseguire la colorazione di ematossilina ed eosina (H & E).
- Preparare 17 piatti di colorazione con quanto segue: xilene (quattro piatti), etanolo al 100% (alcol assoluto) (quattro piatti), etanolo al 90%, etanolo all'80%, etanolo al 70%, etanolo al 50%, PBS (tre piatti), soluzione di ematossilina, soluzione di eosina. Trasferisci le diapositive da un piatto all'altro secondo i passaggi seguenti ed esegui tutto a RT.
NOTA: La procedura in ogni piatto può essere ripetuta circa 10 volte (ad esempio, se si utilizza un piatto da 20 diapositive, è possibile effettuare 200 macchie senza cambiare i liquidi). - Deparaffinizzare le sezioni per incubazione a 65 °C per 30 minuti nell'incubatrice. Immergere gli scivoli in xilene per 30 min. Ripetere 1x in xilene nuovo per 30 min.
- Immergere i vetrini in etanolo al 100% per 5 min. Ripetere 1x in nuovo etanolo al 100% per 5 min. Immergere le diapositive nella fila di etanolo, 90%, 80%, 70% e 50%, per 2 minuti in ogni diluizione.
- Immergere i vetrini in soluzione salina tamponata con fosfato (PBS) per 5 min. Pulire il liquido in eccesso da tutto il tessuto e dal lato posteriore dei vetrini.
- Macchiare le sezioni in soluzione di ematossilina (vedere Tabella dei materiali) per 7-8 min. Lavare in acqua corrente per 30 s dal retro in modo da non danneggiare le sezioni. Ripetere il passaggio 5.3.4.
- Macchiare le sezioni con soluzione di eosina (vedere Tabella dei materiali) per 30 s. Lavare come indicato al passaggio 5.3.5 e quindi ripetere il passaggio 5.3.4.
- Immergere i vetrini in etanolo al 100% (alcool assoluto) per 2 min. Ripetere 1x in nuovo etanolo al 100% per 2 min.
- Immergere gli scivoli in xilene per 5 min. Ripetere 1x nel nuovo xilene per 5 min.
- Lasciare asciugare all'aria le sezioni per 15 minuti a RT. Aggiungere una goccia di mezzo di montaggio (vedere Tabella dei materiali) su una copertina e quindi posizionarla nella parte superiore della sezione.
- Preparare 17 piatti di colorazione con quanto segue: xilene (quattro piatti), etanolo al 100% (alcol assoluto) (quattro piatti), etanolo al 90%, etanolo all'80%, etanolo al 70%, etanolo al 50%, PBS (tre piatti), soluzione di ematossilina, soluzione di eosina. Trasferisci le diapositive da un piatto all'altro secondo i passaggi seguenti ed esegui tutto a RT.
- Esaminare la sezione al microscopio ottico con un ingrandimento di 20x o 40x e acquisire immagini (Figura 7).
6. Test di permeabilità vascolare
NOTA: In alternativa alla misurazione dello spessore dell'orecchio, è possibile eseguire un test di permeabilità vascolare.
- Sensibilizzare i topi il giorno "0" (passi 3.1.1-3.1.3), quindi, il giorno "4", anestetizzare i topi (passo 3.2.2) e applicare direttamente hapten sulle orecchie (passo 3.2.4), omettendo la misurazione dell'orecchio 0 h.
- A 23 ore dopo la sfida, anestetizzare i topi (passo 3.2.2).
- Iniettare per via endovenosa (i.v.) 8,3 μL/g di peso corporeo dell'1% di colorante blu di Evans (vedere Tabella dei materiali) in Soluzione salina tamponata con fosfato di Dulbecco (DPBS).
- Anestetizzare nuovamente i topi in anestesia profonda (passo 3.2.2)-1 ora dopo l'iniezione blu di Evans.
- Raccogliere biopsie dell'orecchio (passo 4.1).
NOTA: Dopo questa procedura, i topi devono essere sottoposti a eutanasia (ad esempio, per lussazione cervicale). - Estrarre il colorante dal tessuto, posizionare i punzoni auricolari nei tubi contenenti 1 mL di formammide e incubare a 37 °C nell'atmosfera del 5% di CO2 per 18 ore.
- Centrifugare le biopsie a 3.000 x g per 3 minuti a RT. Raccogliere i supernatanti con una pipetta.
- Misurare l'OD a una lunghezza d'onda di λ = 565 nm in piastre a fondo piatto a 96 pozzetti contro un bianco contenente formammide. Il colore è stabile per 24 ore. Leggere la concentrazione dei campioni di prova dalla curva standard (utilizzare le concentrazioni di blu di Evans comprese tra 0,2-30 μg di colorante/mL di formammide) (Figura 8).
NOTA: Le piastre devono essere fatte di polipropilene, che ha una capacità di legame inferiore in modo che le proteine o il DNA non si leghino.
7. Raccolta del siero e misurazione degli anticorpi anti-TNP immunoglobuline (IgG1)
- Dopo aver raccolto le biopsie dell'orecchio (passaggio 4.1), quando il topo è ancora in anestesia profonda, rimuovere il bulbo oculare con una pinzetta, esercitare una leggera pressione sul topo e raccogliere il sangue dal seno retroorbitale nel tubo (fiala con gel per ottenere siero, vedere Tabella dei materiali). Un metodo alternativo per raccogliere il sangue potrebbe essere quello di perforare il cuore con una siringa e raccogliere il sangue.
NOTA: Il sangue deve essere raccolto dopo aver rimosso le orecchie. Lo stesso metodo di sanguinamento deve essere utilizzato in un intero studio a causa di potenziali differenze nei parametri ematici18. Dopo questa procedura, i topi devono essere eutanasizzati (ad esempio, per lussazione cervicale). - Invertire un minimo di 6x, attendere 30 minuti affinché il sangue si coaguli, quindi centrifugare a 1.300-2.000 x g per 10 minuti a RT.
NOTA: il protocollo può essere messo in pausa qui. Il campione è stabile a -20 °C per 6 mesi. - Rivestire una piastra a fondo piatto a 96 pozzetti con 50 μL di albumina sierica bovina coniugata con 2,4,6-trinitrofenile (TNP-BSA) disciolto in DPBS alla concertazione di 10 μg/mL. Successivamente, rivestire la seconda piastra con albumina sierica bovina (BSA) da sola disciolta in DPBS (sfondo) ad una concentrazione di 10 μg/ml. Incubare durante la notte a 4 °C.
NOTA: il siero di topo contiene anticorpi (Abs) contro BSA, quindi i campioni devono essere testati su entrambe le piastre e, successivamente, è necessario eseguire un calcolo (OD TNP-BSA - OD BSA). - Lavare le piastre con 300 μL di DPBS contenenti lo 0,05% di Tween 20. Ripeti 3x.
- Preparare il diluente di saggio (AD): DPBS contenente l'1% di BSA. Bloccare i pozzetti con AD per 1 ora a RT. Lavare di nuovo (passaggio 7.4).
- Preparare uno standard interno (iSTD): sensibilizzare i topi con TNCB (passaggi 3.1.1-3.1.3) e, 10 giorni dopo la sensibilizzazione, raccogliere ed esaminare il siero da tutti i donatori (passo 7.1 e passo 7.2).
- Aggiungere alla piastra 50 μL di concentrazioni graduate di iSTD diluite con AD per realizzare la curva standard (descritta nella Tabella 3). Aggiungere alla piastra 50 μL di campioni di siero. Testare ogni campione e curva standard su entrambe le piastre (rivestite TNP-BSA e BSA). Incubare per 2 ore a RT. Lavare le piastre (passaggio 7.4).
- Aggiungere 50 μL di anticorpo monoclonale biotinilato anti-topo IgG1 (mAb, vedere Tabella dei materiali) diluito 1:250 con AD e incubare per 1 ora a RT. Lavare di nuovo (passaggio 7.4).
- Aggiungere 50 μL di streptavidina perossidasi di rafano (HRD streptavidina, vedere Tabella dei materiali) diluita 1:2000 con AD e incubare per 30 minuti a RT al buio. Lavare la piastra (passaggio 7.4).
- Aggiungere 50 μL di substrato TMB (vedere Tabella dei materiali) e incubare per 30 minuti a RT al buio.
- Arrestare la reazione enzimatica aggiungendo 25 μL di 1 M H2SO4; la reazione è stabile per 30 min.
- Misurare l'OD a una lunghezza d'onda di λ = 450 nm e uno sfondo di 570 nm (lo sfondo deve essere sottratto da ogni misurazione di 450 nm). Quando si presentano i risultati, sottrarre le misurazioni BSA dal TNP-BSA per i campioni e la curva standard. Quindi, calcolare l'unità (U) di anticorpi secondo la curva standard (Figura 9).
8. Trasferimento adottivo delle cellule effettrici CHS
NOTA: questa procedura è illustrata nella Figura 2.
- Donatori (al rapporto di un donatore:1 ricevente): sensibilizzare i topi con TNCB il giorno "0" (passi 3.1.1-3.1.3).
- Il giorno "4", anestetizzare l'anestesia profonda dei topi (passo 3.2.2).
- Isolare con pinza i linfonodi ascellari e inguinali (ALN) e la milza (SPL). Raggruppare gli ALN in un flaconcino e gli SPL in un altro.
NOTA: C'è un linfonodo ascellare dietro il muscolo pettorale in ogni ascella. Un linfonodo inguinale nella regione dell'anca si trova accanto a tre vasi sanguigni. La milza si trova sul lato sinistro del corpo dietro l'intestino e lo stomaco19. Lavora con strumenti sterili in un armadio di biosicurezza per mantenere condizioni sterili. Dopo questa procedura, i topi devono essere eutanasizzati (ad esempio, per lussazione cervicale). - Schiacciare il tessuto tra le estremità smerigliate di due vetrini per microscopio. Passare la sospensione cellulare attraverso un filtro cellulare con una dimensione dei pori di 70 μm (vedere Tabella dei materiali).
- Lavare le cellule con DPBS integrato con siero bovino fetale all'1% (FBS). Centrifugare a 300 x g per 10 min a 4 °C. Decantare il surnatante e risospescere il pellet cellulare rimanente in 1-5,0 ml di DPBS.
- Contare le cellule vive usando un emocitometro20 con blu di trypan e mescolare 10 μL della sospensione cellulare con 90-990 μL (a seconda del numero di cellule) di blu di tripano. Prendere in considerazione la diluizione quando si calcola il numero di cella (10x-100x).
- Preparare una miscela di ALN e SPL (rapporto 1:1): 8,0 x 106 fino a 7,0 x 107/mouse in 200 μL di DPBS.
- Riceventi (topi singenici naïve): anestetizzare topi riceventi naïve (fase 3.2.2) e iniettare e.v. con una miscela preparata di cellule effettrici CHS (fase 8.7). Nel gruppo di controllo dei topi, non iniettare alcuna cellula.
- Misurare lo spessore dell'orecchio prima di (0 h) e dopo (24 h) la sfida (passaggi 3.2.1-3.2.6) (Figura 10).
- Inoltre, eseguire test su cellule effettrici CHS isolate (ad esempio, fenotipizzazione cellulare o misurazione di citochine prodotte dalle cellule effettrici CHS mediante citometria a flusso). Possono anche essere stabilite colture cellulari e la capacità delle cellule effettrici CHS di proliferare in presenza dell'antigene o la quantità di citochine secrete nei supernatanti di coltura può essere valutata21,22 (dati non presentati).
NOTA: l'esecuzione di test aggiuntivi richiede di conseguenza un numero maggiore di donatori di cellule.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Per l'induzione CHS, gli animali sono stati sensibilizzati tramite verniciatura della pelle (addominale) con 150 μL del 5% di TNCB o finta sensibilizzati con il solo veicolo. Il giorno "4", le risposte di gonfiore dell'orecchio di entrambe le orecchie sono state indotte dalla pittura a contatto (sfida) con 10 μL di TNCB allo 0,4% in entrambi i topi precedentemente sensibilizzati al contatto con TNCB (gruppo di test) e topi del gruppo di controllo (sham sensibilizzato). I dati presentati mostrano che i topi sensibilizzati con TNCB e sfidati 4 giorni dopo hanno sviluppato un aumento significativo del gonfiore dell'orecchio rispetto a quelli sensibilizzati allo sham sfidati in modo simile (Figura 3, Tabella 2, test vs. gruppo di controllo). I risultati del gonfiore dell'orecchio sono stati completamente convalidati in ulteriori studi, evidenziando che un aumento dell'edema dell'orecchio determinato con un micrometro concordato con l'aumento del peso dell'orecchio (Figura 4), l'attività MPO (Figura 5), la concentrazione di IFN-γ negli estratti dell'orecchio (Figura 6), l'aumento dell'ispessimento del derma edematoso nell'esame istologico (Figura 7) e la permeabilità vascolare dell'orecchio (Figura 8) ). Un aumento della concentrazione di anticorpi IgG1 specifici del TNP è stato riscontrato anche nei sieri dei topi in esame rispetto agli animali di controllo (Figura 9).
Come esempio di risposta immunitaria mediata da cellule T, la CHS può anche essere trasferita in topi riceventi singenici naïve. I donatori sono stati sensibilizzati dall'applicazione di TNCB e, successivamente, le cellule effettrici CHS sono state somministrate per via endovenosa nei topi riceventi naïve, che sono stati sfidati con l'hapten e testati per CHS 24 ore dopo (Figura 10). Gli animali che hanno ricevuto le cellule effettrici CHS da donatori precedentemente sensibilizzati con TNCB hanno mostrato un aumento significativo del gonfiore dell'orecchio rispetto agli animali che sono stati sfidati solo (non hanno ricevuto alcuna cellula).
La reazione CHS ha un meccanismo complesso e coinvolge varie cellule. La presentazione dell'antigene e l'attivazione delle cellule T/B si verificano negli organi linfatici periferici (ad esempio, ALN e SPL). È stato determinato che le cellule effettrici CHS impoverite di cellule CD4+ ma non CD8+ prima del trasferimento cellulare adottivo hanno provocato l'assenza della reazione CHS nei topi riceventi. Queste cellule sono risultate positive per IFN-γ (fattore di trascrizione T-box TBX21, Tbet+) e IL-17A (recettore nucleare orfano gamma correlato al recettore dell'acido retinoico, RORγT+) (Figura supplementare 1).
I risultati presentati dagli esperimenti rappresentativi sono stati eseguiti su topi maschi e femmine C57BL/6 e CBA/J a 8-12 settimane di età. Seguendo le regole 3R nell'uso degli animali23, in particolare la riduzione, ai fini di questo articolo, i risultati degli esperimenti sono mostrati su piccoli gruppi di animali. I dati nei grafici sono mostrati come ± SEM. La significatività statistica è stata fissata a p < 0,05. I grafici sono stati disegnati utilizzando il software Prism (vedi Tabella dei materiali).

Figura 1: Induzione di CHS. Sensibilizzazione, sfida e misurazione dell'orecchio. Abbreviazioni: CHS = reazione di ipersensibilità al contatto; TNCB = 2,4,6-trinitroclorobenzene. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Trasferimento adottivo delle cellule effettrici CHS. Abbreviazioni: ALNs = linfonodi ascellari e inguinali; CHS = reazione di ipersensibilità da contatto; i.v. = per via endovenosa; SPLs = milza; TNCB = 2,4,6-trinitroclorobenzene. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Valutazione rappresentativa del CHS al TNCB mediante la misurazione del gonfiore dell'orecchio con un micrometro. I topi erano sensibilizzati TNCB (gruppo di test) o sham (gruppo di controllo) e successivamente sfidati. Lo spessore del padiglione auricolare è stato misurato prima e dopo la sfida e le differenze nel gonfiore dell'orecchio sono state calcolate sottraendo lo spessore dell'orecchio di 0 ore (μm) dallo spessore dell'orecchio di 24 ore (μm). Il gonfiore dell'orecchio è stato espresso come ± SEM, ****p < 0,0001, n = 10 topi/gruppo (dati della Tabella 2). Abbreviazioni: CHS = reazione di ipersensibilità al contatto; SEM = errore standard della media; TNCB = 2,4,6-trinitroclorobenzene. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Valutazione rappresentativa del CHS mediante la misurazione del peso dell'orecchio. Il peso dell'orecchio è uno dei parametri che corrisponde al gonfiore dell'orecchio. I topi erano sensibilizzati TNCB (gruppo di test) o sham (gruppo di controllo) e successivamente sfidati. A 24 ore dalla sfida, sono stati prelevati pugni di 6 mm di diametro dalle orecchie rimosse. I punzoni sono stati pesati su una bilancia analitica di laboratorio. Il peso dell'orecchio è stato espresso in milligrammi (mg) come media ± SEM, ***p < 0,001, n = 10 topi/gruppo. Abbreviazioni: CHS = reazione di ipersensibilità al contatto; SEM = errore standard della media; TNCB = 2,4,6-trinitroclorobenzene. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Valutazione rappresentativa dell'attività MPO. L'aumento dell'attività MPO negli estratti tissutali è correlato all'infiammazione dell'orecchio. I topi sensibilizzati al TNCB (gruppo di test) e i topi sensibilizzati sham (gruppo di controllo) sono stati sfidati. A 24 ore dopo la sfida, le orecchie sono state rimosse e sono stati estratti ed elaborati punzoni dell'orecchio di 6 mm di diametro. L'attività MPO è espressa in U per contenuto proteico (U/g di proteina). Risultati visualizzati come media ± SEM, **p < 0,01, n = 5-6 topi/gruppo. Abbreviazioni: CHS = reazione di ipersensibilità al contatto; MPO = mieloperossidasi; SEM = errore standard della media; TNCB = 2,4,6-trinitroclorobenzene; U = unità. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Valutazione rappresentativa della produzione di citochine-IFN-γ concentrazione negli estratti dell'orecchio. I topi erano sensibilizzati TNCB (gruppo di test) o sham (gruppo di controllo) e successivamente sfidati. A 24 ore dopo la sfida, le orecchie sono state rimosse e sono stati presi pugni dell'orecchio di 6 mm di diametro. La concentrazione di IFN-γ è stata determinata negli omogeneizzati tissutali mediante ELISA. Risultati mostrati come ± sem medi, *p < 0,05, n = 5 topi/gruppo. Abbreviazioni: CHS = reazione di ipersensibilità al contatto; IFN-γ = interferone gamma; SEM = errore standard della media; TNCB = 2,4,6-trinitroclorobenzene. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7: Istologia rappresentativa del tessuto auricolare. Colorazione di ematossilina ed eosina. I topi erano sensibilizzati TNCB (gruppo di test) o sham (gruppo di controllo) e successivamente sfidati. (A-C) L'esame istologico nel gruppo di prova si è manifestato in una concentrazione significativamente aumentata di cellule infiammatorie (cellule mononucleate e polimorfonucleate), principalmente nel derma, con formazione di microabbasso nell'epidermide. Sono stati notati anche ispessimento del derma edematoso e un'epidermide iperplastica ispessita. (D-E) Gruppo di controllo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 8: Test rappresentativo di permeabilità vascolare. L'edema del tessuto auricolare osservato è il risultato di una maggiore permeabilità vascolare. Per determinare i cambiamenti nella permeabilità vascolare, i topi sono stati sensibilizzati TNCB (gruppo di test) o sham (gruppo di controllo) e poi sfidati 4 giorni dopo. A 23 ore dopo la sfida, è stato iniettato il blu evans e, 1 ora dopo l'iniezione blu di Evans, gli animali sono stati sottoposti a eutanasia e sono stati fatti pugni dell'orecchio di 6 mm di diametro. Risultati mostrati come ± SEM, **p < 0,01, n = 5 topi/gruppo. Abbreviazioni: CHS = reazione di ipersensibilità al contatto; SEM = errore standard della media; TNCB = 2,4,6-trinitroclorobenzene. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 9: Misurazione rappresentativa degli anticorpi anti-TNP IgG1. La concentrazione di anticorpi anti-TNP IgG1 nel siero è stata misurata 24 ore dopo la sfida con hapten TNCB in topi sensibilizzati fittizi (controllo) e in topi sensibilizzati al TNCB (gruppo di test). I sieri raccolti sono stati testati per la concentrazione di anticorpi da ELISA. Risultati mostrati come ± seM medi, ***p < 0,001, n = 10 topi/gruppo. Abbreviazioni: CHS = reazione di ipersensibilità al contatto; IgG1 = immunoglobulina G sottoclasse 1; SEM = errore standard della media; TNCB = 2,4,6-trinitroclorobenzene. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 10: Trasferimento adottivo rappresentativo delle cellule effettrici CHS. Le cellule effettrici CHS sono state ottenute da donatori sensibilizzati con TNCB. Successivamente, le cellule immunitarie raccolte sono state iniettate, cioè, in riceventi singenici ingenui, che sono stati sfidati per l'elicitazione della fase effettrice CHS. Il gruppo di controllo dei topi non ha ricevuto alcuna cellula prima della sfida. Lo spessore del padiglione auricolare è stato misurato prima e dopo la sfida. Risultati mostrati come ± sem medi, ***p < 0,001, n = 7 topi/gruppo. Abbreviazioni: CHS = reazione di ipersensibilità al contatto; SEM = errore standard della media; TNCB = 2,4,6-trinitroclorobenzene. Fare clic qui per visualizzare una versione più grande di questa figura.
| Ceppo di topo | Soluzione di sensibilizzazione (dose) sull'addome rasato |
Soluzione di elicitazione (dose) su entrambi i lati dell'orecchio / s |
Giornata di sensibilizzazione / elicitazione | Refs | |||||||||||
| BALB/c (H-2d); C57BL/6 (H-2b) TCRδ-/-, β2m-/-, CD1d-/- (B10 PL (sfondo H-2u ) |
25 μL di DNFB allo 0,5 % in miscela acetone-olio d'oliva (rapporto 4:1) | 5 μL dello 0,1 % di DNFB nella miscela acetone-olio d'oliva (rapporto 4:1) | 0 / 5 | 22 | |||||||||||
| C57BL/6 (H-2b) | 50 μL di DNFB allo 0,5 % in miscela acetone-olio d'oliva (rapporto 4:1) | 25 μL dello 0,2 % di DNFB in miscela acetone-olio d'oliva (rapporto 4:1) | 0 / 5 | 32 | |||||||||||
| C57BL/6 (H2b); IL-17A-/- (sfondo C57BL/6) | 150 μL di TNCB al 5% in miscela acetone-etanolo (rapporto 1:3) | 10 μL di 0,4 % TNCB in miscela olio d'oliva-acetone (rapporto 1:1) | 0 / 4 | 33 | |||||||||||
| CBA/J (H-2k); C57BL/6 (H-2b) TLR2-/-, MyD88-/-, IL-17A-/- (sfondo C57BL/6) |
150 μL del 5 % TNP-Cl (TNCB) in una miscela acetone-etanolo (rapporto 1:3) | 10 μl dello 0,4 % TNP-Cl (TNCB) in miscela olio d'oliva-acetone (rapporto 1:1) | 0 / 4 | 21 | |||||||||||
| C57BL/6 (H-2b); BALB/c (H-2d) | 25 μL di 1 % TNCB in un acetone | 10 μL di 0,1 o 0,2 % TNCB in un acetone (e superiore fino all'1 %) | 0 / 7 | 34 | |||||||||||
| C57BL/6 (H-2b); TLR2-/-/ TLR4-/- (topi a doppio knockout su sfondo C57BL/6) |
100 μL del 3 % di TNCB in un acetone | 20 μL di 1 % TNCB in un acetone (solo sul lato posteriore delle orecchie) | 0 / 5 | 31 | |||||||||||
| C57BL/6 (H-2b) Topi con deficit di MHC classe II (sfondo C57BL/6) |
100 μL di 3 % TNCB in miscela acetone-olio d'oliva (rapporto 4:1) | 20 μL di 0,5 o 1 % di TNCB nella miscela acetone-olio d'oliva (rapporto 4:1) | 0 / 6 | 35 | |||||||||||
| C57BL/6 (H-2b) | 100 μL di 7 % TNCB in un acetone | 20 μL 1 % TNCB in un acetone | 0 / 5 | 36 | |||||||||||
| C57BL/6 (H-2b) | 100 μL 3 % OX in etanolo | 20 μL 1 % OX in un etanolo | 0 / 5 | ||||||||||||
| C57BL/6 (H-2b); CD4-/-, CD8-/- (sfondo C57BL/6) | 25 μL dello 0,5 % DNFB in acetone-olio d'oliva (rapporto 4:1) | 10 μL dello 0,2 % DNFB in acetone-olio d'oliva (rapporto 4:1) | 0 / 5 | 10 | |||||||||||
| C57BL/6 (H-2b); CD4-/-, CD8-/- (sfondo C57BL/6) | 150 μL del 3 % ox in alcool-acetone (rapporto 3:1) | 10 μL 1% OX in alcool-acetone (rapporto 3:1) | 0 / 5 | ||||||||||||
| C57BL/6 (H-2b); C3H/HeN (H-2k); TLR4-/- (sfondo C3H/HeJ); MyD88-/- (sfondo C57BL/6) | 100 mg/orecchio di 10 % NiCl2 nel petrolato bianco sul lato dorsale di entrambe le orecchie | 10 % NiCl2 in petrolato bianco | 0,1,2 / 23, 24 | 37 | |||||||||||
| NOD (H-2g7) MyD88-/- (sfondo NOD) | 400 μL di FITC allo 0,5 % in acetone e ftalato di dibutile | 10 μL di 0,1 % FITC in acetone e dibutilftalato | 0 / 5 | 25 | |||||||||||
Tabella 1: Confronto del modello CHS in vari studi. Abbreviazioni: DNFB = 1-fluoro-2,4-dinitrobenzene; FITC = isotiocianato di fluoresceina; NiCl2 = cloruro di nichel (II); TNCB = 2,4,6-trinitroclorobenzene; TNP-Cl = cloruro di trinitrofenile; OX = ossazolone. Fare clic qui per scaricare questa tabella.
| Gruppo di controllo (negativo) | Gruppo di prova (reazione CHS) | ||||||
| Mouse # orecchio: L, R | 0 h spessore dell'orecchio [μm] | Spessore dell'orecchio 24 h [μm] | 24 h – 0 h spessore orecchio [μm] | Mouse # orecchio: L, R | 0 h spessore dell'orecchio [μm] | Spessore dell'orecchio 24 h [μm] | 24 h – 0 h spessore orecchio [μm] |
| 1 L | 365 | 380 | 15 | 1 L | 345 | 427.5 | 82.5 |
| 1 R | 335 | 380 | 45 | 1 R | 340 | 455 | 115 |
| 2 L | 345 | 355 | 10 | 2 L | 355 | 475 | 120 |
| 2 R | 327.5 | 352.5 | 25 | 2 R | 342.5 | 457.5 | 115 |
| 3 L | 340 | 370 | 30 | 3 L | 340 | 460 | 120 |
| 3 R | 325 | 355 | 30 | 3 R | 345 | 495 | 150 |
| 4 L | 335 | 380 | 45 | 4 L | 357.5 | 432.5 | 75 |
| 4 R | 340 | 350 | 10 | 4 R | 335 | 402.5 | 67.5 |
| 5 L | 350 | 380 | 30 | 5 L | 335 | 387.5 | 52.5 |
| 5 R | 337.5 | 360 | 22.5 | 5 R | 335 | 425 | 90 |
| 6 L | 335 | 365 | 30 | 6 L | 350 | 430 | 80 |
| 6 R | 340 | 375 | 35 | 6 R | 342.5 | 405 | 62.5 |
| 7 L | 345 | 337.5 | 0 | 7 L | 340 | 502.5 | 162.5 |
| 7 R | 345 | 335 | 0 | 7 R | 327.5 | 447.5 | 120 |
| 8 L | 370 | 380 | 10 | 8 L | 327.5 | 515 | 187.5 |
| 8 R | 375 | 355 | 0 | 8 R | 327.5 | 540 | 212.5 |
| 9 L | 385 | 370 | 0 | 9 L | 330 | 415 | 85 |
| 9 R | 342.5 | 362.5 | 20 | 9 R | 327.5 | 390 | 62.5 |
| 10 L | 307.5 | 340 | 32.5 | 10 L | 337.5 | 445 | 107.5 |
| 10 R | 325 | 350 | 25 | 10 R | 352.5 | 455 | 102.5 |
| Significare | 20.75 | Significare | 108.5 | ||||
| ± SEM | 3.245 | ± SEM | 9.565 | ||||
Tabella 2: Esempio rappresentativo di calcolo della differenza di spessore dell'orecchio nella fase effettore di CHS. Calcolo della differenza di spessore del padiglione auricolare prima e dopo la sfida con l'hapten: 24 h di spessore dell'orecchio (μm) - 0 h di spessore dell'orecchio (μm). Ogni orecchio conta come una misurazione separata. Gonfiore dell'orecchio espresso in micrometri (μm) ± SEM, n = 20. Abbreviazioni: L = sinistra; R = destra. Fare clic qui per scaricare questa tabella.
| Diluizione iSTD con AD | anti-TNP IgG1 Ab (U/mL) |
| 100x | 250 |
| 200x | 125 |
| 400 volte | 62.5 |
| 800x | 31.25 |
| 1600x | 15.63 |
| 3200x | 7.8 |
| solo AD | 0 |
Tabella 3: Preparazione delle diverse concentrazioni di iSTD per la curva standard per la misurazione anti-TNP IgG1 Ab. La diluizione iSTD 100x è stata assunta come 250 U di anti-TNP IgG1 Ab. Abbreviazioni: Ab = anticorpo; AD = diluente di saggio; iSTD = standard interno; IgG1 = immunoglobulina G sottoclasse 1; TNP = 2,4,6-trinitrofenile; U = unità. Fare clic qui per scaricare questa tabella.
Figura supplementare 1: Il fenotipo delle cellule effettrici CHS. Le cellule effettrici CHS sono state ottenute da ALN e SPL dei donatori, che erano stati precedentemente sensibilizzati con TNCB. (A) Utilizzando la tecnica MACS, le cellule effettrici CHS (INTERI ALN e SPL) sono state esaurite di cellule CD4+ o CD8+. Successivamente, il trasferimento cellulare adottivo è stato condotto prima dell'elicitazione della fase effettrice CHS. Il gonfiore dell'orecchio è stato espresso come ± SEM. (B-E) Utilizzando una tecnica di citometria a flusso, le cellule effettrici CHS e naïve (ottenute da topi naïve) sono state colorate per IFN-γ, Tbet, IL-17A e RORγt prima dell'analisi. Le cellule sono state chiuse per la popolazione TCRβ+CD4+. Risultati mostrati come ± media SEM, ***p < 0,001, **p < 0,01, * p < 0,05, n = 4-6 topi/gruppo. Abbreviazioni: ALNs = linfonodi ascellari e inguinali; CD4 = cluster di differenziazione 4; CHS = reazione di ipersensibilità da contatto; IFN-γ = interferone gamma; IL = interleuchina; MACS = smistamento cellulare ad attivazione magnetica; ns = non significativo; RORγt = recettore nucleare orfano gamma correlato al recettore dell'acido retinoico; SEM = errore standard della media; SPLs = milza; Tbet = fattore di trascrizione T-box TBX21; TCRβ = recettore beta delle cellule T; TNCB = 2,4,6-trinitroclorobenzene. Fare clic qui per scaricare questo file.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
La CHS è indotta tramite apteni, che si legano agli antigeni autoproteici nella pelle, creando neoantigeni. La CHS è mediata dal reclutamento extravascolare locale di cellule T effettrici CHS antigene-effettrici circolanti, che provoca gonfiore nel tessuto sfidato, con un picco di 24 ore dopo l'esposizione della pelle secondaria allo stesso aptenato6. Il gonfiore del tessuto è causato principalmente dall'infiltrazione di leucociti e dalla deposizione di fibrina leucocitaria-dipendente24. Questi cambiamenti possono essere rilevati con un micrometro che misura il gonfiore dell'orecchio di topi sensibilizzati e sfidati contro sham-sensibilizzati e sfidati.
CHS può anche essere determinato dal confronto del peso dell'orecchio. Quindi, i punzoni auricolari utilizzati per la determinazione del peso dell'orecchio possono essere utilizzati per ulteriori test. Gli infiltrati cellulari nelle orecchie infiammate sono costituiti da linfociti T produttori di citochine e neutrofili MPO-positivi. Negli omogeneizzati del tessuto auricolare, è possibile misurare vari parametri, come l'attività MPO o la concentrazione di citochine pro-infiammatorie (ad esempio, TNF-α, IFN-γ, IL-17A o altri) utilizzando il test ELISA o l'espressione dell'mRNA della citochina nella pelle utilizzando il test qPCR25. Inoltre, i cambiamenti di permeabilità dei vasi possono essere valutati utilizzando il test blu Evans21,26.
Nel tessuto auricolare infiammato, i cambiamenti osservati possono anche essere integrati con test in vitro, evidenziando la proliferazione delle cellule T e la produzione di citochine. Questo può essere facilmente realizzato coltivando ALN in presenza di antigeni proteici coniugati con aptene22,27. La valutazione della secrezione di citochine da parte di ALN isolati da topi sensibilizzati ma non sfidati fornisce dettagli sulla produzione di citochine da parte delle cellule effettrici CHS nel luogo della loro induzione.
Limitazioni
Molti micrometri misurano il gonfiore dell'orecchio con precisione diversa. Ad esempio, la pressione più bassa viene esercitata da una pinza a molla, quindi sembra che i risultati riflettano al meglio la misurazione effettiva dello spessore dell'orecchio. Tuttavia, i micrometri che esercitano più pressione, come Mitutoyo, sono suscettibili di comprimere più strettamente il fluido che si accumula nelle orecchie nella fase iniziale della formazione dell'edema. La natura bifasica del CHS può essere visualizzata più chiaramente utilizzando tali micrometri perché viene esercitata una maggiore pressione. Questo è più difficile quando si utilizza una pinza a molla con una leggera pressione28. Tuttavia, in alcuni studi, lo spessore delle orecchie è stato misurato con una pinza29. Inoltre, l'esperienza dell'osservatore garantisce misurazioni accurate, che possono essere influenzate da sentimenti soggettivi, anche se l'osservatore non è a conoscenza dei gruppi sperimentali.
Qui sono stati descritti metodi alternativi che possono aiutare a confermare le misurazioni del gonfiore dell'orecchio con un micrometro, rendendo i dati presentati più affidabili e meno soggettivi. Tuttavia, queste strategie alternative per la valutazione del CHS possono essere utilizzate solo in un determinato momento. Le misurazioni micrometriche possono essere ripetute in vari punti temporali, consentendo di studiare la cinetica CHS.
Modifiche
Il protocollo per lo studio della reazione CHS che utilizziamo nel nostro laboratorio differisce significativamente da quelli utilizzati in altri laboratori, tra cui la dose di hapten e la composizione del solvente utilizzata sia per l'elicitazione che per la sensibilizzazione, nonché il punto temporale in cui viene valutata la reazione. Lo spessore dell'orecchio può essere misurato in diversi punti temporali (ad esempio, 2 ore, 24 ore, 48 ore e 72 ore dopo la sfida)10,30. La Tabella 1 mostra diversi modelli sperimentali, in particolare le differenze nel ceppo animale, hapten, e i tempi di sensibilizzazione/challenge utilizzati in vari studi 10,21,22,26,31,32,33,34,35,36,37 . Il protocollo CHS potrebbe anche essere condotto senza previa rasatura dell'addome dei topi.
La differenza successiva riguarda l'esecuzione dell'elicitazione (sfida) stessa. Come è tipico, la sensibilizzazione viene effettuata dipingendo la pelle dell'addome dei topi rasati con l'apteno o il veicolo da solo. Successivamente, in entrambi i gruppi, un orecchio viene sfidato con hapten diluito su ciascun lato dell'orecchio. Come controllo, l'orecchio opposto è verniciato con una quantità identica di veicolo da solo10,31.
Passaggi critici
Il momento più critico è quello di attivare CHS, poiché i risultati del test dipendono da esso. (1) La soluzione di Hapten è molto volatile e sensibile alla luce, quindi deve essere ben chiusa e protetta dalla luce e, quando è in uso, deve essere rapidamente applicata sulla pelle degli animali in modo che non evapori. (2) Dopo aver applicato l'apteno sulla pelle dell'addome, deve essere asciugato prima che l'animale ritorni nella gabbia perché i topi possono spalmarlo contro la lettiera o applicarlo alle orecchie con le zampe (quindi la misurazione dello spessore del padiglione auricolare può essere inadeguata). (3) Sono noti anche vari metodi di etichettatura degli animali, come la marcatura delle code di topo con un marcatore resistente ai solventi. Tuttavia, i coloranti presenti nel marcatore potrebbero (non studiati) diventare un hapten e innescare CHS. Pertanto, in questo studio, è stato scelto un metodo di marcatura che non influisce sulla reazione. (4) La scelta di un metodo di rasatura è molto importante in quanto può irritare la pelle. In questo protocollo, è stato utilizzato un sapone grigio perché ha proprietà lenitive; accelera il trattamento di tagli minori e ferite incandescenti, che è aiutato dai suoi effetti antibatterici. Lenisce il gonfiore e l'infiammazione della pelle.
Sono necessarie ulteriori indagini e standardizzazione delle procedure sperimentali, compreso l'uso animale (ceppo e sesso), per confrontare i risultati di diversi studi.
Molti diversi fattori ambientali e nuove sostanze con funzioni biologiche possono essere testati nel modello CHS. Questo modello può essere utile se i ricercatori vogliono dimostrare se i fattori testati modulano le risposte immunitarie dipendenti dalle cellule T.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Gli autori non hanno nulla da rivelare.
Acknowledgments
Questo studio è stato supportato dalla sovvenzione SUBZ. A020.22.060 dell'Università di Medicina di Wroclaw, Polonia, e da sovvenzioni del Ministero della Scienza e dell'Istruzione Superiore N N401 545940 a MS e IP2012 0443 72 a MMS.
Materials
| Name | Company | Catalog Number | Comments |
| 70% ethanol | Merck KGaA, Darmstadt, Germany | 65350-M | for surface disinfection |
| 96-well flat-bottom plates, polypropylene | Greiner Bio-One GmbH, Kremsmunster, Austria | 655101 | for MPO and Evans blue measurement - plates should be made of polypropylene, that has a lower binding capacity so proteins or DNA will not bind |
| Acetone (ACS reagent, ≥99.5%) | Merck KGaA, Darmstadt, Germany | 179124 | |
| Aluminum foil | Merck KGaA, Darmstadt, Germany | Z185140 | |
| Analytical balance | Sartorius Weighing Technology GmbH, Goettingen, Germany | PRACTUM224-1s, 29105177 | |
| Automated tissue processor | MediMeas Instruments, Sarsehri, Haryana, India | MTP-E-212 | automatically prepare tissue samples by fixing, dehydrating, clearing, and infiltrating them with paraffin |
| BD Vacutainer SST II Advance (tube with gel for obtaining serum) | Becton Dickinson (BD), Franklin Lakes, NJ, USA | BD 366882 | |
| Bicinchoninic acid kit for protein determination | Merck KGaA, Darmstadt, Germany | BCA1-1KT | |
| Biotin Rat Anti-Mouse IgG1 | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 553441 | |
| BSA (bovine serum albumine) | Merck KGaA, Darmstadt, Germany | A9418 | protein assays & analysis, 2 mg/mL |
| Cell strainer, pore size 70 μm | BIOLOGIX, China | 15-1070 | suitable for 50 mL tubes |
| Coverslip | VWR, Radnor, Pennsylvania, United States | 631-1583 | 24 mm, but it possible to use different size |
| Disposable pipettes capacity: 5 mL, 10 mL, 25 mL | Merck KGaA, Darmstadt, Germany | Z740301, Z740302, Z740303 | |
| DPBS (Dulbecco′s phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 14190144 | no calcium, no magnesium, mammalian cell culture |
| DPX Mountant for histology | Merck KGaA, Darmstadt, Germany | 6522 | mounting media for H-E, might be used some other e.g, Canada balsam |
| Dumont 5 tweezers - straight | Animalab, Poznan, Poland | 11251-10FST | surgical instruments for procedures on mice (should be steriled) |
| Dumont 7 tweezers - bent | Animalab, Poznan, Poland | 11272-50FST | surgical instruments for procedures on mice (should be steriled) |
| Eosin Y solution, alcoholic | Merck KGaA, Darmstadt, Germany | HT110116 | |
| Eppendorf Safe-Lock Tubes 1.5 mL | Eppenforf, Germany | 3,01,20,086 | polypropylene |
| Eppendorf Safe-Lock Tubes, 2.0 mL | Eppenforf, Germany | 3,01,20,094 | polypropylene, round bottom (the homogenization beads can easily move) |
| Ethanol 100% (absolute alkohol) | Merck KGaA, Darmstadt, Germany | 1.07017 | |
| Ethanol 96% | Merck KGaA, Darmstadt, Germany | 1.59010 | |
| Evans blue | Merck KGaA, Darmstadt, Germany | E2129 | |
| FBS (fetal bovine serum) | ThermoFisher Scientific, Waltham, Massachusetts, USA | A3160802 | |
| Formalin solution, neutral buffered, 10% | Merck KGaA, Darmstadt, Germany | HT501128 | |
| Formamide 99.5% (GC) | Merck KGaA, Darmstadt, Germany | F7503 | |
| Freezer -20 °C | Bosch, Germany | GSN54AW30 | |
| Fridge +4 °C / freezer -20 °C | Bosch, Germany | KGV36V10 | mammalian Cell Culture, qualified, Brazil, 10 x 50 mL |
| Glass microskope slides, SuperFrost Plus | VWR, Radnor, Pennsylvania, United States | 631-0108, 631-0446, 631-0447, 631-0448, 631-0449 | Slides that eliminates the need to apply adhesive materials or protein coatings, to preventing any tissue sections loss during staining. |
| Graph Pad Prism | GraphPad Software Inc. | v. 9.4.0 | |
| Grey soap | Pollena Ostrzeszów, Producent Chemii Gospodarczej Sp. Z.o.o. , Sp. K., Poland | Bialy jelen soap bar | grey Soap Bar Natural Hypoallergenic. Generally available product |
| H2SO4 (sulfuric acid) 1 mol/l (1 M) | Merck KGaA, Darmstadt, Germany | 1.60313 | |
| Harris hematoxylin solution | Merck KGaA, Darmstadt, Germany | HHS16 | |
| Hemocytometer | VWR, Avantor, U.S.A | 612-5719 | manual counting chamber is recommend, which is more accurate |
| Hexadecyltrimethylammonium bromide | Merck KGaA, Darmstadt, Germany | H5882 | |
| Homogenizer | QIAGEN Hilden, Germany | Tissue Lyser LT, SN 23.1001/05234 | homogenizer with stainless steel beads (diameter 5 mm) for 2 mL centrifuge tubes |
| Horseradish peroxidase streptavidin (HRP streptavidin) | Vector Laboratories, Inc., Burlingame, CA, USA | SA-5004-1 | |
| Hydrogen peroxide solution (H202) | Merck KGaA, Darmstadt, Germany | H1009 | |
| Incubator Heracell 150i | Thermo Electron LED Gmbh, Germany | 41071068 | 37 oC in the atmosphere of 5 % CO2, and 65 0C for deparaffinization the sections for histology |
| Ketamine 100 mg/mL, solution for injection | Biowet Pulawy Sp. z o.o., Pulawy, Poland | cat.# not avaliable | |
| KH2PO4 (potassium dihydrogen phosphate) 99.995% anhydrous basis | Merck KGaA, Darmstadt, Germany | 1.05108 | |
| Laboratory Centrifuge | Heraeus Megafuge 1.0R, Thermo Scientific, Germany | B00013899 | speed to 300 x g, with cooling to 4 0C |
| Laboratory Centrifuge | Heraeus Fresco 21, Thermo Scientific, Germany | 75002425 | speed to 3,000 x g, with cooling to 4 0C |
| Mask (FFP2) | VWR, Radnor, Pennsylvania, United States | 111-0917 | for working with ortho-dianisine dihydrochloride |
| Mice | Breeding unit of the Chair of Biomedical Sciences, Faculty of Health Sciences, Jagiellonian University Medical College, Krakow, Poland | CBA/J, C57BL/6 | |
| Micrometer | Mitutoyo, Tokyo, Japan | 193-111 | digit Outside Micrometer, Ratchet Stop, 0-25mm Range, 0.001mm Graduation, +/-0.002mm Accuracy, https://shop.mitutoyo.pl/web/mitutoyo/pl_PL/all/all/Mikrometr%20analogowy%20/PR/193-111/index.xhtml |
| microplate, 96 well, microlon, high binding (for ELISA test) | Greiner Bio-One GmbH, Kremsmunster, Austria | 655061 | with maxi-sorp binding surfaces for reliable and reproducible results in colormetric assays |
| Microscope with objectives | Leica Microsystems CMS GmbH, Germany | DM1000, 294011-082007 | histology presented in the paper was performed under ThermoFisher Scientific EVOS M5000 Imaging System, with objectives: FL 20X LWDPH, 0.40NA/3.1WD and FL 40X LWDPH 0.65NA/1.79WD |
| Myeloperoxidase from human leukocytes (MPO standard) | Merck KGaA, Darmstadt, Germany | M6908 | |
| Na2HPO4 x 7 H2O (sodium phosphate dibasic heptahydrate) | Merck KGaA, Darmstadt, Germany | S9390 | |
| Olive-oil | Merck KGaA, Darmstadt, Germany | 75343 | pure, natural |
| OptEIA Mouse IFN-γ ELISA Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555138 | |
| Ortho-dianisine dihydrochloride | Merck KGaA, Darmstadt, Germany | D3252 | |
| Paraffin wax | Merck KGaA, Darmstadt, Germany | 76242 | beads, waxy solid |
| PBS (phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 20012027 | pH 7.2, mammalian cell culture |
| ph meter | Elmetron, Poland | CP-401 | |
| Pipettes, variable volume with tips | Merck KGaA, Darmstadt, Germany | EP3123000900-1EA | 3-pack, Option 1, 0.5-10 uL/10-100 uL/100-1000 uL, includes epT.I.P.S. |
| Razor blade | VWR, Radnor, Pennsylvania, United States | PERS94-0462 | scraper and cutter blades, single edge, aluminium spine, 100 blades per box, individually wrapped |
| Rotary microtome | MRC Laboratory-Instruments, Essex, CM20 2HU UK | HIS-202A | |
| Scissors - straight, sharp / sharp | Animalab, Poznan, Poland | 14060-10FST | Surgical instruments for procedures on mice (should be steriled) |
| Screw cap (open top) | Merck KGaA, Darmstadt, Germany | 27056 | black polypropylene hole cap, for use with 22 mL vial with 20-400 thread |
| Spectrophotometer | BioTek Instruments, U.S.A | 201446 | universal microplate spectrophotometer: λ range: 200 - 999 nm, absorbance measurement range: 0.000 - 4.000 Abs |
| Staining dish 20 slides with rack | Merck KGaA, Darmstadt, Germany | S6141 | e.g. 20 slide staining dishes complete with covers, slide rack and handle |
| Sterile Disposable Biopsy Punch 6mm | Integra LifeSciences, Princeton, NJ, USA | 33-36 | |
| Surgical scissors | Animalab, Poznan, Poland | 52138-46 | surgical instruments for procedures on mice (should be steriled) |
| Tissue processing cassettes | Merck KGaA, Darmstadt, Germany | Z672122 | tissue processing/ embedding cassettes with lid |
| TMB Substrate Reagent Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555214 | |
| TNCB (2,4,6-trinitrochlorobenzene) | Tokyo Chemical Industry CO., LTD, Japan | C0307 | |
| TNP-BSA (bovine serum albumin conjugated with 2,4,6-trinitrophenyl) | Biosearch Technologies LGC, Petaluma, CA, USA | T-5050 | |
| T-PER (tissue protein extration reagent) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 78510 | |
| Tubes 15 mL sterile | Merck KGaA, Darmstadt, Germany | CLS430055 (Corning) | polypropylene, conical bottom |
| Tubes 50 mL, sterile | Merck KGaA, Darmstadt, Germany | CLS430290 (Corning) | polypropylene, conical bottom |
| Tween 20 | Merck KGaA, Darmstadt, Germany | P1379 | |
| Vials, screw top, clear glass (vial only) 22 mL | Merck KGaA, Darmstadt, Germany | 27173 | for the preparation of hapten, screwed on so that it does not evaporate |
| Water bath | AJL Electronic, Poland | LW102 | |
| Wax (paraffin) dispenser | VWR, Radnor, Pennsylvania, United States | 114-8737 | |
| Xylazine (xylapan 20 mg/mL) solution for injection | Vetoquinol Biowet Sp. z o.o., Gorzow Wielkopolski, Poland | cat.# not avaliable | |
| Xylene (histological grade) | Merck KGaA, Darmstadt, Germany | 534056 |
References
- Nosbaum, A., Vocanson, M., Rozieres, A., Hennino, A., Nicolas, J. F. Allergic and irritant contact dermatitis. European Journal of Dermatology. 19 (4), 325-332 (2009).
- Hertl, M., et al. Predominance of epidermal CD8+ T lymphocytes in bullous cutaneous reactions caused by beta-lactam antibiotics. The Journal of Investigative Dermatology. 101 (6), 794-799 (1993).
- Martin, S. F. T lymphocyte-mediated immune responses to chemical haptens and metal ions: implications for allergic and autoimmune disease. International Archives of Allergy and Immunology. 134 (3), 186-198 (2004).
- Takeyoshi, M., Iida, K., Suzuki, K., Yamazaki, S. Skin sensitization potency of isoeugenol and its dimers evaluated by a non-radioisotopic modification of the local lymph node assay and guinea pig maximization test. Journal of Applied Toxicology. 28 (4), 530-534 (2008).
- Nakamura, K., Aizawa, M. Studies on the genetic control of picryl chloride contact hypersensitivity reaction in inbred rats. Transplantation Proceedings. 13 (2), 1400-1403 (1981).
- Asherson, G. L., Ptak, W. Contact and delayed hypersensitivity in the mouse. I. Active sensitization and passive transfer. Immunology. 15 (3), 405-416 (1968).
- Honda, T., Egawa, G., Grabbe, S., Kabashima, K. Update of immune events in the murine contact hypersensitivity model: toward the understanding of allergic contact dermatitis. The Journal of Investigative Dermatology. 133 (2), 303-315 (2013).
- Kaplan, D. H., Jenison, M. C., Saeland, S., Shlomchik, W. D., Shlomchik, M. J. Epidermal langerhans cell-deficient mice develop enhanced contact hypersensitivity. Immunity. 23 (6), 611-620 (2005).
- Wang, L., et al. Langerin expressing cells promote skin immune responses under defined conditions. Journal of Immunology. 180 (7), 4722-4727 (2008).
- Wang, B., et al. CD4+ Th1 and CD8+ type 1 cytotoxic T cells both play a crucial role in the full development of contact hypersensitivity. Journal of Immunology. 165 (12), 6783-6790 (2000).
- Mori, T., et al. Cutaneous hypersensitivities to hapten are controlled by IFN-gamma-upregulated keratinocyte Th1 chemokines and IFN-gamma-downregulated langerhans cell Th2 chemokines. The Journal of Investigative Dermatology. 128 (7), 1719-1727 (2008).
- Peszkowski, M. J., Warfvinge, G., Larsson, A. Allergic and irritant contact responses to DNFB in BN and LEW rat strains with different TH1/TH2 profiles. Acta Dermato-Venereologica. 74 (5), 371-374 (1994).
- Henningsen, S. J., Mickell, J., Zachariae, H. Plasma kinins in dinitrochlorobenzene contact dermatitis of guinea-pigs. Acta Allergologica. 25 (5), 327-331 (1970).
- Maibach, H. I., Maguire, H. C. Elicitation of delayed hypersensitivity (DNCB contact dermatitis) in markedly panleukopenic guinea pigs. The Journal of Investigative Dermatology. 41, 123-127 (1963).
- Martel, B. C., Lovato, P., Bäumer, W., Olivry, T. Translational animal models of atopic dermatitis for preclinical studies. The Yale Journal of Biology and Medicine. 90 (3), 389-402 (2017).
- Jin, H., He, R., Oyoshi, M., Geha, R. S. Animal models of atopic dermatitis. The Journal of Investigative Dermatology. 129 (1), 31-40 (2009).
- Li, Y. Z., Lu, X. Y., Jiang, W., Li, L. F. Anti-inflammatory effect of qingpeng ointment in atopic dermatitis-like murine model. Evidence-Based Complementary and Alternative. 2013, 907016 (2013).
- Hoggatt, J., Hoggatt, A. F., Tate, T. A., Fortman, J., Pelus, L. M. Bleeding the laboratory mouse: Not all methods are equal. Experimental Hematology. 44 (2), 132-137 (2016).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and th17 differentiation of naïve CD4 T lymphocytes. Journal of Visualized Experiments. (79), e50765 (2013).
- Vlab, A. Hemocytometer - Counting of Cells. Amrita University. , Available from: https://www.youtube.com/watch?v=MKS0KM3lr90 (2011).
- Majewska-Szczepanik, M., Strzepa, A., Marcińska, K., Wen, L., Szczepanik, M. Epicutaneous immunization with TNP-Ig and Zymosan induces TCRαβ+ CD4+ contrasuppressor cells that reverse skin-induced suppression via IL-17A. International Archives of Allergy and Immunology. 164 (2), 122-136 (2014).
- Majewska-Szczepanik, M., Zemelka-Wiącek, M., Ptak, W., Wen, L., Szczepanik, M. Epicutaneous immunization with DNP-BSA induces CD4+ CD25+ Treg cells that inhibit Tc1-mediated CS. Immunology and Cell Biology. 90 (8), 784-795 (2012).
- Directive 2010/63 / EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union. , Available from: https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2010:276:0033:0079:En:PDF (2010).
- Colvin, R. B., Dvorak, H. F. Role of the clotting system in cell-mediated hypersensitivity. II. Kinetics of fibrinogen/fibrin accumulation and vascular permeability changes in tuberculin and cutaneous basophil hypersensitivity reactions. Journal of Immunology. 114, 377-387 (1975).
- Szczepanik, M., et al. Regulation of contact sensitivity in non-obese diabetic (NOD) mice by innate immunity. Contact Dermatitis. 79 (4), 197-207 (2018).
- Askenase, P. W., Majewska-Szczepanik, M., Kerfoot, S., Szczepanik, M. Participation of iNKT cells in the early and late components of Tc1-mediated DNFB contact sensitivity: Cooperative role of γδ-T cells. Scandinavian Journal of Immunology. 73 (5), 465-477 (2011).
- Zemelka-Wiącek, M., Majewska-Szczepanik, M., Ptak, W., Szczepanik, M. Epicutaneous immunization with protein antigen induces antigen-non-specific suppression of CD8 T cell mediated contact sensitivity. Pharmacological Reports. 64 (6), 1485-1496 (2012).
- Van Loveren, H., et al. Use of micrometers and calipers to measure various components of delayed-type hypersensitivity ear swelling reactions in mice. Journal of Immunological Methods. 67 (2), 311-319 (1984).
- Tsuji, R. F., et al. B cell-dependent T cell responses: IgM antibodies are required to elicit contact sensitivity. The Journal of Experimental Medicine. 196 (10), 1277-1290 (2002).
- Campos, R. A., et al. Cutaneous immunization rapidly activates liver invariant Valpha14 NKT cells stimulating B-1 B cells to initiate T cell recruitment for elicitation of contact sensitivity. The Journal of Experimental Medicine. 198 (12), 1785-1796 (2003).
- Rühl-Muth, A. C., Maler, M. D., Esser, P. R., Martin, S. F. Feeding of a fat-enriched diet causes the loss of resistance to contact hypersensitivity. Contact Dermatitis. 85 (4), 398-406 (2021).
- Bour, H., et al. histocompatibility complex class I-restricted CD8+ T cells and class II-restricted CD4+ T cells, respectively, mediate and regulate contact sensitivity to dinitrofluorobenzene. European Journal of Immunology. 25 (11), 3006-3010 (1995).
- Majewska-Szczepanik, M., et al. Obesity aggravates contact hypersensitivity reaction in mice. Contact Dermatitis. 87 (1), 28-39 (2022).
- Katagiri, K., Arakawa, S., Kurahashi, R., Hatano, Y. Impaired contact hypersensitivity in diet-induced obese mice. Journal of Dermatological Science. 46 (2), 117-126 (2007).
- Bouloc, A., Cavani, A., Katz, S. I. Contact hypersensitivity in MHC class II-deficient mice depends on CD8 T lymphocytes primed by immunostimulating Langerhans cells. The Journal of Investigative Dermatology. 111 (1), 44-49 (1998).
- Martin, S., et al. Peptide immunization indicates that CD8+ T cells are the dominant effector cells in trinitrophenyl-specific contact hypersensitivity. The Journal of Investigative Dermatology. 115 (2), 260-266 (2000).
- Vennegaard, M. T., et al. Epicutaneous exposure to nickel induces nickel allergy in mice via a MyD88-dependent and interleukin-1-dependent pathway. Contact Dermatitis. 71 (4), 224-232 (2014).
Tags
Immunologia e infezione Numero 187 Modello murino Dermatite allergica da contatto (ACD) ipersensibilità da contatto (CHS) gonfiore dell'orecchio permeabilità vascolare mieloperossidasi (MPO) citochine 2,4,6-trinitroclorobenzene (TNCB) haptenErratum
Formal Correction: Erratum: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis
Posted by JoVE Editors on 01/19/2023.
Citeable Link.
An erratum was issued for: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis. The Protocol and Representative Results sections were updated.
Step 3.2.1 of the Protocol has been updated from:
On day "4", prepare 0.4% hapten: TNCB in an acetone-ethanol mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
to:
On day "4", prepare 0.4% hapten: TNCB in an acetone: olive oil mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
Figure 1 of the Representative Results has been updated from:
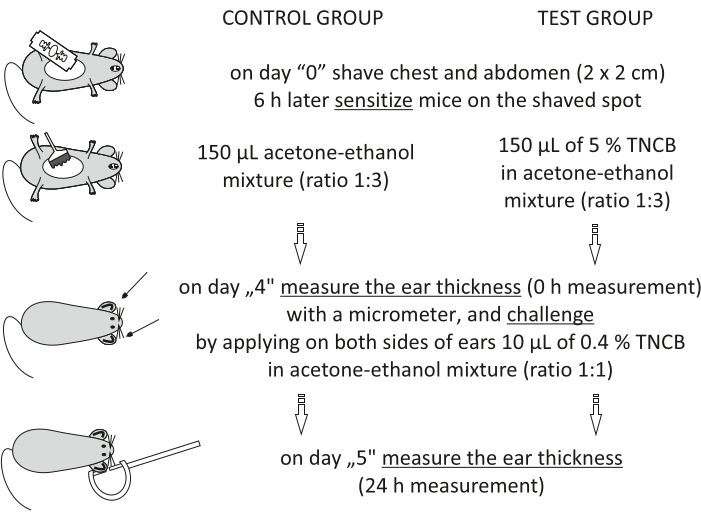
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
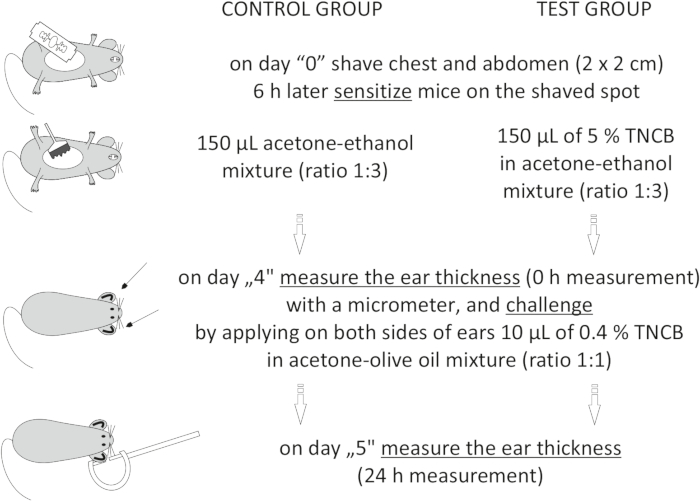
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
Figure 2 of the Representative Results has been updated from:
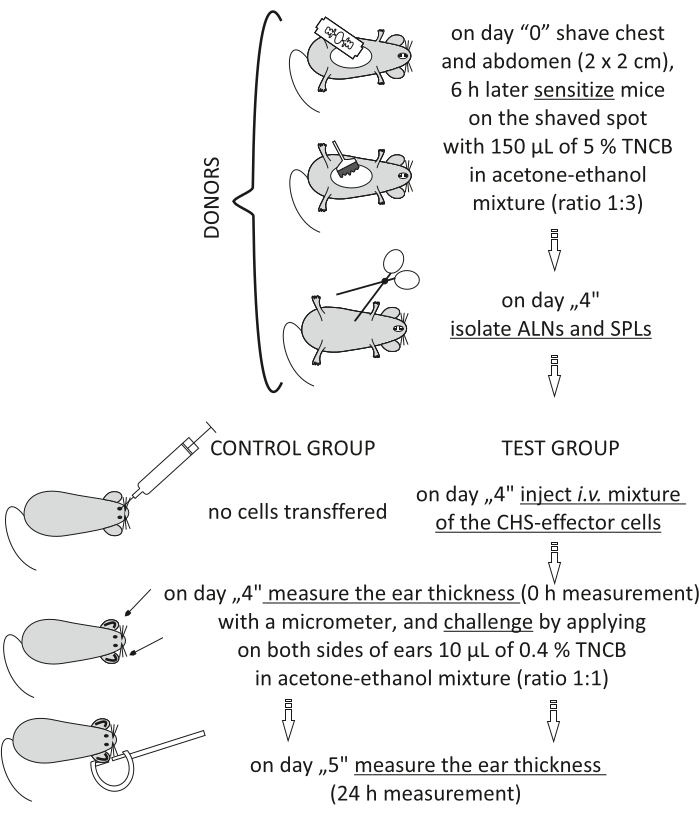
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
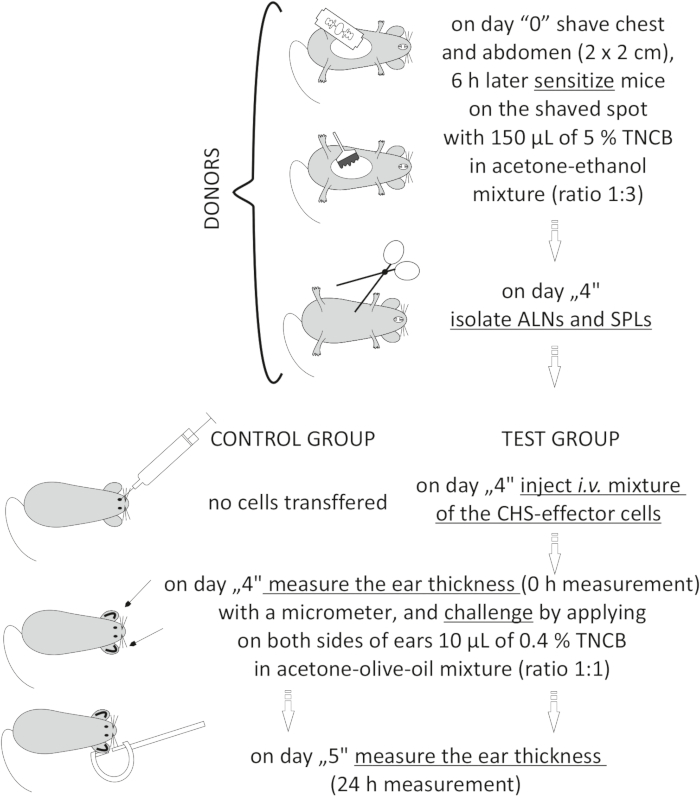
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.



