Overview
Fonte: Laboratorio del Dr. Neal Abrams - SUNY College of Environmental Science and Forestry
Tutte le reazioni chimiche hanno un tasso specifico che definisce il progresso dei reagenti che vanno ai prodotti. Questo tasso può essere influenzato dalla temperatura, dalla concentrazione e dalle proprietà fisiche dei reagenti. Il tasso include anche gli intermedi e gli stati di transizione che si formano ma non sono né il reagente né il prodotto. La legge della velocità definisce il ruolo di ciascun reagente in una reazione e può essere utilizzata per modellare matematicamente il tempo necessario affinché una reazione proceda. La forma generale di un'equazione di tasso è mostrata di seguito:
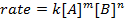
dove A e B sono concentrazioni di diverse specie molecolari, m e n sono ordini di reazione, e k è la costante di velocità. La velocità di quasi tutte le reazioni cambia nel tempo man mano che i reagenti si esauriscono, rendendo meno probabile che si verifichino collisioni efficaci. La costante di velocità, tuttavia, è fissa per ogni singola reazione a una data temperatura. L'ordine di reazione illustra il numero di specie molecolari coinvolte in una reazione. È molto importante conoscere la legge della velocità, compresa la costante di velocità e l'ordine di reazione, che possono essere determinati solo sperimentalmente. In questo esperimento, esploreremo un metodo per determinare la legge della velocità e lo useremo per comprendere il progresso di una reazione chimica.
Principles
Cinetica e Termodinamica
Tutte le reazioni chimiche sono governate da due fattori, cinetica e termodinamica. Il fattore termodinamico è la differenza di energia libera rilasciata durante una reazione chimica. Questa energia libera, chiamata spontaneità, è un valore complesso derivante dall'entalpia (calore) e dall'entropia (disordine) all'interno di una reazione chimica. La cinetica si riferisce alla velocità di una reazione chimica e alla velocità con cui il sistema raggiunge l'equilibrio. Mentre la cinetica può spiegare la velocità della reazione, la termodinamica fornisce informazioni sulla sua energetica. In parole povere, la termodinamica si riferisce alla stabilità e la cinetica si riferisce alla reattività.
Determinazione della velocità
La velocità è una misurazione basata sul tempo, il che significa che cambia costantemente man mano che una reazione procede. Questo può essere rappresentato usando una legge di tasso differenziale, esprimendo il cambiamento di concentrazione su un cambiamento nel tempo. Sperimentalmente, la legge del tasso differenziale è difficile da usare, quindi possiamo usare il calcolo e rappresentare la legge dei tassi come la legge dei tassi integrata integrando la legge del tasso differenziale. La legge della velocità integrata rappresenta le concentrazioni di reazione all'inizio della reazione e ad un intervallo di tempo specificato. Di seguito è riportata una tabella dell'ordine, della legge delle tariffe e della legge delle tariffe integrata:

Ogni ordine spiega la dipendenza della concentrazione del reagente dalla velocità di reazione. Ad esempio, una legge del tasso di ordine zero, tasso = k, indica che il tasso dipende solo dalla costante di velocità, non dalla concentrazione del reagente. Questo è comune nelle reazioni catalitiche in cui il catalizzatore è un solido e l'area della superficie non cambia durante la reazione. Una legge sul tasso di 1° ordine mostra che il tasso dipende dalla concentrazione di un reagente, sebbene possano essere presenti altri reagenti. Una legge del tasso di2 ° ordine indica che la velocità dipende dalla concentrazione di due reagenti nella reazione. Quei reagenti possono essere gli stessi, cioè tasso = k[A]2, o diverso, tasso = k[A] [B]. Poiché le due concentrazioni cambiano costantemente, le costanti di velocità di secondo ordine possono essere difficili da misurare in laboratorio. Indipendentemente dall'ordine, l'utilizzo della legge dei tassi integrata semplifica l'analisi dei dati consentendo il grafico dei dati e l'applicazione di un'equazione lineare per adattarsi ai dati. Poiché solo una legge di velocità integrata si adatta ai dati, la costante di velocità di una reazione e l'ordine di reazione possono essere immediatamente identificati.
Un esperimento di cinetica
La determinazione della legge della velocità inizia con l'impostazione di un esperimento di cinetica per la reazione chimica. Un esperimento di cinetica è attentamente controllato in modo che le misurazioni siano effettuate a intervalli di tempo al fine di determinare il cambiamento di concentrazione di una specie nel tempo. Quella specie può essere un reagente (diminuzione della concentrazione con il tempo) o un prodotto (aumento della concentrazione con il tempo). Se sono coinvolti più reagenti, è anche molto importante che la concentrazione di un solo reagente cambi nel tempo. L'aumento della concentrazione degli altri reagenti molto più alta del reagente studiato fa sembrare che la concentrazione di un solo reagente cambi durante l'esperimento.
In questo esperimento, viene esplorata la decomposizione catalitica del perossido di idrogeno su un catalizzatore di platino. Poiché il platino è un catalizzatore, è coinvolta solo una specie che si decompone in due prodotti secondo la seguente reazione:
2 H2O2(aq) → O2(g) + 2 H2O(l)
Poiché uno dei prodotti, O2, è un gas, è possibile misurare l'aumento di pressione del sistema nel tempo e utilizzare la legge del gas ideale (PV = nRT) per correlare la pressione alle moli. Una volta fatto questo per diverse concentrazioni del reagente, l'ordine di reazione e la legge della velocità possono essere risolti.
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. Preparazione delle diluizioni H2O2
- Il perossido di idrogeno al 3% ha una concentrazione di 0,882 M. Preparare 5 diluizioni che vanno da 0,882 M a 0,176 M (Tabella 1). Preparare queste soluzioni volumetricamente, ma prepararle in modo additivo poiché il soluto è molto diluito e i volumi di acqua sono additivi.
- Posizionare le soluzioni a bagnomaria a temperatura costante o lasciarle sul piano di lavoro per equilibrare a temperatura ambiente. Un intervallo di temperatura di 20-25 °C (293-298 K) è buono per questa reazione.

Tabella 1. Soluzioni H2O2 utilizzate.
2. Preparazione del recipiente di reazione
- Per determinare il volume del recipiente di reazione, riempire una grande provetta verso l'alto con acqua e inserire un tappo di gomma a 1 foro nella provetta fino a quando l'acqua non si stringe e l'acqua spinge fuori i lati e attraverso la parte superiore.
- Rimuovere il tappo e versare l'acqua in un cilindro graduato per determinare il volume esatto dell'acqua. Questo è il volume totale del recipiente di reazione (provetta).
3. Misurare l'evoluzione dell'ossigeno
- Sostituire l'acqua con 50 ml della prima soluzione di perossido di idrogeno e rimetterla nel bagno d'acqua. Una volta bilanciato, aggiungere il disco di reazione rivestito in platino e sigillare il sistema con un tappo collegato a un sensore di pressione del gas. Questi dischi sono comunemente usati nei sistemi di pulizia delle lenti a contatto.
- Una volta configurato il sensore di pressione per acquisire dati a 2 punti/s, eseguire l'esperimento per 120 s. Il sensore di pressione del gas Vernier, GPS-BTA, è raccomandato per questo esperimento.
- Le bolle devono essere osservate quando il perossido viene decomposto in ossigeno gassoso e acqua. Rilasciare la pressione, smaltire la soluzione, risciacquare e sostituire la soluzione con la successiva soluzione di perossido di idrogeno. Ripetere la misurazione della pressione del gas fino a quando tutte le soluzioni non vengono testate.
4. Analisi dei dati
- Trasferisci tutti i file di dati di pressione rispetto al tempo in un programma di fogli di calcolo.
- Determinare i tassi iniziali - supponiamo che la concentrazione di perossido di idrogeno non sia cambiata molto durante il breve lasso di tempo dell'esperimento. I dati rappresentano la regione lineare iniziale dell'esperimento di cinetica.
- Determinare la pendenza tracciando la pressione rispetto al tempo e utilizzando una formula di pendenza o una regressione lineare. Traccia la pressione in qualsiasi unità comune.
- La pendenza è la velocità iniziale in unità dipressione O2/s.
- Determinazione dell'ordine di reazione
- Poiché la pressione di O2 evoluto è direttamente proporzionale alle moli di H2O2decomposte, tracciando il ln(velocità iniziale) vs. ln[H2O2]0 si ottiene una pendenza equivalente all'ordine della reazione. La concentrazione iniziale di perossido di idrogeno, [H2O2]0, è quella utilizzata in ciascuna delle prove.
- L'equazione per la legge del tasso è
 . Prendendo il logaritmo naturale (ln) dell'equazione si produce un'equazione lineare
. Prendendo il logaritmo naturale (ln) dell'equazione si produce un'equazione lineare  , dove m, la pendenza, è l'ordine della reazione.
, dove m, la pendenza, è l'ordine della reazione.
- L'equazione per la legge del tasso è
- Poiché la pressione di O2 evoluto è direttamente proporzionale alle moli di H2O2decomposte, tracciando il ln(velocità iniziale) vs. ln[H2O2]0 si ottiene una pendenza equivalente all'ordine della reazione. La concentrazione iniziale di perossido di idrogeno, [H2O2]0, è quella utilizzata in ciascuna delle prove.
- Determinazione della costante di velocità, k
- Per ogni prova, convertire la velocità, PO2/s, in unità di atm/s se la velocità è in un'unità diversa come torr/s.
- Poiché le bolle si sono evolute in soluzione acquosa, sottrarre la pressione di vapore dell'acqua dalla pressione del sistema per ogni prova. Il nuovo tasso riflette solo la pressione dovuta all'evoluzione dell'ossigeno.
- Applicare la legge del gas ideale per convertire il tasso da atm/s in moli/s in ogni prova.
- Riorganizzare PV = nRT in n = PV/RT. L'unità s-1 rimane invariata. Il volume è equivalente al volume della provetta meno il volume della soluzione (50 ml).
- Utilizzare la reazione chimica bilanciata per convertire da moli di ossigeno prodotti a moli di perossido di idrogeno decomposto in ogni prova.
- Dividere i moli di H2O2 per il volume della soluzione, 0,050 L, per ottenere la molarità di H2O2 decomposo al secondo, [H2O2]/s.
- Poiché questo esperimento segue la cinetica del primo ordine, dividere la velocità, [H2O2]/s, per la concentrazione originale della soluzione per ogni prova, [H2O2]0, per ottenere una costante di velocità, k. Questa soluzione per la costante di velocità varierebbe leggermente in base all'ordine della reazione precedentemente determinato.
- Media le costanti di velocità per ogni prova insieme poiché la temperatura è costante.
Tutte le reazioni chimiche hanno una velocità specifica, che definisce la velocità con cui i reagenti si trasformano in prodotti.
Le reazioni chimiche sono governate da due fattori: cinetica e termodinamica. I fattori termodinamici spiegano se si verificherà o meno una reazione e se assorbe o emette energia durante il processo.
La cinetica si riferisce alla velocità di una reazione chimica e alla velocità con cui il sistema raggiunge l'equilibrio. La cinetica di una reazione è descritta dalla legge della velocità cinetica, che definisce la velocità in base a una costante di velocità di reazione, alla concentrazione dei componenti e all'ordine della reazione.
Questo video introdurrà la cinetica di reazione utilizzando l'equazione della legge di velocità e dimostrerà come determinare la legge di velocità per una determinata reazione in laboratorio.
Per una reazione generale, la velocità di reazione è uguale alla velocità costante volte le concentrazioni dei reagenti, ciascuno elevato a un ordine di reazione. La costante di velocità, k, è fissa per una reazione a una data temperatura.
Gli ordini di reazione sono indipendenti dai coefficienti stechiometrici. Invece dipendono dal meccanismo di reazione e illustrano come la velocità è correlata alla concentrazione di reagenti. Ad esempio, se la velocità di reazione è invariata quando la concentrazione di "A" raddoppia, la reazione non dipende dalla concentrazione e l'ordine è zero.
Se la velocità raddoppia quando la concentrazione del reagente "A" raddoppia, allora la reazione è di primo ordine rispetto a "A". Lo stesso comportamento è vero per il reagente "B". L'ordine complessivo di una reazione è la somma dei singoli ordini di reazione per ciascun reagente.
Durante una reazione, la concentrazione di reagenti cambia con il tempo. Si noti che l'equazione del tasso di base non include il tempo come variabile e può solo mettere in relazione il tasso e la concentrazione in un punto temporale specifico. Tuttavia, la velocità cambia man mano che la reazione procede e quando i reagenti si esauriscono. L'uso di una legge di tasso differenziale può mettere in relazione il cambiamento di concentrazione con il tempo.
La legge della velocità per una reazione deve essere determinata sperimentalmente, quando una reazione chimica è attentamente controllata a una temperatura costante e la concentrazione dei reagenti o dei prodotti misurata a intervalli di tempo specifici. Poiché le misurazioni della concentrazione vengono effettuate in punti temporali discreti, la legge della velocità differenziale è difficile da correlare ai dati sperimentali.
L'integrazione della legge differenziale dei tassi si traduce in un'equazione più semplice, chiamata legge dei tassi integrata. La legge della velocità integrata confronta le concentrazioni di reagenti all'inizio della reazione e in un momento specificato.
L'equazione della legge di velocità integrata varia a seconda dell'ordine della reazione. Queste equazioni possono assumere la forma lineare y=mx+b. Quindi, un grafico di concentrazione vs tempo produce un grafico lineare per un'equazione di ordine zero, un grafico del registro naturale di concentrazione vs tempo produce un grafico lineare per un'equazione del primo ordine e così via. Adattando i dati sperimentali a queste equazioni, l'ordine di una reazione può essere facilmente determinato. La costante di velocità, k, può quindi essere determinata utilizzando la pendenza della linea. Infine, le unità di k variano a seconda dell'ordine della reazione. Per una reazione di ordine zero, le unità sono moli per litro al secondo, per una reazione di primo ordine, le unità sono secondi inversi e per una reazione di secondo ordine le unità sono litro per mole al secondo.
Ora che le basi delle leggi della velocità cinetica sono state spiegate, diamo un'occhiata a come determinare sperimentalmente la legge del tasso per la decomposizione del perossido di idrogeno in acqua e ossigeno.
In questo esperimento, viene esplorata la decomposizione catalitica del perossido di idrogeno su un catalizzatore di platino.
In primo luogo, preparare 5 diluizioni di perossido di idrogeno, come mostrato nella tabella. In questo caso, le concentrazioni vanno da 0,882 a 0,176 M, utilizzando una soluzione stock al 3% o 0,882 M. Lasciare che le soluzioni si equilibrano a temperatura ambiente.
Quindi, preparare il recipiente di reazione utilizzando una provetta. Per prima cosa determina il volume riempiendo una grande provetta verso l'alto con acqua. Quindi, inserire un tappo di gomma a 1 foro fino a quando non è stretto e l'acqua spinge fuori dal foro attraverso la parte superiore.
Rimuovere il tappo e versare l'acqua in un cilindro graduato per misurare il volume esatto. Questo è il volume del vaso di reazione.
Quindi, versare 50 ml della prima soluzione di perossido di idrogeno nella provetta, quindi posizionare il tubo nel bagno d'acqua a 25 °C. Una volta bilanciato, aggiungere un disco di reazione rivestito in platino e sigillare il sistema con un tappo collegato a un sensore di pressione del gas.
Poiché uno dei prodotti è ossigeno gassoso, l'aumento della pressione nel sistema viene utilizzato per misurare l'aumento di ossigeno. Impostare il sensore di pressione per acquisire dati a 2 punti per s, quindi eseguire l'esperimento per 120 s. Le bolle dovrebbero essere visibili quando il perossido si decompone in ossigeno gassoso e acqua.
Al termine del periodo di reazione, rilasciare la pressione e smaltire la soluzione di perossido. Risciacquare il tubo, quindi riempire il tubo con la successiva soluzione di perossido di idrogeno. Ripetere la misurazione della pressione del gas per tutte le soluzioni.
Traccia la pressione rispetto ai dati temporali per ogni soluzione. La pressione dell'ossigeno evoluto è direttamente proporzionale alle moli di ossigeno formate secondo la legge del gas ideale. Dopo la reazione chimica, le moli di ossigeno formate possono essere utilizzate per calcolare le moli di perossido di idrogeno decomposto. In primo luogo, supponiamo che la concentrazione di perossido di idrogeno non sia cambiata in modo significativo durante la breve durata dell'esperimento. Pertanto, i dati tracciati rappresentano solo la regione iniziale dell'esperimento di cinetica.
Determinare la pendenza di ciascun set di dati utilizzando una regressione lineare. La pendenza è uguale alla velocità di reazione iniziale in unità di pressione di ossigeno al secondo.
Successivamente, traccia del registro naturale della velocità di reazione iniziale rispetto al registro naturale della concentrazione iniziale di perossido. La pendenza è uguale all'ordine di reazione, m, ed è approssimativamente uguale a uno. Pertanto, la reazione è di primo ordine.
Il tasso per ogni prova è in unità di pressione in Torr, al secondo. Per determinare la costante di velocità, convertire prima la velocità in unità di atmosfere al secondo. Poiché le bolle si sono evolute nella soluzione acquosa, sottrarre la pressione di vapore dell'acqua dalla pressione del sistema per ogni prova. La nuova velocità riflette quindi solo la pressione dovuta all'evoluzione dell'ossigeno.
Applicare la legge del gas ideale per convertire il tasso da atmosfere di per sé a talpe per s per ogni prova. Due volte le moli di ossigeno prodotte sono uguali alle moli di perossido di idrogeno decomposto, secondo la stechiometria di reazione chimica. Quindi, utilizzare il volume di reazione per convertire le unità della velocità in molarità al secondo.
Determinare le costanti di velocità per ogni prova dividendo il tasso in molarità per s per la concentrazione iniziale. In questo esperimento, la costante di velocità media, k, è di circa 1,48 x 10-4 per s. La reazione è di primo ordine, nota dal log naturale - grafico del log naturale mostrato in precedenza. Pertanto, la legge sulle tariffe può essere scritta come mostrato.
Ora che hai esaminato come determinare la legge del tasso per una reazione chimica, diamo un'occhiata ad alcune aree in cui viene applicato questo concetto.
Le reazioni chimiche sono utilizzate nella sintesi di composti e materiali utilizzati in una vasta gamma di applicazioni scientifiche. È importante comprendere la velocità di reazione in queste fasi di sintesi, al fine di controllare l'avanzamento di una reazione.
Ad esempio, la sintesi di nanocristalli e nanorod di seleniuro di cadmio procede attraverso una serie di reazioni chimiche. Ogni reazione ha una propria velocità di reazione discreta, e quindi la fase di sintesi è attentamente controllata in base alla velocità di conoscenza della reazione; alcuni lenti e altri molto veloci.
La legge della velocità di reazione può anche essere usata per descrivere il decadimento radioattivo e determinare l'emivita del materiale radioattivo. L'emivita si riferisce alla quantità di tempo necessaria affinché la concentrazione di un materiale scenda a metà della sua concentrazione iniziale.
La radioattività segue la cinetica del primo ordine, il che significa che il tempo necessario affinché il materiale radioattivo decada a un livello sicuro può essere caratterizzato molto bene, consentendo un corretto trasporto e stoccaggio di materiale radioattivo e rifiuti radioattivi.
Simile ai materiali radioattivi, i farmaci hanno anche un'emivita e si degradano nel corpo. Ad esempio, alcuni farmaci hanno costanti di tasso elevato, il che significa che si degradano rapidamente e devono essere assunti frequentemente. La conoscenza di questo tasso di degradazione consente la determinazione del dosaggio, dell'uso e del metodo di consegna appropriati.
Hai appena visto l'introduzione di JoVE ai tassi di reazione. Ora dovresti capire i diversi ordini di reazioni chimiche, come si relazionano alle velocità di reazione chimica e come determinare la legge di velocità per una determinata reazione chimica in laboratorio.
Grazie per l'attenzione!
Subscription Required. Please recommend JoVE to your librarian.
Results
Dati sull'evoluzione dell'ossigeno e tassi iniziali

Figura 1. Dati di pressione e tempo per ogni prova a temperatura costante. La pendenza è equivalente alla velocità istantanea della reazione.
Ordine di reazione
- I dati per cinque prove e il grafico con pendenza sono riportati di seguito (Tabella 2, Figura 2). La pendenza di 0,9353 ≈ 1, è un valore intero dell'ordine di reazione.

Tabella 2. Risultati di 5 studi H2O2.

Figura 2. Grafico naturale del log di concentrazione vs. tasso. La pendenza è equivalente all'ordine della reazione.
Costante di velocità, k
- Calcola la velocità in mol O2/s usando la legge del gas ideale sottraendo prima la pressione di vapore dell'acqua a 294 K (temperatura dell'esperimento cinetico), 18,7 torr.
- Calcolare la costante di velocità dividendo la velocità, [H2O2]/s per la concentrazione iniziale di [H2O2]0.

Tabella 3. Calcolo della costante di velocità, k.
- La costante di velocità media, 2,25 x 10-4 s-1 indica che la reazione è di primo ordine in base alle unità. La legge del tasso potrebbe essere riscritta come: tasso = 2,25 x 10-4 s-1[H2O2]0
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Mentre la determinazione delle variabili della legge del tasso può essere coinvolta matematicamente, i metodi sono in realtà abbastanza semplici. Finché è possibile misurare la scomparsa di un reagente o l'aspetto di un prodotto, i grafici di velocità possono essere utilizzati per calcolare la costante di velocità. Un'estensione di questo metodo viene spesso utilizzata per determinare l'energia di attivazione diunareazione, E a , misurando la velocità e calcolando la costante di velocità a una varietà di temperature. Questo metodo prevede l'uso dell'equazione di Arrhenius, k = Ae(-Ea/RT). La combinazione della legge della velocità, incluso l'ordine di reazione, con l'energia di attivazione di una reazione fornisce un profilo cinetico completo per quanto velocemente (o lentamente) una reazione progredisce e fornisce informazioni del mondo reale su come fattori come la temperatura e la concentrazione possono influenzare quella reazione.
La cinetica chimica trova applicazioni in industrie e campi diversi come quello farmaceutico, la sicurezza nucleare, il risanamento ambientale e i filtri solari. Ad esempio, un certo farmaco può avere una costante di velocità molto grande, il che significa che decade molto rapidamente nel corpo. Ciò influisce sull'utilizzo, sul dosaggio e sul metodo di consegna. Per quanto riguarda la scienza nucleare, la radioattività segue la cinetica del primo ordine, il che significa che il tempo necessario affinché il materiale nucleare decada a un livello sicuro è molto ben caratterizzato. Le misurazioni sarebbero molto simili al metodo qui presentato e potrebbero anche essere applicate al decadimento di molti inquinanti ambientali. Allo stesso modo, anche i filtri solari decadono con profili cinetici noti che consentono ai produttori di informare i consumatori in quanto tempo la protezione solare deve essere applicata per mantenere livelli di sicurezza.
Subscription Required. Please recommend JoVE to your librarian.
References
- Method adapted from Vetter, T. A., Colombo, D. P. Jr. Kinetics of Platinum-Catalyzed Decomposition of Hydrogen Peroxide, J. Chem. Ed. 80 (7), 788-798 (2003).
- David R. Lide, ed. CRC Handbook of Chemistry and Physics. Boca Raton, Florida: CRC Press (2005).





 . Prendendo il logaritmo naturale (ln) dell'equazione si produce un'equazione lineare
. Prendendo il logaritmo naturale (ln) dell'equazione si produce un'equazione lineare  , dove m, la pendenza, è l'ordine della reazione.
, dove m, la pendenza, è l'ordine della reazione.