Overview
Quelle: Labor von Dr. Dana Lashley - College of William and Mary
Demonstration von: Matt Smith
Wenn neue Anleihen im Verlauf einer chemischen Reaktion entstehen, erfordert es, dass die beteiligten Spezies (Atome oder Moleküle) in unmittelbarer Nähe kommen und miteinander kollidieren. Die Zusammenstöße zwischen diesen Arten sind häufiger und effektiver je höher die Geschwindigkeit mit dem diese Moleküle bewegen. Eine weit verbreitete Faustregel, hat seine Wurzeln in der Arrhenius Gleichung1, Staaten, die Erhöhung der Temperatur um 10 K etwa verdoppelt die Rate einer Reaktion, und Erhöhung der Temperatur von 20 K wird die Rate vervierfachen:
(1)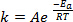
Gleichung (1) findet sich oft in ihrer logarithmischen Form:
(2)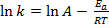
wo k ist die Rate der chemischen Reaktion, A ist der Frequenzfaktor (in Bezug auf die Häufigkeit der molekulare Kollisionen) Eein ist für die Reaktion erforderliche Aktivierungsenergie, R ist die ideale Gaskonstante und T ist die Temperatur, bei der die Reaktion stattfindet.
Eine höhere Temperatur bedeutet daher, dass eine Reaktion viel schneller abgeschlossen ist. Jedoch in einigen Fällen ist es wünschenswert, Reaktionen bei niedrigen Temperaturen, trotz der senkende Wirkung auf die Rate der Reaktion durchzuführen. Einige Szenarien sind in diesem Zusammenhang erläuterten weiter unten.
Wenn es sinnvoll, eine Reaktion unter Raumtemperatur ausgeführt wird, verwenden Chemiker kühlende Bäder um eine bestimmte Temperatur oder Temperaturbereich beizubehalten. Durch die Platzierung der Reaktionskolben innerhalb einer entsprechenden kühlendes Bad sind Reaktionen auf eine gewünschte Temperatur abgekühlt. Die Reagenzien in der Reaktion kommen nie in direktem Kontakt mit den Chemikalien in das kühlende Bad. Das kühlende Bad kann bestehen aus einem kryogenen (Kühlung) Bauteil (z. B. Eis, Trockeneis oder flüssigem Stickstoff) oder möglicherweise eine Mischung der kryogenen Komponente mit einem bestimmten Lösungsmittel und/oder ein Additiv Salz. Das Lösungsmittel soll effektiv Temperatur das Kühlmittel auf der Reaktionskolben zu übertragen, und der Zweck des Zusatzstoffes ist der Gefrierpunkt des Gemisches zu senken (oder drücken). (Beachten Sie, dass es möglich ist für einen Stoff ein Lösungsmittel und Zusatzstoff sein.)
Principles
Daran erinnern Sie, dass wenn eine Lösung bei einer niedrigeren Temperatur als die reine Flüssigkeit gefriert, ist dies durch eine colligative Eigenschaft, bekannt als Gefrierpunkt Depression verursacht. Die senkende Wirkung auf den Gefrierpunkt ist proportional zur Menge des gelösten Stoffes (additive), die eine flüssige Lösungsmittel hinzugefügt wird. Dieser Effekt wird durch Gleichung (3) beschrieben:
(3) ΔDTf = Tf (Lösungsmittel) − Tf (Lösung) = Km × w
Δ DT f ist der Gefrierpunkt Depression und wird durch den Unterschied in der eisigen Temperatur des Lösungsmittels von selbst, und dass die Lösung mit Zusatz/gelösten beschrieben.
K f ist der Gefrierpunkt Depression Konstante für das System und m das Einheitensymbol für die Lösung. Chemiker verwenden Sie diesen Effekt zur Geltung, um eine Vielfalt von unterschiedlichen Temperaturen mit relativer Leichtigkeit und Wirtschaftlichkeit zu schaffen.
Die Temperaturen erreicht durch Abkühlung Bäder können schwanken. Das Bad muss überwacht werden und bei Bedarf Anpassungen. Um beste Ergebnisse zu erzielen sollte das Bad Schiff selbst gut isoliert sein. Falls verfügbar, sollte ein Dewar-Fläschchen für das kühlende Bad verwendet werden. In Abwesenheit einer Dewar-Flasche ist es möglich, das Bad in einem Glas oder Kautschuk Gefäß, mit dem Behälter isoliert so gut wie möglich (z.B. mit Alufolie oder ein Handtuch) einzurichten. Das Schiff muss Thermo-Stall auf der gewünschten Temperatur und sollte nicht zu knacken.
Viele verschiedenen Bad-Variationen gibt es für das relativ kostengünstig und einfach erreichen der unterschiedlichen Temperaturen unterhalb der Raumtemperatur im chemischen Labor.
- Bei Temperaturen knapp unter Null (aber wenn nötig bis zu - 55 ° C) wird eine Eis-Wasserbad mit verschiedenen Zugabe von Salzen dienen.
- Für Temperaturen bis zu-78 ° C werden trocken-Eis-Bäder in verschiedenen Lösungsmitteln eingesetzt.
- Temperaturen unter-78 ° C bis-196 ° C erhalten Sie durch Verwendung von flüssigem Stickstoff.
Diese kühlende Bäder einrichten ist relativ einfach und die Verfahren sind am Ende dieses Dokuments.
Eis-Wasser-Bäder
Diese Art des Bades ist sehr einfach einzurichten und in jedem Bachelor Lehrlabor. Es gibt viel Flexibilität in der Art von Bad Gefäß zu verwenden, weil Eis-Bäder nicht sehr tiefen Temperaturen erreichen und keine Gefahr besteht der Rissbildung eines Schiffes.
Während Eiswasser selbst eine Temperatur von 0 ° C hat, kann eine Schmelzpunkt Depression durch Zugabe von bestimmten Salzen wie NaCl, MgCl2 oder CaCl2erreicht werden. Die erreichten endgültigen Temperaturen variieren und können durch die Menge an Additiv pro 100 g Eis eingestellt werden. Eine gemeinsame Eisbad ist eins mit NaCl als Zusatz an 33 g NaCl pro 100 g Eis hinzugefügt. Die Endtemperatur erreicht auf diese Weise ist etwa-20 ° C. Die kälteste Temperatur, die ein Eis-Wasserbad erreichen kann ist etwa-55 ° C, die durch die Zugabe von 143 g CaCl2 Hexahydrat pro 100 g Eis gewonnen wird.
Trocken-Eis-Bäder
Trockeneis ist festes Kohlendioxid und defilieren bei einer Temperatur von-78 ° C. Es ist ein ziemlich billig Kältemittel und leicht zugänglich in vielen Laboratorien. Für effiziente Wärmeübertragung von dieser Temperatur an einem Reaktionsgefäß, ein Lösungsmittel erforderlich ist, hat einen Schmelzpunkt von unter-78 ° C. Lösungsmittel mit einem höheren Schmelzpunkt oder mp (besser bezeichnet als Gefrierpunkt in diesem Fall) können auch verwendet werden und führen zu einer höheren Temperatur.
Ein Lösungsmittel, die oft in einem trocken-Eis-Bad verwendet wird ist Aceton (mp =-95 ° C), die ist leicht verfügbar und preiswert. Ein trocken-Eis-Bad in Aceton hält eine Temperatur von-78 ° C für einen Zeitraum von Zeit, deren Länge richtet sich nach dem Grad der Isolierung. Dies ist die häufigste trocken-Eis-Bath-System.
Für höhere Temperatur trocken-Eis-Bäder sind mit höheren Einfrieren Punkte Lösemittel. Die erworbenen Badtemperatur entspricht nicht immer den Gefrierpunkt des Lösungsmittels. Temperaturen, die durch die verschiedenen Systeme finden Sie unter Tabelle 2 .
Aufgrund der niedrigen Temperaturen erreicht durch diese Art des Bades sollten kryogene Schutzhandschuhe immer getragen werden, beim Umgang mit Trockeneis.
Das Bad-Schiff für ein trocken-Eis-Bad ist im Idealfall ein Dewar. Wenn ein Dewar nicht verfügbar ist, wird ein Glas, Kautschuk oder Edelstahl Schiff verwendet, aber beachten Sie, dass die Isolierung werden nicht sehr optimal und das Bad wird immer häufiger angepasst werden müssen.
| Trockeneis Bad Kühltemperaturen | |
| Mischung | T (° C) |
| p-Xylol/Trockeneis | + 13 |
| Cyclohexan/Trockeneis | + 6 |
| Benzol/Trockeneis | + 5 |
| Ethylenglykol/Trockeneis | -15 |
| Carbon Titantetrachlorid/Trockeneis | -23 |
| 3-Heptanone/Trockeneis | -38 |
| Acetonenitrile/Trockeneis | -42 |
| Cylcohexanone/Trockeneis | -46 |
| Diethyl Carbitol/Trockeneis | -52 |
| Chloroform/Dry ice | -61 |
| Carbitol Acetat/Trockeneis | -67 |
| Ethanol/Trockeneis | -72 |
| Aceton/Trockeneis | -78 |
| Isopropanol/Trockeneis | -78 |
Tabelle 2. Liste der verschiedenen Mischungen trocken-Eis-Bad.
Flüssiger Stickstoff-Bäder
Flüssigem Stickstoff Schneematsch Bäder werden verwendet, wenn sehr niedrige Temperaturen, unter der ein trocken-Eis-Bad gewünscht werden. Flüssiger Stickstoff ist ein Kältemittel mit einem Schmelzpunkt von-196 ° C, was ist die Temperatur des Bades, wenn keine zusätzlichen Lösungsmittel verwendet wird. Beachten Sie, dass im Gegensatz zu Trockeneis, N2 ist eine Flüssigkeit und die Verwendung von einem Additiven Lösungsmittel für gleichmäßige Wärmeübertragung ist nicht notwendig. Wenn eine höhere Temperatur als-196 ° C gewünscht wird, ist eine Vielzahl von verschiedenen organischen Lösungsmitteln für Mischungen verwendet, die führt bei verschiedenen Temperaturen, ähnlich wie der Fall mit trocken-Eis-Bad war. Temperaturen, die durch die verschiedenen Systeme finden Sie unter Tabelle 3 .
Aufgrund der sehr niedrigen Temperaturen flüssig N2 Bäder nur ein Dewar sollte als der Bad-Behälter verwendet werden und arbeiten Sie immer mit Handschuhen beim Umgang mit diesem Kältemittel.

Tabelle 3. Liste von flüssigem Stickstoff Bäder mit unterschiedlichen Lösungsmitteln. 2
Subscription Required. Please recommend JoVE to your librarian.
Procedure
Kühlende Bad Einrichtung
Bereiten Sie für eine allgemeine Konfiguration kühlende Bad Wahl vor, wie unten beschrieben und Tauchen Sie den Reaktionskolben in die Wanne (Abbildung 1). Füllen Sie nicht ganz Bad Behälter, aber lassen Sie genügend Platz zum Eintauchen der Reaktionskolben zu ermöglichen.
Hinweis: Wenn Feuchtigkeit empfindlich reagiert, seien Sie vorsichtig, wenn Sie die Flasche oder einem anderen Teil des Geräts (z. B. einen Tropftrichter) Reagenzien hinzufügen. Wenn eine Öffnung entsteht, während die Glaswaren in kühlendes Bad eingetaucht ist, dann Zimmertemperatur Luft schnell fließt innen und führt Feuchtigkeit in.

Abbildung 1. Beispiel für eine kühlende Bad Set-up in einem drei-Hals Rundboden Kolben mit Tropftrichter, Thermometer unter inerter Atmosphäre.
1. machen ein Eis-Wasserbad
- Für ein Eis-Wasserbad mit einem Zusatz wiegen und Bad Gefäß der Wahl die entsprechende Menge an Eis hinzufügen. Ein Dewar ist hilfreich aber nicht notwendig. Das Schiff kann werden Kunststoff-, Gummi-(z.B. einen Eimer) oder Glas (z.B. ein großes Kristallisation Gericht). Fügen Sie 500 g Eis für dieses Experiment ein 1 L Gefäß hinzu.
- Wiegen Sie die entsprechende Menge an Additiv Beratung ein Eisbad (Tabelle 1), und das Eis fügen Sie das Additiv hinzu. Für dieses Experiment wiegen und der Bad-Behälter 165 g (= 5 x 33 g) NaCl hinzufügen.
- Das Bad-Schiff eine kleine Menge entionisiertem Wasser hinzu und rühren Sie gründlich mit einem rühren Stab. Fügen Sie gerade genug Wasser hinzu, bis das Eis bedeckt ist.
- Erkundigen Sie sich bei einem Thermometer um sicherzustellen, dass die gewünschte Temperatur erreicht ist. Nachstellen Sie die Menge des Zusatzstoffs ggf.. Das Bad wird nicht seine Temperatur sehr lange beibehalten und Anpassungen in kurzen Abständen von ca. alle 20-30 min gemacht werden müssen. Dafür ist es möglicherweise erforderlich, pipette etwas von dem Wasser in der Badewanne und mehr Eis und Additiv.
| Substanz | G/100 g H2O | Endtemperatur (° C) |
| Na2CO3 | 20 | -2,0 |
| NH4Nr.3 | 106 | -4,0 |
| NaC2H3O2 | 85 | -4,7 |
| NH4Cl | 30 | -5,1 |
| NaNO3 | 75 | -5,3 |
| Na2S2O3 ● 5 H2O | 110 | -8.0 |
| CaCl2 ● 6 H2O | 41 | -9.0 |
| KCl | 30 | -10.9 |
| KI | 140 | -11.7 |
| NH4Nr.3 | 60 | -13.6 |
| NH4Cl | 25 | -15.4 |
| NH4Nr.3 | 45 | -16.8 |
| NH4SCN | 133 | -18.0 |
| NaCl | 33 | -21,3 |
| CaCl2 ● 6 H2O | 81 | -21.5 |
| H2SO4 (66,2 %) | 23 | -25 |
| NaBr | 66 | -28 |
| H2SO4 (66,2 %) | 40 | -30 |
| C2H5OH (4°) | 105 | -30 |
| MgCl2 | 85 | -34 |
| H2SO4 (66,2 %) | 91 | -37 |
| CaCl2 ● 6 H2O | 123 | -40.3 |
| CaCl2 ● 6 H2O | 143 | -55 |
Tabelle 1. Salz/Eis kühlende Mischungen, die durch das Mischen der Salze mit Wasser oder Eis bei den angegebenen Temperaturen und in den angegebenen Mengen gewonnen werden. 1
(2) macht ein Trockeneis Bad
- Kryogene Schutzhandschuhe und Schutzbrille aufsetzen. Üben Sie dies immer im Umgang mit Trockeneis und nie mit bloßen Händen berühren Sie, denn es kann schnell die Haut verbrennen und Erfrierungen verursachen.
- Für einen Bad-Behälter mit einem Volumen von ca. 1 L ca. 1/3 aus einem Block von Trockeneis (in der Regel in ~ 2 lb Blöcke verfügbar) zu nehmen und in ein paar kleinere Stücke brechen.
- Fügen Sie die Stücke von Trockeneis der Bad-Behälter.
- Fügen Sie langsam das organische Lösungsmittel (z.B. Aceton hinzu), das Trockeneis unter ständigem Rühren mit einem Glasstab. Gibt es eine kräftige zischt durch CO2 -Gas-Entwicklung.
- Weiterhin langsam Lösungsmittel hinzufügen und rühren, bis eine homogene Gülle-Formen und die meisten von Trockeneis löst. Dies soll sicherstellen, dass die Wärmeübertragung auf den Reaktionskolben möglichst einheitlich ist.
- Legen Sie einen kalten Temperatur Thermometer in die Wanne um sicherzustellen, dass die gewünschte Temperatur erreicht ist.
- Auf dem trocken-Eis-Bad in regelmäßigen Abständen zu überprüfen Sie, und fügen Sie weitere Stücke von Trockeneis bei einem Anstieg der Temperatur fällt. Die Intervallzeit hängt vom Grad der Isolierung, aber ist in der Regel um alle 45 – 60 Minuten.
(3) macht ein Bad von flüssigem Stickstoff
- Kryogene Schutzhandschuhe und Schutzbrille aufsetzen. Immer üben Sie dies im Umgang mit flüssigen Stickstoff wie es schnell Hautgewebe und Auge Flüssigkeiten, Erfrierungen oder bleibende Augenschäden verursachen brennen kann.
- Für ein Bad ohne Zusatzstoffe die entsprechende Menge an N2 Hinzufügen eines Dewar zu einer Temperatur von-196 ° C. Fahren Sie mit Schritt 3.3, wenn dies die gewünschte Temperatur ist.
- Für ein Bad mit Zusätzen zuerst die Dewar ein organisches Lösungsmittel der Wahl (siehe Tabelle 3 , das richtige Lösungsmittel für die richtige Temperatur zu finden) hinzufügen, und dann langsam das Lösungsmittel Flüssigkeit N2 hinzufügen.
- Legen Sie einen kalten Temperatur Thermometer in die Wanne um sicherzustellen, dass die gewünschte Temperatur erreicht ist. Im Gegensatz zu den anderen Bädern hält N2 Flüssigkeitsbad innerhalb eines Dewar seine Temperatur für Stunden zu einer Zeit.
- Aktivieren Sie das Bad in angemessenen Abständen (wenige Stunden) um festzustellen, ob weitere N2 benötigt wird.
Bestimmte chemischen Reaktionen müssen unterhalb der Raumtemperatur für die Sicherheit oder das gewünschte Produkt zu erhalten durchgeführt werden.
Ein kühlendes Bad ermöglicht ein System für die Dauer der Reaktion auf einen bestimmten Temperaturbereich gehalten werden. Dies wird erreicht, indem man den Reaktionskolben ins Bad, kühlen die Reaktion ohne jemals direkten Kontakt mit den Reagenzien.
Das Bad ist in der Regel ein gut isoliertes Gefäß wie ein Dewar-Fläschchen mit der kryogenen Komponenten notwendig, um die gewünschte Temperatur zu erreichen. In einfachen Setups wie diese Temperatur ist nicht stabil, und das Bad muss überwacht und angepasst während des Verfahrens.
Dieses Video entdecken die verschiedenen kühlende Bäder regelmäßig genutzt, um Reaktionen unterhalb der Raumtemperatur durchzuführen.
Während einer chemischen Reaktion muss die Tierart für neue Anleihen zu kollidieren. Erhöhung der Temperatur erhöht die innere Energie des Systems und bewirkt dieser Arten zu schneller bewegen, was bedeutet, dass sie häufiger kollidieren werden. Infolgedessen gehen schneller Reaktionen bei höheren Temperaturen.
In einigen Fällen ist es jedoch wünschenswert, Reaktionen bei niedrigen Temperaturen, trotz der Senkung der Rate der Reaktion durchzuführen. Zum Beispiel einige Reaktionen sind auch kräftig und gekühlt werden müssen, um zu verhindern, verschütten und bauen Sie Druck. Stark exotherme Reaktionen könnte auch schnell überkochen und herausspritzen, wenn nicht gekühlt, erstellen ein Sicherheitsrisiko.
Kühlung kann genutzt werden, um einen wirtschaftlichen Vorteil zu bieten. Zum Beispiel spart verhindern, dass das Kochen von einem Lösungsmittel oder die Zersetzung des Reagens Zeit und Ressourcen.
Kühlung wird auch häufig verwendet, um Kontrolle welches Produkt wird durch eine Reaktion, die im Wettbewerb hat ergab Wege. In diesen Reaktionen wird der Weg mit der niedrigere Aktivierungsenergie bei niedrigeren Temperaturen erzeugt, während der Weg mit der höheren Aktivierungsenergie bei höheren Temperaturen bevorzugt wird.
Nun, da Sie die Bedeutung der laufenden Reaktionen unterhalb der Raumtemperatur zu verstehen, werfen wir einen Blick auf verschiedene Arten der Kühlung Bäder vorbereiten.
Eis-Wasser-Bäder sind einfach einzurichten, und gibt es in jeder Lehre Chemielabor. Während Eiswasser selbst eine Temperatur von 0 ° C hat, kann eine Schmelzpunkt Depression durch Zugabe von bestimmten Salzen erreicht werden.
Dies ermöglicht Eiswasser Bäder zum Erreichen einer Temperatur von-40 ° C. Die Endtemperatur ist einstellbar durch erhöhen oder verringern die Konzentration des Salzes Additiv.
Einrichten einer Eis-Wasserbad, beginnen durch wiegen die entsprechenden Beträge aus Eis und Salz Additiv, dargelegt in der Eis-Bad-Tabelle in Text Protokoll gefunden.
Fügen Sie das Salz, das Eis. Gießen Sie eine kleine Menge entionisiertem Wasser in den Behälter. Mit einem Rührstäbchen, das Bad gründlich mischen.
Nun, da das Bad eingerichtet wurde, überprüfen Sie mit einem Thermometer um sicherzustellen, dass die gewünschte Temperatur erreicht ist. Wenn es nicht hat, mehr Salz als nötig. Wenn die richtige Temperatur erreicht ist, legen Sie das Reaktionsgefäß in das Eisbad.
Eis-Wasser-Bäder nicht behalten ihre Temperatur lange und müssen alle 20-30 min eingestellt. Um die Solltemperatur zu halten, ist es möglicherweise erforderlich, entfernen das flüssige Wasser und mehr Eis und Salz dazugeben.
Für Temperaturen bis zu-78 ° C sind Trockeneis Bäder genutzt. Trockeneis ist festes Kohlendioxid, so effiziente Wärmeübertragung von ihm auf einem Reaktionsgefäß Lösungsmittel benötigt. Da Trockeneis bei-78 ° C sublimiert, muss ein Lösungsmittel mit einem Gefrierpunkt unter dem verwendet werden, wenn diese Temperatur erreicht werden soll. Lösungsmittel mit höheren Einfrieren Punkten können genutzt werden, um wärmere Trockeneis Bäder zu erstellen. Zur Vorbereitung einer Trockeneis Bad zunächst kryogenen Schutzhandschuhe und Schutzbrille aufsetzen. Lassen Sie niemals Trockeneis Touch nackte Haut.
Erhalten Sie für eine 1 L-Bad ca. 1/3 aus einem Block von Trockeneis und brechen sie in kleinere Stücke in den Behälter.
Fügen Sie langsam das ausgewählten organische Lösungsmittel, das Trockeneis unter ständigem Rühren mit einem Glasstab. Es werden eine kräftige zischt wie Kohlendioxid-Gas entwickelt.
Weiterhin langsam fügen Lösungsmittel und rühren, bis die meisten das Trockeneis löst sich auf und bilden eine homogene Gülle. Dies sorgt dafür, dass die Wärmeübertragung an den Reaktionskolben möglichst einheitlich ist.
Mit einem kalten Temperatur Thermometer oder Thermoelement, sicherzustellen Sie, dass das Bad die gewünschte Temperatur erreicht hat, dann legen Sie den Reaktionsbehälter ins Bad.
Überwachen Sie das Bad in regelmäßigen Abständen zu, und fügen Sie Stücke von Trockeneis hinzu, wenn ein Anstieg der Badtemperatur bemerkt wird.
Schließlich wenn die gewünschte Badetemperatur liegt unter welchem Trockeneis bieten kann, wird flüssiger Stickstoff verwendet. Flüssiger Stickstoff hat einen Schmelzpunkt von-196 ° C und Lösungsmittel sind nur erforderlich, wenn wärmere Bäder zu erstellen.
Aufgrund der extrem niedrigen Temperaturen von flüssigem Stickstoff ist ein Dewar das einzig akzeptable Schiff.
Um ein flüssig-Stickstoff-Kühlung-Bad vorzubereiten, indem auf Schutzbrille und Schutzhandschuhe kryogenen beginnen. Vorsicht beim Umgang mit flüssigen Stickstoff, da es Erfrierungen und bleibende Augenschäden verursachen kann.
Für ein Bad mit Zusätzen bestimmen der geeigneten organischen Lösungsmittels für die gewünschte Temperatur entnehmen Sie bitte der Flüssigstickstoff-Tabelle im Text gefunden. Fügen Sie das Lösungsmittel, das Dewar, dann langsam den flüssigen Stickstoff.
Legen Sie eine kalte Temperatur Thermometer oder Thermoelement in die Wanne um sicherzustellen, dass die gewünschte Temperatur erreicht ist. Legen Sie dann den Reaktionsbehälter ins Bad.
Für ein Bad ohne Zusatzstoffe fügen Sie einfach die entsprechende Menge an Stickstoff, Dewar, eine Temperatur von-196 zu erhalten ° C .
Überwachen Sie das Bad in regelmäßigen Abständen zu sehen, ob zusätzliche Stickstoff benötigt wird.
Viele verschiedene Arten von Reaktionen in verschiedenen wissenschaftlichen Schüler nutzen kühlende Bäder unterhalb der Raumtemperatur zu betreiben.
Mechanische Laborprozesse, ähnlich wie sehr exotherme Reaktionen können auch unerwünschte Hitze erstellen.
In diesem Beispiel wurde Bulk-Barium-Kupfer-Tetrasilicate durch beide solid-State und Flussmittel Synthese zu schmelzen. Dann wurden diese geschichteten Materialien geblähter mit Beschallung Techniken.
Beschallung verwendet Schallwellen, um Partikel zu agitieren. Jedoch weil es einen hochenergetischen Prozess handelt, kann es überschüssigen Wärme in einer Probe erstellen.
Daher wurde eine Eis-Wasserbad abkühlen die Probe während des einstündigen Beschallung-Prozesses verwendet. Verhindern, dass diese überschüssige Heizung gewährleistet die Integrität und Konsistenz der Produktausbeute.
In diesem Beispiel wurde ein Trockeneis Bad verwendet, um sicherzustellen, dass diese Diiodomethyllithium durch Deprotonierung von Diiodomethane synthetisiert wurde.
Reagenzien wurden in einer Runde Talsohle Kolben mit Stir Bar hinzugefügt. Dann wurde der Runde Talsohle Kolben ein Dewar. Trockeneis und Aceton wurden hinzugefügt, um die Dewar, und den gesamten Apparat war abgedeckt, um Lichteinfall zu minimieren. Geringe Energie war essentiell für die Stabilität des Produktes.
Trockeneis und flüssigen Stickstoff Bäder dienen häufig als Kühlfallen, um Proben zu kondensieren. Insbesondere können diese Kühlfallen den sicheren Transport von luftempfindlichen Substanzen helfen, Kontamination der Ausrüstung zu verhindern. In diesem Beispiel wurde eine Kühlfalle flüssiger Stickstoff verwendet, eine flüchtige und Oxidation empfindlichere Probe später Vorbereitung auf Masse spectrometrical Analyse zu kondensieren.
Das System wurde zuerst gereinigt und erhitzt, um jede möglichen Verunreinigungen zu entfernen. Die abschließbare Reagenzglas wurde dann in flüssigem Stickstoff, um Kondensation der Probe durch die Schlenk Linie ermöglichen versenkt. Die Probe wurde dann für die Analyse durch Massenspektrometrie entfernt.
Sie habe nur Jupiters Einführung in die Durchführung von Reaktionen unterhalb der Raumtemperatur beobachtet. Sie sollten jetzt verstehen, Eiswasser, Trockeneis und Flüssigstickstoff kühlen Bäder, und warum sie chemisch wichtig sind.
Danke fürs Zuschauen!
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Wann ist es sinnvoll, eine Reaktion bei einer niedrigen Temperatur ausgeführt?
Zur Beantwortung dieser Frage lassen Sie uns untersuchen, vier verschiedene Anwendungen:
Anwendung 1. Manchmal Reaktionen sind auch kräftig und exotherm und das Reaktionsgemisch gekühlt werden muss, um zu verhindern, verschütten und Druck Aufbau durch Gasentwicklung. Eine stark exotherme Reaktion kann auch ein Sicherheitsrisiko werden, da das Reaktionsgemisch schnell Überkochen kann (viele organische Lösungsmittel haben in der Regel niedrige Siedepunkte) und herausspritzen. Eine sehr häufige Anwendung hierfür ist das abschrecken oder Aufarbeitung Schritt wo eine Reaktion zunächst unter wasserfreien Bedingungen durchgeführt wird reagiert mit Wasser und Säure am Ende in Ordnung, Protonate das Endprodukt und alle verbleibenden reaktive Zwischenprodukte und Edukte reagieren. Beispielsweise benötigen die Grignard-Reaktion, eine sehr häufige Reaktion in der organischen Chemie, die abschrecken Schritt am Ende in Kühlung, obwohl eine Eis-Wasserbad bei 0 ° C genügt:
(4)
Anwendung 2. Kühlung kann auch verlangt werden für Zusatz-Schritte am Anfang einer Reaktion, wenn eine exotherme Reaktion sonst dazu führen würde, das Kochen aus dem organischen Lösungsmittel. Dies ist unerwünscht, da Reaktionen am besten in Lösungsmitteln durchgeführt werden. Mehr Lösungsmittel zum Ausgleich der Lösungsmittel hinzufügen ist nicht nur verschwenderisch und unwirtschaftlich sondern auch mühsam als Lösungsmittel in vielen Reaktionen eine vorherige Trocknung Schritt erfordern zu machen, wasserfrei. Darüber hinaus ist es möglich, dass bestimmte Reagenzien bei höheren Temperaturen thermisch zersetzen.
Um diese Ereignisse in einer exothermen Reaktion zu vermeiden, wird ein Reagenz oft tropfenweise per Spritze oder Tropftrichter ein Fläschchen mit einem anderen Reagens in Lösungsmittel beim Rühren und kühlen hinzugefügt. Auf diese Weise kann der Zusatz jederzeit gestoppt werden, wenn die Reaktion zu kräftig wird. Oft die Reaktion deutlich unter 0 ° C gekühlt werden muss und ein Eis-Wasserbad reicht nicht aus.
Ein Beispiel für eine Reaktion, wenn dies erforderlich ist, ist die Zugabe von starken Basis n-Butyllithium (n-BuLi), Diisopropylamine, Lithium Diisopropylamide (LDA) zu bilden.
(5)
Bei fehlender ein kühlendes Bad kann n-BuLi zersetzen, da höhere Temperaturen erreicht werden:
(6)
Anwendung 3. In einigen chemischen Reaktionen gibt es mehr als ein Produkt was von einem konkurrierenden chemischen Weg. Ein Produkt kann das Ergebnis eines Weges mit einem stabileren Übergangszustand, erfordern weniger Aktivierung Energie (Ea1), während das andere Produkt mehr Aktivierungsenergie (Ea2 benötigen) aber insgesamt stabiler ist. Das ehemalige wird kinetische Produkt genannt, während letztere das thermodynamische (TD)-Produkt heißt (siehe Energie-Diagramm in Abbildung 2).
Durch die Kontrolle der Reaktionstemperatur können wir kontrollieren, wer von diesen Produkten gebildet wird. Da das kinetische Produkt weniger Aktivierungsenergie erfordert ist es das Produkt, das bei niedrigen Temperaturen gebildet wird. Durchführung einer Reaktion bei niedrigen Temperaturen oft sorgt für die Bildung des kinetischen Produkts über die thermodynamischen Produkt.
Ein klassisches Beispiel im Bereich der Enolate Chemie ist die Reaktion von 2-Methylcyclohexanone mit unterschiedlichen Untergestellen unter verschiedenen Reaktionsbedingungen. Die Reaktionspartner ist eine unsymmetrische Keton und besitzt daher zwei verschiedene Arten von α-Wasserstoffatome. Kleinen Basen, wie z. B. NaOH Deprotonate das Keton mehr hoch substituierte seitlich, die Ergebnisse in stabiler, thermodynamische Enolate (7). Basen, die mehr sterisch anspruchsvoll sind, Deprotonate das Keton auf der weniger gehinderten Seite, wodurch die kinetische Enolate (8). Die Bildung von kinetische Enolate haben einen viel höheren Ertrag, wenn die Reaktion bei-78 ° C im Vergleich zur Raumtemperatur durchgeführt wird. Die beiden Formen der Enolate können dann mit einer geeigneten Elektrophil, z. B. Methyiodide, reagiert werden, um die α-alkyliert Produkte unten bilden.
(7) (8)
Die sterisch anspruchsvolle Basis verwendet, um die kinetische Enolate zu erhalten ist oft LDA, deren Zubereitung früher im Schema (5) gezeigt wurde. Es ist wichtig, die Temperaturregelung auf-78 ° C, die kinetische Enolate zu equilibrate zurück in die thermodynamische Enolate zu verhindern. (Hinweis: Es gibt keine Bedeutung auf die Temperatur von-78 ° C außer, die es leicht von einem trocken-Eis-Bad in Aceton gewonnen wird.)
Neben der Temperaturregelung ist Zusatz-Reihenfolge und Art der Zugabe von Reagenzien entscheidend. Für optimale Ergebnisse die kinetische Enolate bevorzugt ist eine Lösung von Keton Edukt tropfenweise die LDA-Basis in Lösungsmittel hinzugefügt. Oft ist das wasserfreie Lösungsmittel verwendet für die Reaktion mit LDA THF. Eine Beispiel-Reaktion wird im Schema (9) angezeigt.
(9)

Abbildung 2. Energie-Diagramm für eine Reaktion, die eine kinetische und thermodynamische Produkt.
Anwendung 4. In einigen Fällen ist es möglich, die Reaktivitäten von Reagenzien mit Temperatur zu regulieren. Betrachten Sie beispielsweise die Reduzierung der ein Ester. Reaktionen mit starken Hydrid Reduktionsmittel Lithium Aluminium Hydrid (LAH) Ergebnis bei der Reduzierung der Ester bis hin zum jeweiligen primärer Alkohol (10). Allerdings können das sperrige Hydrid Reduktionsmittel Diisobutylaluminum Hydrid (DIBAL) für selektive Reduktion von einem Ester, die jeweiligen Aldehyd. Übermäßige Reduzierung auf die primäre Alkohol vermieden werden, so lange, wie die Reaktionstemperatur ist bei unter-78 ° C (noch besser nach unten bis-90 ° C) gehalten werden und nur eine stöchiometrische DIBAL entspricht gebrauchte (12). Bei Temperaturen oberhalb von-70 ° C DIBAL wird zu reaktiv und verringert die Ester, primärer Alkohol (11).
(10)-(12)
Subscription Required. Please recommend JoVE to your librarian.
References
- Gordon, A. J., Ford, R. A. The Chemist's Companion - A Handbook of Practical Data, Techniques, and References. Chapter 11 (1973) ISBN: 978-0-471-31590-2.
- Rondeau, R. E. Slush baths. J. Chem. Eng. Data. 11, 124 (1966)




