Overview
Fonte: Tamara M. Powers, Departamento de Química da Texas A&M University
Em 1951, Kealy e Pauson relataram à Natureza a síntese de um novo composto organometálico, ferroceno. 1 Em seu relatório original, Pauson sugeriu uma estrutura para ferrocene na qual o ferro é singly ligado (ligações sigma) a um átomo de carbono de cada ligante cícloenta(Figura 1, Estrutura I). 1,2,3 Este relatório inicial levou ao amplo interesse na estrutura da ferrocena, e muitos cientistas líderes participaram da elucidação estrutural desta nova molécula interessante. Wilkinson e Woodward foram rápidos em sugerir uma formulização alternativa onde o ferro é "sanduíche" entre dois ligantes de ciclopentadiena, com ligação igual a todos os 10 átomos de carbono(Figura 1, Estrutura II). 4 Aqui, vamos sintetizar a ferrocene e decidir, com base em dados experimentais (IR e 1H NMR), qual dessas estruturas é observada. Além disso, estudaremos a eletroquímica da ferrocene coletando um voltammograma cíclico. No decorrer deste experimento, introduzimos a regra de 18 elétrons e discutimos a contagem de elétrons de valência para complexos metálicos de transição.
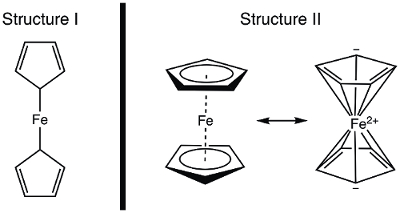
Figura 1. Duas estruturas propostas de ferroceno.
Principles
Regra de 18 elétrons e contagem total de elétrons de valência:
Ao desenhar estruturas de pontos de Lewis, é importante lembrar a regra do octeto, que afirma que os átomos dos elementos principais do grupo têm 8 elétrons em sua camada de valência. No entanto, a regra do octeto não vale para metais de transição, que têm nove orbitais de valência (um s,três p, e cinco d orbitais) e podem, assim, acomodar até 18 elétrons. Portanto, uma regra de 18 elétrons se aplica a complexos metálicos de transição. Como a regra do octeto, há exceções à regra de 18 elétrons, mas em geral, complexos metálicos de transição com 18 elétrons de valência são considerados compostos altamente estáveis.
Existem dois métodos que podem ser usados para determinar a contagem total de elétrons de valência de um complexo metálico de transição: o modelo iônico (carregado) e o modelo covalente (neutro). 5 A aplicação adequada de qualquer método deve dar origem à mesma contagem total de elétrons. Ambos os modelos usam três classificações de ligantes chamadas tipo X-, L e Z. Cada tipo de ligante contribui com um número diferente de elétrons para a contagem total de elétrons e depende do método utilizado. Os ligantes do tipo X incluem grupos aniônicos como halidos, hidróxido e alcóxidos. Ligantes do tipo L incluem doadores de pares solitários, como aminas e fosfinos. Finalmente, os ligantes do tipo Z são aceitadores de par de elétrons; portanto, os ligantes do tipo Z são ácidos lewis neutros, como a BR3. Consideraremos a molécula Co(NH3)3Cl3 para demonstrar os dois métodos (Figura 2).

Figura 2. Exemplo de contagem de elétrons, Co(NH3)3Cl3.
Modelo Iônico:
Primeiro, considere o número de elétrons contribuídos pelo átomo central. Co está no Grupo 9 da tabela periódica e, portanto, tem 9 elétrons de valência. No modelo iônico, o estado de oxidação do metal precisa ser considerado. Uma vez que o estado de oxidação do Co em Co(NH3)3Cl3 é +3, o número total de elétrons de valência contribuídos pelo metal no modelo iônico é de 6 e−(Tabela 1). No modelo iônico, ambos os ligantes do tipo X e L doam 2 e– para a contagem total de elétrons, enquanto os ligantes do tipo Z não contribuem com elétrons. Para o exemplo Co(NH3)3Cl3, existem dois tipos de ligantes presentes. Cl é um ligante tipo X e NH3 é um ligante tipo L. Usando o modelo iônico, a contagem total de elétrons é de 18 e− (Tabela 1).
Mesa 1. e− contagem de Co(NH3)3Cl3 usando os modelos iônicos e covalentes
| Ligante/átomo central | Tipo ligante |
e− contribuição
(modelo iônico) |
e− contribuição
(modelo covalente) |
| Co | n/a | 6 e− | 9 e− |
| 3 NH3 | L | 3 x (2 e−) | 3 x (2 e−) |
| 3 Cl | X | 3 x (2 e−) | 3 x (1 e−) |
| Carga de íon | n/a* | − (0) | |
| Total e− contagem | 18 e− | 18 e− | |
*A carga do íon contendo metal NÃO está incluída na contagem total de elétrons usando o modelo iônico. A carga é contabilizada no estado de oxidação do metal (elétrons contribuídos pelo átomo central).
Modelo covalento:
Para o modelo covalente, a e− contribuição do átomo central é igual ao número total de valência e– para o átomo neutro (neste caso 9 e−). Ligantes do tipo X doam 1 e−, ligantes do tipo L doam 2 e−e ligantes do tipo Z doam 0 e−. Finalmente, se a molécula é iônica, a carga do íon contendo o centro metálico precisa ser subtraída do metal mais os elétrons ligantes. Utilizando o modelo covalente, a contagem total de elétrons para Co(NH3)3Cl3 também é de 18 e− (Tabela 1).
Contagem de elétrons para ferrocenos e cáção ferrocênio:
Usando o modelo covalente, Fe tem 8 e−. Se considerarmos a ligação em ferrocene como a da Estrutura I, os ligantes cyclopentadiene (Cp) são doadores do tipo X e, portanto, cada um contribui com 1 elétron(Tabela 2). Assim, teríamos 10 elétrons de valência. No entanto, na Estrutura II, cada anel Cp doa 5 elétrons (ligante tipo L2X), onde temos duas ligações duplas (cada uma são doadoras do tipo 2 elétrons, tipo L) e um doador do tipo X (o radical). Isso dá um total de 18 elétrons(Tabela 2).
Mesa 2. Contagem de elétrons para ferroceno (Fc) e ferrocênio (Fc+) cation usando o modelo covalente
| Ligante/átomo central | Estrutura I | Estrutura II | ||||
| Tipo ligante | Fc | Fc+ | Tipo ligante | Fc | Fc+ | |
| Fe | -- | 8 e− | 8 e− | -- | 8 e− | 8 e− |
| Cp | X | 2 x (1 e−) | 2 x (1 e−) | L2X | 2 x (5 e−) | 2 x (5 e−) |
| Carga de íon | − (0) | − (+1) | Carga de íon | − (0) | − (+1) | |
| Contagem total de elétrons | 10 e− | 9 e− | Contagem total de elétrons | 18 e− | 17 e− | |
Ferroceno passa prontamente por uma oxidação de 1 e− para produzir casção ferrocênio (Equação 1).
 (1)
(1)
Vamos considerar a contagem de elétrons resultante para a cáção ferrocênio das estruturas I e II. Após uma oxidação 1 e− , ferroceno torna-se iônico. Portanto, a carga (+1) da tação ferrocênio precisa ser subtraída dos elétrons de valência(Tabela 2). Subtrair a carga resulta em contagem total de elétrons de 9 e− e 17 e- para a Estrutura I e Estrutura II, respectivamente.
Qual estrutura de Ferrocene está correta?:
Se a estrutura I estiver correta, com apenas 10 elétrons de valência, a ferrocena seria altamente reativa no Fe. A oxidação para produzir a cção ferrocênio seria bastante desafiadora neste caso, uma vez que a Estrutura I da ferrocene é deficiente eletrônica. Por outro lado, a Estrutura II da ferrocene obedece à regra de 18 elétrons e, portanto, é consistente com a ferrocena sendo um composto estável. Neste caso, a oxidação da ferrocena ao ferrocênio produziria uma espécie de 17 e– . Com base na contagem de elétrons, pode-se prever que a ferroceno exibe a Estrutura II; vamos pensar em como demonstrar a estrutura correta espectroscopicamente.
Antes da publicação dos dados estruturais, a estrutura da ferrocena foi deduzida de suas propriedades magnéticas e espectroscópicas, bem como de sua reatividade. Vamos considerar o espectro de IR que iríamos prever para as duas estruturas. Estrutura I exibe dois prótons quimicamente inequivalentes e deve, assim, dar origem a mais de um modo de alongamento C-H no espectro IR. Em contraste, a Estrutura II exibe um único tipo de ligação C-H e, portanto, deve exibir um único estiramento C-H. Se a espectroscopia de NMR estivesse prontamente disponível na década de 1950, isso também forneceria uma pista: duas ressonâncias no espectro 1H para estrutura I, e uma ressonância para a Estrutura II seria prevista. Neste experimento, sintetizaremos a ferrocene e usaremos dados espectroscópicos para fornecer evidências de sua estrutura.
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. Quebrando o Dimer Cyclopentadiene(Figura 3)
Cyclopentadiene sofre uma reação diels-alder consigo mesmo para dar dicyclopentadiene. Esta reação é reversível, por isso a rachadura é realizada usando o princípio de La Châtelier para conduzir a reação reversa destilando o monômero cyclopentadiene (b.p. 42 °C) longe do dimer dicyclopentadiene (b.p. 170 °C). A reação de dimerização é lenta quando a cciclopentadiene é mantida fria, mas deve estar recém-preparada para sintetizar com sucesso a ferrocena.
- A um frasco de fundo redondo de 25 mL, adicione uma barra de mexida e 10 mL de dimer dicyclopentadiene.
ATENÇÃO: Tenha cuidado para usar apenas dicyclopentadiene e cyclopentadiene em um capô de fumaça, pois ambos são produtos químicos fedorentos. - Conecte o frasco de fundo redondo a um aparelho de destilação fracionada (consulte o módulo "Destilação Fracionada" na série Essencial da Química Orgânica), e coloque em um banho de óleo em uma placa quente agitada. Certifique-se de ter os frascos coletados em um banho de gelo. Aperte o aparelho no lugar.
- Coloque a placa quente a 160 °C e mexa suavemente a solução.
- Destila fracionária ~ 5 mL do monômero Cp do dimer (39-42 °C).

Figura 3. Rachaduras de dicyclopentadiene.
2. Síntese de Ferroceno (Figura 4)
- A um frasco schlenk de 100 mL, adicione uma barra de agitação e 15 g de KOH finamente moído.
ATENÇÃO: KOH é muito corrosivo e higroscópico! O KOH deve ser moído em um capô bem ventilado e usado imediatamente após a preparação. - Adicione 30 mL de 1,2 dimetiletilete ao frasco enquanto mexe.
- Conecte o frasco ao nitrogênio e coloque um septo de borracha sobre o pescoço do frasco.
- Enquanto mexe sob nitrogênio, adicione 2,75 mL de ciclopentadiene através de seringa. Deixe isso mexer por pelo menos 10 minutos antes da adição do ferro.
- Enquanto a reação está mexendo, adicione uma barra de agitação, 3,25 g de fecl moído2·4H2O, e 12,5 mL DMSO a um frasco schlenk separado de 50 mL. Coloque um septo no pescoço e mexa sob nitrogênio até que todo o ferro tenha dissolvido.
- A cânula transfere a solução de ferro para a solução cyclopentadienyl sob nitrogênio dropwise ao longo de 30 min. Para um procedimento mais detalhado, revise o vídeo "Síntese de um Metalloceno Ti(III) Usando técnica de linha Schlenk" nesta série Química Inorgânica.
- Uma vez que a adição esteja completa, mexa por mais 30 minutos.
- Enquanto isso, em um béquer frio 45 mL de 6 M HCl adicionando gelo esmagado (50 g) diretamente à solução.
- Quando a reação estiver completa, despeje a mistura sobre o chorume e mexa por alguns minutos. Cristais laranja devem se formar.
- Colete os cristais em um funil Büchner (equipado com papel filtro) e lave o precipitado com água.
- Deixe os sólidos secarem no ar.

Figura 4. Síntese de ferrocena.
3. Purificação da Ferrocena. Purifique o produto por sublimação (para um procedimento mais detalhado, consulte o vídeo "Purificação da Ferrocene por Sublimação").
4. Caracterização da Ferrocena
- Prepare e colete um espectro de ferroceno de 1H NMR.
- Colete um espectro ir de ferrocene.
- Colete um vídeo ciclílico de ferroceno (veja o vídeo "Voltammetry Cíclica" na série Essencial da Química Analítica).
A determinação estrutural dos compostos organometólicos é crucial para entender a reatividade de uma determinada molécula. Vários modelos e técnicas permitem aos cientistas elucidar compostos em questão, como por exemplo ferroceno.
Ferroceno, um composto organometálico, foi relatado pela primeira vez por Kealy e Pauson em 1951. Eles propuseram uma estrutura consistindo de um átomo de ferro com duas ligações únicas a dois átomos de carbono em anéis de ciclopentadiene separados.
No entanto, Wilkinson e Woodward sugeriram uma alternativa para a estrutura ferrocena, na qual o átomo de ferro é "sanduíche" entre dois anéis de ciclopentadiene, com igual ligação a todos os 10 átomos de carbono. A estrutura proposta por Wilkinson foi confirmada por cristalografia de raios-X e NMR de prótons.
Este vídeo ilustrará a regra de 18 elétrons para prever a estrutura dos complexos organometálicos, a síntese da ferrocena, sua análise espectroscópica e eletroquímica, e algumas de suas aplicações.
Ao propor estruturas moleculares, considere sempre a quantidade de elétrons de camada de valência. Os elementos do grupo principal podem acomodar até 8 elétrons, enquanto os metais de transição podem conter até 18 elétrons em sua concha de valência. Os metais de transição têm nove orbitais de valência, 1 s,3 pe 5 d orbitais, com dois elétrons em cada. Com algumas exceções, complexos metálicos de transição com 18 elétrons de valência são compostos altamente estáveis.
Para determinar a contagem total de elétrons de um complexo metálico de transição, dois modelos podem ser usados: o iônico, ou o método covalente. Ambos os métodos utilizam as mesmas classificações de ligantes: ligantes do tipo X incluem grupos aniônicos como halidos, hidróxido ou alcóxido; Os ligantes do tipo L incluem doadores de pares solitários, como aminas e fosforas; e ligantes do tipo Z são ácidos Lewis neutros, que são aceitadores de par de elétrons. Para demonstrar os dois modelos, vamos usar Co(NH3)3Cl3 como exemplo.
Considere o átomo co, que está no Grupo 9 da tabela periódica e tem 9 elétrons de valência. Como o estado de oxidação do cobalto neste complexo é de +3, o número total de elétrons de valência contribuídos é de 6.
Os ligantes do tipo X, sendo os ligantes do tipo 3 Cl e L, os 3 NH3,contribuem com um total de 12 elétrons, enquanto os ligantes do tipo Z não estão disponíveis - produzindo um total de 18 elétrons.
No modelo covalente o estado de oxidação de cobalto é ignorado, e a molécula não é iônica, resultando em 9 elétrons no total. Ligantes do tipo X doam um elétron; Ligantes do tipo L doam dois elétrons; e ligantes do tipo Z, se presentes, não contribuem com nenhum - também produzindo um total de 18 elétrons.
A contagem de elétrons totais na ferrocena é mais complexa: o átomo de ferro contribui com 8 elétrons de valência, enquanto os anéis de cícloentadiene são classificados como ligantes do tipo L2X, fornecendo 5 elétrons cada, que vêm das duas ligações duplas e um radical, resultando em um total de 18 elétrons. Considerando que a estrutura original proposta de Pauson resultaria em apenas 10 elétrons, por causa dos ciclolopentadienes unidas.
Agora que discutimos os princípios da determinação da estrutura, vamos sintetizar a ferrocena e identificar qual estrutura está correta.
Em um capô de fumaça, adicione uma barra de mexida e 50 mL dicyclopentadiene a um frasco de fundo redondo de 100 mL. Em seguida, conecte o frasco de fundo redondo a um aparelho de destilação, e coloque-o em um banho de óleo, com o frasco receptor em um banho de gelo.
Coloque a placa quente a 160 °C e mexa delicadamente. Destile fracionáriamente aproximadamente 5 mL do monômero cílopentadieno, que deve ser mantido frio.
Adicione a um frasco schlenk de 200 mL rotulado A, uma barra de agitação e KOH recém-moído. Em seguida, adicione 30 mL 1,2-dimethoxyethane, conecte o frasco a uma linha N2 e encaixe com um septo de borracha.
Enquanto mexe sob uma atmosfera N2, adicione à solução 2,75 mL cyclopentadiene via seringa e mexa por pelo menos 10 min.
Em um frasco schlenk separado de 200 mL rotulado B, adicione o fecl moído2•4H2O e 12,5 mL DMSO. Em seguida, encaixe um septo de borracha, conecte-se a uma linha N2 e mexa sob uma atmosfera N2 até que todo o ferro tenha dissolvido.
Quando esta etapa estiver completa, insira uma agulha de ponta dupla em cada frasco de Schlenk, e a cânula transfira a solução de ferro para a solução de cyclopentadiene dropwise durante um período de 30 minutos.
Quando a reação estiver completa, despeje a mistura em um béquer contendo um chorume de 6 M HCl e 50 g de gelo esmagado e mexa por alguns minutos. Colete os cristais laranja resultantes por filtragem de vácuo em um funil frito, lave precipitado com água gelada e, em seguida, seque o ar. Purifique os cristais por sublimação.
Em seguida, prepare uma amostra de RMN da ferrocena purificada dissolvida em clorofórmio-d. Use o acessório ATR do espectrômetro infravermedo para obter um espectro IR. E, por último, coletar um voltammograma cíclico da ferrocena em acetonitrila, a uma taxa de varredura de 100 mV/s.
A análise nmr mostra um único pico de 4,17 ppm, o que confirma que todos os átomos de hidrogênio são magneticamente equivalentes. Além disso, o espectro IR mostra um único trecho de SP2 C-H a 3096 cm-1, confirmando que os átomos de hidrogênio são equivalentes, e que a estrutura do Wilkinson proposto está correta.
Por fim, vamos dar uma olhada no CV da ferrocene, que mostra um único evento de oxidação. O valor de meio E1/2 pode ser calculado tomando a média do potencial de pico catódico e o potencial de pico anodódico. Na acetonitrila, o casal ferroceno/ferrocênio redox ocorre com um potencial de 90 mV.
Agora que discutimos um procedimento para preparar a ferroceno, vamos olhar para algumas de suas aplicações.
As reações de acoplamento cruzado catalisada por paládio são uma valiosa ferramenta sintética na indústria farmacêutica. No entanto, uma reação lateral indesejada comum é a eliminação beta-hidreto, que podem ser minimizados com o uso de 1,1'-bis (diphenylphosphino)ferrocene ou dppf como agente de quesquente com PdCl2, formando [1,1'-Bis(diphenylphosphino)ferrocene]palladium(II) dichloride abreviado como (dppf)PdCl2.
A supressão da eliminação beta-hidreto, e o alto rendimento do produto, foi atribuída ao grande ângulo de mordida do ligante dppf. Com o advento do catalisador, reações como o acoplamento Suzuki são possíveis e tipicamente usadas para agrupar grupos alquilas primários usando reagentes 9-BBN.
A facilidade com que a ferrocena pode sofrer substituição eletrofílica aromática, como na aciclação friedel-crafts, ou a reação de formilação/Mannich, tornou-a uma fonte promissora para candidatos a drogas organometólicas. Esses tipos de drogas organomelólicas têm atraído interesse devido à sua variedade estrutural. Por exemplo, m-arenes podem suportar três funcionalidades, e M-carbenes pode suportar duas.
Atualmente, a ferroquina, que contém elementos de ferrocena e cloroquina, está sendo avaliada como uma droga antimalárica comercial. Além disso, o ferrocifeno, que se baseia nos elementos da ferrocena e do tamoxifen, está atualmente sendo submetido a testes clínicos como um potencial medicamento contra o câncer de mama. Além disso, estão sendo feitos esforços no desenvolvimento de análogos nucleosídeos de ferrocena no estudo das vias de DNA/RNA.
Você acabou de assistir a introdução de JoVE à estrutura da ferrocena. Agora você deve entender a regra de 18 elétrons, a síntese e caracterização da ferrocena, e várias de suas aplicações. Obrigado por assistir!
Subscription Required. Please recommend JoVE to your librarian.
Results
Caracterização ferrocena:
1 H NMR (clorofórmio-d,300 MHz, δ, ppm): 4,15 (s).
O espectro de 1H NMR de ferroceno mostra claramente uma única ressonância, consistente com a estrutura II.
Um CV de ferrocene é dado abaixo. O valor E1/2 obtido para a oxidação da ferrocena foi +90 mV (acetonitrilo, taxa de varredura 100 mV/s, 0,1 M (Bu4N)PF6, eletrodo de trabalho de carbono vidrado). O casal ferroceno/ferrocenium redox é comumente usado como referência em voltammetry cíclica. Quando usado como referência, o valor E1/2 de ferroceno é definido igual a 0 V.

Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Neste vídeo, discutimos a ferrocene e o papel que ela desempenhou no desenvolvimento da química organometálica. Ferrocene foi sintetizado e caracterizado por 1H NMR e espectroscopia ir. Ambos os espectros são consistentes com o 18 e− Estrutura II, onde o ferro é "sanduíche" entre dois ligantes de cílopentadiena, com ligação igual a todos os 10 átomos de carbono(Figura 1, Estrutura II). A oxidação da ferrocena à castação ferrocênio foi observada eletroquimicamente.
Em 1973, após a caracterização estrutural da ferrocena, Wilkinson foi um dos dois químicos premiados com o Prêmio Nobel de Química "por [seu] trabalho pioneiro ... sobre a química do organometálico, os chamados complexos sanduíche". 6 Seu trabalho influenciou e expandiu o campo emergente da química organometálica. Embora o primeiro composto organometólico tenha sido preparado em 1849, foi apenas na década de 1950 que avanços significativos foram feitos para entender como os metais podem se ligar aos átomos de carbono. Hoje, o campo da química organometálica, ou a química de compostos que formam ligações metal-carbono, é central para muitas aplicações. Isso inclui: energia, células solares sensibilizadas por corantes, catálise, polimerização, descoberta e síntese de drogas, sistemas bioinorgânicos e diodos orgânicos emissores de luz (OLEDs). 7
A própria ferrocene também desempenha um papel ativo no campo da química organometálica. Ferrocene prontamente participa da substituição eletrofílica aromática; na verdade, é 100.000 vezes mais reativo do que o benzeno nessas reações. A Ferrocene encontrou a aplicação generalizada como um componente estrutural de ligantes bidentatos na catálise organometálica. Por exemplo, 1,1'-bis (diphenylphosphino)ferrocene (dppf) é uma ligante quenteante usada em catálise homogênea. Os metais de transição de ligantes dppf1,2ºe3º row, incluindo ni, pd e pt. [1,1'-Bis (diphenylphosphino) ferrocene]palladium(II) dicloreto é um exemplo de catalisador de acoplamento cruzado de paládio para formação de ligação C-C e C-heteroatom(Figura 5). 8 No vídeo "MO Theory of Transition Metal Complexes", vamos sintetizar dois complexos metálicos com dppf.

Figura 5. [1,1'-Bis (diphenylphosphino) ferrocene]paladium(II) dicloreto (II) é um catalisador de acoplamento cruzado para a formação de títulos C-C e C-X.
Subscription Required. Please recommend JoVE to your librarian.
References
1. Kealy, T. J., Pauson, P. L. A New Type of Organo-Iron Compound. Nature. 168 (4285), 1039-1040 (1951).
2. Pauson, P. L. Ferrocene—how it all began. J Organomet Chem. 637, 3-6 (2001).
3. Seeman, J. I., Cantrill, S. Wrong but seminal. Nat Chem. 8 (3), 193-200 (2016).
4. Wilkinson, G., Rosenblum, M., Whiting, M. C., Woodward, R. B. The Structure of Iron Bis-cyclopentadienyl. 74, 2125-2126 (1952).
5. Green, M. L. H., Parkin, G. Application of the Covalent Bond Classification Method for the Teaching of Inorganic Chemistry. J Chem Educ. 91 (6), 807-816 (2014).
6. Press Release. http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1973/press.html.
7. Crabtree, R. H. The Organometallic Chemistry of the Transition Metals, 6th ed. John Wiley & Sons. Hoboken. 2014.
8. Gildner, P. G., Colacot, T. J. Reactions of the 21st Century: Two Decades of Innovative Catalyst Design for Palladium-Catalyzed Cross-Couplings. Organometallics. 34, 5497-5508 (2015).




