Overview
Fonte: Vy M. Dong e Zhiwei Chen, Departamento de Química da Universidade da Califórnia, Irvine, CA
Este experimento demonstrará a hidrogenação do chalcone como exemplo de uma reação de hidrogenação alquena(Figura 1). Neste experimento, o paládio sobre carbono (Pd/C) será usado como catalisador heterogêneo para o processo. Um balão será usado para abastecer a atmosfera de hidrogênio.
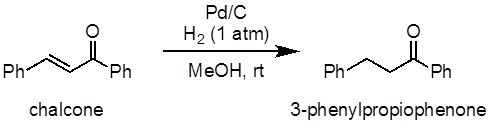
Figura 1: Diagrama mostrando a hidrogenação do chalcone para 3-fenileifenona.
Principles
A adição de hidrogênio através de uma unidade de insaturação é chamada de reação de hidrogenação. Desde sua descoberta em 1897 por Paul Sabatier, a hidrogenação catalisada metálica de π-ligações, como alkenes (Figura 2), evoluiu para um importante processo em química. Ao longo dos anos, novos e mais robustos catalisadores foram desenvolvidos, o que ampliou o escopo desse processo e permitiu que as hidrogenações fossem assimétricas. Quando um catalisador heterogêneo é usado, o mecanismo aceito (Figura 3) começa com a adsorção de hidrogênio na superfície do catalisador Pd/C. Em seguida, a ligação do alquerio ocorre seguida de duas transferências sequenciais de hidreto que fornecem o alkane saturado. Sob um catalisador homogêneo, o mecanismo é diferente; observe que a funcionalidade cetona também pode sofrer redução. No entanto, a hidrogenação catalítica é quimoseletiva em direção à moiety alkene.

Figura 2: Diagrama mostrando a reação geral de hidrogenação alkene.

Figura 3: Diagrama mostrando o mecanismo para hidrogenação de alquenia catalítica.
Subscription Required. Please recommend JoVE to your librarian.
Procedure
- Adicione 210 mg de chalcone, 12 mg de 5% Pd/C e 8 mL de MeOH a um frasco de fundo redondo de 25 mL equipado com uma barra de agitação magnética.
- Sele o frasco de fundo redondo com um septo de borracha e comece a mexer a mistura de reação.
- Obtenha um balão de hidrogênio do cilindro de gás hidrogênio e reserve.
- Com uma agulha, aplique um vácuo na mistura de reação até que o borbulhante seja observado.
- Pare o vácuo e insira o balão de hidrogênio.
- Depois dos 30, remova o balão de hidrogênio.
- Repita os passos 4-6, mais três vezes.
- Insira o balão de hidrogênio e deixe a mistura de reação mexer por 30 minutos.
- Remova o balão de hidrogênio e o septo. Filtro de vácuo a mistura de reação através de uma almofada celite em um frasco de fundo redondo asfaltado.
- Remova o solvente por evaporação rotativa para obter o produto 3-fenileifenona como um sólido branco.
- Calcule o rendimento percentual e estabeleça sua pureza e identidade por ponto de fusão e 1H NMR.
Desde sua descoberta em 1897 por Paul Sabatier, a hidrogenação catalisada metálica de π-ligações, como alqueas, evoluiu para um importante processo em química orgânica.
A hidrogenação é uma reação química que adiciona hidrogênio através de ligações insaturadas em um composto orgânico.
O uso de reações de hidrogenação vai além da síntese orgânica em laboratório, e tem aplicações importantes nas indústrias de energia, alimentos e farmacêuticas.
Este vídeo ilustrará os princípios da hidrogenação, um procedimento para hidrogenação chalcone, e algumas aplicações laboratoriais.
A hidrogenação de uma ligação carbono-carbono dobrada é uma reação de redução, com uma molécula de hidrogênio adicionando através da ligação. Normalmente é necessário um catalisador heterogêneo contendo paládio, platina ou níquel para que o processo ocorra.
A reação é geralmente realizada à temperatura ambiente com o composto insaturado dissolvido em um solvente adequado, como um álcool ou ácido acético. Uma pequena quantidade de catalisador é adicionada a esta solução, que é então abalada e agitada na presença de gás hidrogênio.
A hidrogenação é iniciada por gás hidrogênio absorvendo a superfície do catalisador metálico. Isso resulta na dissociação dos dois átomos de hidrogênio.
Em seguida, o composto orgânico insaturado se liga ao catalisador através de sua ligação π, que permite duas transferências sequenciais de hidreto para o par de carbono. Finalmente, a ligação monogentada carbono-carbono é liberada do catalisador e o processo se repete até que o reagente limitante se esgote.
Agora que discutimos os princípios da hidrogenação, vamos olhar para a hidrogenação do chalcone usando um catalisador heterogêneo.
Para iniciar o procedimento, pegue os reagentes e vidros e leve-os para o banco do laboratório. Adicione 210 mg de chalcone, 12 mg de 10% de pádio-carbono, 1 mL de acetato de etila e 8 mL de metanol a um frasco de fundo redondo de 25 mL equipado com uma barra de agitação magnética.
Em seguida, sele o frasco com um septo de borracha e comece a mexer a reação em uma placa de agitação. Enquanto a mistura estiver mexendo, encha um balão com uma agulha e uma válvula presas, usando hidrogênio de um cilindro.
Agora, com a válvula fechada, insira a agulha no septo de borracha no frasco e aplique um vácuo na outra abertura no frasco. Quando borbulhar é observado na mistura, desligue o vácuo.
Agora abra a válvula e deixe o hidrogênio fluir para o frasco. Após 30 segundos, remova o balão de hidrogênio e sele-o. Repita os passos de infusão de vácuo e hidrogênio mais três vezes.
No último ciclo, deixe o balão de hidrogênio preso ao frasco e deixe a mistura de reação mexer por 30 minutos.
Para coletar os produtos de reação, primeiro remova o balão de hidrogênio e o septo. Em seguida, o vácuo filtra a mistura de reação através de uma almofada de celite em um frasco de fundo redondo asfaltado.
Por fim, remova o solvente por evaporação rotativa para obter o produto, que deve ser um sólido branco na aparência. O rendimento é determinado pesando o conteúdo do frasco asfaltado. A identidade do composto pode então ser confirmada através da análise do ponto de fusão e da RMN 1H.
Neste procedimento, um rendimento de 72% é obtido a partir da hidrogenação do chalcone. Foi medida uma faixa de ponto de fusão de 65 a 70 °C para a amostra obtida, o que é consistente com os dados publicados para 3-fenileifenona. Além disso, os picos obtidos a partir do 1H NMR correspondem aos ambientes de hidrogênio esperados para o composto saturado.
Agora que olhamos para um procedimento para hidrogenação, vamos dar uma olhada em algumas aplicações.
Na indústria de energia, os combustíveis sintéticos são produzidos a partir de fontes não-hidrocarbonetos, como carvão e biomassa. Friedrich Bergius, que ganhou o Prêmio Nobel em 1931 por sua descoberta, inventou um processo para tratar o carvão com hidrogênio e um catalisador de metal sob alta temperatura e pressão para formar hidrocarbonetos.
O biocombustível, uma fonte de energia química derivada de madeira, grama, resíduos agrícolas e outras biomassas, está sendo desenvolvida como uma alternativa sustentável e neutra em carbono aos combustíveis fósseis. Nesta aplicação, a hidrogenação catalisada de rutênio e a hidrodeoxingação mediada por cobalto-molbdenum são usadas para remover grupos reativos de vinil e oxigênio. Os combustíveis hidrotratados são menos corrosivos e têm maior estabilidade térmica.
Você acabou de ver o vídeo de JoVE sobre Hidrogenação. Agora você deve entender os conceitos dessa reação, como ela é realizada em laboratório, e algumas de suas aplicações. Obrigado por assistir!
Subscription Required. Please recommend JoVE to your librarian.
Results
3-Feniofenona foi obtida como sólido branco (150 mgs, 71% de rendimento); m.p. 65-70 °C; 1 H NMR (400 MHz, CDCl3) δ 8,00 (d, J = 7,2 Hz, 2H), 7,59 (t, J = 7,2 Hz, 1H), 7,49 (t, J = 7,6 Hz, 2H), 7,37-7,26 (m, 5H), 3,35 (t, J = 7,2 Hz, 2H), 3,12 (t, J = 7,6 Hz, 2H)
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Neste experimento, demonstramos uma reação de hidrogenação catalítica de um alquenô. Chalcone foi hidrogenado para formar 3 fenilpropiofenona.
A hidrogenação é uma reação exotermica (libera calor) porque o alkano do produto é mais estável do que o alquerio reacionário. A quantidade se o calor liberado da reação pode servir como um indicador da estabilidade do alqueado. Na indústria alimentícia, a hidrogenação é usada para processar óleos vegetais, que são triglicérides com múltiplas unidades de alquen. Variar as condições de reação controla o grau de hidrogenação. A hidrogenação é usada para a síntese industrial de hidrocarbonetos a partir do carvão. Isso é conhecido como o processo de Bergius e envolve o tratamento do carvão (carbono elementar) com altas pressões de hidrogênio e um catalisador de metal sob alta temperatura. Seu inventor, Friedrich Bergius, recebeu o Prêmio Nobel de Química em 1931.
Subscription Required. Please recommend JoVE to your librarian.




