Overview
Source : Kerry M. Dooley et Michael g. Benton, département de génie chimique, Louisiana State University, Baton Rouge, Louisiane
Traitement de substances biochimiques implique opérations unitaires tels que la cristallisation, ultracentrifugation, filtration sur membrane et la chromatographie préparative, qui ont tous en commun la nécessité de séparer le grand de petites molécules, ou solides du liquide. Parmi eux, la cristallisation est la plus importante d’un point de vue tonnage. Pour cette raison, il est couramment employée en pharmaceutique, chimique et industries de transformation des aliments. Exemples biochimiques importants incluent des séparations chirales,1 purification des antibiotiques,2 séparation des acides aminés précurseurs et nombreux autres pharmaceutical, additif alimentaire de4-5 ,6-7 et3 agrochimiques purifications. 8 Le contrôle de la distribution de taille et de morphologie cristalline est essentiel à l’économie du processus, que ces facteurs affectent le coût des opérations de traitement en aval telles que le séchage, filtration et solides convoyage. Pour plus d’informations sur la cristallisation, consultez un manuel spécialisé ou un manuel d’opérations unitaires. 9
L’unité cristallisoir (Figure 1) permet l’étude de : (a) les effets des paramètres clés, tels que la sursaturation et taux de refroidissement/chauffage, sur la distribution de taille de cristal, la morphologie et la teneur en matières solides ; (b) et le contrôle en ligne des processus de cristallisation. Sursaturation peut être contrôlée en modifiant les conditions telles que les taux d’agitation et de la température. Les différentes classifications de cristallisation comprennent le refroidissement par évaporation, à pH swing et modification chimique. Dans cette expérience, un microscope hors ligne mesurera de cristaux s’étendant dans la taille de 10-1000 μm, une gamme de taille standard pour les produits biologiques.
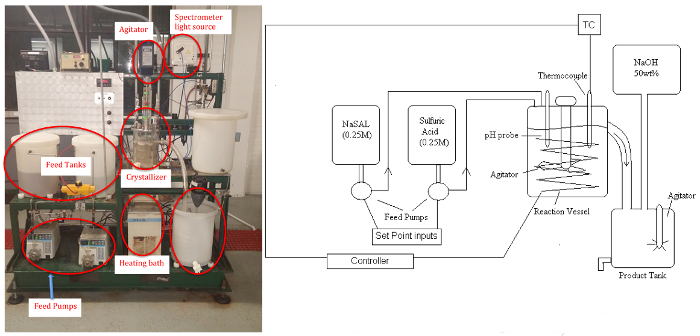
Figure 1 : P & ID de schéma (à gauche) et image (à droite) du cristallisoir. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Cette expérience démontrera une « modification chimique », ou « pH-swing » cristallisation, à produire des cristaux de (SAL) (précurseur de l’aspirine) acide salicylique de la réaction rapide de solutions aqueuses de salicylate de sodium base (nasale), qui sont à la base, et acide sulfurique (H2SO4) à n’importe où de 40-80 ° C. 11
Na+SAL + 0,5 H2SO4 SAL (ppt) + Na+ + 0,5 oui42-
Le sulfate de sodium sous-produit reste soluble. L’appareil est constitué de deux réservoirs d’alimentation à vitesse variable trois pompes (péristaltiques), le cristallisoir (réservoir agité à approcher une température uniforme et la concentration, L ~ 5), une circulation bain pour contrôler la température, contrôleur de puissance, réservoir de produit et un réservoir de maquillage pour alimentation régénération avec une solution de NaOH (si désiré). Les échantillons seront analysés par un spectromètre UV-visible pour l’ion salicylate solubles résiduels, et le produit de l’acide salicylique crystal sera séché et pesé. Une sonde de pH peut servir à déterminer l’équilibre lorsque les conditions de réaction sont modifiées.
Principles
Une suspension mixte, cristallisoir (MSMPR) mélangé-produit-enlèvement est analogue à un réacteur agité-réservoir continu - un mélange parfait des phases solides et liquides est supposé. Cristallisoirs industriels rarement (voire jamais) approchent comportement MSMPR, mais le concept est utile dans les unités de l’échelle pilote et banc. C’est parce qu’il fournit un moyen facile d’estimer les paramètres clés comme la croissance taux G et taux de nucléation, B0. Les cristaux existants et autres surfaces solides, tels que l’agitateur, catalysent la nucléation. La densité, n, des cristaux est une densité de probabilité en ce qui concerne L, la dimension des cristaux primaires. Par conséquent, /(Σn dL) dL n représente la fraction de cristaux longueur L à L + dL. Dans des textes standard, qu'il est montré que pour un cristalliseur MSMPR, la solution du modèle de bilan d’ensemble de la population pour n est :
 (1)
(1)
où B0 est la fonction crystalnucleation en mols/vol/heure, et G est le taux de croissance de cristaux, dL/dt. L’équation (1) prévoit une distribution exponentielle pour la densité produite dans un MSMPR. En utilisant le zéro (reliée à la concentration de cristal) et première (lié à la taille moyenne des cristaux) moments de la distribution, le B0 et le G sont :
 (2)
(2) (3)
(3)
où Cs est la concentration de cristaux solides dans la boue, τ est le temps de résidence, qui est environ le volume de liquid divisé par le débit volumétrique alimentation, et  est la longueur moyenne sur une base de numéro, qui est déterminée au microscope .
est la longueur moyenne sur une base de numéro, qui est déterminée au microscope .
Donc, pour un cristalliseur MSMPR, le taux de croissance et de nucléation est déterminées par les paramètres de contrôle normal (taux d’agitation, température, débit, etc.). Toutefois, la répartition devrait toujours être exponentielle, et les écarts par rapport à une distribution exponentielle représentent un mélange imparfait des solides ou les liquides. Le cristallisoir MSMPR (réservoir agité) est mal adapté à cristallisations industrielles car il fournit une distribution exponentielle de tailles de cristal, alors que dans la plupart des applications, une distribution relativement étroite, gaussienne, est souhaitée pour l’uniformité du produit . Son étude est pertinente parce que : (a) il est presque toujours un élément d’une plus grande conception cristallisoir ; (b) il est idéal pour laboratoire et pilote travaux parce que le niveau des taux de nucléation et de croissance et de sursaturation peut facilement être extraites les données brutes ; et (c) il est l’exemple le plus simple dont géométrie peut être liée à la distribution de taille de cristal.
Pour une vitesse constante température et agitateur, fois B0 et G sont directement liés à la ΔC de sursaturation, qui est la force motrice de transfert de masse de cristallisation :12
 (4)
(4)
Les pouvoirs b et g sont spécifiques du système et peuvent varier sur une large plage (par exemple, 1-7,2 g). 12
Subscription Required. Please recommend JoVE to your librarian.
Procedure
Organique (salicylate de sodium, nasale) et acide (acide sulfurique, 0,25 M = 0,50 N) solutions seront données le cristallisoir. Assurez-vous de porter des gants en latex pour manipuler les voies nasales, l’acide salicylique ou leurs solutions et l’acide sulfurique de 0,25 M.
L’ensemble du système est commandé depuis un PC en utilisant un contrôleur commercial distribué avec une interface similaire à celle de la Figure 1. Toutes les électrovannes marche-arrêt ou 3 voies et contrôleur consigne peut être utilisé et modifié à l’aide de cette interface. Un schéma montre l’évolution des valeurs analogiques (débit, température) associés à l’unité.
1. mise en route le cristalliseur
Au début d’une série, tous les contrôleurs continus doivent être en mode manuel et solénoïde tous les robinets doivent être soit fermé (marche-arrêt) ou en mode de recycler (3 voies).
- Veillez à ce que le cristallisoir est plein au niveau du trop-plein (~4.15 L) indiquée sur le réservoir agité, avec coulis de l’eau et l’acide salicylique (dans la cristallisation, la boue est souvent appelée « magma »). S’il est pas plein, ajouter via le port de l’addition.
- Activer l’agitateur pour le cristallisoir et thethermostated pour le bain et les pompes.
- Réglez le régulateur de température pour la température du bain à AUTO et le point de consigne de la température désirée. La température recommandée est environ 53° C pour un cristalliseur de 50° C.
- Réglez la vitesse de la pompe à l’aide de l’interface (par exemple, 30 % ouvert). Connaissant la concentration des flux, régler les débits d’équivalence stoechiométrique basé sur l’équation (1).
- Confirmer que le réservoir de produit n’est pas complète et que le robinet de vidange est fermé.
- Puissance de l’équipement de spectromètre et établir une communication avec un lien fourni dans la console de commande. Spectromètre procédures sont détaillées dans le manuel d’exploitation (SpectraSuite). Étalonnage du spectromètre est fourni.
2. fonctionnement du cristallisoir
- Augmenter la sortie de la pompe comme nécessaire pour atteindre les débits souhaités. Pour la solution d’acide, c’est environ 25-35 mL/min. Pour les voies nasales, il est déterminé par équivalence stoechiométrique.
- Passez dans le mode d’alimentation sur les deux vannes 3 voies. Il s’agit de temps zéro pour une expérience.
- Vérifier périodiquement la ligne de débordement. Sous certaines conditions, il peut bloquer vers le haut. Dans l’affirmative, utilisez un bout de tube en acier pour aléser la ligne d’entrer dans le réservoir de produit.
- Recueillir les cinq échantillons directement depuis le cristallisoir via le port de l’échantillon à l’aide d’une pipette de large-bouche et transférez-les sur essai de 15 mL ou centrifuger les tubes. Prenez deux séries d’échantillons environ 10-15 min d’intervalle.
- Répétition à deux autre résidence espacées fois, contrôle
 (temps de séjour) en variant les débits volumétriques, mais maintien de l’équivalence stoechiométrique.
(temps de séjour) en variant les débits volumétriques, mais maintien de l’équivalence stoechiométrique.
3. fermer le cristalliseur
- Pour arrêter le système, définir les vannes 3 voies à recycler et les sorties de la pompe à 0 %.
- Retourner le régulateur de température manuel à 0 % de sortie et éteint les pompes, les agitateurs et les Bain thermostaté.
- Si vous utilisez le spectrophotomètre, n’oubliez pas de fermer les lumières.
4. analyse
Les concentrations de voies nasales et de l’acide salicylique dissous peuvent être mesurées simultanément par spectroscopie UV-visible. Les absorbances de salicylate dissous et l’acide salicylique peuvent supposer additif car on observe le même chromophore. Instructions complémentaires figurent dans l’annexe A. La concentration de l’acide salicylique peut également être déterminée par gravimétrie en unités de kg/m3 de boue.
- Centrifuger les tubes de 15 mL pour 5 min et noter le volume de l’échantillon liquide extrait par décantation. Le liquide décanté peut être utilisé pour l’analyse spectrophotométrique nasale.
- Sécher les tubes à essai contenant les solides debout dans le four à 70 ° c, pendant deux jours.
- Peser, nettoyer les tubes, puis re-sécher brièvement avant d’être re-pesée pour obtenir le poids des cristaux.
Cristallisation industrielle est appliquée pour la séparation et la purification de composés et mélanges. Afin de concevoir des systèmes économiques, différents paramètres doivent être étudiés. La cristallisation est utilisée pour la séparation de composés chiraux et acides aminés, ou pour la purification des antibiotiques, des additifs alimentaires et des composés agrochimiques. Différents moyens de cristallisation incluent swing refroidissement, chimique, modification, évaporation ou pH. Un cristallisoir peut être utilisé pour étudier les principaux paramètres influant sur le développement de crystal, telles que le refroidissement et de tarifs ou de sursaturation. Avec le microscope, la taille des cristaux et la morphologie peuvent être surveillés et dépendances de divers facteurs observés. Dans cette expérience, salicylate de sodium réagit avec l’acide sulfurique, conduisant à la précipitation de l’acide salicylique, qui est un précurseur de l’aspirine. Échantillons sont analysés par microscopie, analyse gravimétrique et UV visible. Cette vidéo illustre le concept, l’analyse et l’application d’une unité de cristalliseur.
Pour une échelle en place d’un cristallisoir, il est important d’estimer les paramètres clés. Ceux-ci peuvent être étudiés à l’aide d’une unité MSMPR. Bien que cristallisoirs industrielles se comportent vraiment comme des MSMPRs, le concept est toujours d’actualité pour le banc et les unités à l’échelle pilote. Le cristallisoir MSMPR est analogue à un réacteur continu, agite l’intérieur du réservoir. Il suppose un mélange parfait des phases solides et liquides. MSMPRs sont utilisés pour évaluer les paramètres clés de la cristallisation, tels que le taux de nucléation de cristal, qui est également connu sous le nom de la fonction de la naissance et le taux de croissance du cristal. La nucléation est catalysée par des cristaux existants et des surfaces solides tels que les murs du réacteur. Le modèle de bilan d’ensemble de la population pour un cristallisoir MSMPR donne la densité N des cristaux, qui est une densité de probabilité en ce qui concerne L, la dimension des cristaux primaires. Dans un MSMPR, la distribution du numéro est prévue pour être une loi exponentielle. Le taux de croissance et fonction de naissance peut être déterminé en utilisant le zéro et les premiers instants de cette distribution. Plus important encore, ils peuvent également être liées à la sursaturation, qui est la force motrice de transfert de masse dans la cristallisation, et qui est, à son tour, dépend de la température et taux d’agitation. Pour une vitesse constante de la température et agitateur, la natalité à la croissance et la fonction sont directement liées à sursaturation, tant les pouvoirs B et G peuvent être calculées par régression linéaire. Selon le modèle MSMPR, la densité des cristaux diminue exponentiellement avec la longueur. Un écart par rapport à la distribution exponentielle impliquerait un mélange imparfait de matières solides ou liquides. Dans les applications industrielles, des distributions gaussiennes relativement étroites de tailles de cristal sont requis, et non exponentiel. Néanmoins, le modèle MSMPR est toujours utile, notamment dans les usines pilotes, car elle permet la détermination de la croissance et de taux de natalité, mais aussi le degré de sursaturation des données brutes. Maintenant que vous êtes familiarisé avec le modèle MSMPR, nous allons appliquer le concept à l’expérience.
Porter les EPI approprié lors de la manipulation des solutions de sodium salicylate et acide sulfurique. Notez les propriétés physiques de base de l’acide salicylique pour une utilisation ultérieure. Avant votre départ, vous pouvez vous familiariser avec le système de cristallisation. L’appareil est constitué de deux réservoirs d’alimentation, pompes à vitesse variable, un réservoir de cristalliseur-agité de cinq litres, un bain circulant pour le contrôle de la température, contrôleur de puissance, du produit du réservoir et un conteneur d’appoint pour la régénération des alimentaire, en utilisant une solution d’hydroxyde de sodium. Le système est exploité à l’aide d’un système de contrôle distribué et une interface graphique, d'où des valves peuvent être utilisés pour contrôler la température et le débit. Une sortie schématique fournissant les tendances de la température et le débit est également disponible.
Vérifiez que tous les contrôleurs continus sont réglés sur le mode manuel, et que toutes les électrovannes sont soit dans le fermé, bidirectionnelle ou dans la corbeille, trois voies mode. Assurez-vous que le cristallisoir est pleine d’eau et certains boue acide salicylique pour le niveau de débordement de 4,15 litres environ, comme il est indiqué sur le réservoir agité. Ajouter l’eau et l’acide salicylique en utilisant le port de plus si le réservoir n’est pas plein. Activer l’agitateur pour le cristallisoir et le Bain thermostaté et pompes. Régler le régulateur de température pour la température du bain à l’automobile et le point de consigne à la température souhaitée, habituellement environ 53 degrés Celsius pour un cristalliseur de 50 degrés Celsius. Réglez la vitesse de la pompe pour donner environ 25 à 35 millilitres par minute pour la solution d’acide. Pour le salicylate de sodium, le débit est déterminé par des équivalents stoechiométriques. À l’aide de la dite nourrir des concentrations, définir les débits équivalents stoechiométriques. Assurez-vous que le réservoir de produit n’est pas plein et la vanne de vidange est fermée. Ensuite, allumez le spectromètre et utilisez un lien fourni dans la console de contrôle pour vérifier que la communication entre les appareils est établie.
Passez dans le mode d’alimentation sur les deux vannes à trois voies. Ceci définit le temps zéro pour une expérience. Vérifier périodiquement la ligne de débordement pour tout blocage. Utiliser un morceau d’acier tube à distance de la ligne de pénétrer dans le réservoir de produit à l’aide du trou prévu si le blocage est détecté. Après une heure, utiliser une pipette de large ouverture et l’insérer dans le port de l’échantillon du cristallisoir. Recueillir suffisamment pour remplir suffisamment cinq pré-pesés 15 millilitre centrifugeuse ou tubes à essai. Prenez deux séries d’échantillons de 10 à 15 minutes d’intervalle. Varier les débits volumétriques au contrôle TOW et ajuster pour deux autres fois espacées de résidence. Maintenir les équivalents stoechiométriques et prélever des échantillons comme avant. Lorsque vous avez terminé, réglez la sortie de la pompe à zéro pour cent, les vannes trois voies à recycler. Le régulateur de température de retour au manuel à zéro pour cent de sortie et éteint les pompes, les agitateurs et les Bain thermostaté.
La concentration en ions salicylate peut être déterminée à l’aide de vis de l’UV et la concentration de l’acide salicylique solide peut être déterminée par gravimétrie en kilogrammes par mètre cube de lisier. Avant l’analyse, tout d’abord centrifuger les échantillons pendant 5 minutes et décanter le liquide. Enregistrer le volume total de l’échantillon récupéré. Combiner des échantillons de liquides provenant d’un ensemble donné et diluer par 50 à 100 fois. Pour le liquide, mesurer l’absorbance de la salicylate de sodium et l’acide salicylique en utilisant un spectromètre UV visible. L’absorbance est considéré comme additif, puisque le même chromophore est détecté pour les deux échantillons. Pour le dosage gravimétrique, utilisez les solides restant dans la centrifugeuse ou tubes à essai. Sécher le poteau de tubes dans le four à 70 ° c pendant deux jours. Puis réévaluer les tubes refroidis afin de déterminer le poids des cristaux et la concentration en kilogrammes par litre. Enfin, à l’aide d’un microscope, déterminer la distribution de longueur des cristaux aciculaires l’acide salicylique.
Calculer la concentration de cristaux solides pour toutes les courses via la méthode gravimétrique. Générer un bilan massique sur salicylate. Puis, calculez le temps de sursaturation et résidence. Ensuite, déterminez que le cristal donne sur une base animale et produit, en utilisant les taupes du produit, l’alimentation et le produit dissous salicylate. Utiliser la concentration de cristal, cristal dimension et temps de séjour à résoudre pour la natalité de fonction et de la croissance. Alors estimer les pouvoirs G et B par le biais de régressions linéaires des fonctions log. Voici un exemple d’une cristallisation à 50 degrés Celsius. La puissance de B est deux fois plus grande que G, ce qui indique que la sursaturation affecte le taux de natalité plus que le taux de croissance. Ces pouvoirs servirait pour l’échelle vers le haut si la sursaturation est inchangée. Des comparaisons avec d’autres expériences peuvent identifier les facteurs qui influencent la croissance et la naissance systémier, mélange insuffisant, pH et impuretés ioniques dans l’eau de maquillage.
Cristallisation industrielle est largement appliquée dans les industries pharmaceutiques, chimiques et alimentaire pour la séparation et la purification de composés divers. Danazol est un stéroïde synthétique qui est utilisé pour le traitement de l’endométriose. Comme pour beaucoup d’autres composés pharmaceutiques, Danazol est hydrophobe et peu solubles dans l’eau. Par conséquent, le produit brut de Danazol est initialement dissous dans l’éthanol et puis recristallisé en le mélangeant avec de l’eau, qui produit des cristaux de produit pur, petites particules de taille. Cristallisoirs industrialisés peuvent être utilisés dans la production des lysosomes. L’appareil peut être conçu pour produire une distribution très étroite cristal taille grâce à l’application d’une pompe autour d’échangeur de chaleur, ce qui augmente légèrement la température pour dissoudre les cristaux plus petits. La granulométrie peut être réglée en séparant les grains cristallins sur la base de leurs vitesses terminales. Ce concept trouve également application dans la cristallisation des sels inorganiques.
Vous avez juste regardé introduction de Jove à cristallisation industrielle. Vous devez maintenant comprendre le cristallisoir MSMPR modèle, comment faire fonctionner l’appareil de cristallisation et comment analyser les résultats. Merci de regarder.
Subscription Required. Please recommend JoVE to your librarian.
Results
La figure 2 présente des données représentatives qui suggère modestes déviations par rapport à la distribution de taille de cristal de la MSMPR idéale même à des vitesses relativement élevées et de faibles concentrations d’alimentation.

Figure 2 . Distribution de taille de cristal pour 0,16 M flux NaSAL, 540 tr/min, 60 ° C
Les cristaux qui se forment à partir de cette expérience sont généralement en forme de l’aiguille, et la distribution de longueur peut être déterminée au microscope. Longueurs d’échantillon avec des dimensions de la taille (en microns) de cristaux typiques sont indiquées à la Figure 3. La gamme normale et privilégiée des cristaux est 100-1000 microns.

Figure 3 . Agrandie de cristaux d’acide salicylique. Les tailles sont en microns. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
En supposant que les équations de la cristalliseur MSMPR (1-4) et à l’aide d’un bilan de masse sur le salicylate, exécute la concentration de cristaux solides dans le magma (CSAL), la résidence times (τ), le taux de croissance fonctionne G, quantités de sursaturation en phase aqueuse ΔC sur une base molaire, nucléation fonction B0et le cristal donne à la fois un produit et une alimentation de base ont été déterminés. La fonction G a été calculée à l’aide de la distribution de la taille de l’équation (3). Et la sursaturation et les équations de bilan massique sont :
 (5)
(5)
 (6)
(6)
où Q1 est le débit volumétrique de la solution nasale, Q,t est le débit-volume total (Cnasale)0 est la concentration d’alimentation des voies nasales dans Q1et Cnasale et CSAL sont le produit concentrations de salicylate soluble et cristaux, respectivement. Ceq est la concentration d’équilibre (interfaciale) de salicylate, qui était ~2.2 g/L sur la plage de température utilisée dans cette démonstration.
Le rendement a été défini sur une base alimentaire tel que :
 (7)
(7)
Et sur une base produit seulement comme :
 (8)
(8)
Si l’erreur % du bilan massique sur salicylate est grande, alors il est probable que CSAL ou Cnasale sont dans l’erreur, car tous deux sont difficiles à mesurer avec précision. En regardant les valeurs de Y1 et Y2 (qui donne une tendance plus raisonnable), la principale source de l’erreur peut être déterminée.
Des valeurs de G et B0, les pouvoirs « g » et « b » dans l’équation (4) ont été estimées à l’aide de la régression linéaire. Franck et coll. rapports une puissance « g » ~ 3 et « b » d’environ 6 pour ce système de11 en utilisant des conditions hautement stériles et agitateur haute vitesses. Déterminer les différences entre les compétences expérimentales « g » et « b » et celles de Franck et coll. est utile pour identifier les facteurs qui pourraient influer sur les fonctions de nucléation et de croissance. Des données représentatives pour une cristallisation de 50° C avec des concentrations alimentation de 0,35 M (nasale) et 0,25 M (H2SO4) figurent au tableau 1.
Le tableau 1. Données de cristallisation
| Débit, en mL/min | Τ |  |
Cnasale | CSAL | Y1 | Y2 | |
| NaSAL | H2SO4 | min | mm | mol/L | g/mL | % | % |
| 119 | 59,5 | 23.3 | 700 | 0,063 | 0,022 | 69 | 72 |
| 85 | 42,5 | 32,6 | 876 | 0,059 | 0,026 | 81 | 76 |
| 51 | 25.5 | 54,3 | 1190 | 0,055 | 0,026 | 81 | 77 |
Ces données ont servi également à résoudre pour G et B0 et régression linéaire a été réalisée afin de déterminer les pouvoirs « g » et « b » à l’aide de l’équation linéarisée (4). Régression linéaire des fonctions log (un exemple est illustré à la Figure 4) donne g = 1,1 et b = 2.4. Alors que la tendance des pouvoirs (b environ deux fois plus grand que g) était le même que celui observé à Franck et al., les puissances significativement différents, et les dépendances sur ΔC de sursaturation sont beaucoup plus petites. Ceci suggère que des facteurs autres que les ΔC pourraient avoir une incidence sur les taux de nucléation et de croissance, comme le brassage inadéquat, le pH relativement élevé (pour équimolaire nourrit sont le pH entre 2,2 et 2,4) et des impuretés ioniques introduites dans l’eau (l’approvisionnement municipal). Ces pouvoirs expérimentales servirait dans tous les calculs mesurent-vers le haut, parce qu’autre que ΔC, ces facteurs seraient vraisemblablement présents dans les deux les dessins à l’échelle pilote et industrielles.

La figure 4. Régression linéaire du taux de croissance G en fonction de la sursaturation ΔC
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Cette expérience a montré comment effectuer les mesures de concentration, de débit et de température brutes et théorie MSMPR permet d’estimer les paramètres clés nécessaires pour concevoir un système cristalliseur de vastes et complexes. Le rôle essentiel que joue la temps de séjour dans l’obtention de rendements de haute cristallerie et en contrôlant la taille moyenne des cristaux, a été explorée. Souvent, il y a un temps de séjour optimale puisque très gros cristaux est rarement souhaitable. Le même est vrai pour le mélange - mélange doit être suffisante pour garder les cristaux solides de se déposer au fond, mais en même temps, la vitesse de l’agitateur est souvent un coût d’exploitation important.
Certains des problèmes souvent vécue avec cet appareil - blocages partiels en raison de l’agglomération de particules, difficultés d’obtention de sursaturation uniforme grâce à un mélange imparfait et long temps pour atteindre l’état d’équilibre - sont communs à même bien conçu industriel cristallisoirs. C’est pourquoi les dessins cristalliseur vus dans la documentation du fabricant sont souvent étonnamment complexes.
Ce processus est similaire à cristallisations d’autres produits biologiques, comme la L-ornithine-L-aspartate, qui est utilisé pour traiter l’insuffisance hépatique chronique. Les précurseur de L-ornithine chlorhydrate frais 5 > 300$ / kg et est difficile à recycler, conception pour haute cristallerie donne est critique. Un exemple d’un antisolvent, par opposition à cristallisation pH-swing, biologique est le raffinement du danazol, un stéroïde synthétique utilisé pour traiter l’endométriose. 13 de nombreux médicaments sont hydrophobes avec faible solubilité dans l’eau. En dissolvant le produit brut danazol dans l’éthanol et puis re-il cristallise en mélangeant avec de l’eau, un produit plus pur et plus petites particules de crystal taille peut être obtenu. La cristallisation des protéines est une autre application importante, un exemple étant la production de lysozyme. 1 4
Cristallisoirs industriels peuvent être conçues pour produire des distributions de taille de cristal très étroite par le biais de l’application de la suppression des amendes (p. ex., un pumparound échangeur de chaleur qui augmente légèrement la température pour dissoudre les cristaux plus petits) et taille (de classification par exemple, un « élutriation cuisse » qui sépare les particules sur la base de leurs vitesses terminales, recueillant seulement la plus grande de la population). Ces conceptions ont été développées pour la cristallisation de sel inorganique, mais sont maintenant inscrites dans le domaine biologique.
Liste du matériel
| Nom | Compagnie | Numéro de catalogue | Commentaires |
| Agitateur, 150 W | Caframo | BDC 3030 | sur le réacteur |
| Circulation chauffage | NESLAB | RTE 110 | 0-100°C, pour réacteur |
| Pompes péristaltiques (2) | Cole-Parmer | MASTERFLEX L/S 7550-60, 1.6-100 tr/min, hp 0,1 | Pour les voies nasales et H2SO4 se nourrit |
| Pompe centrifuge | Cole-Parmer | 7553-00, 6-600 tr/min | Pour le recyclage du produit |
| Spectrophotomètre UV-Vis | Ocean Optics | 2000 USB | Pour l’analyse nasale soluble |
| Alimentation d’énergie UV-Vis | Ocean Optics | DT1000 CE | Pour une utilisation avec USB 2000 |
ANNEXE A – EN UTILISANT UN SPECTROMÈTRE
- Ouvrez le logiciel SpectraSuite. Allumez le UV et le VIS lampes sur la source. N’oubliez pas d’éteindre les feux après l’utilisation. Définir le mode d’acquisition à portée (bouton bleu de S sur la barre d’outils).
- Sur la barre d’outils modifier le Temps d’intégration à 250 ms, le scanne à moyenne 25et la Largeur du wagon couvert à 2. Cochez les cases pour Strobe/lampe activer, Correction foncé électriqueet Correction de lumière parasite.
- Préparer des fichiers Sombre spectre et Spectre de référence . Le spectromètre nécessite la génération d’un fichier de Spectre foncé et un Spectre de référence .
- Plonger la sonde dans un tube à essai rempli avec l’eau distillée.
- Pour créer un fichier de Spectre foncé , débrancher la sonde de la source lumineuse (boîte blanche). Le graphique devrait tracer près de l’axe des abscisses. Pour enregistrer votre nouvellement créé Spectre foncé, cliquez sur l’ampoule grise, puis fichier -> Boutique -> magasin sombre du spectre.
- Pour créer un fichier de Spectre de référence , rebranchez la connexion de la sonde dans la source de lumière. Certains sommets devraient apparaître sur le graphique en SpectraSuite. Pour enregistrer ce Spectre de référence, cliquez sur l’ampoule jaune, puis fichier -> Boutique -> magasin de spectre de référence.
- Si tous les paramètres sont modifiés (par exemple, temps d’intégration, etc.), le Sombre spectre et Spectre de référence doivent être générée de nouveau.
- Basculement d’une portée d’Absorbance (A) mode. Pour les solutions nasales, l’absorbance doit être observée à ~ 300-330 nm.
Quantification n’est possible que si les solutions d’acide salicylique/voies nasales suivent la Loi de Beer-Lambert (A est dans la région linéaire de " """). Pour l’ion salicylate, cette région est A < ~0.9 - 1. Ce critère donné anciens résultats, donne à penser que les solutions nasales doivent être diluées (avec l’eau distillée) à 0,05 g/L ou moins pour la quantification. Ensuite, les solutions inconnues peuvent être quantifiées en comparant à l’absorbance d’une solution étalon convenablement diluée :

où C est s concentration, une absorbance, « u » un inconnu et " "" une solution titrée de nasale. Remarque que les deux « u » et « s » doivent montrer absorbance dans le domaine de linéarité.
En spectroscopie, l’absorbance dépend de deux facteurs, le type de produit chimique et de sa concentration et la longueur de chemin d’accès dans le liquide. Changer la concentration par dilution.
Subscription Required. Please recommend JoVE to your librarian.
References
- C. Wibowo, L. O’Young and K.M. Ng, Chem. Eng. Prog., Jan. 2004, pp. 30-39.
- W.J. Genck, Chem. Eng. Prog., Oct. 2004, pp. 26-32.
- S. Takamatsu and D.D.Y. Ryu, Biotechnol. Bioeng., 32, 184-191 (1988).
- F. Wang and K.A. Berglund, Ind. Eng. Chem. Res., 39, 2101-2104 (2000).
- Y. Kim, S. Haam, Y.G. Shul, W.-S. Kim, J.K. Jung, H.-C. Eun and K.-K. Koo, Ind. Eng. Chem. Res., 42, 883-889 (2003).
- K. Hussain, G. Thorsen and D. Malthe-Sorenssen, Chem. Eng. Sci., 56, 2295-2304 (2001).
- H. Gron, A. Borissova and K.J. Roberts, Ind. Eng. Chem. Res., 42, 198-206 (2003).
- F. Lewiner, G. Fevotte, J.P. Klein and F. Puel, Ind. Eng. Chem. Res., 41, 1321-1328 (2002).
- For example: W.L. McCabe, J.C. Smith, and P. Harriott, “Unit Operations of Chemical Engineering”, 7th Ed., McGraw-Hill, New York, 2005, Ch. 27, or C.J. Geankoplis, “Transport Processes and Unit Operations”, 3rd Ed., 1993, Ch. 12.
- P. Barrett, Chem. Eng. Prog., Aug. 2003, pp. 26-32.
- R. Franck, R. David, J. Villermaux and J.P. Klein, Chem. Eng. Sci., 43, 69-77 (1988).
- J. Garside, Chem. Eng. Sci., 40, 3-26 (1985).
- H. Zhao, J.-X. Wang, Qi-An Wang, J.-F. Chen and J. Yun, Ind. Eng. Chem. Res. 46, 8229-8235 (2007).
- J.S. Kwon, M. Nayhouse, G. Orkoulas and P.D. Christofides, Ind. Eng. Chem. Res., 53, 15538-15548 (2014).





 (temps de séjour) en variant les débits volumétriques, mais maintien de l’équivalence stoechiométrique.
(temps de séjour) en variant les débits volumétriques, mais maintien de l’équivalence stoechiométrique.