Overview
Fonte: Kerry M. Dooley e Michael G. Benton, Departamento de Engenharia Química, Louisiana State University, Baton Rouge, LA
O processamento de bioquímicos envolve operações unitárias como cristalização, ultracentrifugação, filtração de membrana e cromatografia preparatória, todas em comum a necessidade de separar grandes de pequenas moléculas, ou sólidas do líquido. Destes, a cristalização é a mais importante do ponto de vista da tonelagem. Por essa razão, é comumente empregado nas indústrias farmacêutica, química e de processamento de alimentos. Exemplos bioquímicos importantes incluem separações quirais,1 purificação de antibióticos,2 separação de aminoácidos de precursores,3 e muitos outros farmacêuticos,4-5 aditivos alimentares,6-7 e purificações agroquímicas. 8 O controle da morfologia cristalina e da distribuição de tamanho é fundamental para a economia do processo, pois esses fatores afetam os custos das operações de processamento a jusante, como secagem, filtração e transporte de sólidos. Para obter mais informações sobre cristalização, consulte um livro didático especializado ou um livro didático de Operações unitárias. 9
A unidade cristalizadora (Figura 1) permite o estudo de: (a) os efeitos dos parâmetros-chave, como taxas de supersaturação e resfriamento/aquecimento, sobre conteúdo de sólidos, morfologia e distribuição do tamanho do cristal; b E o controle on-line dos processos de cristalização. A supersaturação pode ser controlada alterando condições como taxa de agitação e temperatura. As diferentes classificações de cristalização incluem resfriamento, evaporação, balanço de pH e modificação química. Neste experimento, um microscópio offline medirá a partir de cristais que variam em tamanho de 10-1000 μm, uma faixa de tamanho típico para biológicos.
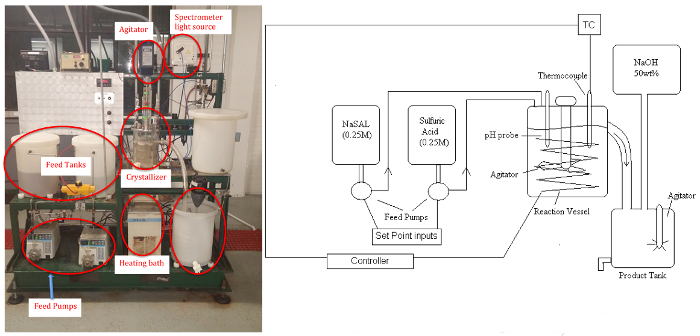
Figura 1: Esquema P&ID (esquerda) e imagem (direita)de Cristalizador. Clique aqui para ver uma versão maior desta figura.
Este experimento demonstrará uma cristalização "modificação química", ou "pH-swing", para gerar cristais de ácido salicílico (SAL) (precursor de aspirina) a partir da reação rápida de soluções aquosas de salicilato básico de sódio (NaSAL), que são ácido básico e sulfúrico (H2SO4) em qualquer lugar entre 40 e 80°C.
Na+SAL + 0,5 H2SO4 SAL (ppt) + Na+ + 0,5 SO42-
O subproduto sulfato de sódio permanece solúvel. O aparelho é composto por dois tanques de ração, três bombas de velocidade variável (peristáltica), o cristalizador (tanque mexido para temperatura e concentração uniforme aproximado, ~5 L), um banho circulante para controle de temperatura, controlador de energia, tanque de produto e um tanque de maquiagem para regeneração de ração com solução NaOH (se desejar). As amostras serão analisadas por um espectrômetro UV-Vis para o íon salicílico solúvel residual, e o produto de cristal ácido salicílico será seco e pesado. Uma sonda de pH pode ser usada para determinar estado estável quando as condições de reação são alteradas.
Principles
Um cristalizador de suspensão mista e remoção de produto misto (MSMPR) é análogo a um reator de tanque agitado contínuo - a mistura perfeita de fases sólidas e líquidas é assumida. Os cristalizadores industriais raramente (se nunca) abordam o comportamento do MSMPR, mas o conceito é útil em unidades de bancada e escala de piloto. Isso porque fornece uma maneira fácil de estimar parâmetros-chave como taxa de crescimento, G e taxa de nucleação, B0. Tanto cristais existentes quanto outras superfícies sólidas, como o agitador, catalisam a nucleação. A densidade numémia, n, dos cristais é uma densidade de probabilidade em relação a L, a dimensão cristalina primária. Portanto, n dL/(Σn dL) representa a fração de cristais de comprimento L a L+dL. Nos textos padrão é demonstrado que para um cristalizador MSMPR, a solução do modelo geral de equilíbrio populacional para n é:
 (1)
(1)
onde B0 é a função de cristalnucleação em mols/vol/tempo, e G é a taxa de crescimento dos cristais, dL/dt. A equação (1) prevê uma distribuição exponencial para a densidade numémia produzida em um MSMPR. Utilizando o zeroth (relacionado à concentração de cristal) e o primeiro (relacionado ao tamanho médio do cristal) momentos da distribuição, B0 e G são:
 (2)
(2) (3)
(3)
onde Cs é a concentração de cristais sólidos no chorume, τ é tempo de residência, que é aproximadamente o volume líquido dividido pela taxa de fluxo volumoso de alimentação, e  é o comprimento médio em uma base numérica, que é determinado microscopicamente.
é o comprimento médio em uma base numérica, que é determinado microscopicamente.
Portanto, para um cristalizador MSMPR, as taxas de crescimento e nucleação são determinadas pelos parâmetros de controle normais (taxa de agitação, temperatura, taxas de fluxo, etc.). No entanto, a distribuição deve ser sempre exponencial, e quaisquer desvios de uma distribuição exponencial representam uma mistura imperfeita dos sólidos ou do líquido. O cristalizador MSMPR (tanque mexido) é pouco adequado para cristalizações industriais porque fornece uma distribuição exponencial de tamanhos de cristal, enquanto na maioria das aplicações uma distribuição relativamente estreita, gaussiana, é desejada para a uniformidade do produto. Seu estudo é relevante porque: (a) é quase sempre um elemento de um desenho cristalizador maior; b É idealmente adequado para o trabalho em escala de banco e de plantas-piloto, pois o grau de supersaturação e taxas de crescimento e nucleação pode ser facilmente extraído dos dados brutos; e (c) é o exemplo mais fácil para o qual a geometria pode estar ligada à distribuição do tamanho do cristal.
Para temperatura constante e velocidade do agitador, tanto B0 quanto G estão diretamente relacionados com a supersaturação ΔC, que é a força motriz de transferência de massa para cristalização:12
 (4)
(4)
Os poderes b e g são específicos do sistema e podem variar em uma ampla faixa (por exemplo, 1-7.2 para g). 12
Subscription Required. Please recommend JoVE to your librarian.
Procedure
Soluções orgânicas (saliciilato de sódio, NaSAL) e ácido (ácido sulfúrico, 0,25 M = 0,50 N) serão alimentados com o cristalizador. Certifique-se de usar luvas de látex ao manusear NaSAL, ácido salicílico ou suas soluções, e o ácido sulfúrico de 0,25 M.
Todo o sistema é controlado a partir de um PC usando um controlador distribuído comercial com uma interface semelhante à da Figura 1. Todas as válvulas solenoides on-off ou de 3 vias e os set points do controlador podem ser operados e alterados usando esta interface. Um esquema mostra tendências dos valores analógicos (taxas de fluxo, temperatura) associados à unidade.
1. Iniciando o Cristalizador
No início de uma corrida, todos os controladores contínuos devem estar no modo manual, e todas as válvulas solenoides devem ser fechadas (on-off) ou no modo de reciclagem (3 vias).
- Certifique-se de que o cristalizador está cheio ao nível de transbordamento, (~4,15 L) indicado no tanque mexido, com água e pasta de ácido salicílico (na cristalização, o chorume é muitas vezes chamado de "magma"). Se não estiver cheio, adicione-os através da porta de adição.
- Ligue o agitador para o cristalizador e othermostado para o banho e as bombas.
- Coloque o controlador de temperatura para a temperatura do banho para AUTO e o ponto de configuração para a temperatura desejada. A temperatura recomendada é de ~53°C para um cristalizador de 50°C.
- Defina as velocidades da bomba usando a interface (por exemplo, 30% aberta). Conhecendo as concentrações dos rações, defina as taxas de fluxo para equivalência estequiométrica com base na Equação (1).
- Confirme se o tanque do produto não está cheio e que a válvula de drenagem está fechada.
- Ligue o equipamento espectrômetro e estabeleça comunicação com um link fornecido no console de controle. Os procedimentos do espectrômetro estão detalhados no manual de operação (SpectraSuite). A calibração do espectrômetro é fornecida.
2. Operando o Cristalizador
- Aumente a saída da bomba conforme necessário para atingir as taxas de fluxo desejadas. Para a solução ácida, este é ~25-35 mL/min. Para o NaSAL, é determinado pela equivalência estequiométrica.
- Mude para modo de alimentação em ambas as válvulas de 3 vias. Este é o tempo zero para um experimento.
- Verifique periodicamente a linha de transbordamento. Sob certas condições, pode bloquear. Se assim for, use um pedaço de tubo de aço para retirar a linha que entra no tanque do produto.
- Colete cinco amostras diretamente do cristalizador através da porta de amostra usando uma pipeta de boca larga e transfira-as para tubos de teste de 15 mL ou centrífuga. Pegue dois conjuntos de amostras com cerca de 10-15 minutos de distância.
- Repita em dois outros tempos de residência amplamente espaçados, controlando (tempo de
 residência) variando as taxas de fluxo volumétrico, mas mantendo a equivalência estequiométrica.
residência) variando as taxas de fluxo volumétrico, mas mantendo a equivalência estequiométrica.
3. Desligando o Cristalizador
- Para desligar o sistema, ajuste as válvulas de 3 vias para reciclar e as saídas da bomba para 0 %.
- Devolva o controlador de temperatura ao MANUAL a 0% de saída e desligue as bombas, agitadores e banho termostato.
- Se usar o espectrômetro, lembre-se de desligar as lâmpadas.
4. Análise
As concentrações de naSAL e ácido salicílico dissolvida podem ser medidas simultaneamente pela espectroscopia UV/Vis. As absorções de salicilato dissolvido e ácido salicílico podem ser assumidas aditivas porque o mesmo cromoforo é observado. Outras instruções estão incluídas no apêndice A. A concentração de ácido salicílico também pode ser determinada gravimetricamente em unidades de pasta de kg/m3.
- Centrifugar os tubos de 15 mL por 5 min e registrar o volume de amostra líquida recuperada por decantação. O líquido decantado pode ser usado para análise espectrofotométrica NaSAL.
- Seque os tubos de ensaio contendo os sólidos eretos no forno de convecção a 70ºC, por dois dias.
- Pesar, limpar os tubos e secar brevemente antes de re-pesar para obter o peso dos cristais.
A cristalização industrial é aplicada para a separação e purificação de compostos e misturas. Para projetar sistemas econômicos, vários parâmetros devem ser estudados. A cristalização é utilizada para a separação de compostos quiral e aminoácidos, ou para purificação de antibióticos, aditivos alimentares e compostos agroquímicos. Diferentes meios de cristalização incluem resfriamento, modificação química, evaporação ou balanço de pH. Um cristalizador pode ser usado para investigar parâmetros-chave que afetam o desenvolvimento de cristais, como resfriamento e taxas ou supersaturação. Com o microscópio, o tamanho do cristal e a morfologia podem ser monitorados e dependências de vários fatores observados. Neste experimento, o salicilato de sódio é reagido com ácido sulfúrico, levando à precipitação do ácido salicílico, que é um precursor da Aspirina. As amostras são analisadas por UV vis, uma análise gravimétrica e microscopia. Este vídeo ilustrará o conceito, análise e aplicação de uma unidade cristalizadora.
Para uma escala de um cristalizador, é importante estimar parâmetros-chave. Estes podem ser estudados usando uma unidade MSMPR. Embora os cristalizadores industriais realmente se comportem como MSMPRs, o conceito ainda é relevante para unidades de bancada e escala piloto. O cristalizador MSMPR é análogo a um reator contínuo e agitado. Assume uma mistura perfeita de fases sólidas e líquidas. Os MSMPRs são usados para avaliar parâmetros-chave de cristalização, como a taxa de nucleação cristalina, que também é conhecida como função de nascimento e taxa de crescimento de cristal. A nucleação é catalisada por cristais existentes e superfícies sólidas, como as paredes do reator. O modelo geral de equilíbrio populacional para um cristalizador MSMPR produz a densidade numémia N dos cristais, que é uma densidade de probabilidade em relação a L, a dimensão cristalina primária. Em um MSMPR, a distribuição de números é prevista para ser uma distribuição exponencial. A função de nascimento e a taxa de crescimento podem ser determinadas utilizando o zero e os primeiros momentos dessa distribuição. Mais importante, eles também podem estar relacionados com a supersaturação, que é a força motriz de transferência de massa na cristalização, e que, por sua vez, depende da taxa de agitação e temperatura. Para uma temperatura constante e velocidade do agitador, tanto a função de nascimento quanto a taxa de crescimento estão diretamente relacionadas à supersaturação, e os poderes B e G podem ser determinados pela regressão linear. De acordo com o modelo MSMPR, a densidade numédicamente de cristais diminui exponencialmente com o comprimento. Um desvio da distribuição exponencial implicaria uma mistura imperfeita de sólidos ou líquidos. Em aplicações industriais, são necessárias distribuições gaussianas relativamente estreitas de tamanhos de cristal, em vez de exponenciais. No entanto, o modelo MSMPR ainda é útil, particularmente em plantas piloto, pois permite a determinação das taxas de crescimento e natalidade, bem como o grau de supersaturação a partir de dados brutos. Agora que você está familiarizado com o modelo MSMPR, vamos aplicar o conceito ao experimento.
Use EPI adequado ao manusear soluções de salicilato de sódio e ácido sulfúrico. Anote as propriedades físicas básicas do ácido salicílico para uso posterior. Antes de começar, familiarize-se com o sistema de cristalização. O aparelho consiste em dois tanques de ração, bombas de velocidade variável, um tanque de cinco litros de cristalização, um banho circulante para controle de temperatura, controlador de energia, tanque de produto e um tanque de maquiagem para regeneração alimentar, usando uma solução de hidróxido de sódio. O sistema é operado usando um sistema de controle distribuído e uma interface gráfica, a partir da qual as válvulas podem ser operadas para controlar a temperatura e o fluxo. Uma saída esquemática que fornece tendências de vazão e temperatura também está disponível.
Verifique se todos os controladores contínuos estão definidos no modo manual, e se todas as válvulas solenoides estão no modo fechado, bidirecional ou no modo de reciclagem, de três vias. Certifique-se de que o cristalizador está cheio de água e um pouco de chorume ácido salicílico ao nível de transbordamento de aproximadamente 4,15 litros, como indicado no tanque mexido. Adicione água e ácido salicílico usando a porta de adição se o tanque não estiver cheio. Ligue o agitador para o cristalizador e o banho e as bombas termostatos. Defina o controlador de temperatura para a temperatura do banho em automático, e o ponto de partida para a temperatura desejada, geralmente aproximadamente 53 graus Celsius para um cristalizador de 50 graus Celsius. Defina as velocidades da bomba para dar aproximadamente 25 a 35 mililitros por minuto para a solução ácida. Para o salicilato de sódio, a taxa de fluxo é determinada por equivalentes estequiométricos. Usando as concentrações de alimentação conhecidas, defina as taxas de fluxo para equivalentes estequiométricos. Certifique-se de que o tanque do produto não está cheio e que a válvula de drenagem esteja fechada. Em seguida, ligue o espectrômetro e use um link fornecido no console de controle para verificar se a comunicação entre o aparelho está estabelecida.
Mude para modo de alimentação em ambas as válvulas de três vias. Isso define o tempo zero para uma experiência. Verifique periodicamente a linha de estouro para qualquer bloqueio. Use um pedaço de tubo de aço para remotamente a linha que entra no tanque do produto usando o orifício fornecido se o bloqueio for detectado. Após uma hora, use uma pipeta de boca larga e insira-a na porta de amostra do cristalizador. Colete amostra suficiente para preencher o suficiente cinco centímetros de centrífugas de 15 mililitros ou tubos de ensaio. Pegue dois conjuntos de amostras de 10 a 15 minutos de diferença. Varie as taxas de fluxo volumoso para controlar o TOW e ajuste para dois outros dois tempos de residência amplamente espaçados. Mantenha os equivalentes estequiométricos e colete amostras como antes. Quando terminar, ajuste a saída da bomba para zero por cento, as válvulas de três vias para reciclar. Devolva o controlador de temperatura ao manual a zero por cento de saída e desligue as bombas, agitadores e banho termostato.
A concentração de íon salicilato pode ser determinada usando UV vis e a concentração de ácido salicílico sólido pode ser determinada gravimetricamente como quilogramas por quilogramas por quilograma em cubos de chorume. Antes da análise, as primeiras amostras centrífugas por cinco minutos e decantam o líquido. Regisso volume total da amostra recuperada. Misture as amostras líquidas de um determinado conjunto e dilua em 50 a 100 vezes. Para o líquido, meça a absorvância do salicilato de sódio e o ácido salicílico utilizando o espectrômetro UV vis. Supõe-se que a absorvância seja aditiva, uma vez que o mesmo cromoforo é detectado para ambas as amostras. Para a determinação gravimétrica, use os sólidos restantes nos tubos de centrífugas ou ensaios. Seque os tubos eretos no forno de convecção a 70 graus Celsius por dois dias. Em seguida, resfrie os tubos de ensaio resfriados para determinar o peso dos cristais e a concentração em quilogramas por litro. Por último, utilizando um microscópio, determina a distribuição de comprimento dos cristais de ácido salicílico em forma de agulha.
Calcule a concentração de cristal sólido para todas as corridas através do método gravimétrico. Gere um equilíbrio de massa no salicilato. Então, calcule a supersaturação e o tempo de residência. Em seguida, determine os rendimentos do cristal em uma base de ração e produto, usando as verrugas do produto, alimentação e o produto salicilato dissolvido. Use a concentração de cristal, a dimensão cristalina e o tempo de residência para resolver para a função de nascimento e taxa de crescimento. Em seguida, estime os poderes G e B através de regressões lineares das funções de tronco. Aqui está um exemplo de cristalização a 50 graus Celsius. O poder de B é duas vezes maior que G, indicando que a supersaturação está afetando a taxa de natalidade mais do que a taxa de crescimento. Esses poderes seriam usados para escalar se a supersaturação não for alterada. Comparações com outros experimentos podem identificar fatores que influenciam as funções de crescimento e nascimento, como mistura inadequada, pH e impurezas iônicas na água de compor.
A cristalização industrial é amplamente aplicada nas indústrias farmacêutica, química e de processamento de alimentos para separação e purificação de vários compostos. Danazol é esteroide sintético que é usado para o tratamento da endometriose. Como em muitos outros compostos farmacêuticos, o Danazol é hidrofóbico e mal solúvel em água. Portanto, o produto Danazol bruto é inicialmente dissolvido em etanol e depois recriminado misturando-o com um pouco de água, que produz cristais puros, pequenos tamanhos de partículas. Os cristalizadores industrializados podem ser utilizados na produção de licososmos. O aparelho pode ser projetado para produzir uma distribuição muito estreita do tamanho de cristal através da aplicação de uma bomba em torno do trocador de calor, o que eleva ligeiramente a temperatura para dissolver os menores cristais. A distribuição de tamanho pode ser regulada separando as partículas de cristal com base em suas velocidades terminais. Esse conceito também encontra aplicação na cristalização de sais inorgânicos.
Você acabou de assistir a introdução de Jove à cristalização industrial. Agora você deve entender o modelo de cristalizador MSMPR, como operar a unidade de cristalização e como analisar os resultados. Obrigado por assistir.
Subscription Required. Please recommend JoVE to your librarian.
Results
A Figura 2 apresenta dados representativos que sugerem desvios modestos da distribuição do tamanho de cristal do ideal do MSMPR mesmo em velocidades relativamente altas e baixas concentrações de alimentação.

Figura 2. Distribuição de tamanho de cristal para alimentação NaSAL de 0,16 M, 540 rpm, 60 ° C
Os cristais que se formam a partir deste experimento são tipicamente em forma de agulha, e a distribuição de comprimento pode ser determinada microscopicamente. Comprimentos de amostra com dimensões de tamanho (em mícrons) de cristais típicos são mostrados na Figura 3. A faixa normal e preferida de cristais é de 100-1000 mícrons.

Figura 3. Cristais de ácido salicílico ampliados. Os tamanhos estão em mícrons. Clique aqui para ver uma versão maior desta figura.
Assumindo as equações do cristalizador MSMPR (1-4), e utilizando um equilíbrio de massa no salicilato, corre a concentração de cristais sólidos no magma (CSAL),os tempos de residência (τ), as funções de taxa de crescimento G, quantidades de supersaturação na fase aquosa ΔC em uma base molar, função de nucleação B0, e os rendimentos de cristal em um produto e uma alimentação de base foram determinados. A função G foi calculada a partir da Equação (3) usando a distribuição de tamanho. E as equações de supersaturação e equilíbrio de massa são:
 (5)
(5)
 (6)
(6)
onde o Q1 é a taxa de fluxo volumétrico da solução NaSAL, Qt é taxa de fluxo volumétrico total, (CNaSAL)0 é a concentração de alimentação de NaSAL no Q1, e CNaSAL e CSAL são as concentrações do produto de salicilato solúvel e cristais, respectivamente. Ceq é a concentração de equilíbrio (interfacial) de salicilato, que foi ~2,2 g/L sobre a faixa de temperatura usada nesta demonstração.
O rendimento foi definido em uma base de alimentação como:
 (7)
(7)
E em uma base somente de produtos como:
 (8)
(8)
Se o erro % no equilíbrio de massa no salicilola é grande, então é provável que cSAL ou CNaSAL estejam em erro, pois ambos são difíceis de medir com precisão. Olhando para os valores de Y1 e Y2 (no qual dá uma tendência mais razoável), a fonte primária do erro pode ser determinada.
Dos valores para G e B0,os poderes "g" e "b" na Equação (4) foram estimados por regressão linear. Franck et al. relata um poder "g" de ~3 e "b" de ~6 para este sistema11 usando condições altamente estéreis e altas velocidades de agitador. Determinar as diferenças entre as potências experimentais "g" e "b" e as de Franck et al. é útil na identificação de fatores que possam estar influenciando as funções de crescimento e nucleação. Dados representativos para uma cristalização de 50°C com concentrações de alimentação de 0,35 M (NaSAL) e 0,25 M (H2SO4) são mostrados na Tabela 1.
Mesa 1. Dados de cristalização
| Taxa de fluxo, mL/min | τ |  |
CNaSAL | CSAL | Y1 | Y2 | |
| Nasal | H2SO4 | Min | milímetro | mol/L | g/mL | % | % |
| 119 | 59.5 | 23.3 | 700 | 0.063 | 0.022 | 69 | 72 |
| 85 | 42.5 | 32.6 | 876 | 0.059 | 0.026 | 81 | 76 |
| 51 | 25.5 | 54.3 | 1190 | 0.055 | 0.026 | 81 | 77 |
Esses dados também foram utilizados para resolver para G e B0 e a regressão linear foi realizada para determinar os poderes "g" e "b" utilizando a Equação linearizada (4). Regressão linear das funções de tronco (um exemplo é mostrado na Figura 4) deu g = 1,1 e b = 2,4. Embora a tendência nos poderes (b cerca de duas vezes maior que g) fosse a mesma observada em Franck et al., os próprios poderes diferem significativamente, e as dependências da supersaturação ΔC eram muito menores. Isso sugere que outros fatores além do ΔC podem estar afetando as taxas de crescimento e nucleação, como a mistura inadequada, os pH's relativamente altos (para alimentação equimolar os pH's estão entre 2,2-2,4), e impurezas iônicas introduzidas na água (o abastecimento municipal). Esses poderes experimentais seriam usados em qualquer cálculo de escala, porque além de ΔC, esses fatores provavelmente estariam presentes tanto na escala piloto quanto nos projetos industriais.

Figura 4. Regressão linear da taxa de crescimento G em função da supersaturação ΔC
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Este experimento demonstrou como fazer medições de concentração bruta, fluxo e temperatura e usar a teoria do MSMPR para estimar os parâmetros-chave necessários para projetar um sistema cristalizador grande e complexo. O papel crítico que o tempo de residência desempenha na obtenção de altos rendimentos de cristais e no controle do tamanho médio dos cristais, foi explorado. Muitas vezes há um tempo de residência ideal porque cristais muito grandes raramente são desejáveis. O mesmo vale para a mistura - a mistura deve ser suficiente para evitar que os cristais sólidos se instalem até o fundo, mas ao mesmo tempo a velocidade do agitador é muitas vezes um custo operacional significativo.
Alguns dos problemas frequentemente experimentados com esta unidade - bloqueios parciais devido à aglomeração de partículas, dificuldades na obtenção de supersaturação uniforme devido à mistura imperfeita, e longos tempos para atingir estado estável - são comuns até mesmo a cristalizadores industriais bem projetados. É por isso que os desenhos cristalizadores vistos na literatura dos fabricantes são muitas vezes incrivelmente complexos.
Este processo é semelhante às cristalizações de outros biológicos, como l-ornithine-L-aspartato, que é usado para tratar insuficiência hepática crônica. 5 O cloridrato L-ornithine precursor custa >$300/kg e é difícil de reciclar, por isso o design para altos rendimentos de cristais é fundamental. Um exemplo de um antisolvente, em oposição ao pH-swing, cristalização biológica é o refinamento do danazol, um esteroide sintético usado para tratar a endometriose. 13 Muitas drogas são hidrofóbicas com má solubilidade na água. Dissolvendo o produto danazol bruto no etanol e, em seguida, re-cristalizá-lo misturando-se com água, um produto cristalizador de tamanho de partícula mais puro e menor pode ser obtido. A cristalização das proteínas é outra aplicação importante, sendo um exemplo a produção de lysozyme. 14
Os cristalizadores industriais podem ser projetados para produzir distribuições muito estreitas do tamanho do cristal através da aplicação da remoção de multas (por exemplo, um trocador de calor que aumenta ligeiramente a temperatura para dissolver os menores cristais) e classificação de tamanho (por exemplo, uma "perna de elutriação" que separa partículas com base em suas velocidades terminais, coletando apenas os maiores da população). Esses conceitos de design foram desenvolvidos para cristalização inorgânica do sal, mas agora estão se movendo para o reino biológico.
Lista de Materiais
| Nome | Companhia | Número do catálogo | Comentários |
| Agitador, 150 W | Caframo | BDC 3030 | no reator |
| Aquecedor circulante | Neslab | RTE 110 | 0-100°C, para reator |
| Bombas peristálticas (2) | Cole-Parmer | Masterflex L/S 7550-60, 1.6-100 rpm, 0.1 cv | Tanto para naSAL quanto H2SO4 alimenta |
| Bomba centrífuga | Cole-Parmer | 7553-00, 6-600 rpm | Para reciclagem de produtos |
| Espectrofotômetro UV-Vis | Óptica Oceânica | USB 2000 | Para análise solúvel de NaSAL |
| Fonte de alimentação UV-Vis | Óptica Oceânica | DT1000 CE | Para uso com USB 2000 |
APÊNDICE A – UTILIZANDO O ESPECTRÔMETRO
- Abra o software SpectraSuite. Ligue as lâmpadas UV e VIS na fonte. Certifique-se de desligar as lâmpadas depois de usar. Defina o modo de aquisição para Escopo (botão Azul S na barra de ferramentas).
- Na barra de ferramentas altere o Tempo de Integração para 250 ms,os Scans para Média para 25e a Largura do Carro de Caixa para 2. Verifique as caixas para estroboscóvia/ativação da lâmpada, correção escura elétricae correção da luz perdida.
- Prepare arquivos dark spectrum e reference spectrum. O espectrômetro requer a geração de um arquivo Dark Spectrum e um arquivo Spectrum de referência.
- Mergulhe a sonda em um tubo de ensaio cheio de água DI.
- Para criar um arquivo Dark Spectrum, desligue a sonda da fonte de luz (caixa branca). O gráfico deve quase rastrear o eixo x. Para salvar seu espectro escurorecém-criado, clique na lâmpada cinza e, em seguida, faça o arquivo -> store -> armazenar espectro escuro.
- Para criar um arquivo Reference Spectrum, conecte a conexão do teste de volta à fonte de luz. Alguns picos devem aparecer no gráfico em SpectraSuite. Para salvar este espectro de referência,clique na lâmpada amarela e, em seguida, faça o arquivo -> Store -> Armazenar espectro de referência.
- Se ALGUMA configuração for alterada (por exemplo, Tempo de Integração, etc.), o Espectro Escuro e o Espectro de Referência devem ser gerados novamente.
- Mude do modo Escopo para Absorvância (A). Para as soluções NaSAL, a absorvância deve ser observada em ~300 - 330 nm.
A quantificação só é possível se as soluções de ácido naSAL/salicílico seguirem a lei Beer-Lambert (A está na "região linear"). Para o íon salicílate, esta região é A < ~0,9 - 1. Dado os resultados passados, este critério sugere que as soluções NaSAL devem ser diluídas (com água DI) a 0,05 g/L ou menos para quantificação. Em seguida, as soluções desconhecidas podem ser quantificadas comparando-se à absorção de uma solução padrão adequadamente diluída:

onde C é concentração, A absorbance, "u" um desconhecido, e "s" uma solução padrão de NaSAL. Observe que ambos "u" e "s" devem mostrar absorvância dentro da faixa linear.
Na espectroscopia, a absorvância depende de dois fatores, o tipo de produto químico e sua concentração, e o comprimento do caminho no fluido. Mude a concentração por diluição.
Subscription Required. Please recommend JoVE to your librarian.
References
- C. Wibowo, L. O’Young and K.M. Ng, Chem. Eng. Prog., Jan. 2004, pp. 30-39.
- W.J. Genck, Chem. Eng. Prog., Oct. 2004, pp. 26-32.
- S. Takamatsu and D.D.Y. Ryu, Biotechnol. Bioeng., 32, 184-191 (1988).
- F. Wang and K.A. Berglund, Ind. Eng. Chem. Res., 39, 2101-2104 (2000).
- Y. Kim, S. Haam, Y.G. Shul, W.-S. Kim, J.K. Jung, H.-C. Eun and K.-K. Koo, Ind. Eng. Chem. Res., 42, 883-889 (2003).
- K. Hussain, G. Thorsen and D. Malthe-Sorenssen, Chem. Eng. Sci., 56, 2295-2304 (2001).
- H. Gron, A. Borissova and K.J. Roberts, Ind. Eng. Chem. Res., 42, 198-206 (2003).
- F. Lewiner, G. Fevotte, J.P. Klein and F. Puel, Ind. Eng. Chem. Res., 41, 1321-1328 (2002).
- For example: W.L. McCabe, J.C. Smith, and P. Harriott, “Unit Operations of Chemical Engineering”, 7th Ed., McGraw-Hill, New York, 2005, Ch. 27, or C.J. Geankoplis, “Transport Processes and Unit Operations”, 3rd Ed., 1993, Ch. 12.
- P. Barrett, Chem. Eng. Prog., Aug. 2003, pp. 26-32.
- R. Franck, R. David, J. Villermaux and J.P. Klein, Chem. Eng. Sci., 43, 69-77 (1988).
- J. Garside, Chem. Eng. Sci., 40, 3-26 (1985).
- H. Zhao, J.-X. Wang, Qi-An Wang, J.-F. Chen and J. Yun, Ind. Eng. Chem. Res. 46, 8229-8235 (2007).
- J.S. Kwon, M. Nayhouse, G. Orkoulas and P.D. Christofides, Ind. Eng. Chem. Res., 53, 15538-15548 (2014).





 residência) variando as taxas de fluxo volumétrico, mas mantendo a equivalência estequiométrica.
residência) variando as taxas de fluxo volumétrico, mas mantendo a equivalência estequiométrica.