Overview
ソース: パーチェットティボー1,2,3, ムニエ・シルヴァン1,2,3, ソフィー・ノヴォールト 4, レイチェル・ゴルブ1,2,3
リンパポイシスのための1ユニット、免疫学科、パスツール研究所、パリ、フランス
2 INSERM U1223, パリ, フランス
3ユニバーシテ パリ ディデロ, ソルボンヌ パリ シテ, セルレ パストゥール, パリ, フランス
4フローサイトメトリープラットから, サイトメトリーとバイオマーカー UtechS, 翻訳科学センター, パスツール研究所, パリ, フランス
免疫システムの全体的な機能は、感染性の生物や他の侵略者から体を守るためにあります.白血球、または白血球は、免疫系の主要なプレーヤーです。感染すると、それらは活性化され、免疫応答を開始する。白血球は、生物学的、物理的、および/または機能的(例えば、サイズ、粒度、分泌)であり得る異なるパラメータに基づいて、様々なサブ集団(例えば、骨髄細胞、リンパ球、樹状細胞)に分けることができる。白球を特徴付ける一つの方法は、主に受容体である表面タンパク質を介してです。各白色細胞集団は、集団間のサブセットを定義できる受容体(例えば、細胞傷害性、活性化、移行受容体)の特定の組み合わせを発現する。免疫系は広範囲の細胞集団を包含するので、免疫応答への参加を解読するためにそれらを特徴付ける必要があります。
フローサイトメトリー(FCまたはFCM)は、細胞表面および細胞内分子の発現を分析し、異種細胞混合物中の異なる細胞タイプを特徴付け、定義するための広く使用されている方法である。フローサイトメーターは、流体、光学、エレクトロニクスの3つの主要なサブシステムで構成されています。流体システムは、レーザーの前を1つずつ通過できるように、流れの中で細胞を輸送します。光学系は、粒子を照らす光源(レーザー)、得られた光を照らす光学フィルター、蛍光信号から適切な検出器で構成されています。最後に、エレクトロニクスシステムは、検出された光信号をコンピュータで処理できる電子信号に変換します。個々のセルがレーザー光の前を通過すると、光が散乱します。ビームの前にある検出器は、前方散乱(FS)と側面測定側散乱(SC)に複数の検出器を測定します。FSは細胞サイズと相関し、SCは細胞の粒度に比例する。このようにして、細胞集団は、多くの場合、その大きさと粒度のみの違いに基づいて区別することができます。
細胞の大きさ、形状、複雑さを解析することに加えて、フローサイトメトリーは細胞表面受容体の発現を検出するために広く使用されています(1)。これは、既知の細胞特異的受容体に結合するフルオロクロム標識モノクローナル抗体を使用することによって達成される。励起時に、これらの結合したフルオロクロムは、検出およびスコア付け可能な発光波長と呼ばれる特定の波長の光を放出します。蛍光測定は、フルオロクロム標識細胞表面受容体に関する定量的および定性的なデータを提供します。血液学者は、免疫細胞集団の治療フォローアップのためにFCを最初に使用した(2)。現在では、免疫表現、細胞生存率、遺伝子発現、細胞数計、GFP分析など幅広い用途に使用されています。
FACS(蛍光活性化細胞選別機)は、蛍光標識を用いて細胞の集団を亜集団に分類する特殊なタイプのフローサイトメトリーです。従来のフローサイトメトリーと同様に、最初のFS、SC、蛍光データが収集されます。次に、機械は電荷(負または正)を適用し、静電偏向システム(電磁石)は、適切なチューブに細胞を含む帯電液滴の収集を容易にする。
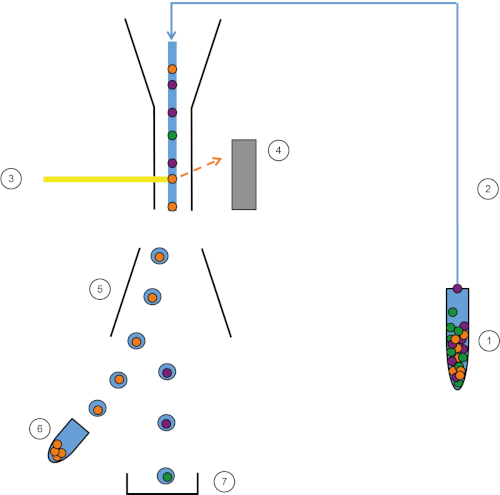
図 1: FACS の概略表現。試料(1)はFACS(2)で吸引され、レーザー(3)の前に通過する。細胞蛍光は蛍光検出器(4)によって感知される。最後に、細胞は液滴に組み込まれ、目的の細胞は偏向板(5)によって偏向し、集採取管(6)に集まる。残りのセルはゴミ箱に入ります (7)。この図のより大きなバージョンを表示するには、ここをクリックしてください。
FACS の並べ替えの側面には、多くの利点があります。RT-qPCR、細胞周期、サイトカイン分泌などの遺伝子発現の解析など、免疫系における特定の細胞の役割を理解するのに役立つ多くのテストがあります。しかし、明確で具体的な結果を得るために、細胞を上流に精製する必要があります。ここで、FACSは有用であり、所望の細胞は非常に高い純度で選別することができ、信頼性が高く、再現可能な結果をもたらす。FACSはまた、核または他の細胞内染色に基づいて、および表面受容体の存在、不在、および密度に応じて細胞をソートするために使用することができます。FACSは現在、細胞の亜集団の精製のための標準的な技術であり、同時に4つの集団までソートする能力を有する。
このラボ演習では、脾臓白血病を単離する方法と、FACSを用いて脾臓白血病細胞混合物からBリンパ球細胞を特異的にソートする方法を示す。
Procedure
1. 準備
- 始め始めの前に、実験室の手袋と適切な防護服を着用してください。
- すべての解剖ツールを殺菌し、まず洗剤で、次に70%のエタノールで乾燥させ、その後完全に乾燥させます。
- 2%の胎児子牛血清(FCS)を含むハンクのバランス塩溶液(HBSS)の50mLを調調します。
2. 解剖
- 二酸化炭素送達システムを用いて、低酸素症でマウスを安楽死させる。サパンの位置の解剖プレート上で安楽死マウスを固定し、はさみと鉗子を使用して縦開腹術を行います。
- 鉗子を使用して、腹部の右側に腸と胃を動かして胃と脾臓を露出させる。脾臓は胃に付着している。
- 鉗子を使用して、慎重に胃から脾臓を取り外し、HBSS 2%FCSの5mLを含むペトリ皿に入れます。
3. 免疫細胞分離
- 脾臓を40μmのセルストレーナーに置き、同じペトリ皿の上に置きます。脾臓をプランジャーでつぶし、同じ皿に切り離します。
- 解離された脾臓と流体を15mL遠心管に移します。
- 10°Cで7分間370 x gでチューブを遠心分離し、ペレットを避け、上清を廃棄します。
- 赤血球をlyseseにアセテートカリウムの2mLで再濁させる。2 分間待ってから、HBSS 2% FCS を使用して最大 15 mL の音量を構成します。
- 10°Cで7分間370 x gでチューブを再度遠心分離します。上清を廃棄し、HBSS 2%FCSの5mLでペレットを再懸濁します。
- トリパンブルー染色アッセイを用いて細胞をカウントし、HBSS 2%FCSの適切な体積を使用して、最終的な細胞濃度を107細胞/mLに調整します。
4. 細胞染色
- 細胞懸濁液の200μLを6本のFACSチューブに移し、1〜6の標識を付ける。
- 10°Cで7分間370 x gでチューブを遠心分離し、ペレットを避けて上清を廃棄します。
- 次に、表1に従って200μL HBSS 2%FCSに適切な量の抗体を添加して6種類の新規抗体混合物を調出す。
- 次に、これらの抗体混合物を対応する番号付きFACSチューブに移す。
- 細胞懸濁液を暗闇の氷上で20分間混合してインキュベートする。
- 各チューブにHBSS 2%FCSの1mLを追加し、10°Cで3分間370 x gで再び遠心分離機を追加します。
- 上清を廃棄し、HBSS 2%FCSの200μLでペレットを再懸濁する。
- 再懸濁ペレットを新しいFACSチューブに移します。

表1:抗体混合組成物。200μLのHBSS+抗体の6つの混合物を試験用に調製した。ミックス1はPMT設定用、ミックス2~5は補償設定用、ミックス6はセルソート用です。
5. FACSキャリブレーション
- まず、ソーターをオンにして「流体スタートアップ」を実行します。
- ストリームをオンにしてから、ストリームが安定するまで 15 分間待ちます。
- ストリームの振幅を調整して、離れたドロップ形成を取得します。次に、「スイート スポット」をクリックして振幅調整を完了します。
- ニュートラル密度(N.D.)フィルタ-1.0を入れ、サイトメーターの設定とトラッキングを表す「CST」インターフェースを開きます。
- 毎日の品質管理を実行するには、まず製造元の指示に従って FACS メディアで CST ビーズを希釈し、次に CST 制御を実行します。
- CST 制御が完了したら、N.D. 1.0 フィルターをサイトメーターの N.D. 2.0 フィルターに置き換えます。
- 次に、製造元の指示に従って FACS 媒体でドロップ遅延ビーズを希釈し、FACS にロードします。
- 適切な並べ替えがドロップ遅延を実行するようにするには -
- 最初に「電圧」をクリックし、次に「光フィルタ」をクリックします。右の象限は 100% に等しくする必要があります。必要に応じて、サイトメーターの左右の赤いレーザーネジを調整して、右象限で100%を得る。
- 次に、テストソートを実行して、ストリームが収集チューブに入っていることを確認します。これを行うには、[廃棄物の引き出し]をクリックし、[テストソート]を開始します。サイドストリームが収集チューブに入っていることを確認します。そうでない場合は、電圧を調整します。
- 実験テンプレートに移動します。次に、「Accudrop ドロップ遅延」の実験を開き、「並べ替えレイアウト」をクリックします。
- 流量を変更して、1 秒あたり 1000 ~ 3000 イベントを取得します。
- [電圧]をクリックし、[光フィルタ]をクリックします。左側の象限は 0 に、右の象限は 100 に等しくする必要があります。
- [レイアウトの並べ替え]ウィンドウで [並べ替え]をクリックし、[キャンセル]をクリックします。左側の象限は 100 に、右の象限は 0 に等しくする必要があります。左象限が95未満の場合は、自動的に調整するために「自動遅延」をクリックします。
6. フローサイトメトリーと純度制御
- チューブ1(染色されていない細胞)から始めてフローサイトメトリーを開始し、細胞形態とフルオロクロムの負のピークを定義する。前方および側面散乱を設定し、各蛍光パラメータの電圧を定義します。各ドット プロットのグリッドを使用して、最初の 10 年間に負の母集団を配置します。
- 次に、サイトメーターにチューブ2(単色制御)をロードする。負の母集団中央値と正の母集団中央値が整列するか、自動計算ソフトウェアを使用するまで、スペクトルの重なりを調整します。信号をスケールに保つことが重要です。補正コントロールは、実験用フルオロクロムと検出器の設定と一致する必要があります。10,000 イベントを記録します。
- チューブ 3、4、および 5 (その他の単一カラー コントロール) でこれらの手順を繰り返します。
- 次に、チューブ6(多染色細胞)をロードし、特定のゲーティング戦略を用いて目的の細胞集団を定義する。
- [レイアウトの並べ替え] ウィンドウで、対象のセルの人口を選択します。「ターゲットイベント」でセルしきい値を選択し、「精度」で精度レベルを選択します。ここでは 1 つの母集団のみが並べ替えられていますが、4 つの異なる母集団を同時に並べ替えることができます。
- 準備ができたら、"並べ替え"と"OK"をクリックし、セルの並べ替えを待ちます。
- 細胞の選別が完了したら、HBSS 2%FCSの90マイクロリットルの新しいFACSチューブに10μLのソートされた細胞を最初にピペッティングして純度制御を行います。
- 次に、チューブにサイトメーターをロードします。セルの表現型を記録および分析し、ゲーティング戦略が意図したとおりに機能したことを確認します。
7. データ分析
- 「FlowJo」ソフトウェアを開き、「すべてのサンプル」ウィンドウで各チューブのファイルをドラッグします。
- ファイルをダブルクリックして、新しいウィンドウで開きます。
- 「ポリゴン」をクリックし、以前に使用したゲーティング戦略を再作成します。
- 他のすべてのファイルで手順を繰り返します。
- ドットプロットを視覚化するには、「レイアウトエディタ」をクリックし、チューブ6から関心のある集団をドラッグし、レイアウトエディタタブで純度コントロールをドラッグします( セルは、純度コントロールに関心のある集団にのみ表示されます)(図2参照)。
- 選別された細胞内のBリンパ球の純度を確認するには、「テーブルエディタ」をクリックしてください。チューブ6からBリンパ球集団をドラッグし、テーブル内の純度コントロールを行います。
- [統計]メニューで CD45+セルの頻度を選択して、この細胞集団の純度をテストし、[テーブルを作成]をクリックします。
- パラメータ値は新しいテーブルに表示されます。純度制御ウィンドウで、CD45+細胞内のBリンパ球の頻度を確認し、98%より高くする必要があります(図2、下パネル参照)。
免疫系は、白血球とも呼ばれる白血球を生成することにより、病原体の侵入から体を保護します。病原体が正常に生物に感染すると、多種多様な白血病が活性化され、この協調反応は免疫応答と呼ばれる。
多くの場合、研究者は病原体に応答して活性化された免疫細胞の特定の種類と数を識別することができることが有用である。フローサイトメトリーは、研究者が表面に発現する特定のエピトープに基づいて細胞を分離することを可能にする技術です。これは、既知の免疫細胞特異的エピトープに結合するフルオロクロムタグ付きモノクローナル抗体を使用して達成され、励起時に、これらの結合フルオロクロムは、フローサイトメーターによって検出され、得点することができる光の波長を放出します。
フローサイトメーターは、3つのシステムで構成されています。流体系は、レーザーの前を1つずつ通過できるように、流れの中で細胞を輸送します。光学系は、蛍光色素の有無を認識するレーザーと検出器で構成されています。最後に、電子システムは、収集した光学データを分析用の電子ファイルに変換します。
フローサイトメトリーの拡張は、蛍光活性化細胞選別器(FACS)であり、特定の細胞集団を濃縮し、独立して研究することができます。細胞の選別は、マイクロ液滴を形成する流体流中の振動ノズルを使用して行われ、それぞれが単一の細胞を含む。次に、検出器は、各液滴から蛍光灯が放出されているかどうかを判断し、その情報に基づいて、電磁石は各細胞に負または正の電荷を与えます。次に、強い電界は、異なる帯電液滴を別々の容器にソートします。最終的に、容器の1つは、特定の細胞表面分子の発現に基づいて細胞の均質な集団を含む。
このビデオでは、フローサイトメトリーを使用してマウス脾臓組織とFACSから白血病を単離し、Bリンパ球を選択する方法を学びます。
まず、実験室の手袋と適切な防護服を着用してください。次に、解剖はさみと鉗子を洗剤で洗い、次に70%のエタノールで洗い、次にきれいなペーパータオルで乾かします。
次に、ハンクのバランス塩溶液(HBSS)を50ミリリットルのチューブに49ミリリットルを追加します。胎児ふくらはぎ血清(FCS)の1ミリリットルを追加し、HBSS 2%FCS溶液を作成し、約10回上下にゆっくりとパイプで混合します。
次に、解剖プレート上のスプーリン位置に安楽死マウスを置きます。はさみと鉗子で、腹腔にアクセスするために縦腹腔切り目を行う。鉗子を使用して腹部の右側の腸を片側に移動させ、胃と脾臓を露出させる。脾臓は胃に付着している。次に、ピペットを使って、HBSS 2%FCSの5ミリリットルをペトリ皿に入れます。鉗子を使用して、慎重に胃から脾臓を取り外し、ペトリ皿に脾臓を置きます。
免疫細胞を単離するには、まず脾臓を40ミクロンの細胞ストレーナーにペトリ皿に置きます。脾臓をプランジャーでつぶし、皿に切り離します。次に、ペトリ皿から解離した脾臓と流体を15ミリリットルの遠心管にピペットする。10°Cで7分間370回gでチューブを遠心分離し、ペレットを邪魔しないように慎重にチューブを取り出します。
次に、上清を取り出し、ペレットを避け、適切な廃棄物容器に液体を捨てます。次に、遠心管にACKライシングバッファーの2ミリリットルを追加し、赤血球を再中断し、lyseseします。2 分間待ってから、HBSS 2% FCS を追加して、合計体積が 15 ミリリットルになります。遠心分離を繰り返します。慎重にチューブを取得し、上清を廃棄します。HBSS 2% FCSの5ミリリットルで再びペレットを再中断します。
再懸濁した細胞を数えるために、トリパンブルーの5マイクロリットルで細胞懸濁液の5マイクロリットルを希釈する。次に、カバーガラスとマラセススライドの間にこの希釈された細胞懸濁液の5マイクロリットル滴を静かに堆積させます。さて、40倍の倍率で顕微鏡下で、存在する細胞の数を数える。次いで、HBSS 2%FCSの適切な体積を加えて1ミリリットル当たり7番目の細胞に細胞濃度を10に調整する。
免疫細胞を染色するには、まず6本のFACSチューブを1本から6本のラベルを貼ります。次に、200マイクロリットルの細胞溶液を6本のチューブのそれぞれに移す。これらのチューブを摂氏10度で7分間370回gで遠心し、上清を取り除きます。
次に、6 つの新しい FACS チューブを 1 ~ 6 個、ピペット 200 マイクロリットルの HBSS 2% FCS にそれぞれラベルを付けます。表1に従って各チューブに適切な量の抗体を添加して6種類の新規抗体混合を調出す。混合1は、抗体を添加しない無染色細胞用である。2~5個を混合し、それぞれ補償設定用に異なる単一抗体を含む。混合6は、ソートに使用される多染色細胞のための4つの抗体をすべて含む。
次に、これらの抗体混合物を対応する番号付きFACSチューブに移す。これらの溶液を摂氏4度または暗闇の氷の上で20分間インキュベートします。次に、各チューブにHBSS 2%FCSの1ミリリットルを追加し、再び遠心分離機を追加します。上清を廃棄し、HBSS 2%FCSの200マイクロリットルでペレットを再懸濁します。最後に、再懸濁ペレットを新しいラベル付きFACSチューブに移します。
FACS を実行するには、まずソーターをオンにします。次に、サイトメーターメニューを選択し、流体起動をクリックします。画面の指示に従います。
[ストリーム] タブで赤い十字をクリックしてストリームをオンにし、ストリームが安定するまで 15 分間待ちます。ストリーム タブに明確なデタッチされたドロップが表示されるまで、ストリームの振幅を調整します。次に、甘いスポットをクリックして振幅調整を完了します。レーザーの前に中性密度(ND)フィルタ1.0を挿入します。
画面上部のサイトメーターメニューを開き、サイトメーターの設定とトラッキングを表すCSTを選択します。毎日の品質管理を行うには、まず製造元の指示に従ってFACSチューブにFACS媒体を使用してCSTビーズを希釈します。次に、チューブをマシンにロードし、[CST] タブで [実行] をクリックして CST コントロールを実行します。
CST コントロールが完了したら、ND 1.0 フィルタをサイトメーターの ND 2.0 フィルターに置き換えます。次に、製造元の指示に従ってFACS媒体で落下遅延ビーズを希釈し、チューブをFACSにロードします。適切な並べ替えを行うには、まず電圧をクリックしてから光学フィルタをクリックしてドロップ遅延を実行します。光学フィルタの右象限は100%に等しく、ドロップの100%がマシンによって登録されていることを示します。必要に応じて、サイトメーターの左右の赤いレーザーネジを調整して、右象限で100%を得る。ストリームが収集チューブに入るようにすることが重要です。これを行うには、廃棄物の引き出しをクリックしてテストソートを実行し、並べ替えをテストします。サイドストリームが収集チューブに入っていることを確認します。そうでない場合は、並べ替えタブの下の電圧を調整します。
ブラウザタブを選択し、共有ビューをクリックして、実験用テンプレートに移動します。次に、Accudrop_DROP DELAY 実験を開き、並べ替えレイアウト ボタンをクリックします。次に、1 秒あたり 3,000 イベントに達するまで流量レートを操作して、取得ダッシュボードのしきい値レートを変更します。電圧をクリックし、光学フィルタをクリックします。左側の象限は 0 に、右の象限は 100 に等しい必要があります。
最後に、並べ替えレイアウト ウィンドウで、[並べ替え] をクリックし、[キャンセル] をクリックします。左側の象限は 100 に、右の象限は 0 に等しくする必要があります。左側の象限が 95 未満の場合は、[自動遅延] をクリックして、ソフトウェアに電圧を自動的に増加し、左側の象限のドロップの 100% を取得するように指示します。
フローサイトメトリーを開始するには、まず、無染色細胞を使用して、細胞形態とフルオロクロムの負のピークを定義します。これを行うには、マシン内の未染色セルを含むチューブ1を配置し、取得ダッシュボードタブの下に負荷をクリックします。[サイトメーター] タブで、セルの人口が画面上のドットの密度が高いように表示されるまで、前方と側面の散乱電圧を調整します。リンパ球は小さな細胞なので、前方散乱が低く、側の散乱が少ない。
次に、細胞メータータブのフルオロクロムの電圧を調整して、負のレベルの細胞集団がグローバルワークシートタブの最初の10年になるまで、背景蛍光を除去します。サイトメーターメニューで、ビュー構成をクリックし、すべてのフルオロクロムが存在することを確認します。次に、チューブ2をサイトメーターに入れ、負荷をクリックします。[サイトメーター] タブのスペクトルの重なりを調整し、負の母集団中央値と正の母集団中央値がグローバル ワークシート タブに揃えるまで調整します。[取得] タブで、イベントを [10,000 に記録する] パラメーターに設定し、レコードをクリックします。チューブ 3、4、および 5 でこれらの手順を繰り返します。
次に、多染色細胞を含むチューブ6をロードする。Bリンパ球を単離するには、まず、その形態に基づいて細胞をソートするパラメータを設定します。最初のウィンドウでは、Y 軸に FSC-A 前方散布領域をプロットし、X 軸上に SSC-A 側散布領域をプロットします。散布図では、各ドットはセルを表します。グローバル ワークシート上のポリゴン ゲートをクリックし、前方散布が低く、中間側散布を持つ母集団を選択します。新しいドット プロット ウィンドウで、ウィンドウを右クリックし、メニューから人口を表示し、[P1] をクリックします。
次に、新しいウィンドウで、X 軸上の Y 軸と CD45 の生存率をプロットして、生存可能な CD45 正のセルをゲートします。ポリゴン ゲートを使用して、生存率が低く CD45 信号の高いセルを円で囲み、P2 を選択して選択したセルを新しいウィンドウに表示します。次のウィンドウでは、CD45陽性白血病のゲートは、Tリンパ球を除く。X 軸に CD45 を、Y 軸に CD3 を使用して、高い CD45 信号と低い負の CD3 信号で母集団を丸め、P3 を選択します。最後に、Bリンパ球を同定するCD19陽性細胞のゲート。Y 軸に CD19 を、X 軸に CD3 を使用して、高い CD19 信号と低い負の CD3 信号で母集団を丸め、P4 を選択します。
すべての並べ替えパラメータが設定されました。次に、並べ替えレイアウト ウィンドウで、ゲートされた 4 番目の母集団である関心のある P4 の細胞母集団を選択し、B リンパ球のみをソートするようにマシンに指示します。ターゲット イベントを 10,000 セルに設定し、精度を純度に設定します。私たちは1つの人口だけを並べ替えています。ただし、最大 4 つの異なる母集団を同時に並べ替えることができます。準備ができたら、[並べ替え] と [OK] をクリックします。次に、セルの並べ替えを待ちます。
細胞の選別が完了したら、HBSS 2%FCSの90マイクロリットルの新しいFACSチューブに選別された細胞の10マイクロリットルをピペッティングすることにより、純度制御を実行します。チューブをサイトメーターに入れ、負荷をクリックしてからレコードをクリックしてセルの表現型を分析し、ゲーティング戦略が意図したとおりに機能したことを確認します。
次に、選別された細胞を分析し、マウス脾臓から単離した白血病の中のBリンパ球の割合を決定する。開始するには、FlowJo アイコンをダブルクリックし、各チューブのファイルをすべてのサンプル ウィンドウにドラッグします。
ポリゴンをクリックし、前のセクションで使用したゲーティング戦略を再作成します。次に、レイアウトエディタをクリックし、チューブ6から関心のあるBリンパ球母集団をドラッグし、純度コントロールをレイアウトエディタタブにドラッグします。この例では、右上のプロットは全脾細胞懸濁液からソートされたBリンパ球を表し、右下のプロットは純度コントロールです。細胞は、純度コントロールに関心のある集団にのみ現れるべきです。
ソートされた細胞内のBリンパ球の純度を確認するには、テーブルエディタをクリックします。Bリンパ球母集団をチューブ6からドラッグし、テーブル内の純度コントロールを行います。統計メニューで、この細胞集団の純度をテストするためにCD45陽性細胞の頻度を選択します。次に、[テーブルの作成] をクリックします。パラメータ値は新しいテーブルに表示されます。純度制御ウィンドウで、CD45陽性細胞内のBリンパ球の頻度を確認し、98%より高くする必要があります。
Subscription Required. Please recommend JoVE to your librarian.
Results
このプロトコルでは、FACS技術を用いて脾臓Bリンパ球を精製した。まず脾臓から白血病を単離し、染色した。Bセル表面マーカーを組み合わせて、それらをソートするゲーティング戦略を作成しました(図2、上パネル)。実験の最後に、採取管内の細胞が「純度試験」を介してB細胞であるかどうかを検証した。我々は同じゲーティング戦略を維持し、細胞の98%以上が実際にB細胞であることを観察しました(図2、下パネル)。したがって、FACSは、高純度で免疫細胞集団を単離するための有効なプロトコルである。収集した細胞は、細胞培養、RT-qPCR、細胞毒性アッセイなどの下流実験に使用できます。

図2:ゲーティング戦略とソート後の純度のテスト(A)細胞は、まず形態に基づいてゲートされ(左:FSC-A、SSC-A)、次いで生き残った(左中:生存率、CD45)、CD45+細胞(CD45、CD3)をCD19およびCD3に対してプロットした。CD19+セルのみが並べ替えられました。(B)細胞選別後に得られた細胞の一部の純度試験結果。この図のより大きなバージョンを表示するには、ここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
フローサイトメトリーは、高純度で免疫細胞集団を特徴付け、ソートする直接の技術です。それは特定の細胞集団の濃縮を可能にし、病原体に対する免疫応答を解読することを可能にする研究分野の原始的なツールである。利用可能なフルオロクロムおよびサイトメータの数の増加に伴い、検出可能なパラメータの数は非常に増加する。その結果、FACSデータのバイオインフォマティクス解析が始まり、細胞メトリー(3)を流れる新たな地平が開かれました。フローサイトメトリーは、血液学および腫瘍学(4)の他のアプリケーションを提供し、診断ツールの開発に使用されます。
Subscription Required. Please recommend JoVE to your librarian.
References
- Lanier, L. L. Just the FACS. The Journal of Immunology, 193 (5), 2043-2044 (2014).
- Walker, J. M. Epiblast Stem Cells IN Series Editor.
- Tung, J. W., Heydari, K., Tirouvanziam, R., Sahaf, B., Parks. D. R., Herzenberg, L. A., and Herzenberg. L. A. Modern Flow Cytometry: A Practical Approach. Clinics in Laboratory Medicine. 27 (3), 453-468 (2007).
- Walker, J. M. Tumor Angiogenesis Assays IN Series Editor.




