Overview
Fuente: Meunier Sylvain1,2,3, Perchet Thibaut1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Unidad de Linfopoyesis, Departamento de Inmunología, Instituto Pasteur, París, Francia
2 INSERM U1223, París, Francia
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, París, Francia
4 Flow Cytometry Platfrom, Citometría y Biomarcadores UtechS, Centro de Ciencias Traslacionales, Instituto Pasteur, París, Francia
La defensa contra los patógenos depende de la vigilancia del sistema inmunitario. Este sistema es complejo y comprende muchos tipos de celdas, cada uno con funciones específicas. Esta compleja composición permite respuestas inmunitarias a una gran diversidad de patógenos y lesiones. La inmunidad adaptativa permite respuestas específicas contra patógenos específicos. La mayoría de las células responsables de este tipo de inmunidad son los linfocitos (células B y células T). Por lo general, las células B responden a infecciones extracelulares (como infecciones bacterianas) y las células T responden a infecciones intracelulares (como infecciones virales). Los diferentes tipos de células en las poblaciones de linfocitos se pueden caracterizar por la combinación de proteínas de superficie celular que expresan y/o por un panel de citoquinas secretadas.
La clasificación magnética permite el enriquecimiento de las poblaciones celulares objetivo utilizando propiedades magnéticas y la expresión de una o varias proteínas de superficie celular (1, 2). Esta técnica consta de tres pasos. En primer lugar, las células se incuban con cuentas magnéticas que se acoplan con uno o varios anticuerpos monoclonales específicos. Las células que expresan proteínas superficiales que se unen a estos anticuerpos se unen a las cuentas magnéticas. Luego, las poblaciones celulares objetivo son capturadas con un imán. Para terminar, las células objetivo se eluyen del imán. Al final, se obtienen dos productos de clasificación, uno que contiene células sin etiquetar y el segundo que contiene las células diana junto con las cuentas magnéticas. Las columnas se pueden utilizar para mejorar la eficiencia de la clasificación magnética. En la columna, un elemento no magnético alarga la ruta de la celda a través de la columna. Por lo tanto, el flujo celular se ralentiza, facilitando la captura celular por el imán.
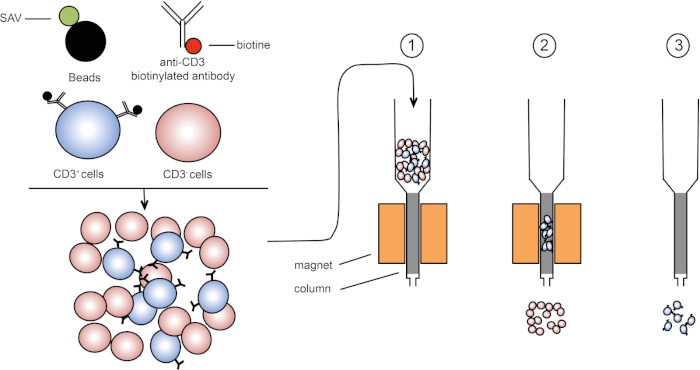
Figura 1: Representación esquemática de separación magnética. Los leucocitos timicos están manchados con anticuerpos biotinilados anti-CD3. Después del lavado, las perlas acopladas con estreptavidina (SAV) fijan específicamente la biotina en anticuerpos anti-CD3. (1) Las celdas se transfieren en una columna. (2) El imán no retiene las células sin etiquetar, mientras que las células CD3-positivas permanecen en la columna. Finalmente, la columna se separa del imán y (3) las células CD3-positivas se eluyen en medio. Haga clic aquí para ver una versión más grande de esta figura.
Existen dos tipos de clasificación magnética (3). En la clasificación positiva, las células de interés se capturan con las cuentas magnéticas. En la clasificación negativa, las células no deseadas se eliminan capturando con las cuentas magnéticas que llevan los anticuerpos apropiados. Esta técnica MACS permite un buen enriquecimiento de células específicas y mejora el porcentaje de células recuperadas de 1-20% a 60-98% en un órgano. Después de la clasificación, es necesario verificar la pureza de la célula y la clasificación por diferentes métodos (por ejemplo, citometría de flujo). La técnica MACS es ideal para enriquecer una población objetivo para otros experimentos como el cultivo celular o el análisis del ciclo celular.
En este ejercicio de laboratorio, demostramos cómo aislar leucocitos timicos y, a partir de entonces, enriquecer las células timómicas CD3-positivas de la mezcla utilizando la técnica de clasificación de células magnéticas.
Procedure
1. Preparación
- Antes de comenzar, ponte guantes de laboratorio y ropa protectora adecuada.
- Lave todas las herramientas de disección, primero con un detergente y luego con 70% de etanol y luego séquelas con una toalla de papel limpia.
- Preparar 200 ml de la solución salina equilibrada de Hank (HBSS) que contiene un 2% de suero de becerro fetal (FCS).
2. Disección
- Ancle un ratón eutanasiado en una placa de disección en la posición supina.
- Usando tijeras y fórceps realizar una laparotomía longitudinal para acceder a la cavidad torácica.
- Retire el corazón para acceder al timo, que se encuentra por encima del corazón. Luego, identifica el timo, que se compone de dos lóbulos blancos y se encuentra en la cavidad torácica por encima del corazón.
- Usando fórceps separa cuidadosamente el timo y colócalo en el plato Petri con 5 ml de HBSS 2% FCS.
3. Aislamiento de células inmunes
- Coloque el timo en un colador de células de 40 m sobre el mismo plato de Petri. Aplastar el timo con un émbolo para disociarlo en el mismo plato.
- Transfiera el timo disociado y el líquido a un tubo centrífugo de 15 ml.
- Lavar el plato Petri con 5 ml de HBSS 2% FCS y transferir el medio lavado también en el mismo tubo centrífugo.
- Centrifugar el tubo a 370 x g durante 7 min a 20oC y desechar el sobrenadante evitando el pellet.
- Resuspenda el pellet en 2 ml de acetato de potasio para lisar los eritrocitos. Espere 2 minutos y luego suba el volumen hasta 14 ml usando HBSS 2% FCS.
- Centrifugar el tubo de nuevo a 370 x g durante 7 min a 20oC. Deseche el sobrenadante y resuspenda el pellet en 5 ml de HBSS 2% FCS.
- Calcule la concentración celular utilizando el ensayo de tinción azul trypan y ajuste la concentración celular final a 107 células/ml utilizando el volumen apropiado de HBSS 2% FCS.
4. Etiquetado magnético de las células inmunitarias
- Tome dos tubos FACS. Etiquetar un tubo, "células T no enriquecidas", y el otro tubo, "células T enriquecidas", que se separarán mediante etiquetado magnético.
- Distribuir la solución celular en cada uno de los dos tubos FACS.
- Centrifugar el tubo de "células T enriquecidas" a 370 x g durante 3 min a 20oC y desechar el sobrenadante evitando el pellet.
- Resuspenda el pellet en 250 ml de mezcla de anticuerpos biotinilados anti-CD3 (Tabla 1, Mezcla 1).
| Mezcla | Reactivos de etiquetado | Dilución |
| 1 | Anticuerpo biotinylato anti-CD3 | 1/400 (en HBSS 2% FCS) |
| 2 | Abalorios acoplados de Streptavidin | 1/5 (en HBSS 2% FCS) |
| 3 | Anti-CD3 BV421 | 1/200 (en HBSS 2% FCS) |
Tabla 1: Los anticuerpos mezclan composición. Las mezclas 1 y 2 se utilizan para la separación magnética. Mix 3 se utiliza para evaluar el enriquecimiento celular después de la separación magnética.
- Incubar la mezcla de anticuerpos de suspensión celular durante 15 minutos a 4oC en la oscuridad.
- Añadir 3 ml de HBSS 2% FCS a ambos tubos y centrifugarlos de nuevo a 370 x g durante 3 min a 20oC.
- Deseche el sobrenadante y resuspenda el pellet en perlas acopladas con estreptavidina de 250 ol (Tabla 1, Mezcla 2).
- Incubar la mezcla celular y las cuentas durante 20 minutos sobre hielo.
- A continuación, añadir 3 ml de HBSS 2% FCS y mezclar bien y centrifugar de nuevo a 370 x g durante 3 min a 20 oC.
- Resuspenda el pellet en 2 ml de HBSS 2% FCS.
5. Separación magnética de células CD3-positivas
- Coloque la columna en el imán y agregue 3 ml de HBSS 2% FCS para humidificar el sistema. Espera 5 minutos.
- A continuación, clasifique las celdas etiquetadas en la columna.
- Después de que la suspensión celular pase a través de la columna, lave la columna X3 veces con 3 ml de HBSS 2% FCS.
- A continuación, retire la columna del imán y colóquela en un tubo de recogida de 15 ml.
- Para eluir las celdas de destino, agregue 5 ml de HBSS 2% FCS a la columna y enjuague la columna con el émbolo.
- Repita el paso de elución con otros 5 ml de HBSS 2% FCS.
6. Evaluación del enriquecimiento de células objetivo por citometría de flujo
- Transfiera 500 l de suspensión celular eluida a un tubo FACS etiquetado como "células T enriquecidas". Transfiera 200 l de suspensión de "células T no enriquecidas" a un segundo FACS.
- A continuación, centrifugar ambos tubos a 370 x g durante 7 min a 20oC.
- Deseche el sobrenadante y, a continuación, añada 100 ml de anticuerpo fluorescente Mix 3 (ver Tabla 1) a ambos tubos.
- Incubar ambos tubos durante 20 min a 4oC en la oscuridad.
- A continuación, añadir 3 ml de HBSS 2% FCS a los tubos y centrifugarlos a 370 x g durante 3 min a 20oC.
- Deseche el sobrenadante y, a continuación, vuelva a suspender cada tubo en 250 ml de HBSS 2% FCS.
- Ahora, evalúe la tasa de enriquecimiento celular CD3-positiva por citometría de flujo.
7. Análisis de datos
- Abra el icono 'FlowJo' y arrastre los archivos para cada tubo en la ventana"Toda la muestra".
- Haga doble clic en el archivo "células T enriquecidas" para mostrar la gráfica de puntos que muestra la dispersión hacia delante (FSC-A) en el eje X y la dispersión lateral (SSC-A) en el eje Y.
- Haga clic en"Polígono"para rodear las poblaciones de linfocitos.
- A continuación, haga doble clic en la población en círculos para crear una nueva ventana.
- Seleccione "FSC-W" en el eje Y y "FSC-A" en el eje X, y circule las celdas negativas FSA-W. En la ventana"Identificación de subpoblación",asigne a la población de células el nombre "células únicas".
- Haga doble clic en la población en círculos para crear una nueva ventana. Seleccione "CD3"en el eje Y y circule las celdas con título CD3. En la ventana"Identificación de subpoblación"nombre su población celular "células T".
- Repita con las "células T no enriquecidas".
- Para visualizar la población de celdas, haga clic en " Editor dediseño" y arrastre la población"Células T"de "células T enriquecidas" y "células T no enriquecidas" a la pestaña.
- Aparecerán gráficas de puntos que representan linfocitos CD3+. Las células CD3+ solo deben aparecer en la población de interés en el tubo enriquecido CD3+.
- Para evaluar el enriquecimiento de linfocitos CD3+ en las células ordenadas, haga clic en"Editorde tablas", y luego arrastre la población de "células T" de "células T enriquecidas" y "células T no enriquecidas" a la tabla.
- En el menú"Estadística",seleccione"Frecuencia de linfocitos" célulaspara comprobar el porcentaje de células CD3+ en todos los linfocitos, luego haga clic en"Crear tabla".
- Los valores de parámetro aparecerán en una nueva tabla. Para las "células T enriquecidas", la frecuencia de las células CD3+ debe ser de alrededor del 80%.
La clasificación celular activada magnéticamente, o MACS, es una técnica que permite a los investigadores separar las células en función de epítopos específicos expresados en sus superficies.
El proceso generalmente comienza con la extracción de un órgano o tejido, como el timo. Luego, las células se separan mecánicamente, generalmente por aplastamiento, hasta que el tejido se disocia en células individuales. Las células no deseadas se pueden eliminar en esta etapa a través de la adición de productos químicos. Por ejemplo, el amonio-cloruro-potasio, o tampón ACK, se puede utilizar para lise eritrocitos no deseados.
A continuación, un anticuerpo conjugado con una molécula llamada biotina se añade a la suspensión, y estos complejos se unen a los epítopos de la superficie de las células diana. La biotina tiene una alta afinidad por otra molécula llamada streptavidina. En el siguiente paso, las moléculas de estreptavidina fusionadas con cuentas magnéticas se añaden a las células etiquetadas como anticuerpos. Cuando la biotina y la estreptavidina entran en contacto, se unen firmemente. El resultado es que las células de interés están recubiertas con cuentas magnéticas. Este complejo se conoce a veces como un sándwich. En este caso, CD3 en la membrana celular en la parte inferior, luego anti-CD3 conjugado a la biotina, y finalmente, la esptavidina conjugada con cuentas magnéticas.
Estas células etiquetadas ahora se pueden colocar en una columna que contiene una matriz que, asistida por la gravedad, permite que las células pasen lentamente por un imán. A medida que lo hagan, las células con cuentas magnéticas se pegarán al borde del tubo más cercano al imán, mientras que las células no etiquetadas continuarán en un tubo de recolección a continuación. A continuación, las células etiquetadas se pueden eliminar de la columna simplemente quitando el imán, añadiendo una solución eluyente y aplicando una suave presión con un émbolo para eliminarlas de la columna y en un tubo de recolección fresco. En última instancia, este proceso permite una recuperación de 60 a 98% de las células de interés.
En este procedimiento, aislaremos los leucocitos timicos de un ratón y usaremos MACS para ordenar las células T CD3 positivas antes de confirmar la eficiencia de la clasificación utilizando FACS.
Para empezar, ponte cualquier equipo de protección apropiado, incluyendo una capa de laboratorio y guantes. A continuación, lave un par de tijeras dissección y fórceps con 70% de etanol y séquelas con una toalla de papel limpia. A continuación, prepare 200 mililitros de SUERO de becerro fetal HBSS 2% o FCS, mezclando cuatro mililitros de FCS con 196 mililitros de HBSS.
Ancle un ratón eutanasiado en una posición supina en una placa de disección. Con tijeras y fórceps, realice una laparotomía longitudinal para acceder a la cavidad torácica. Primero, quita el corazón para tener acceso al timo, que se encuentra sobre el corazón. Luego identifica el timo, que se compone de dos lóbulos blancos. Usando fórceps, desenganche cuidadosamente el timo y colóquelo en un plato de Petri con cinco mililitros de HBSS 2% FCS.
Para aislar las células inmunitarias, coloque primero el timo en un colador de células de 40 micrómetros en el plato Petri. Aplastar el tejido con un émbolo para disociarlo en el plato. Después de esto, enjuague el émbolo y el colador con HBSS 2% FCS para recuperar las células adheridas. Luego, pipetee las células disociadas del timo y el líquido de la placa Petri en un tubo centrífugo de 15 mililitros. Lave el plato Petri con cinco mililitros de HBSS 2% FCS y transfiera esta solución de lavado al tubo centrífugo de 15 mililitros también.
A continuación, centrifugar el tubo a 370 veces g durante siete minutos a 20 grados centígrados. Deseche el sobrenadante y resuspenda el pellet en dos mililitros de tampón de lising ACK para liciar los eritrocitos. Incubar durante dos minutos a temperatura ambiente en la parte superior del banco. A continuación, llevar el volumen a 14 mililitros con HBSS 2% FCS. Centrifugar el tubo a 370 veces g durante siete minutos a 20 grados centígrados. Luego, deseche el sobrenadante y resuspenda las células en cinco mililitros de HBSS 2% FCS.
Estimar la concentración celular utilizando una diapositiva De Malassez como se muestra en el protocolo para el aislamiento FACS de linfocitos B y ajustar la concentración celular a 10 a las séptimas células por mililitro con HBSS 2% FCS.
Transfiera 500 microlitros de solución celular en dos tubos FACS. Etiquetar un tubo de células T no enriquecidas y el otro tubo enriquecido de células T, que se separarán mediante etiquetado magnético.
Centrifugar el tubo de células T enriquecidos a 370 veces g durante tres minutos a 20 grados centígrados. Deseche el sobrenadante y resuspenda el pellet en 250 microlitros de anticuerpo anti CD3 acoplado a biotina diluido uno de cada 400 en HBSS 2% FCS. Incubar las células durante 20 minutos sobre hielo y en la oscuridad. Añadir tres mililitros de HBSS 2% FCS a los tubos y centrifugardelos de nuevo a 370 veces g durante tres minutos a 20 grados Centígrados. Deseche el sobrenadante y resuspenda el pellet en 250 microlitros de perlas acopladas con estreptavidina diluidas una de cada cinco en HBSS 2% FCS. Incubar la mezcla de células y cuentas durante 20 minutos sobre hielo. A continuación, agregue tres mililitros de HBSS 2% FCS al tubo, pipeta hacia arriba y hacia abajo para mezclar, y centrifugar de nuevo a 370 veces g durante tres minutos a 20 grados Centígrados. Resuspenda el pellet en dos mililitros de HBSS 2% FCS.
Coloque la columna en el imán y agregue tres mililitros de HBSS 2% FCS para humidificar el sistema. A continuación, pipetee las celdas manchadas en la columna. Después de que la suspensión celular pase a través de la columna, lave la columna tres veces con tres mililitros de HBSS 2% FCS. A continuación, retire la columna del imán y colóquela en un tubo de 15 mililitros. Para eluir las celdas de destino, agregue cinco mililitros de HBSS 2% FCS a la columna y enjuague la columna con un émbolo. Repita este paso con otros cinco mililitros de HBSS 2% FCS.
Para evaluar la eficacia del aislamiento celular objetivo, primero transfiera 500 microlitros de suspensión celular eluida a un tubo FACS y etiquete las células T enriquecidas. A continuación, centrifugar los tubos enriquecidos y no enriquecidos a 370 veces g durante siete minutos a 20 grados centígrados. Deseche el sobrenadante y, a continuación, añada 100 microlitros de anticuerpos fluorescentes diluidos uno en 200 en HBSS 2% FCS a ambos tubos. Incubar las células durante 20 minutos sobre hielo y en la oscuridad. A continuación, añadir tres mililitros de HBSS 2% FCS a los tubos y centrifugarlos a 370 veces g durante tres minutos a 20 grados Centígrados. Deseche el sobrenadante y luego resuspenda los pellets en 250 microlitros de HBSS 2% FCS. Ahora, evalúe la velocidad de enriquecimiento de células CD3-positiva usando la citometría de flujo como se muestra en el protocolo FACS.
Ahora, determinaremos la frecuencia de los linfocitos CON positivo CD3 entre todos los timocitos que estaban aislados del timo del ratón. Para empezar, haga doble clic en el icono FlowJo y arrastre los archivos para cada tubo en la ventana de muestra. A continuación, haga doble clic en el archivo de celdas T enriquecidos para mostrar las celdas registradas a partir de esa muestra en una gráfica de puntos que muestra la dispersión hacia delante, FSCA, en el eje X, y dispersión lateral, SSCA, en el eje Y.
Haga clic en polígono para rodear las poblaciones de linfocitos. A continuación, haga doble clic en la población en círculos para crear una nueva ventana. Seleccione FSC-W en el eje Y y FSC-A en el eje X y circule las celdas negativas FSA-W. En la ventana de identificación de subpoblación, asigne un nombre a la población de celdas Células únicas. A continuación, haga clic en Aceptar en la ventana de identificación de subpoblación, luego haga doble clic en la población en círculos para crear una nueva ventana. Seleccione CD3 en el eje Y y circule las celdas con positivo CD3. En la ventana de identificación de subpoblación, asigne un nombre a las células T de la población celular. Repita con el archivo de celdas T no enriquecidos. Para visualizar el rellenado de celdas, haga clic en Editor de diseño y arrastre la población de celdas T de celdas T enriquecidas y archivos de celdas T no enriquecidos a la pestaña.
Aparecerán gráficas de puntos que representan linfocitos CON positivo CD3. Las células CD3 positivas sólo deben aparecer en la población de interés en el tubo enriquecido cd3 positivo. Para evaluar el enriquecimiento de linfocitos con positivo CD3 en las células ordenadas, haga clic en Editor de tablas y, a continuación, arrastre la población de células T de células T enriquecidas y archivos de células T no enriquecidas a la tabla. En el menú de estadísticas, seleccione Frecuencia de células de linfocitos para comprobar el porcentaje de células con indicadores CD3 en todos los linfocitos. A continuación, haga clic en Crear tabla. Los valores de parámetro aparecerán en una nueva tabla. Para las células T enriquecidas, la frecuencia de las células CON m2 con positivo CD3 debe estar alrededor del 80% o superior.
Subscription Required. Please recommend JoVE to your librarian.
Results
En este protocolo, las células CD3 positivas se enriquecieron a partir de leucocitos timicos utilizando la clasificación de células magnéticas (Figura 1). Antes del enriquecimiento de células magnéticas, las células CD3 positivas representaban el 53,6% del total de células timicas (Figura 2, paneles superiores). Después del enriquecimiento de células magnéticas, el porcentaje de células con positivo CD3 aumentó al 95% (Figura 2, paneles inferiores). Por lo tanto, MACS es una técnica de enriquecimiento celular simple, rápida y eficiente para enriquecer las poblaciones celulares deseadas a partir de una mezcla de suspensión celular.

Figura 2: Estrategia de gating y clasificación de pruebas de pureza. Las celdas se encerradan primero en función de su morfología (izquierda: FSC-A, SSC-A), y luego las células se trazan contra CD3 (derecha: CD3, SSC-A). El panel superior representa la suspensión de la célula del timo antes del enriquecimiento celular. El panel inferior representa la suspensión de la célula del timo después de la clasificación de células magnéticas. Haga clic aquí para ver una versión más grande de esta figura.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
La tecnología de separación magnética es un método común para clasificar fácil y rápidamente una población celular objetivo. Usando células T anticuerpos específicos y cuentas magnéticas enriquecimos la frecuencia de las células T en nuestra muestra. La tasa de pureza al final del experimento depende del porcentaje de células diana en la suspensión celular inicial. Las células obtenidas después de la clasificación de células magnéticas se pueden utilizar para diversos propósitos, como la transferencia celular o el análisis del ciclo celular. Otro método de clasificación, utilizando citometría de flujo, se puede utilizar para enriquecer las celdas. Esta técnica produce una tasa de pureza muy alta después de la clasificación celular, sin embargo, requiere más pasos y toma más tiempo.
Subscription Required. Please recommend JoVE to your librarian.
References
- Owen, C. S. and Sykes, N. L. Magnetic labeling and cell sorting. Journal of Immunological Methods. 73 (1), 41-48 (1984).
- Miltenyi, S., Müller, W., Weichel, W. and Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Plouffe, B. D., Murthy, S. K. and Lewis, L. H. Fundamentals and application of magnetic particles in cell isolation and enrichment: a review. Reports on Progress in Physics. 78 (1), (2014).




