Overview
Source: Tonya J. Webb1
1 Département de microbiologie et d'immunologie, University of Maryland School of Medicine et Marlene and Stewart Greenebaum Comprehensive Cancer Center, Baltimore, Maryland 21201
ELISPOT est un test standardisé et reproductible utilisé pour détecter les réponses immunitaires cellulaires. L'essai utilise une méthode d'analyse immunosorbent liée à l'enzyme (ELISA) pour détecter les réponses immunitaires à cellule unique qui peuvent être visualisées par taches, d'où le nom ELISPOT. ELISPOT a été décrit pour la première fois en 1983, par Czerkinsky, comme méthode d'énumération du nombre d'hybridomas à cellules B produisant des immunoglobulines spécifiques à l'antigène (1). Le même groupe a développé le résultat pour mesurer la fréquence des lymphocytes T produisant de la cytokine. Maintenant ELISPOT est devenu une norme d'or pour mesurer l'immunité des lymphocytes T spécifiques à l'antigène dans les essais cliniques et les candidats vaccins. Par exemple, après la vaccination ou lors d'une infection, les cellules plasmatiques et les cellules de la mémoire B sécrètent des anticorps qui assurent une protection. Typiquement, ces réponses de cellules de B sont évaluées en mesurant des titers de sérum des anticorps antigène-spécifiques. Cependant, ce type d'analyse, généralement mesurée par ELISA, peut ne pas inclure les cellules de mémoire B, qui peuvent être présentes même en l'absence de niveaux d'anticorps sériques détectables. En outre, il a été bien établi que les cellules de mémoire B circulantes sont importantes pour la réponse rapide et protectrice d'anticorps observée après la réexposition d'agent pathogène, ainsi il est essentiel d'être en mesure de détecter ces cellules. Par conséquent, pour évaluer clairement les réponses de cellules B de mémoire spécifiques à l'antigène, il faut utiliser ELISA et ELISPOT (2).
L'évaluation ELISPOT utilise une plaque contenant des puits doublés de membrane qui sont recouverts d'anticorps afin de capturer les protéines sécrétées d'intérêt. Ensuite, la plaque est chargée de cellules et de stimuli pour induire la production de protéines. Les protéines sécrétées sont capturées par les anticorps enduits à la surface. Après le temps d'incubation approprié, les cellules sont enlevées et la molécule sécrétée est détectée en utilisant un anticorps biotinylated qui est spécifique pour un épitome différent, par rapport à l'anticorps de capture. Ensuite, la peroxidase de streptavidine est ajoutée, suivie de l'ajout d'un substrat qui permet la détection des taches (figure 1). La force de cet analyse est qu'il permet de quantifier le nombre de cellules produisant la protéine d'intérêt. Fait important, on peut évaluer s'il y a des changements dans le nombre total de cellules produisant une protéine spécifique ou si les cellules individuelles au sein d'une population produisent plus de protéines. En outre, il peut fournir des informations sur la cinétique et peut être utilisé pour évaluer l'activation immunitaire globale (stimulation mitogène) par rapport aux réponses spécifiques à l'antigène (simulation d'antigène). L'analyse ELISPOT permettra la détection d'une cellule activée parmi 300 000 cellules suivant une activation mitogène ou spécifique à l'antigène.
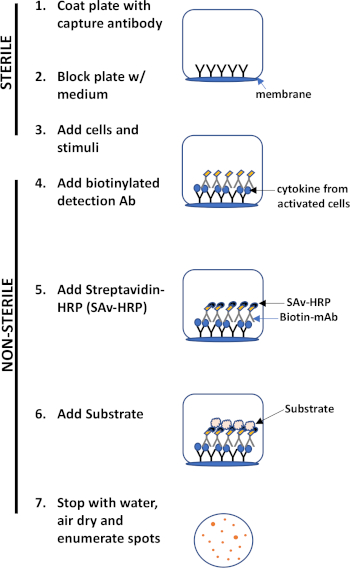
Figure 1 : Aperçu du protocole ELISPOT.
Les principaux avantages de cet exemple sont sa- a. Simplicité- le protocole est relativement simple et simple. Il ne nécessite pas d'expertise technique, b. Sensibilité - il permet la détection des cellules immunitaires au niveau des cellules uniques et nécessite très peu de cellules par rapport à d'autres méthodes telles que la cytométrie du débit, c. Fonctionnalité - il fournit des données quantitatives concernant le système immunitaire fonction.
Cet exercice de laboratoire démontre le protocole ELISPOT pour la détection des splenocytes sécrétion IFN-MD, mais comme mentionné ci-dessus cet analyse peut également être utilisé pour évaluer la sécrétion d'anticorps par les cellules B (3).
Procedure
1. Mise en place
Buffers et réactifs
- Saline saline (PBS) tamponnée de phosphate stérile sans calcium ni magnésium
- Tampon de revêtement- PBS stérile ou tampon de carbonate
- Assay diluent- 10% sérum bovin fœtal (FBS) en PBS
- Culture cellulaire moyenne- RPMI 1640 avec 10% FBS, pénicilline/streptomycine, et L-glutamine
- Tampon de lavage- PBS contenant 0.05% Tween20
- Eau distillée double (ddH2O)
- Substrat de détection- 100 mg AEC (3-amino-9-éthyle-carbazole) en 10 mL DMF (N,N, Dimethylformamide).
équipement
- Hotte d'écoulement laminaire
- Incubateur humidifié (fixé à 37oC, 5% CO2)
- Lecteur ELISPOT automatisé ou microscope disséquer
Matériaux
- Plaques ELISPOT
- Réservoirs stériles et non stériles
- Pipettors et conseils
- Pipettes sérologiques stériles
- Tubes de polypropylène stériles et coniques
- Deux bouteilles de compression pour le lavage de plaque
Réagents spécifiques d'assay
- Cellules- cellules primaires ou lignées cellulaires (ici, des splenocytes de souris C57BL/6 ont été utilisés)
- Stimulants- mitogène ou antigène (ici, phorbol 12-myristate 13-acetate (PMA, 50 ng/mL) et ionomycine (1 M) ont été utilisés)
- Anticorps primaires- anticorps biotinylated anti-cytokine de détection d'anticorps (dilué à 2 'g/mL dans le diluant d'analyse)
- Anticorps secondaire- streptavidin-horseradish peroxidase (SAv-HRP)
2. Procédure
couche
- En gardant les conditions stériles et à l'intérieur d'une hotte à débit laminaire, diluer l'anticorps purifié anticytokine à une concentration finale de 0,5-4,0 g/mL dans un tampon de revêtement stérile. (Remarque : pour l'utilisation de l'IFN et de l'IL-6 à 5 g/mL).
- Transférer la solution d'anticorps de capture, 100 l/puits, à la plaque ELISPOT.
- Couvrir la plaque d'un couvercle de plaque et sceller pour éviter l'évaporation.
- Incuber la plaque toute la nuit à 4oC.
Blocage
- Le lendemain, découvrez la plaque ELISPOT dans le capot à débit laminaire. Invertis rapidement la plaque sur des lingettes stériles pour enlever la solution d'anticorps de capture de chaque puits.
- Ensuite, ajoutez 200 L de milieu de culture cellulaire à chaque puits. Cette étape bloquera la liaison non spécifique pendant l'assiduité.
- Remplacer le couvercle de la plaque et l'incuber pendant 2 heures à 37 oC.
Cellules de placage et d'activation
- Pendant que la plaque couve, préparez une solution mitogène 2X contenant 50 ng/mL PMA et 1 ionomycine m dans le milieu de culture cellulaire.
- Ensuite, préparez les suspensions cellulaires cibles à une concentration de stock de 2 x 106 cellules/mL.
- Une fois l'incubation terminée, retirez le milieu de culture cellulaire de chaque puits en inversant rapidement la plaque sur des lingettes stériles à l'intérieur du capot à flux laminaire.
- Ensuite, générer une dilution en série 2X de la solution de suspension de cellules de stock. Pour ce faire, ajoutez d'abord 200 l de la solution de stock de suspension cellulaire préparée dans les puits de la rangée supérieure de la plaque ELISPOT.
- Ensuite, ajoutez 100 L de milieu de culture de cellules ordinaires aux cinq rangées suivantes de la plaque sous les lignes contenant la solution de stock cellulaire.
- Après cela, effectuer une dilution en série 2X en pipetting 100 L de la suspension cellulaire de la rangée supérieure dans la rangée directement ci-dessous. Assurer un bon mélange en pipetting doucement cette solution de haut en bas pour assurer une distribution uniforme des cellules.
- Répétez ce processus pour les quatre rangées restantes.
- Quitter la sixième rangée avec le milieu de la culture seulement. Il servira de contrôle expérimental.
- Ensuite, ajoutez 100 L de la solution mitogène préparée aux puits expérimentaux des cinq premières rangées de la plaque. Dans les puits de contrôle et la sixième rangée, ajouter 100 L du milieu de culture cellulaire sans mitogène.
- Remplacer le couvercle de la plaque et incuber la plaque à 37 oC, 5 % de CO2 dans un incubateur pendant 20 à 48 heures. (Remarque : 20 à 24 heures est généralement suffisante pour détecter l'IL-2 et le TNF, alors que 48 heures sont optimales pour l'IL-4 et l'IFN).
découverte
Anticorps primaires
- Préparer l'anticorps anticytokine biotinylated à une concentration de 2 g/mL dans le diluant d'analyse.
- Préparer 20-25 ml de tampon de lavage à ce moment en mélangeant 0,05% Tween-20 dans PBS.
- Une fois l'incubation terminée, décapiter la plaque et l'inverser rapidement sur un évier pour enlever tout le liquide des puits. (Remarque : Après ce point, la plaque n'a plus à être stérile).
- Ensuite, lavez l'assiette en ajoutant un tampon de lavage de 200 l à chaque puits. Expulsez ce liquide en inversant rapidement et en faisant glisser la plaque sur un évier. Répétez ce processus pour un total de cinq lavages.
- Ensuite, ajoutez 100 L de la solution anticytokine diluée anti-cytokine détection à chaque puits. Incuber à température ambiante pendant 2 heures à température ambiante ou pendant la nuit à 4oC.
Anticorps secondaires
- Une fois l'incubation terminée, expulser l'anticorps de détection en inversant et en faisant glisser la plaque au-dessus de l'évier.
- Comme auparavant, lavez la plaque 5 fois avec un tampon de lavage de 200 l, en expulsant le liquide entre chaque lavage.
- Ajouter ensuite 100 lde de solution de peroxidase streptavidin-horraie diluée à chaque puits (dilué à sa concentration optimale prédéterminée dans le diluant d'assay).
- Remplacer le couvercle de la plaque et incuber à température ambiante pendant 1,5 à 2 heures à 37 oC.
Substrat
- Après l'incubation, pas plus de 15 minutes avant l'utilisation, activez d'abord la solution de substrat AEC selon les instructions du fabricant.
- Ensuite, jetez le contenu des puits et lavez la plaque cinq fois avec un tampon de lavage, comme avant.
- Ensuite, ajoutez immédiatement 100 l de solution de substrat AEC préparée dans chaque puits.
- Incuber la plaque à température ambiante pendant 10 à 20 minutes tout en surveillant le développement de la tache.
- Arrêtez la réaction en rinçant la plaque avec de l'eau et en faisant glisser la plaque sur l'évier.
- Blot la plaque sur des essuie-tout et laisser sécher l'assiette pendant la nuit ou jusqu'à ce qu'elle soit complètement sèche. L'enlèvement du plateau en plastique sous la plaque facilitera le séchage.
3. Acquisition et analyse de données
- Après le séchage, les taches sont prêtes à être comptées avec un lecteur de plaque automatisé. Ici, le lecteur CTL Immunospot est utilisé, mais ce protocole peut être adapté pour n'importe quel lecteur.
- D'abord allumer l'instrument, puis l'ordinateur. Ensuite, ouvrez le programme CTL et cliquez sur " Compter les scans ".
- Poussez " éjecter " pour que le plateau s'étende de la machine. Ensuite, retirez l'adaptateur en plastique et alignez la ligne « A » sur la plaque et l'adaptateur ELISPOT.
- Choisissez un nom de fichier et un emplacement pour que le fichier soit enregistré et chargez la plaque sur le plateau.
- Ensuite, cliquez sur "charger" sur le logiciel et fermez la porte sur le côté de la machine.
- Appuyez sur "start- après comptage." Assurez-vous que le fichier est enregistré, puis ouvrez le logiciel de contrôle de qualité "QC" pour analyser les données et compter le nombre de points.
Notes:
- Le nombre minimum de cellules doit être déterminé dans les expériences préliminaires. Le nombre optimal de places est de 50 euros/puits. Si trop de cellules sont chargées, il sera difficile de détecter des taches distinctes. En outre, les cellules se chevauchent et peuvent ne pas former une monocouche sur la membrane, de ce fait le niveau de détection peut être réduit.
- Lors de l'optimisation de l'expérience, considérez le niveau d'expression attendu de la protéine cible. Plus l'expression est basse, plus le nombre de cellules requises par puits est élevé.
- Contrairement à ELISA, il est préférable de laver la plaque à la main plutôt que d'utiliser une laveuse à assiette. Les plaques ELISPOT sont plus délicates et il faut éviter de perforer la membrane PVDF.
- Il faut limiter le mouvement de la plaque pendant la période d'incubation car elle peut causer des taches à la tache.
- Les plaques doivent être stockées dans l'obscurité, car l'exposition à la lumière directe provoque la décoloration des taches.
L'immunospot lié à l'enzyme, ou ELISPOT, est une méthode pour analyser la réponse immunitaire à un agent pathogène ou des dommages cellulaires. Il permet de quantifier l'activation de différentes cellules immunitaires en détectant des protéines spécifiques qu'elles sécrètent. Par exemple, ELISPOT est couramment utilisé pour mesurer les réponses des lymphocytes T lors de l'exposition à un antigène étranger en détectant les cytokines sécrétées.
Pour un analyse ELISPOT à base de cytokine, le processus commence par le revêtement d'une microplaque ELISPOT avec un anticorps de capture, qui est spécifique à la cytokine cible. Après le revêtement d'anticorps, les lymphocytes T sont ajoutés aux puits et stimulés par un agent externe, comme l'anticorps anti-CD3, par exemple. Les cellules sécrètent alors la cytokine cible, qui est immédiatement immobilisée par l'anticorps de capture. Puisque la protéine est capturée instantanément après la sécrétion des cellules vivantes, sans dilution ou dégradation, cet assay a une grande précision. Après l'immobilisation de la cytokine cible, un anticorps de détection est ajouté, qui se lie également à la cytokine capturée.
La technique ELISPOT peut également être utilisée pour quantifier la mémoire des cellules B après une infection ou une vaccination en analysant leur production d'anticorps spécifiques. Dans un ELISPOT à base d'anticorps, un antigène spécifique est utilisé au lieu d'un anticorps pour l'étape de capture, où l'antigène sera lié à la plaque, ou à l'étape de détection, où l'antigène détecte l'anticorps cible après la capture. Dans toutes les variations du processus, pour les lymphocytes T ou B, l'anticorps de détection ou l'antigène est biotinylated, ce qui lui permet de se lier à une enzyme de détection conjuguée à la streptavidine, comme le raifort peroxidase. Puis, sur l'ajout du substrat de la peroxidase, AEC, un précipité sombre et insoluble est produit. Ce précipité marque l'emplacement de la protéine capturée, et chaque cellule sécrétrice se traduit par un endroit visible, qui peut être quantifié à l'aide d'un lecteur ELISPOT ou d'un microscope. La taille des taches est une estimation relative de la quantité de protéines sécrétées dans chaque cellule. Cet analyse peut détecter les réponses immunitaires des cellules simples, même dans des sous-populations relativement petites de cellules sécrétrices, ce qui le rend utile pour étudier les réponses immunitaires au niveau cellulaire.
Dans cette vidéo, vous apprendrez à effectuer un analyse ELISPOT, puis quantifier les taches représentant les cellules sécrétrices.
Tout au long de l'expérience, assurez des conditions stériles en travaillant dans une hotte à débit laminaire et en portant des gants.
Tous les calculs de ce protocole sont basés sur le volume nécessaire pour une plaque de 96 puits.
Tout d'abord, diluer l'anticorps de capture anti-cytokine. Pour ce faire, transférer 10 millilitres de tampon dans un tube conique stérile de 15 millilitres. Ensuite, utilisez une pipette pour ajouter 10 microlitres d'un milligramme par millilitre d'anticorps monoclonal au tampon pour créer une solution avec une concentration finale d'un microgramme par millilitre. Ensuite, versez la solution d'anticorps de capture dans un réservoir stérile et, à l'aide d'une pipette multicanal, distribuez 100 microlitres dans chaque puits d'une plaque ELISPOT de 96 puits.
Couvrir la plaque d'un couvercle de plaque, sceller pour éviter l'évaporation, et incuber toute la nuit à quatre degrés Celsius. Le lendemain, découvrez la plaque ELISPOT dans le capot à débit laminaire. Invertis rapidement la plaque sur des lingettes stériles pour enlever la solution d'anticorps de capture de chaque puits. Ensuite, utilisez une pipette multicanal pour ajouter 200 microlitres de milieu de culture cellulaire à chaque puits. Cette étape bloquera la liaison non spécifique pendant l'assiduité. Remplacer le couvercle de la plaque et couver dans un incubateur de 37 degrés Celsius pendant deux heures.
Pendant que la plaque est incubating, préparer une solution de mitogène 2X en ajoutant un microlitre de PMA et 20 microlitres d'ionomycine à 10 millilitres de milieu de culture cellulaire pour atteindre une concentration finale de 15 nanogrammes par millilitre PMA et une ionomycine micromolaire.
Les suspensions cellulaires des splenocytes de souris devraient également être préparées à ce moment dans une hotte stérile. À l'aide d'un microscope et d'un hémocytomètre, mesurez la concentration des cellules et ajustez le volume total jusqu'à ce qu'une concentration de deux millions de cellules par millilitre soit atteinte.
Une fois l'incubation terminée, inversion rapide de la plaque sur des lingettes stériles pour enlever le milieu de culture cellulaire de chaque puits. Ensuite, ajoutez 200 microlitres de la solution de stock de suspension cellulaire préparée aux puits de la rangée supérieure de la plaque ELISPOT. Configurez l'expérience en triple, de sorte que chaque type de cellule testé sera plaqué dans un ensemble de trois colonnes groupées. En dessous de cela, ajouter 100 microlitres de milieu de culture de cellules simples aux cinq rangées suivantes de la plaque, en dessous des lignes contenant la solution de stock cellulaire.
Ensuite, effectuez une dilution en série en pipetting 100 microlitres de la suspension cellulaire de la rangée supérieure dans la rangée directement ci-dessous, doucement pipetting la solution de haut en bas pour répartir uniformément les cellules. Répétez ce processus pour les rangées restantes, en déplaçant 100 microlitres de la ligne précédente à la ligne ci-dessous à chaque étape, en continuant jusqu'à ce que la cinquième rangée a été diluée en série. Quitter la sixième rangée avec le milieu de culture cellulaire seulement, pour servir de contrôle. Pour stimuler les cellules dans les puits expérimentaux de la plaque, ajouter 100 microlitres de la solution mitogène préparée aux suspensions cellulaires dans chaque puits de rangées une à cinq. Assurez-vous de quitter la sixième rangée, qui servira de contrôle, non stimulée. Remplacer le couvercle et couver la plaque à 37 degrés Celsius et 5 % de CO2 pendant 24 à 48 heures.
Préparer l'anticorps anticytokine dilué biotinylated. Tout d'abord, préparer 50 millilitres de diluant d'assay en ajoutant 5 millilitres de sérum bovin fœtal de 10% à 45 millilitres de PBS. Ensuite, diluer l'anticorps de détection à une concentration de 2 microgrammes par millilitre dans le diluant d'analyse. Aussi, préparer 20 à 25 millilitres de tampon de lavage à ce moment, en mélangeant 0,05% Tween-20 et PBS.
Une fois l'incubation terminée, décapiter la plaque et l'inverser rapidement pour enlever tout le liquide des puits. Laver la plaque en ajoutant environ 200 microlitres de tampon de lavage à chaque puits. Expulsez ce liquide en inversant rapidement et en faisant glisser la plaque sur un évier. Répétez ce processus quatre fois de plus pour un total de cinq lavages. Ensuite, ajoutez 100 microlitres de la solution d'anticorps de détection diluée à chaque puits, remplacez le couvercle et incubez à température ambiante pendant deux heures. Après l'incubation, expulser la solution d'anticorps de détection des puits de la plaque en inversant et en faisant glisser la plaque sur l'évier.
Comme auparavant, lavez la plaque cinq fois avec un tampon de lavage, en expulsant le liquide entre chaque lavage. Après le lavage final, préparer la solution de peroxidase de streptavidin-raifort en la diluant selon les instructions du fabricant. Ensuite, avec les puits de la plaque vide, ajouter 100 microlitres de streptavidin dilué- raifort peroxidase solution à chaque puits. Remettre le couvercle sur la plaque et couver à température ambiante pendant deux heures.
Après l'incubation, pas plus de 15 minutes avant l'utilisation, activez la solution de substrat AEC préfabriquée. Jeter le contenu des puits et laver la plaque cinq fois avec un tampon de lavage, comme avant. Ensuite, ajoutez immédiatement 100 microlitres de solution de substrat AEC préparée dans chaque puits. Laisser la plaque à température ambiante se développer pendant environ 10 à 20 minutes, tout en surveillant le développement des taches. Ces taches apparaîtront sous forme de petits cercles obscurcis à la surface des puits. Ensuite, arrêtez la réaction en rinçant la plaque avec de l'eau et en la faisant glisser sur l'évier. Blot l'assiette sur des essuie-tout et laisser sécher à l'air pendant la nuit ou jusqu'à ce qu'elle soit complètement sèche. L'enlèvement du plateau en plastique sous la plaque facilitera le séchage. Après le séchage, les taches sont prêtes à être comptées avec un lecteur de plaque automatisé.
Ici, le lecteur CTL ImmunoSpot est utilisé, mais ce protocole peut être adapté pour n'importe quel lecteur. Ensuite, ouvrez le programme CTL et cliquez sur Scan Count. Poussez l'éjectisme pour que le plateau s'étende de la machine. Ensuite, retirez l'adaptateur en plastique et alignez la rangée A sur la plaque et l'adaptateur ELISPOT. Choisissez un nom de fichier et l'emplacement pour que le fichier soit enregistré et chargez la plaque et l'adaptateur sur le plateau. Cliquez sur Charger sur le logiciel et fermez la porte sur le côté de la machine. Ensuite, appuyez sur Démarrer après le comptage. Assurez-vous que le fichier est enregistré, puis ouvrez le logiciel Quality Control QC pour analyser les données et compter le nombre de points. Exportez ces données en tant que fichier Excel. Une fois l'analyse terminée, cliquez sur Eject pour récupérer la plaque.
Dans cette expérience, des cellules de type sauvage et de souris tumorales ont été plaquées et analysées pour le gamma IFN. Notez que le nombre de taches diminue avec la diminution de la concentration cellulaire. En règle générale, les données ELISPOT sont présentées comme le nombre de nombres de taches par nombre de cellules plaquées. Dans cet exemple, le nombre de taches a été affiché dans un graphique à barres, chaque concentration cellulaire respective étant répertoriée sur l'axe X. Notez que le nombre de taches indique le nombre de cellules activées par nombre total de cellules dans une population donnée.
Subscription Required. Please recommend JoVE to your librarian.
Results
Dans cet analyse ELISPOT, les leucocytes spléniques des souris de type sauvage et tumeur-portantes ont été analysés pour IFN-MD. La figure 2 A montre l'image visuelle du résultat de l'analyse. Les nombres dans la couleur verte indiquent le nombre de taches par puits (TNTC indique « trop nombreux pour compter »). Notez que le nombre de taches diminue avec la diminution de la concentration cellulaire.

Figure 2A : Diminution des réponses immunitaires chez les souris porteuses de tumeurs. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
En règle générale, les données ELISPOT sont présentées comme le nombre de nombres de taches par nombre de cellules plaquées. Dans la figure 2 B, le nombre de taches est affiché dans un graphique à barres, chaque concentration cellulaire respective étant répertoriée sur l'axe X. Aux fins du graphique, 150 ont été utilisés pour indiquer le nombre maximal de taches. Le nombre de leucocytes spléniques murines producteurs d'IFN est inférieur à celui des léuocytes de type sauvage.

Figure 2B : Diminution des réponses immunitaires chez les souris porteuses de tumeurs. Des splenocytes ont été moissonnés de c57BL/6 de commande (type sauvage) et de souris tumeur-portantes et stimulés avec LA PMA/ionomycine pendant 48 heures. Les essais ELISPOT ont été utilisés pour quantifier le nombre de leucocytes spléniques producteurs d'IFN. (A) Représentation visuelle et (B) graphique des données. TNTC indique trop nombreux pour être comptés. Aux fins du graphique, 150 ont été utilisés pour indiquer le nombre maximal de taches. Les chiffres verts indiquent le nombre de taches comptées par puits. Les nombres rouges indiquent les puits de référence qui ont été utilisés pour déterminer quelles taches étaient des cellules et quelles taches étaient des débris, des artefacts ou des effets de bord et devraient être exclus de l'analyse.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
L'analyse ELISPOT permet d'évaluer l'activation des cellules immunitaires en déterminant le nombre de cellules sécrétant un analyte spécifique. La taille et l'intensité des taches fournissent des informations sur la quantité d'analyte produite par chaque cellule. Le protocole décrit ci-dessus détaille la détection d'une seule cytokine. Cependant, les développements récents ont amélioré l'utilité de cet exemple. Actuellement, on peut utiliser des colorants de détection fluorescents afin de détecter plusieurs analytes dans un puits. Cela permet de détecter différentes sous-populations de cellules sécrétant l'un ou les deux analytes.
Subscription Required. Please recommend JoVE to your librarian.
References
- Czerkinsky, C. C., Nilsson, L. A., Nygren, H., Ouchterlony, O., & Tarkowski, A. A solid-phase enzyme-linked immunospot (ELISPOT) assay for enumeration of specific antibody-secreting cells. Journal of Immunological Methods, 65 (1), 109-121(1983).
- Wahid, R., Simon, J. K., Picking, W. L., Kotloff, K. L., Levine, M. M., & Sztein, M. B. Shigella antigen-specific B memory cells are associated with decreased disease severity in subjects challenged with wild-type Shigella flexneri 2a. Clinical Immunology, 148 (1), 35-43 (2013).
- Roberts, T. J., Lin, Y., Spence, P. M., Van Kaer, L., & Brutkiewicz, R. R. CD1d1-dependent control of the magnitude of an acute antiviral immune response. The Journal of Immunology, 172, 3454-3461 (2004).




