Overview
출처: 토냐 J. 웹1
1 미생물학 및 면역학학과, 메릴랜드 의과 대학 및 말린과 스튜어트 그린바움 종합 암 센터, 볼티모어, 메릴랜드 21201
ELISPOT은 세포 면역 반응을 검출하는 데 사용되는 표준화되고 재현 가능한 분석입니다. 상기 분석법은 효소연계 면역흡소감분석법(ELISA)-기반 방법을 활용하여 반점에 의해 시각화될 수 있는 단세포 면역 반응을 검출하고, 따라서 이름 ELISPOT이다. ELISPOT은 1983년에, Czerkinsky에 의해, 항원 특이적 면역글로불린(1)을 생성하는 B 세포 혼종의 수를 열거하는 방법으로 처음 기술되었다. 동일한 그룹은 T 림프구를 생산하는 사이토카인의 주파수를 측정하기 위해 분석서를 더욱 개발하였다. 이제 ELISPOT은 임상 시험 및 백신 후보에서 항원 특이적 T 세포 면역을 측정하기위한 금 표준이되었습니다. 예를 들어, 예방 접종 후 또는 감염 중에 혈장 세포 및 메모리 B 세포는 보호를 제공하는 항체를 분비합니다. 전형적으로, 이들 B 세포 반응은 항원 특이적 항체의 혈청 티터를 측정하여 평가된다. 그러나, 이러한 유형의 분석은, 전형적으로 ELISA에 의해 측정된, 검출 가능한 혈청 항체 수준이 없는 경우에 존재할 수 있는 메모리 B 세포를 포함하지 않을 수 있습니다. 더욱이, 순환 메모리 B 세포가 병원균 재노출 에 따라 관찰된 신속하고 보호적인 항체 반응에 중요하다는 것이 잘 확립되어 왔으며, 따라서 이러한 세포를 검출할 수 있는 것이 중요하다. 따라서 항원 특이적 메모리 B 세포 반응을 명확하게 평가하기 위해 ELISA와 ELISPOT 모두 (2)를 사용해야 한다.
ELISPOT 분석은 관심있는 분비 단백질을 포착하기 위해 항체로 코팅된 멤브레인 안감 우물을 포함하는 플레이트를 사용합니다. 이어서, 플레이트는 단백질 생산을 유도하기 위해 세포와 자극으로 적재된다. 분비된 단백질은 표면에 코팅된 항체에 의해 포획됩니다. 적절한 잠복기 후, 세포는 제거되고 분비된 분자는 포획 항체에 비해 상이한 에피토프에 특이적인 생체개화 항체를 사용하여 검출된다. 다음으로, 스트렙타비딘 peroxidase가 첨가되고, 반점의 검출을 허용하는 기판의 첨가(도 1). 이 분석의 강도는 관심있는 단백질을 생산하는 세포의 수를 양량화 할 수 있다는 것입니다. 중요한 것은, 특정 단백질을 생성하는 세포의 총 수에 변화가 있는지 또는 인구 내의 개별 세포가 더 많은 단백질을 생성하는 경우에 평가할 수 있습니다. 더욱이, 운동학에 관한 정보를 제공할 수 있으며 항원 특이적 반응(antigen simulation)에 비해 전반적인 면역 활성화(미토겐 자극)를 평가하는데 사용될 수 있다. ELISPOT 분석은 미토겐성 또는 항원 특이적 활성화에 따라 300,000개의 세포 중 1개의 활성 세포를 검출할 수 있게 한다.
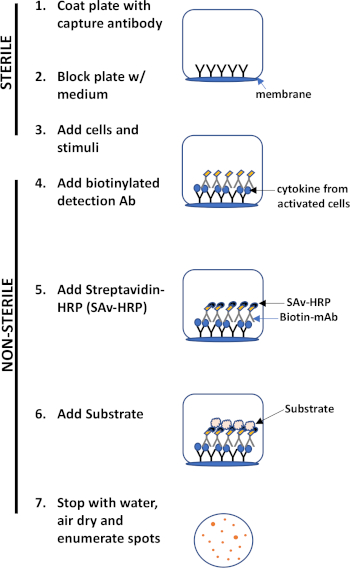
그림 1: ELISPOT 프로토콜 개요입니다.
이 분석의 주요 장점은 그- a입니다. 단순성 - 프로토콜은 비교적 간단하고 간단합니다. 그것은 기술 전문 지식이 필요하지 않습니다, b. 감도- 단일 세포 수준에서 면역 세포의 검출을 허용하고 유동 세포 측정, c와 같은 다른 방법에 비해 거의 세포가 필요합니다. 기능성 - 면역 기능에 관한 정량적 데이터를 제공합니다.
본 실험실 운동은 IFN-γ 분비-비장세포의 검출을 위한 ELISPOT 프로토콜을 보여 주지만, 위에서 언급한 바와 같이 B 세포(3)에 의한 항체 분비를 평가하는 데도 사용될 수 있다.
Procedure
1. 셋업
버퍼 및 시약
- 칼슘이나 마그네슘이 없는 멸균 인산염 완충식염(PBS)
- 코팅 버퍼- 멸균 PBS 또는 탄산완충제
- PBS의 분석 희석제- 10% 태아 소 혈청 (FBS)
- 세포 배양 배지-RPMI 1640 와 10% FBS, 페니실린/연쇄 절제술, 및 L-글루타민
- 워시 버퍼- PBS 포함 0.05% Tween20
- 이중 증류수(ddH2O)
- 검출 기판- 100 mg AEC (3-아미노-9-에틸 카르바졸) 10 mL DMF (N,N, 디메틸포르미드).
설비
- 라미나르 플로우 후드
- 가습 인큐베이터 (37 ° C, 5 % CO2로설정)
- 자동 ELISPOT 리더 또는 해부 현미경
자료
- 엘리스팟 플레이트
- 멸균 및 비멸 저수지
- 파이프토르 와 팁
- 멸균 세로지컬 파이펫
- 멸균, 원식 폴리 프로필렌 튜브
- 플레이트 세척을 위한 스퀴즈 병 2개
분석 특정 시약
- 세포-1차 세포 또는 세포주(여기, C57BL/6 마우스로부터 의 비장구가 사용됨)
- 각성제-미토겐 또는 항원(여기, phorbol 12-myristate 13-아세테이트(PMA, 50 ng/mL) 및 이오노마이신(1 μM)이 사용되었습니다.
- 1차 항체-생체분해된 항세포카인 검출 항체(분석 희석제에서 2 μg/mL로 희석)
- 이차 항체- 연쇄상구당-고추냉이 과산화제 (SAv-HRP)
2. 절차
코팅
- 조건멸 및 라미나르 유동 후드 내부에 보관하고, 정제된 항 사이토카인 포획 항체를 멸균 코팅 버퍼에서 0.5-4.0 μg/mL의 최종 농도로 희석한다. (참고: IFN-γ 및 IL-6의 경우 5 μg/mL을 사용합니다.)
- 캡처 항체 용액, 100 μL/웰, ELISPOT 플레이트로 전송합니다.
- 플레이트 커버로 접시를 덮고 밀봉하여 증발을 방지합니다.
- 접시를 4°C에서 하룻밤 동안 배양합니다.
블로킹
- 다음 날, 라미나르 플로우 후드에 ELISPOT 플레이트를 발견합니다. 플레이트를 멸균 물티슈에 빠르게 반전하여 각 우물에서 캡처 항체 용액을 제거합니다.
- 그런 다음 각 웰에 세포 배양 배지의 200 μL을 추가합니다. 이 단계는 분석 중에 비특이적 바인딩을 차단합니다.
- 플레이트 커버를 교체하고 37°C에서 2시간 동안 플레이트를 배양합니다.
도금 및 활성화 셀
- 플레이트가 배양하는 동안 세포 배양 배지에서 50 ng/mL PMA 및 1 μM 이오노마이신을 함유한 2X 미토겐 용액을 준비한다.
- 이어서, 표적 세포 현탁액을 2 x 106 셀/mL의 육수 농도로 준비한다.
- 인큐베이션이 완료된 후, 라미나르 플로우 후드 내부의 멸균 물티슈에 플레이트를 빠르게 반전시켜 각 우물에서 세포 배양 배지를 제거한다.
- 다음으로, 스톡 셀 서스펜션 용액의 2X 직렬 희석을 생성한다. 이렇게 하려면 먼저 준비된 셀룰러 서스펜션 스톡 용액의 200 μL을 ELISPOT 플레이트의 맨 위 줄의 우물에 넣습니다.
- 그런 다음, 세포 스톡 용액을 포함하는 행 아래 플레이트의 다음 5행에 일반 세포 배양 배지 100 μL을 추가한다.
- 그 후, 맨 위 행에서 바로 아래 행으로 셀룰러 서스펜션의 100 μL을 파이프하여 2X 직렬 희석을 수행합니다. 이 솔루션을 위아래로 부드럽게 파이프하여 세포를 분포할 수 있도록 적절한 혼합을 보장합니다.
- 나머지 네 행에 대해 이 프로세스를 반복합니다.
- 문화 매체만으로 여섯 번째 행을 둡니다. 그것은 실험 적인 제어 역할을 할 것입니다.
- 다음으로, 준비된 미토겐 용액의 100μL을 플레이트의 처음 5열의 실험적 우물에 추가한다. 대조군 우물과 여섯 번째 행에서 미토겐없이 세포 배양 배지의 100 μL을 추가합니다.
- 플레이트 커버를 교체하고 플레이트를 37°C로 교체하고, 인큐베이터에서 5% CO2를 20-48시간 동안 교체합니다. (참고: 20-24시간은 일반적으로 IL-2 및 TNF-α 검출하기에 충분하지만 IL-4 및 IFN-γ 48시간이 최적입니다.
탐지
1차 항체
- 분석 희석제에서 2 μg/mL의 농도로 항체를 검출하는 생체 개화 된 항 사이토카인을 준비합니다.
- PBS에서 0.05% Tween-20을 혼합하여 이 시점에서 20-25mL의 워시 버퍼를 준비하십시오.
- 인큐베이션이 완료되면 접시를 풀고 싱크대에 빠르게 반전하여 우물에서 모든 액체를 제거합니다. (참고:이 시점 이후에는 플레이트를 더 이상 멸균 상태로 보관할 필요가 없습니다).
- 그런 다음 각 웰에 ~200 μL 세척 버퍼를 추가하여 접시를 씻으시고 씻어 주세요. 이 액체를 재빨리 반전시키고 싱크대 위로 판을 쓸어 넘깁니다. 총 5개의 세시에 대해 이 프로세스를 반복합니다.
- 다음으로, 각 웰에 항체 용액을 검출하는 희석된 바이오티니징 항 세포카인의 100 μL을 추가한다. 실온에서 2시간 또는 4°C에서 하룻밤 동안 배양하십시오.
이차 항체
- 인큐베이션이 완료된 후 싱크대 위로 플레이트를 반전시키고 쓸어 넘기면 검출 항체를 추방합니다.
- 이전과 마찬가지로, ~ 200 μL 세척 버퍼로 접시를 5 번 세척하여 각 세척 사이에 액체를 배출하십시오.
- 다음으로 각 우물에 희석 된 스트렙타비딘 고추냉이 과로시다제 용액 100 μL을 추가합니다 (분석 희석제에서 미리 결정된 최적의 농도로 희석).
- 플레이트 커버를 교체하고 37°C에서 1.5-2시간 동안 실온에서 배양합니다.
기판
- 인큐베이션 후, 사용하기 15분 전에 제조업체의 지침에 따라 AEC 기판 용액을 먼저 활성화합니다.
- 다음으로, 우물의 내용물들을 버리고 이전과 마찬가지로 워시 버퍼로 접시를 5번 씻는다.
- 그런 다음 준비된 AEC 기판 용액 100 μL을 각 웰에 즉시 추가합니다.
- 스팟 개발을 모니터링하면서 - 10-20 분 동안 실온에서 플레이트를 배양하십시오.
- 접시를 물로 헹구고 접시를 싱크대 위로 쓸어 넘기면 반응을 멈춥시다.
- 종이 타월에 접시를 부수고 접시가 밤새 또는 완전히 건조 될 때까지 공기 건조할 수 있도록합니다. 접시 아래에 플라스틱 트레이를 제거하면 건조가 용이합니다.
3. 데이터 수집 및 분석
- 건조 후, 반점은 자동화 된 플레이트 리더로 계산 할 준비가되어 있습니다. 여기서 CTL Immunospot 판독기가 사용되지만 이 프로토콜은 모든 판독기에게 적용될 수 있습니다.
- 먼저 계측기를 켜고 컴퓨터를 켭니다. 그런 다음 CTL 프로그램을 열고 "스캔 수"를 클릭합니다.
- 트레이가 기기에서 확장하려면 "배출"을 푸시합니다. 그런 다음, 플라스틱 어댑터를 제거하고 ELISPOT 플레이트 및 어댑터에 행 "A"를 정렬합니다.
- 파일을 저장할 파일 이름과 위치를 선택하고 접시를 트레이에 로드합니다.
- 그런 다음 소프트웨어의 "로드"를 클릭하고 컴퓨터 측면의 문을 닫습니다.
- "계산 후 시작"을 누릅니다. 파일이 저장되었는지 확인하고 품질 관리 "QC" 소프트웨어를 열어 데이터를 분석하고 반점 수를 계산합니다.
노트:
- 최소 셀 수는 예비 실험에서 결정되어야 합니다. 최적의 반점 수는 ~50/well입니다. 너무 많은 세포가 로드되면 뚜렷한 반점을 감지하기가 어려울 것입니다. 추가적으로, 세포는 중첩되고 막에 단층을 형성하지 않을 수 있습니다, 따라서 검출의 수준이 감소될 수 있습니다.
- 실험을 최적화할 때, 표적 단백질의 예상 발현 수준을 고려한다. 발현이 낮을수록 웰당 필요한 셀 수가 높아집니다.
- ELISA와 는 달리 플레이트 세탁기를 사용하기보다는 접시를 손으로 씻는 것이 좋습니다. ELISPOT 플레이트는 더 섬세하며 PVDF 멤브레인에 구멍을 뚫는 것을 피해야합니다.
- 하나는 얼룩을 일으킬 수 있으므로 잠복 기 동안 플레이트의 움직임을 제한해야합니다.
- 직접 광에 노출되면 반점이 사라지기 때문에 플레이트는 어둠 속에서 저장되어야 합니다.
효소-연결된 면역스팟 또는 ELISPOT, 분석법은 병원체 또는 세포 손상에 대한 면역 반응을 분석하는 방법이다. 그것은 그들이 분비 특정 단백질을 검출하여 다른 면역 세포의 활성화의 정량화를 허용합니다. 예를 들어, ELISPOT은 일반적으로 분비된 사이토카인을 검출하여 외국 항원에 노출될 때 T 세포 반응을 측정하는 데 사용됩니다.
사이토카인 계 의 ELISPOT 분석의 경우, 이 과정은 표적 사이토카인에 특정한 포획 항체를 가진 ELISPOT 마이크로플레이트의 코팅으로 시작한다. 항체 코팅 후, T 세포는 우물에 첨가되고 항 CD3 항체와 같은 외부 제제에 의해 자극된다. 세포는 그 때 포획 항체에 의해 즉시 고정되는 표적 사이토카인을 분비합니다. 단백질은 희석 또는 저하없이 살아있는 세포로부터 즉시 분비 후 포획되기 때문에 이 분석은 높은 정확도를 갖는다. 표적 사이토카인이 고정된 후, 검출 항체가 첨가되어 포획된 사이토카인에 결합한다.
ELISPOT 기술은 또한 특정 항체의 그들의 생산을 분석하여 감염 또는 예방 접종 후에 기억 B 세포를 정량화하기 위하여 이용될 수 있습니다. 항체 계 의 ELISPOT에서, 특정 항원은 항원이 플레이트에 결합될 수 있는 포착 단계, 또는 항원이 표적 항체 후 포획을 검출하는 검출 단계에서 항체 대신 에 사용된다. 프로세스의 모든 변이에서, T 세포 또는 B 세포에 대한, 검출 항체 또는 항원은 바이오티니화되어 고추냉이 과산화효소와 같은 연쇄상 구주 검출 효소에 결합할 수 있습니다. 이어서, 퍼록시다제기의 기판을 첨가하면, AEC, 어둡고 불용성 침전제가 생성된다. 이러한 침전은 포획된 단백질의 위치를 표시하고, 각 분비 세포는 ELISPOT 판독기 또는 현미경을 사용하여 정량화될 수 있는 가시적인 반점을 초래한다. 반점의 크기는 각 세포에서 분비되는 단백질의 양을 상대적 추정치입니다. 이 분석체는 분비 세포의 상대적으로 작은 하위 집단에서도 단일 세포에서 면역 반응을 감지할 수 있으므로 세포 수준에서 면역 반응을 연구하는 데 유용합니다.
이 비디오에서는 ELISPOT 분석기를 수행한 다음 분비 세포를 나타내는 반점을 정량화하는 방법을 배웁니다.
실험 전반에 걸쳐 라미나르 플로우 후드에서 작업하고 장갑을 착용하여 멸균 상태를 보장하십시오.
이 프로토콜의 모든 계산은 하나의 96웰 플레이트에 필요한 볼륨을 기반으로 합니다.
첫째, 항 사이토카인 포획 항체를 희석한다. 이렇게 하려면 버퍼 10 밀리리터를 멸균 15 밀리리터 원내 튜브로 옮기십시오. 그런 다음 파이펫을 사용하여 단일 클론 항체의 밀리리터 당 1밀리그램의 10 마이크로리터를 버퍼에 추가하여 밀리리터당 1 마이크로그램의 최종 농도를 가진 용액을 만듭니다. 다음으로, 포획 항체 용액을 멸균 저수지에 붓고, 멀티채널 파이펫을 사용하여, 96웰 ELISPOT 플레이트의 각 웰에 100마이크로리터를 분배한다.
플레이트 커버로 접시를 덮고, 증발을 방지하기 위해 밀봉하고, 섭씨 4도에서 하룻밤 동안 배양하십시오. 다음 날, 라미나르 플로우 후드에 ELISPOT 플레이트를 발견합니다. 플레이트를 멸균 물티슈에 빠르게 반전하여 각 우물에서 캡처 항체 용액을 제거합니다. 다음으로, 멀티채널 파이펫을 사용하여 각 웰에 세포 배양 배지 의 200 마이크로리터를 추가합니다. 이 단계는 분석 중에 비특이적 바인딩을 차단합니다. 플레이트 커버를 교체하고 섭씨 37도 인큐베이터에서 2시간 동안 인큐베이터로 인큐베이션합니다.
플레이트가 배양하는 동안, 밀리리터 PMA 당 15 나노그램과 1개의 마이크로몰라 이오노마이신의 최종 농도를 달성하기 위하여 PMA의 1개의 마이크로리터 및 20 개의 이오노마이신 마이크로리터를 세포 배양 매체의 10 밀리리터에 추가하여 2X 미토겐 용액을 준비합니다.
마우스 비장 세포의 세포 현탁액은 멸균 후드에서이 시간에 준비해야합니다. 현미경 및 혈류계를 사용하여, 세포의 농도를 측정하고 밀리리터 당 2백만 세포의 주식 농도가 도달 할 때까지 총 부피를 조정합니다.
인큐베이션이 완료된 후, 플레이트를 멸균 물티슈에 빠르게 반전하여 각 우물에서 세포 배양 배지를 제거합니다. 다음으로, 준비된 셀룰러 서스펜션 스톡 솔루션 200마이크로리터를 ELISPOT 플레이트의 맨 위 줄에 있는 우물에 추가합니다. 테스트된 각 셀 유형이 3개의 그룹화 컬럼 집합에 도금되도록 트리플리케이트로 실험을 설정합니다. 이 아래에는 셀룰러 스톡 용액을 포함하는 행 아래에 100 마이크로리터의 일반 세포 배양 배지를 다음 5열에 추가합니다.
다음으로, 셀 서스펜션의 100마이크로리터를 맨 위 행에서 바로 아래 행으로 파이프하여 연재 희석을 수행하여 용액을 위아래로 부드럽게 배관하여 셀을 고르게 분배합니다. 나머지 행에 대해 이 프로세스를 반복하여 이전 행에서 아래 행으로 100마이크로리터를 이동하여 다섯 번째 행이 연속적으로 희석될 때까지 계속합니다. 세포 배양 배지만으로 여섯 번째 행을 남겨두고, 대조군역할을 한다. 플레이트의 실험적인 우물에서 세포를 자극하기 위해, 1~5개의 행의 각 웰에서 세포 현탁액에 준비된 미토겐 용액100마이크로리터를 추가한다. 제어 역할을 할 여섯 번째 행을 제거해야합니다, 자극하지. 뚜껑을 교체하고 플레이트를 섭씨 37도, CO2 5%에서 24~48시간 동안 배양합니다.
항체를 검출하는 희석된 바이오티니징 항 세포카인을 준비한다. 먼저, PBS의 45 밀리리터에 10% 태아 소 혈청의 5 밀리리터를 추가하여 50밀리리터의 분석 희석제를 준비하십시오. 다음으로, 검출 항체를 분석 희석제에서 밀리리터 당 2 마이크로그램의 농도로 희석한다. 또한.05% Tween-20 및 PBS를 혼합하여 이 시기에 20~25밀리리터의 워시 버퍼를 준비한다.
인큐베이션이 완료되면 접시를 풀고 신속하게 반전하여 우물에서 모든 액체를 제거합니다. 각 웰에 약 200 마이크로리터의 세척 버퍼를 추가하여 접시를 씻으라. 이 액체를 재빨리 반전시키고 싱크대 위로 판을 쓸어 넘깁니다. 총 5개의 세시에 대해 이 과정을 4회 더 반복합니다. 다음으로, 희석된 검출 항체 용액 100마이크로리터를 각 웰에 추가하고 뚜껑을 교체하고 실온에서 2시간 동안 배양한다. 인큐베이션 후, 싱크대 위에 플레이트를 반전시키고 쓸어 넘기면 플레이트의 우물에서 검출 항체 용액을 추방한다.
이전과 마찬가지로, 세척 버퍼로 접시를 5 번 세척하고 각 세척 사이에 액체를 추방하십시오. 마지막 세척 후, 제조업체의 지시에 따라 희석하여 스트렙타비딘-고추냉이 과로시다제 용액을 준비합니다. 다음으로, 접시의 우물이 비어 있는 상태에서, 각 우물에 희석된 스트렙타비딘-고추냉이 과록시다제 용액 100마이크로리터를 추가합니다. 뚜껑을 접시에 다시 놓고 실온에서 2시간 동안 배양합니다.
인큐베이션 후, 사용하기 15분 전에 미리 만들어진 AEC 기판 용액을 활성화합니다. 우물의 내용물들을 버리고 이전과 마찬가지로 워시 버퍼로 접시를 5번 씻습니다. 그런 다음 준비된 AEC 기판 용액 100마이크로리터를 각 웰에 즉시 추가합니다. 플레이트를 실온에 두어 약 10~20분 동안 개발하며 현장 개발을 모니터링합니다. 이 반점은 우물 표면에 작고 어두운 원으로 나타납니다. 그런 다음 접시를 물로 헹구고 싱크대 위로 쓸어 넘기면 반응을 멈춥시다. 종이 타월에 접시를 블롯하고 밤새 또는 완전히 건조 할 때까지 공기 건조 할 수 있습니다. 접시 아래에 플라스틱 트레이를 제거하면 건조가 용이합니다. 건조 후, 반점은 자동화 된 플레이트 리더로 계산 할 준비가되어 있습니다.
여기서 CTL ImmunoSpot 판독기가 사용되지만 이 프로토콜은 모든 판독기에게 적용될 수 있습니다. 그런 다음 CTL 프로그램을 열고 스캔 카운트를 클릭합니다. 트레이가 기기에서 확장하도록 방부합니다. 그런 다음, 플라스틱 어댑터를 제거하고 ELISPOT 플레이트 및 어댑터에 행 A를 정렬합니다. 파일을 저장할 파일 이름과 위치를 선택하고 플레이트와 어댑터를 트레이에 로드합니다. 소프트웨어의 로드를 클릭하고 컴퓨터 측면의 문을 닫습니다. 그런 다음 계산 후 시작을 누릅니다. 파일을 저장한 다음 품질 관리 QC 소프트웨어를 열어 데이터를 분석하고 반점 수를 계산합니다. 이 데이터를 Excel 파일로 내보냅니다. 분석이 완료되면 이젝트(Dject)를 클릭하여 플레이트를 검색합니다.
본 실험에서, 야생형 및 종양 베어링 마우스로부터의 세포는 IFN 감마를 위해 도금 및 분석되었다. 세포 농도가 감소하면 반점 수가 줄어듭니다. 일반적으로 ELISPOT 데이터는 도금된 셀 수당 현물 수로 표시됩니다. 이 예제에서는 각 셀룰러 농도가 x축에 나열된 막대 그래프에 반점 수가 표시되었습니다. 반점 수는 지정된 집단의 총 셀 수당 활성화된 셀 수를 나타냅니다.
Subscription Required. Please recommend JoVE to your librarian.
Results
본 ELISPOT 분석에서, 야생형 및 종양 베어링 마우스로부터의 비장 백혈구는 IFN-γ 대해 분석하였다. 도 2 A는 분석 결과의 시각적 이미지를 나타낸다. 녹색 색의 숫자는 우물당 반점 수를 나타냅니다(TNTC는 "계산하기에 너무 많다"). 세포 농도가 감소하면 반점 수가 줄어듭니다.

그림 2A: 종양 을 낳는 마우스에 있는 감소된 면역 반응. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
일반적으로 ELISPOT 데이터는 도금된 셀 수당 현물 수로 표시됩니다. 도 2 B에서 각 셀룰러 농도가 X축에 나열되어 있는 막대 그래프에 반점 수가 표시됩니다. 그래프를 위해 150점을 사용하여 최대 반점 수를 나타수 표시했습니다. 종양 을 낳는 동물에서 뮤린 비장 백혈병을 생산하는 IFN-γ 수는 야생 유형보다 낮습니다.

도 2B: 종양 을 낳는 마우스의 면역 반응 감소. 비장세포는 대조군 C57BL/6(야생형) 및 종양 베어링 마우스로부터 수확되었고 48시간 동안 PMA/이오노마이신으로 자극하였다. ELISPOT 의 술은 IFN-γ 생산 비장 백혈구의 수를 양량화하는 데 사용되었다. (A) 데이터의 시각적 및 (B) 그래픽 표현. TNTC는 계산하기에 너무 많은 것을 나타냅니다. 그래프를 위해 150점을 사용하여 최대 반점 수를 나타수 표시했습니다. 녹색 숫자는 우물당 계산된 반점 수를 나타냅니다. 적색 숫자는 어떤 반점이 세포이고 어떤 반점이 이물질, 아티팩트 또는 에지 효과인지를 결정하는 데 사용된 참조 우물을 나타내며 분석에서 제외되어야 합니다.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
ELISPOT 분석법은 특정 분석기를 분비하는 세포의 수를 결정하여 면역 세포 활성화를 평가할 수 있게 합니다. 반점의 크기와 강도는 각 세포에 의해 생성되는 단량에 관한 정보를 제공합니다. 위에 설명된 프로토콜은 단일 사이토카인의 검출을 상세히 설명했습니다. 그러나 최근의 발전은이 분석의 유용성을 향상시켰습니다. 현재, 하나는 우물 내에서 여러 개의 aalytes를 검출하기 위해 형광 검출 염료를 사용할 수 있습니다. 이것은 하나 또는 둘 다 aalytes를 분비하는 세포의 다른 하위 집단의 검출을 허용합니다.
Subscription Required. Please recommend JoVE to your librarian.
References
- Czerkinsky, C. C., Nilsson, L. A., Nygren, H., Ouchterlony, O., & Tarkowski, A. A solid-phase enzyme-linked immunospot (ELISPOT) assay for enumeration of specific antibody-secreting cells. Journal of Immunological Methods, 65 (1), 109-121(1983).
- Wahid, R., Simon, J. K., Picking, W. L., Kotloff, K. L., Levine, M. M., & Sztein, M. B. Shigella antigen-specific B memory cells are associated with decreased disease severity in subjects challenged with wild-type Shigella flexneri 2a. Clinical Immunology, 148 (1), 35-43 (2013).
- Roberts, T. J., Lin, Y., Spence, P. M., Van Kaer, L., & Brutkiewicz, R. R. CD1d1-dependent control of the magnitude of an acute antiviral immune response. The Journal of Immunology, 172, 3454-3461 (2004).




