Overview
资料来源:迈克尔·李1和托尼娅·韦伯1
1马里兰大学医学院微生物学和免疫学系,马里兰州巴尔的摩的马琳和斯图尔特·格林鲍姆综合癌症中心 21201
免疫组织化学 (IHC) 和免疫细胞化学 (ICC) 是使用抗体可视化特定抗原的表达和定位的技术。IHC的首次使用是在1941年,当时阿尔伯特·库因斯利用这项技术来可视化感染肺炎球菌(1)的小鼠在组织部分中存在肺炎球菌抗原。名称,免疫组织化学,是从根"免疫-",指抗体,和"组织-",参照IHC中使用的组织部分。免疫细胞化学中根的"细胞-"突出了ICC和IHC之间的关键区别。IHC使用整个组织的各个部分,而ICC使用从组织分离或培养的细胞。所用样品的差异意味着样品制备在技术上因IHC和ICC而异,但除此之外,ICC和IHC的协议是相同的,人们会发现这些术语是可互换使用的。
在IHC和ICC中,分别带有化学或荧光标记的抗体,如过氧化物酶或罗丹,通过标记的抗体与抗原的特异性结合,用于可视化任何感兴趣的抗原的分布。在IHC的情况下,薄薄的组织切片被固定在幻灯片上,在被染色之前保持组织的结构,从而允许在整个组织环境中显示抗原(图1)。在ICC的情况下,细胞在被染色之前均匀地分布在幻灯片上,允许在单个细胞内显示抗原分布,但不在任何特定组织的结构内。由于两个协议之间的相似性,该协议将侧重于IHC,以解决IHC中涉及样品制备的额外复杂性。
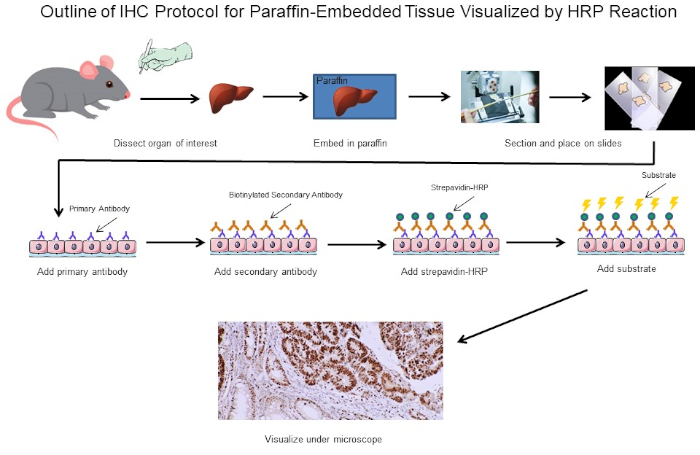
图1:IHC协议大纲。从小鼠解剖的石蜡嵌入组织的 IHC 协议的视觉轮廓。该协议使用生物回位抗体和链球菌-HRP来可视化抗体结合的位置。其他选项,如荧光标记抗体,也是可能的。请点击此处查看此图的较大版本。
执行 IHC 时的第一个重大决策是如何准备组织部分,以便在整个染色过程中保持组织的结构。两个主要选择是石蜡嵌入组织或冷冻组织的新鲜部分的正式固定部分。对于使用哪种方法,没有简单的答案,因为它取决于将进行的下游分析。石蜡嵌入组织的形式固定通常被认为可以更好地保存组织形态,以实现最佳成像,而冷冻新鲜组织可以保留蛋白质功能,用于 IHC 以外的后续检测。此外,新鲜冷冻组织部分已被证明更适合基因表达分析(2)。第三个考虑因素是,您感兴趣的抗原的抗体是否适合固定或冷冻组织部分,因为某些抗体仅针对特定类型的部分进行了优化,可能不适用于其他部分。最后,还需要确定它们需要多久来储存组织部分,因为新鲜冷冻样品必须保持在-80°C,并且不能持续超过一年,而固定切片可以在室温下储存更长时间。这些是确定是使用石蜡嵌入组织的形式固定部分还是冷冻组织的新鲜部分的一些主要考虑因素。最终,如果一个人有足够的组织,最好只是有一些两者。
在这个实验中,我们开始确定环素D1表达是否从淋巴瘤发育的自发小鼠模型增大了扩大的脾脏。首先从野生型小鼠、没有淋巴瘤的转基因小鼠或自发发展淋巴瘤的转基因小鼠中分离出脾组织样本。脾脏组织样本固定在甲醛中,嵌入石蜡中,分片,使用小鼠抗环素D1原抗体染色,然后使用马抗小鼠二次抗体,并使用3,3-二氨基苯甲酸(DAB)开发。然后,在哈里斯赫马图林溶液中对节进行反染色,然后以20倍放大倍率对各部分进行成像。
试剂
石蜡嵌入部分
- 4% 甲醛 (PFA)
- 乙醇(无水变性,组织学等级100%,95%,80%,75%,和50%)。可使用双蒸馏水(ddH2O)从100%库存中稀释
- 二甲苯
- IHC 兼容玻璃滑动,以确保组织部分在整个过程中保持连接。IHC 兼容玻璃玻片具有专用涂层,可从多个零售商处随时获得。如果执行 ICC,请使用室幻灯片。室室幻灯片允许将细胞播种在腔室中并放置在培养箱中,直到细胞附着在幻灯片上并达到适当的汇合点,此时,室可以去除,染色方式可以像 IHC 一样进行。
- 石蜡
- 0.3% 过氧化氢 (H2O2)/甲醇:要制备,添加 1 mL 30% H2O2至 99 mL 甲醇。储存在-20°C
- 抗原检索缓冲液:IHC酸酸缓冲液pH6.0
新鲜冷冻部分
- 最佳切削温度 (OCT) 嵌入化合物
- 最佳固定性:4% PFA 或丙酮已冷却至 -20°C
染色
- 阻塞缓冲区:应由用户确定。一个例子是马血清在1XPBS中稀释
- 稀释原抗体:参见制造商规格
- 稀释的生物防化二级抗体:参见制造商规格
- 稀释的红萝卜过氧化物酶(HRP):仅适用于过氧化物酶可视化。请参阅制造商规格。
- DAB 或其他兼容基板
- 反污(可选)
- 乙醇(无水变性,组织学等级100%和95%)
- 二甲苯
- 奥诺/利莫内山
Procedure
1. 免疫细胞化学细胞的制备
- 通过在24孔培养板的孔中加入0.5 mL的细胞悬浮液,将感兴趣的种子细胞添加到室片或室盖上。
注意:有些细胞可能需要在经过处理的盖玻片上生长,例如用多莱塞处理的盖玻片。最佳治疗条件应由用户根据所使用的细胞类型确定。 - 将板放入加湿CO2培养箱中,让细胞在37°C生长,直到50-70%汇合。
- 一旦细胞达到最佳汇合,从每个孔中取出培养培养物,然后,通过在0.5 mL的4%PFA(在1X PBS中稀释)孵育细胞,并在室温下孵育20分钟,从而修复细胞。
- 用 1 mL 1X PBS 去除固定剂并清洗水井三次。
- 接下来,通过在1X PBS中加入0.5 mL 0.1%的Triton-X-100到每个井中,并在室温下孵育15分钟,从而渗透细胞。
- 吸气缓冲液,用 1x PBS 的 1 mL 洗井三次。
- 盖玻上的细胞现在被固定和渗透。继续为以下免疫组织化学示例演示的染色程序 - 除了孵育应在 24 孔板的孔内进行,而不是直接在组织部分幻灯片上进行。
2. 为染色准备形式固定、石蜡嵌入部分
- 获得准备好的正式固定,石蜡嵌入式组织部分。
脱蜡化
- 将幻灯片浸入 100% 二甲苯中 2 次,每次 5 分钟。
补液
- 将幻灯片浸入 100% 乙醇中 2 次,每次 3 分钟。
- 将幻灯片浸入 95% 乙醇中 3 分钟。
- 将幻灯片浸入 70% 乙醇中 3 分钟。
- 将幻灯片浸入 50% 乙醇中 3 分钟。
阻断内源性过氧化物酶活性
- 在室温下,在 100 mL 的 0.3% H2O2中孵育幻灯片 30 分钟。
- 用 1X PBS 清洗幻灯片 2 次,每次 5 分钟。
抗原检索
- 将幻灯片浸入 IHC 水酸盐缓冲液 (pH 6) 中,煮 20 分钟。
- 组织幻灯片现已准备好进行染色。
3. 制备用于染色的新鲜冷冻、OTC 内嵌部分
- 将 5 mm 的新鲜分离组织放入模具中,并加入 OCT,直到完全覆盖该部分。
- 慢慢地将组织块浸入液氮中,直到完全冻结。样品现在可以在-80°C下储存长达1年。
- 一旦准备切片,将冷冻组织块转移到冷冻,并允许整个设置达到-20°C。
- 使用低温切割 5-10 μm 厚的组织部分,并使用刷子将截面直接放置在 IHC 兼容玻璃玻片上。
- 让滑梯在室温下过夜干燥。幻灯片也可以存储在-80°C。
- 在室温下将幻灯片浸入 250 mL 的 4% PFA 中 15 分钟,在染色前固定幻灯片。最佳固定方法应由用户确定。
- 将幻灯片浸入 250 mL 的 1X PBS 2 次,每次 5 分钟。
- 在室温下将幻灯片浸入 250 mL 的 0.3% H2O2中 30 分钟,以阻止任何内源性过氧化物酶活动。
- 将幻灯片浸入 250 mL 的 1X PBS 2 次,每次 5 分钟。
- 幻灯片现已准备好进行染色。
4. 染色
- 使用阻隔笔用疏水屏障圈组织。
阻塞
- 使用移液器,放置100 μL的阻塞缓冲液(马血清在1X PBS中稀释) - 在室温下在部分上放置1小时。
- 使用移液器清除阻塞缓冲区。
初级抗体孵育
- 在室温下用100μL稀释原抗体溶液(小鼠抗人环素D1在阻断缓冲液中稀释1:100)孵育被包围的组织30分钟。
- 从每张幻灯片上排出原抗体,用 1X PBS 洗涤幻灯片 2 次,每次 5 分钟。
二次抗体孵育
- 在室温下用100μL稀释的生物浸化二次抗体(生物浸化马抗小鼠IgG稀释1:200)孵育样品30分钟。
- 去除二级抗体,从部分中排出,用1X PBS洗涤2次,每次5分钟。
色彩开发
- 使用HRP进行可视化:加入100 μL的阿丁生物锡复合物(ABC)试剂,在室内温度下在暗中孵育30分钟
注意:荧光标记的抗体也可以使用适当的显微镜进行可视化。 - 用 1X PBS 清洗幻灯片 2 次,每次 5 分钟。
- 通过在 DAB 的 100 μL 中孵育各部分,以长达 5 分钟进行开发幻灯片。
- 在室温下加入蒸馏水(dH2O)5分钟,停止发育。
反染色(如果需要)
- 将幻灯片短暂浸入哈里斯血氧林溶液中(或0.5%甲基绿色,在0.1M醋酸钠(pH 4.2)中浸泡10分钟。
- 用 dH2O 洗涤幻灯片,每次洗涤 2 分钟,冲洗掉污渍。每次 5 分钟。
脱水
- 将幻灯片浸入 95% 乙醇中 2 次,每次 5 分钟。
- 将幻灯片浸入 100% 乙醇中 2 次,每次 5 分钟。
- 将幻灯片浸入 100% 二甲苯中 2 次,每次 5 分钟。
- 用纸巾把幻灯片擦干。
安装和盖玻片应用
- 在幻灯片中添加一滴安装介质(如有机体-柠檬安装),并在各部分上放置一个盖玻片。
微观分析
- 在适当的显微镜下观察染色部分进行分析。这里使用标准光学显微镜进行观察,安装数码相机进行成像。
免疫细胞化学和免疫组织化学是培养细胞和组织中感兴趣的蛋白质的染色方法。两种相关技术的基本原理是使用与检测系统标记的特定抗体来识别和可视化蛋白质,并确定其在细胞和组织内的位置以及相对水平。两个实验中的过程都从样品制备开始。
免疫细胞化学,专门可视化细胞中的蛋白质或抗原位置,这涉及三个步骤。第一步是电镀,这需要培养生长介质中的细胞在盖滑或滑动,通常,在培养板的井。其次是固定,在细胞中加入一种沉淀或交联剂(如甲醛),以保持蛋白质的结构完整性,防止酶活性降解。最后一步是渗透,这涉及添加洗涤剂,使细胞膜渗透的染色。
在对应方法中,免疫组织化学、蛋白质或抗原在组织中可视化,样品制备有五个步骤。首先,整个组织被固定,通常与甲醛。然后,将组织嵌入石蜡块中,然后用一种称为微体机的机器分割这个块,将组织切成薄片,可以放置在幻灯片上。接下来,对幻灯片进行脱蜡,或从组织切片周围去除石蜡。然后,可以执行可选的抗原检索步骤。这既可以用热或酶来揭开在固定过程中交联的表位,使它们可用于抗体结合。适当的样品制备后,将目标特异性原抗体添加到细胞或组织样本中。这种初级抗体应与感兴趣的蛋白质结合。接下来,添加二级抗体,检测并结合原抗体。这种二次抗体与一种称为HRP的酶结合,或可以结合。当添加其特定的基板 DAB 时,HRP 将其转换为不溶性棕色沉淀物。这个棕色的污渍标志着目标蛋白的位置。幻灯片还沾染了血氧素,将原子核标为蓝色,并为确定亚细胞定位提供空间参考点。之后,安装介质将添加到幻灯片中,然后加盖滑移,以密封和保存染色样品。最后,可以在光学显微镜上成像幻灯片。
在本视频中,您将观察镀层细胞和组织部分的样品制备技术,然后对组织部分进行免疫染色。
首先,感兴趣的细胞需要坐在盖玻片上。为此,在组织培养罩中工作,将单个盖玻片放入 24 孔板的井中。然后,关闭窗框并打开紫外线,对盖玻片进行至少 15 分钟的消毒。接下来,关闭紫外线。要将感兴趣的细胞从10厘米的培养皿中抬起,吸气介质,用PBS短暂清洗,并将胰蛋白酶加入细胞2分钟。然后,点击板的一侧,确保细胞已分离,并用介质中和胰蛋白酶。接下来,添加 0。5 mL 的电池悬浮液进入每个孔中,确保盖住盖玻片。将板放入加湿的 CO2 培养箱中,让细胞在 37 摄氏度下生长,直到它们汇合 50-70%。
一旦细胞达到最佳汇合,从每个孔中吸出培养基,然后通过在中孵育细胞来固定细胞。在室温下,在1X PBS中稀释5mL4%的甲醛20分钟。去除固定剂后,冲洗细胞在每个盖玻片上添加1mL的1X PBS。立即吸出 PBS,然后重复冲洗 2 次,共洗 3 次。
现在,通过在 1X PBS 中向每个井中添加 0.5 mL 的 0.1% Triton X-100 来渗透细胞。将盘子在室温下保持15分钟。吸气缓冲液,然后通过在每个井中加入1mL的1X PBS来冲洗细胞。立即吸出 PBS 并重复冲洗 2 次,共洗 3 次。现在,盖玻上的细胞是固定和渗透的,继续为以下免疫组织化学示例演示的染色程序,但孵育应在 24 孔板的孔内进行而不是直接在组织部分幻灯片上。
首先,获得准备好的、正式固定的石蜡嵌入组织部分。将幻灯片放入滑架中,然后完全浸入 250 mL 的 100% 二甲苯中,从而对幻灯片进行脱脂。让幻灯片在二甲苯中孵育5分钟。然后,从容器中取出幻灯片,用纸巾擦去,然后放入新的二甲苯浴中,再放入一个新鲜的容器中 5 分钟。
接下来,从100%乙醇开始,在一系列分级乙醇溶液中重新水化各部分3分钟。用纸巾擦拭滑架,并将幻灯片转移到 100% 乙醇的新容器中再工作 3 分钟。继续这个循环的洗涤,用纸巾干燥,并在指定时间内按照指示的乙醇浓度将滑梯转移到新的浴缸中。最后一次乙醇清洗后,用纸巾擦去机架,在室温下用100 mL的0.3%过氧化氢孵育幻灯片30分钟,以阻止任何内源性过氧化物酶活性。在 250 mL 的 1X PBS 中清洗幻灯片 5 分钟。在新鲜 1X PBS 的容器中重复洗涤 5 分钟。
接下来,通过将 IHC 青基酸盐缓冲液中的 250 mL 中滑片浸入 pH 6.0 中,然后煮沸 20 分钟,执行抗原回收。然后,继续染色协议。
要开始 IHC 的染色过程,请用疏水笔圈出各部分,以确定缓冲液需要覆盖的最小面积。然后,使用移液器放置100微升的阻塞缓冲液,这在这个实验中是马血清稀释在1XPBS,在部分。在室温下孵育幻灯片1小时。之后,使用移液器移除阻塞缓冲区。
接下来,通过在1X PBS中稀释的990微升马血清,在1:100稀释时稀释原抗体并阻断缓冲液。5 mL Eppendorf管,然后是10微升的原发抗体。在每个部分加入100微升稀释的原抗体,并在室温下孵育幻灯片30分钟。当计时器响起时,将原抗体从每张幻灯片上排出,然后在 250 mL 的 1X PBS 中洗涤 5 分钟。使用新鲜的 1X PBS 再次重复此洗涤。
当幻灯片在1X PBS中洗涤时,通过在1.5 mL管中加入995微升的阻断缓冲液,然后加入5微升的二级抗体,将二次抗体稀释至1:200稀释,在这种情况下,这是生物酸淡马抗小鼠IGG。在每个部分加入100微升稀释的二级抗体,然后在室温下孵育幻灯片30分钟。30分钟后,将二级抗体从部分中排出,然后在250 mL的1X PBS中清洗幻灯片5分钟。使用新鲜的 1X PBS 重复此洗涤。
现在,加入100微升的阿丁-生物锡复合试剂,在室温下在黑暗中孵育30分钟。接下来,将幻灯片浸入 1X PBS 的 250 mL 中,洗涤 5 分钟。与以前的洗涤步骤类似,使用新鲜的 1X PBS 再次重复此洗涤。接下来,通过在 100 微升 DAB 中孵育各部分长达 5 分钟来开发幻灯片。将部分浸在 250 mL 蒸馏水中 5 分钟,停止开发。
现在,如果需要,可以对幻灯片进行反染色。为此,在 250 mL 的哈里斯赫马图林溶液中短暂浸入幻灯片。将滑片在 250 mL 蒸馏水中洗涤 5 分钟,冲洗掉污渍。使用新鲜的蒸馏水再重复1次洗涤。接下来,使部分脱水。为此,首先用95%乙醇孵育幻灯片5分钟。将幻灯片放在纸巾上,再将它们转移到新鲜 95% 乙醇的新容器中再多 5 分钟。继续循环清洗,用纸巾打上印迹,并将幻灯片转移到新浴缸,按照所示溶液各5分钟。
完成孵育后,用纸巾将幻灯片斑点,然后将一滴安装介质(如有机体-柠檬山)添加到幻灯片中。现在,在各部分放置一个盖玻片,注意不要捕获气泡。现在,这些幻灯片已准备就绪,可在显微镜下进行分析。
要观察染色部分,请使用标准光学显微镜来可视化污渍,使用数码相机来捕捉图像。在这个IHC的这一特殊例子中,比较了来自野生型和自发性、双转基因或DTG小鼠的脾组织,用于研究淋巴瘤中的Dyclin D1表达。组织被石蜡嵌入,切片,并沾染抗环素D1抗体,并成像在20倍放大倍数。Cyclin D1 表达细胞在蓝色组织背景上由红褐色表示。比较不同小鼠图像中的染色强度,无论小鼠基因型如何,未放大的脾脏的Cyclin D1表达量都相对较低。相比之下,DTG小鼠的脾脏增大,显示红褐色染色增加,表明此小鼠模型中的癌症发育与Cyclin D1表达之间存在相关性。
Subscription Required. Please recommend JoVE to your librarian.
Results
IHC 和 ICC 具有广泛的应用。例如,IHC的一个用途是检查肿瘤发育的自发小鼠模型中肿瘤基因的表达。在图2中,我们着手确定在淋巴瘤发育的自发小鼠模型中,在扩大的脾脏中是否增加了环素D1表达。脾脏组织样本固定在副甲醛中,嵌入石蜡中,分片,使用抗环素D1抗体染色(在阻断缓冲液中稀释1:200),然后以20倍放大倍率对各部分进行成像。Cyclin D1 表达细胞在蓝色组织背景上由红褐色表示。这些结果表明,在扩大的脾脏中循环D1表达增加,表明该模型中癌症发育与环素D1表达的相关性。

图2:淋巴瘤自发双转基因(DTG)小鼠模型中的斯普莱辛环素D1表达。用抗Cyclin D1原抗体染色的脾脏组织图像,用甲基绿色反染,并使用生物素化二级抗体和用DAB基质激活的ABC试剂进行可视化。红褐色表示抗体结合的位置,指示在已反染为蓝色的脾组织结构内表达肿瘤细胞的Cyclin D1的存在。请点击此处查看此图的较大版本。
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
免疫组织化学 (IHC) 和免疫细胞化学 (ICC) 是使用抗体可视化特定抗原的表达和定位的技术。组织首先被切成薄部分,保持组织形态,并放置在幻灯片上。然后添加抗体,将感兴趣的抗原结合,并配备一个特定的标记,允许它们在显微镜下可视化。因此,通过这个基本概念,可以可视化和研究抗原在组织结构背景下的分布。然而,虽然总体概念是基本的,但已经发展了多种不同的方法和变体,增加了这些技术的复杂性和实用性。本文涵盖了IHC和ICC的基本概念、使用这些技术时需要考虑的主要决定以及详细的分步协议。IHC 和 ICC 生成的图像通常是最终产品,可以作为强调不同条件下染色量或分布的明显差异而发布。
Subscription Required. Please recommend JoVE to your librarian.
References
- Coons, A. H. Creech, H. J., Jones, N. and Berliner, E. The Demonstration of Pneumococcal Antigen in Tissues by the Use of Fluorescent Antibody, The Journal of Immunology, 45 (3), 159-170 (1942).
- Ripoli, F. L., Mohr, A., Hammer, S. C., Willenbrock, S., Hewicker-Trautwein, M., Hennecke, S., Escobar, H. M. and Nolte, I. A comparison of fresh frozen vs. Formalin-fixed, paraffin-embedded specimens of canine mammary tumors via branched-DNA assay. International Journal of Molecular Sciences, 17 (5) (2016).




