Overview
资料来源:多米尼克·博利诺1,埃里克·勒贡佐夫2,托尼娅·韦伯1
1马里兰大学医学院微生物学和免疫学系,马里兰州巴尔的摩的马琳和斯图尔特·格林鲍姆综合癌症中心 21201
2马里兰大学医学院生物医学工程与技术中心,巴尔的摩,马里兰州 21201
与传统的"广域"显光显微镜相比,共聚焦荧光显微镜是一种成像技术,能够提高光学分辨率。共聚焦显微镜能够通过"激光扫描"实现更好的 x-y 光学分辨率, 通常是一组电压控制的反射镜(电流计或"galvo"反射镜), 一次将激光照明定向到试样的每个像素。更重要的是,共聚焦显微镜通过使用针孔去除来自未位于被扫描的 z 平面位置的聚焦光,从而达到卓越的 z 轴向分辨率,从而使探测器能够从指定的 z 平面收集数据。由于共聚焦显微镜可实现高 z 分辨率,因此可以从一系列 z 平面(也称为 z 堆栈)中收集图像,并通过软件构建 3D 图像。
在讨论共聚焦显微镜的机制之前,考虑样品如何与光相互作用是很重要的。光由光子、电磁能量包组成。冲击生物样品的光子可以通过四种方式之一与构成样品的分子相互作用:1)光子不相互作用,通过样品;2) 光子反射/散射;3) 光子被分子吸收,吸收的能量通过统称为非辐射衰变的过程以热量释放;4) 光子被吸收,然后能量通过荧光过程作为二级光子迅速重新发射。结构允许荧光发射的分子称为荧光。大多数生物样本含有可忽略不计的内源性荧光水;因此,必须使用外源性荧光草来突出样品中感兴趣的特征。在荧光显微镜期间,样品用适当波长的光照亮,供荧光吸收。吸收光子后,氟荧光剂被称为"兴奋",吸收过程称为"激发"。当荧光剂以光子的形式释放能量时,这个过程被称为"发射",发射光子称为荧光。
用于激发荧光的光束由显微镜的物镜聚焦,并汇聚在最大聚焦的"焦点"处。超越焦点,光线再次发散。进入和退出的光束可以可视化为一对锥体接触焦点(参见图1,左侧面板)。衍射现象限制了光束的聚焦程度——光束实际上聚焦到有限大小的点。决定焦点大小的两个因素:1)光的波长,2)物镜的光聚集能力,其特征是其数值光圈(NA)。焦"点"不仅在x-y平面上延伸,而且在z方向上延伸,实际上是一个焦点体积。此焦卷的尺寸定义了光学成像可实现的最大分辨率。虽然光子的数量在焦量内最大,但焦点上方和下方的锥形光路也包含较低的光子密度。因此,光道中的任何荧光光能激发。在传统的(广域)荧光显微镜中,从焦平面上方和下方发射的荧光导致荧光失焦("模糊背景"),从而降低图像分辨率和对比度,如图 1 所示,代表焦平面(红星)上方的荧光发射的红色立方体,导致失焦荧光(右上)。由于使用针孔,这个问题在共聚焦显微镜中得到改善。(图2,右下角)。如图 3 所示,针孔允许来自焦点位置的发射物到达探测器(左图),同时阻止失焦荧光(右)到达探测器,从而提高分辨率和对比度。
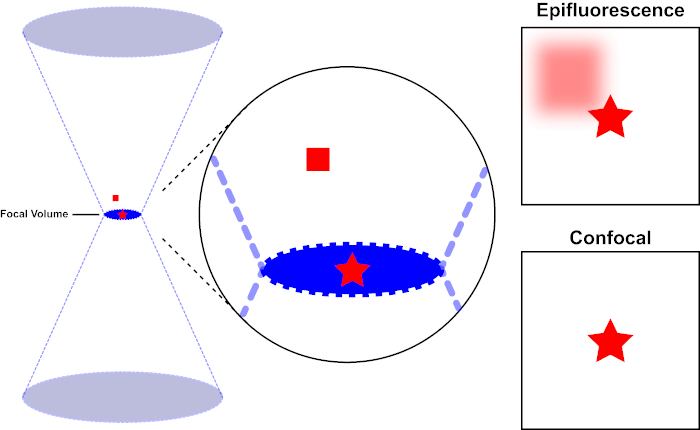
图 1.荧光与共聚焦显微镜的光学分辨率。请点击此处查看此图的较大版本。
用于激发荧光的光束由显微镜的物镜聚焦,并收敛在焦量上,然后分流(左)。红色星表示正在成像的样本的焦点平面,而红色方块表示焦平面上方的荧光发射。当使用表观显微镜拍摄此样本的图像时,从失焦的红色方块发射将可见,并造成"模糊背景"(右上)。共聚焦显微镜有一个针孔,可防止检测焦平面外发出的光,从而消除"模糊背景"(右下角)。
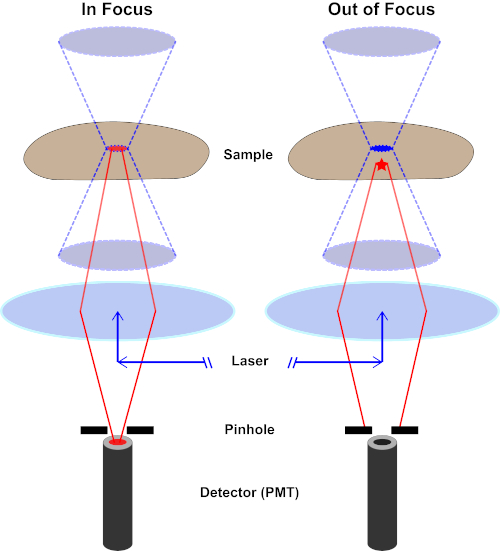
图 2.共聚焦显微镜中的针孔效应。请点击此处查看此图的较大版本。
虽然激发光的最高强度位于透镜的焦点(左,红色椭圆形),但样本的其他部分不在焦点(右,红星)将得到光和荧光。为了防止从这些失焦区域发出的光到达探测器,探测器前面有一个带针孔的屏幕。只有从焦平面发出的对焦中光(左)才能穿过针孔并到达探测器。探针孔挡住了失焦光(右),无法到达探测器。
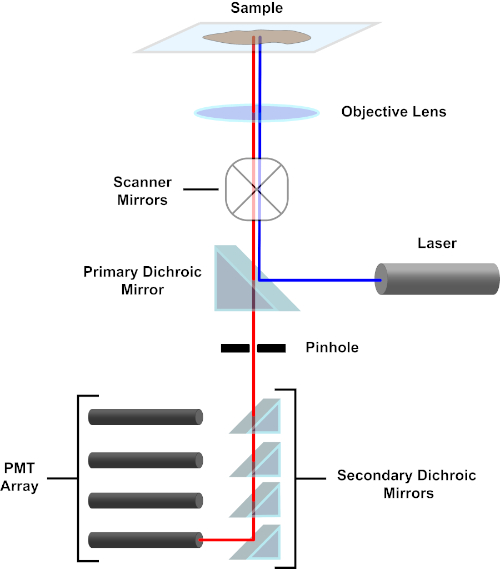
图 3.共聚焦激光扫描显微镜的主要部件。请点击此处查看此图的较大版本。
为了简单起见,共聚焦显微镜的机械描述将仅限于尼康Eclipse TI A1R的描述。虽然不同共聚焦显微镜之间可能存在细微的技术差异,但 A1R 还是很好地描述了共聚焦显微镜的功能。由一系列二极管激光器产生的激发光束由主二色镜反射到目标中,将光线聚焦到被成像的试样上。主二色镜选择性地反射激发光,同时允许其他波长的光通过。然后,光线会碰到扫描镜,以x-y的方式扫描整个试样上的光束,一次照亮一个(x,y)像素。光透镜收集光晕在发光像素处发出的荧光,并通过主二色镜到达一系列光电倍增管 (PMT)。二次二色镜将发射光定向到适当的PMT。样品散射到目标中的激励光由主二色镜反射回试样,从而阻止进入检测光路径并到达 PMT(参见图 3)。这使得相对微弱的荧光可以量化,而不会受到从激发光束散射的光污染,而荧光通常比荧光强度大一个数量级。由于针孔会阻挡焦量外部的光线,因此到达探测器的光线来自一个狭窄的选定z平面。因此,可以从一系列相邻的z平面中收集图像;这一系列图像通常称为"z 堆栈"。通过使用适当的软件,可以处理z堆栈以生成试样 3D 图像。共聚焦显微镜的一个特别优点是能够区分染色的亚细胞定位。例如,膜染色与细胞内染色的区分,这在传统的荧光显微镜(1,2,3)中极具挑战性。
样品制备是共聚焦成像的一个重要方面。光学显微镜技术的优势是成像活细胞或固定细胞的灵活性。当尝试生成 3D 图像时,由于 z 堆栈必须获取的图像数量、维持细胞健康的困难以及活细胞及其细胞器的运动,因此使用固定细胞是典型的。共聚焦荧光的固定和染色细胞的程序与免疫荧光中常用的程序类似。在腔室滑动或盖玻片上培养后,使用甲醛固定细胞以保存细胞形态。非特异性抗体结合被用牛血清白蛋白、牛奶或正常血清阻断。为了保持二次抗体的特异性,所使用的溶液不应来自产生主要抗体的同一物种。细胞用结合感兴趣的抗原的原抗体孵育。在标记多个细胞靶点时,主要抗体必须分别来自不同的物种。标记抗原的抗体然后由荧光酸结合的二级抗体结合。应选择荧光二级抗体,使其与共聚焦显微镜中可用的激光激发波长兼容。在可视化多个抗原时,荧光道的激发/发射光谱应足够不同,以便通过微观分析可以区分其信号。然后,将染色的试样安装在滑轨上进行成像。安装介质用于防止光漂白和样品脱水。如果需要,可以使用包含核反子(例如 DAPI 或 Hoechst)的安装介质 (4)。
在以下协议中,为表达CD1d(LCD1)而转染的小鼠成纤维细胞被识别CD1d和CD107a(LAMP-1)的抗体染色。CD1d 是一种主要的组织相容性复合体 1 (MHC 1) 样受体存在于抗原呈现细胞的表面,呈现脂质抗原。LAMP-1(脂质体相关膜蛋白-1)是一种横膜蛋白,主要存在于脂质膜中。为了获得适当的抗原表达,CD1d通过低pH的感其中体腔,因此LAMP-1被用作本协议的感其中体腔的标记。通过探测不同物种生产的具有抗CD1d和抗LAMP-1的LCD1细胞,可以使用具有独特荧光道的二次抗体来确定细胞中每种蛋白质的定位,以及LAMP-1阳性中是否存在CD1d利索体隔间。
Procedure
1. 材料
缓冲区
- 洗涤缓冲液:1 X 无钙或镁无菌磷酸盐缓冲盐 (PBS)
- 固定缓冲液:PBS中1%的甲醛
- 渗透缓冲器:PBS 中的 0.1% Triton X-100
- 阻断缓冲液:PBS中1%牛血清白蛋白
- 细胞生长培养基:DMEM辅以10%胎儿牛血清(FBS)、青霉素/链霉素和L-谷氨酰胺
设备
- 拉米纳尔流量罩
- 加湿培养箱 (37°C, 5% CO2)
- 共聚焦激光扫描显微镜;在这里,尼康Eclipse Ti激光
材料和试剂
- 室室培养幻灯片
- 带 DAPI 的防褪色安装介质(用于染色核)
- 显微镜盖玻璃
- 精细的任务擦除
- 移管器和提示
测定特异性试剂
- 附着细胞(原细胞或细胞系);这里使用CD1d转染的小鼠成纤维细胞(LCD1)。
- 检测细胞靶点的主要抗体;这里使用了大鼠抗鼠标CD107a(LAMP-1)和鼠标抗鼠标CD1d。
- 荧光团结合原抗体等型的二级抗体;这里使用抗鼠IgG与Alexafluor488和抗小鼠IgG结合的Alexafluor647。
2. 议定书
准备抗体染色
种子细胞
- 重新悬浮生长介质中感兴趣的细胞。
- 然后,将500 μL的细胞悬浮液/每孔种子放入4孔室滑动的孔中。(在这里,LCD1细胞在2.5x105细胞/室的500μL生长培养中播种。种子密度可能因细胞系而异)。
- 在 37°C 的 5%CO2培养箱中孵育室滑动过夜,使细胞粘附在玻璃上。
- 第二天,从每个井中吸出介质,然后用500μL PBS清洗细胞1X。
固定
- 要修复细胞,将500μL 1%的甲醛溶液加入每个井中,并在室温下孵育15分钟。
- 孵化后,将甲醛收集到适当的危险液体废物容器中。
- 然后,用500μL PBS清洗细胞3次,以去除任何固定剂的残留物。
渗透
- 在室温下用500μL渗透缓冲液/井孵育15分钟,使细胞渗透。
- 然后用500μL的PBS短暂地清洗细胞3次。
阻塞
- 用500μL阻断缓冲液在每个井中孵育细胞1小时,在4°C下,以阻止非特异性抗体结合。
初级抗体孵育
- 从滑动室中吸出阻塞缓冲液。
- 然后,向细胞中加入500μL的稀释原抗体溶液。(在这里,抗CD107a(LAMP-1)被稀释1:500,抗CD1d被使用未稀释(1H6单克隆抗体由兰迪·布鲁特凯维奇博士提供)。
- 在 4°C 下孵育幻灯片过夜。
注意:如果探测多个目标,请确保主要抗体是不同的等型。推荐的抗体浓度因制造商而异,应在使用前进行定子。
二次抗体孵育
- 从井中吸出原抗体溶液。
- 用 500 μL PBS 清洗井室 4 次。
- 然后,在每个井中加入500μL的稀释二级抗体溶液。(此处,二级抗体-抗小鼠IgG Alexafluor 647和抗鼠IgG Alexafluor 488在阻塞缓冲液中稀释1:2000)。
- 在黑暗中在室温下孵育1小时。
- 孵育后,吸出二级抗体溶液。
- 用500μL PBS清洗腔室4次,以去除任何未结合的二级抗体。
注意:推荐的抗体浓度因制造商而异,应在使用前进行定子。如果探测多个目标,二级抗体必须与具有独特激发/发射光谱的不同荧光道结合。在选择荧光管时,还要记住核反子(即DAPI)的激发/发射。荧光酸的选择可能会受到使用共聚焦显微镜的激光配置的影响。机器的激光配置将决定哪些荧光光道适合实验。
3. 安装盖玻片
- 首先,小心地从幻灯片上取下腔室。
- 然后,将幻灯片以角度握住精细的任务擦除,然后从边缘取出液体,而不接触单元格。
- 在细胞的每个部分添加1滴含有核染色DAPI的抗褪色安装介质。
- 接下来,使用指尖将其放在边缘上,将 20 mm x 60 mm 盖玻片放在幻灯片上。(避免在细胞上形成气泡,因为它们会干扰成像)。
- 用精细的任务擦拭擦拭两侧任何额外的安装介质,并在室温下将幻灯片存放在黑暗中,长达一周。
4. 共聚焦成像
共聚焦激光扫描显微镜上的图像样本。对于图 2 所示的数据,尼康Eclipse Ti A1R 与 NIS 元素高级研究软件一起使用。以下部分详细介绍了使用上述软件捕获图像的过程。
- 要开始对单元格进行成像,请单击"NIS 软件图标"打开"NIS 元素高级研究软件"。
- 接下来,在控制窗口中单击"TiPad"选项卡并选择所需的成像目标。(此处使用了第一个 40x 目标)。
- 将幻灯片与单元格加载到舞台上,并将其居于镜头下方。
- 现在,在"A1plus 紧凑型 GUI"选项卡上,设置适合使用的荧光道的激光器。单击齿轮符号以打开染料和光谱设置菜单,选择所需的通道,并为每个通道设置激光。
- 然后,在第一个二色镜下的下拉菜单中选择适当的排放。
- 接下来,在"A1plus 紧凑型 GUI"窗口下,单击"Ch. 系列"以设置线路通道系列,该系列设置所使用的激光器是同时或按顺序对样品开火。(此处,选择顺序刀路,从通道 1 开始,然后是通道 2,然后是 4)。
- 之后,点击顶部的"箭头提示"图标开始扫描。此时,当成像是实时的,在'A1plus紧凑型GUI'窗口下,点击滑动刻度并修改针孔大小,以确保限制对焦光。(此处,使用了最低可用设置 (0.5)。
- 接下来,使用滑动刻度将每个激光下的"高压"和"偏移"设置调整到适当的水平,以便检测特定的染色,同时限制任何潜在的背景染色。如果有正染色样品可用,则首先为每个通道对该样本进行成像,以确保激光设置产生最佳信号与噪声比。
注意:长时间使用高激光强度可能会导致光漂白。 - 设置每个激光器的最佳 HV 和偏移值后,单击"ND 采集"选项卡,然后选择"Z"图标以设置 z 系列的参数。接下来,在获取样本的实时图像时,首先通过查找图像底部并单击"底部"按钮来设置底部,然后找到样本的顶部位置并单击"顶部"按钮。通过为每个步骤在 μm 中专门键入首选步长大小,或者指定所需的总步长数来设置步长大小。
- 设置 z 系列参数后,选择图像所需的大小/像素分辨率。为此,请单击"A1plus 紧凑 GUI"窗口,在"大小"图标下选择所需的分辨率。要降低图像的噪点,可以选择"+"符号旁边的下拉菜单,以平均所选图像数。
- 现在,单击"ND 采集菜单"上的"立即运行"选项卡,以开始映像示例。
- 映像完成后,通过单击"文件"保存图像,然后单击"另存为",这将导出带有扩展名".nd2"的图像文件。最后,对每个其他示例重复此过程。
共聚焦荧光显微镜是一种专门的成像技术,通过用抗体结合的荧光染料标记抗原并检测荧光信号,在细胞或组织样本中定位感兴趣的蛋白质或抗原。与广场荧光显微镜相比,它提供了更高的空间分辨率,在物镜焦平面上放置了两个针孔,使其得名共聚焦。它使用户能够在亚细胞水平上可视化染色,例如表面膜染色与细胞内染色之间的区分。
共聚焦显微镜遵循与经典荧光显微镜类似的基本原理。光源的光束(通常是用于共聚焦的激光)由二色镜反射,并由样品上的物镜聚焦。这种光激发荧光道发出不同的波长,通过物镜和二色镜传回相机或目镜。
共聚焦显微镜的分辨率增强主要是由于存在两个针孔,这是非常小的孔,供光线在激发和发射光路径上通过。针孔战略性地放置在物镜的焦点平面上。现在,让我们切换到显微镜排列的侧视图示意图,以检查光路径。穿过激励针孔后,激发光束具有源自焦点的效果,从而使物镜能够将光线聚焦到样品上的一个点上。来自该焦点的发射光束收敛在发射针孔处,从而允许其通过。现在在激发过程中,光道内外的荧光道,在焦点上方和下方,也稍微兴奋。当来自焦点的发射光穿过针孔时,来自离焦点的发射点在发射针孔之前或之后会汇聚,因此被阻塞,从而导致背景荧光减少。
激发-发射-检测周期需要针对目标区域中的每个成像点重复,这可以通过几种不同的方式完成。例如,激光扫描共聚焦使用电流计扫描镜,从而在不同角度偏转激发光。因此,在 XY 平面上将光束扫过试样。旋转光盘共聚焦使用具有针孔阵列的光盘,该光盘旋转以移动针孔的排列。这使用户能够每次照亮样品中的多个小成像点,随着光盘旋转,逐渐覆盖整个区域。由于针孔,探测器上的 XY 图像表示一个狭窄的 Z 平面。因此,可以从一系列连续的 Z 平面(通常称为 Z 堆栈)中收集图像。从这些图像中,适当的软件可以生成样品中荧光信号模式的 3D 描述。
在此协议中,您将观察小鼠成纤维细胞的免疫染色,随后在共聚焦显微镜上进行成像,以差异地可视化细胞表面蛋白和流解体蛋白。
首先,使用无菌技术,将感兴趣的细胞重新悬浮在每口井500微升的生长介质中,然后将它们播种到四井室滑动的井中。在这里,我们使用被转染的小鼠成纤维细胞来表达抗原呈现分子CD1d。为了让细胞粘附在玻璃上,将腔室滑动在37摄氏度的5%二氧化碳培养箱中,并在一夜之间孵育。早晨,从每个井中吸出介质,然后用500微升的PBS清洗细胞一次几秒钟。
要修复细胞,在每个井中加入500微升1%的甲醛溶液,并在室温下孵育15分钟。孵育后,将甲醛收集到适当的危险液体废物容器中,然后用PBS清洗细胞三次,以几秒钟清除任何固定物。
为了让抗体渗透到细胞中,在每个井中加入500微升的渗透缓冲液,并在室温下在工作台上孵育15分钟。渗透后,用500微升的PBS短暂地清洗细胞三次。接下来,在每个井中加入500微升的阻断缓冲液,并在4摄氏度下孵育一小时,以防止非特异性抗体结合。
以适当的工作浓度制备主要抗体,抗CD1d和抗LAMP-1。然后,从井中吸出缓冲液,用500微升稀释的原抗体溶液覆盖每个井中的细胞,然后在4摄氏度的平坦表面上孵育滑道过夜。第二天早上,稀释二级抗体,在这种情况下,一种具有明显荧光标记的抗鼠和抗鼠抗体,在阻断缓冲液中以适当的工作浓度。接下来,从井中吸出原抗体溶液,然后用500微升的PBS清洗细胞四次。然后,将500微升稀释的二级抗体溶液加入每口井中,在室温下在黑暗中孵育一小时。孵育后,吸出二级抗体溶液,用500微升的PBS清洗井4次,以去除任何未结合的二级抗体。
要在最终清洗后安装样品,请小心地从滑轨上拆下腔室。要移除残留的 PBS,请将幻灯片以一定角度握住精细的任务擦除,并在不接触单元格的情况下从边缘取出液体。一旦去除多余的PBS,在细胞的每个部分添加一滴含有核染色DAPI的抗褪色安装介质。接下来,采取20乘60毫米的盖玻片,并使用指尖开始缓慢降低覆盖滑片在任一边缘,注意避免气泡形成在细胞。用精细的任务擦拭擦拭幻灯片上任何额外的安装介质,并将幻灯片存放在室温下,在室内温度下存放长达一周。
要开始对单元格进行映像,请先单击桌面上的 NIS 软件图标。进入控制窗口后,单击顶部的 TiPad 选项卡,然后选择所需的成像目标。然后,将带有单元格的幻灯片加载到舞台上,并将其居于镜头下方。接下来,在 TiPad 选项卡旁边的 A1plus 紧凑型 GUI 选项卡上,设置适合使用的荧光荧光道的激光器。单击齿轮符号以打开染料和光谱设置菜单。染料和光谱设置菜单打开后,选择所需的通道并为每个通道设置激光。然后,在第一个二色镜下的下拉菜单中选择适当的排放。接下来,在 A1plus 紧凑型 GUI 窗口中,单击 Ch.Series 以设置线路通道系列,该系列设置所使用的激光器是同时或按顺序对样品开火。
之后,通过单击顶部的箭头提示图标开始扫描。此时,当成像是实时的时,在 A1plus 紧凑型 GUI 窗口下,单击滑动刻度,并修改针孔大小以确保限制失焦光线。接下来,使用滑动刻度将每台激光下的高压和偏移设置调整到适当的水平,以便检测特定的染色,同时限制任何潜在的背景染色。如果有正的染色样品,首先为每个通道对样品进行成像,以确保激光设置产生最佳的信噪比。设置每个激光器的最佳 HV 和偏移值后,单击 ND 采集选项卡,然后选择 Z 图标以设置 z 系列的参数。
接下来,在获取示例的实时图像时,首先通过查找图像底部并单击底部按钮来设置底部。然后,找到示例的顶部位置,然后单击顶部按钮。通过为每个步骤专门键入首选步长(以微米)或指定所需的总步长数来设置步长大小。要选择图像所需的大小/像素分辨率,请单击 Aiplus 紧凑型 GUI 窗口,并在大小图标下选择所需的分辨率。
要降低图像的噪点,可以选择 ta 符号旁边的下拉菜单,以平均所选图像数。在此之后,单击 ND 采集菜单上的"立即运行"选项卡以开始映像示例。映像完成后,通过单击文件保存图像,然后保存为 ,这将导出带有扩展名点 2 的图像文件。最后,对每个其他示例重复此过程。
在这个实验中,表达表面糖蛋白基因CD1d的小鼠成纤维细胞被固定、免疫染色,并在共聚焦显微镜上成像。此图像以 40 倍的放大倍率显示 Z 堆栈的单个部分,其中 CD1d 被染成红色。样品与LAMP-1(一种水球体标记物)一起以绿色标记。核染色DAPI用于显示细胞核。
在合并三个不同通道的复合图像中,黄色的外观产生于红色和绿色通道的重叠,并指示 CD1d 和 LAMP-1 在等体中共同本地化的区域。只有一种颜色的区域表示存在 CD1d 或 LAMP-1,但没有共同本地化。此图像显示从 z 堆栈中捕获的图像构建的单元格的 3D 渲染,此方法启用了此单元格组的侧视图构造。下图以 100 倍放大倍数从 z 堆栈中分出一个切片,更详细地演示了这两种蛋白质的表达模式。图像右侧的粉红色轮廓框显示图像中粉红色线指定的 x 坐标的横截面,该线表示粉红色线条的侧视图。同样,图像底部的蓝色轮廓框显示图像中由蓝线指定的 y 坐标的横截面,该横线表示蓝线处的前视图。z 堆栈图像的 3D 渲染使用户能够以 3D 形式查看图像,并可视化所有 x、y 和 z 平面。这可以用来研究细胞内不同区域不同污渍的共同定位。
Subscription Required. Please recommend JoVE to your librarian.
Results
在这个实验中,表达表面糖蛋白基因CD1d的小鼠成纤维细胞被固定、免疫染色,并在共聚焦显微镜上成像。使用上述协议获得的代表性图像如图 4 所示。在A的顶部面板中,显示了每个目标的染色图案的单通道图像。这些图像包括捕获的 z 堆栈的单个部分(切片)。右侧面板显示细胞核的 DAPI 染色。中央面板显示 CD1d 以红色和 LAMP-1(一种等体标记)染色,以绿色染色。左侧面板是合并三个不同通道的复合图像。黄色的外观产生于红色和绿色通道的重叠,并指示 CD1d 和 LAMP-1 共同本地化的区域。染色结果确认CD1d在LAMP-1+内皮腔中是局部的。还有一些区域只有一种颜色存在,这表明 CD1d 或 LAMP-1 存在,没有共同本地化。A 的底部面板显示从 z 堆栈中捕获的图像构造的单元格的 3D 渲染。
面板 B 以 100 倍放大倍率从 z 堆栈中显示切片,更详细地演示这两种蛋白质的表达模式。图像右侧的粉红色轮廓框显示图像中粉红色线指定的 x 坐标的横截面,该线表示粉红色线条的侧视图。同样,图像底部的蓝色轮廓框显示图像中由蓝线指定的 y 坐标的横截面,该横线表示蓝线处的前视图。z-Stack 图像的 3D 渲染使用户能够以 3D 形式查看图像,并可视化所有 x、y 和 z 平面。

图4:CD1d和LAMP1的染色。请点击此处查看此图的较大版本。
A、顶部面板:LCD1细胞被固定、渗透,并沾染了CD1d(红色)和LAMP-1(绿色,即溶解体腔的标记物)的抗体。DAPI(蓝色,用于可视化原子核)。合并(左侧面板)显示 CD1d 在 LAMP-1 阳性晚期中皮/乳离体隔间(黄色)中本地化。
A,底部面板:顶部面板中相同单元格的 3D 渲染。图像是使用尼康Eclipse Ti上的40倍油浸物目标,使用NIS元素高级研究软件获取的。
B:100x的 LCD1d 细胞图像与 A 中一样染色,图像底部(蓝色框)上带有特定 y 坐标的堆叠信息(由蓝线表示)。特定 x 坐标的堆栈信息(由粉红色线条表示)显示在图像的右侧(粉红色框)。
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
共聚焦荧光染色是一个相对简单的程序,可生成极高质量的标本图像,其制备方式与传统荧光显微镜类似。简而言之,样品是固定的,渗透的,然后被阻塞。允许对感兴趣的蛋白质或蛋白质进行初级抗体结合,然后使用荧光酸结合的二级抗体来可视化染色。共聚焦荧光显微镜在许多研究领域都有应用。例如,通过染色亚细胞器的标记物以及感兴趣的蛋白质,共聚焦显微镜可用于确定不同蛋白质的亚细胞位置。与传统的荧光显微镜相比,共聚焦成像可以更有效地区分蛋白质的细胞表面和细胞内位置。此外,共聚焦成像还可用于确定两种蛋白质是否在细胞内共同本地化。虽然本协议未概述,也可以对活细胞进行共聚焦荧光显微镜,以检测动态变化。

视频 1:在 NIS 元素高级研究软件中创建的视频,突出显示了通过图像的 3D 渲染移动的能力。请点击此处查看此视频(右键单击下载)。
Subscription Required. Please recommend JoVE to your librarian.
References
- Claxton, N. S., Fellers, T. J. and Davidson, M. W. Laser scanning confocal microscopy. Department of Optical Microscopy and Digital Imaging, National High Magnetic Field Laboratory, Florida State University, 37 p., Unpublished (2010). Available at- http://www.vertilon.com/pdf/PP6207.pdf.
- Ojcius, D. M., Niedergang, F., Subtil, A., Hellio, R. and Dautry-Varsat, A. Immunology and the confocal microscope. Research in Immunology, 147 (3),175-88 (1996).
- Paddock, S. W. and Eliceiri K. W. Laser scanning confocal microscopy: history, applications, and related optical sectioning techniques. Methods in Molecular Biology, 1075, 9-47 (2014).
- Hoff. F. How to prepare your specimen for immunofluorescence microscopy. Philipps University Marburg, Institute of Cytobiology and Cytopathology, Germany. (2015) Available at- http://www.leica-microsystems.com.




