Overview
출처: 도미니크 R. 볼리노1,에릭 A. 레겐조브2,토냐 J. 웹1
1 미생물학 및 면역학학과, 메릴랜드 의과 대학 및 말린과 스튜어트 그린바움 종합 암 센터, 볼티모어, 메릴랜드 21201
2 메릴랜드 대학교 의과대학, 볼티모어, 메릴랜드 주 생물의학 공학 및 기술 센터 21201
공초점 형광 현미경 검사는 기존의 "넓은 필드"상피 현미경 검사법과 비교하여 증가 된 광학 해상도를 가능하게하는 이미징 기술입니다. 공초점 현미경은 "레이저 스캐닝"을 통해 향상된 X-y 광학 해상도를 달성 할 수 있습니다 - 일반적으로 한 번에 시편의 각 픽셀에 레이저 조명을 직접 전압 제어 거울 세트 (갈바노미터 또는 "갈보"거울). 더 중요한 것은, 공초점 현미경은 핀홀을 사용하여 스캔되는 z-평면에 없는 위치에서 발생하는 초점 라이트를 제거하여 검출기가 지정된 z-평면에서 데이터를 수집할 수 있도록 함으로써 우수한 z 축 분해능을 달성한다는 것입니다. 공초점 현미경 검사법에서 달성 가능한 z 해상도가 높기 때문에 일련의 z-평면(z-stack이라고도 함)에서 이미지를 수집하고 소프트웨어를 통해 3D 이미지를 생성할 수 있습니다.
공초점 현미경의 메커니즘을 논의하기 전에 샘플이 빛과 상호 작용하는 방법을 고려하는 것이 중요합니다. 빛은 광자, 전자기 에너지 패킷으로 구성됩니다. 생물학적 샘플에 영향을 미치는 광자네는 4가지 방법 중 하나에서 샘플을 포함하는 분자와 상호 작용할 수 있습니다: 1) 광자 상호 작용하지 않고 샘플을 통과; 2) 광자 반사/산란; 3) 광자 분자에 의해 흡수되고 흡수된 에너지는 종합적으로 비방사부패로 알려진 과정을 통해 열로 방출된다; 및 4) 광자가 흡수되고 에너지는 형광으로 알려진 과정을 통해 보조 광자로 급속히 방출된다. 형광 방출을 허용하는 구조가 있는 분자는 형광증이라고 합니다. 대부분의 생물학적 샘플은 무시할 수 있는 내인성 형광을 함유하고 있습니다. 따라서 외인성 형광은 시료에 대한 관심의 특징을 강조하기 위해 사용되어야 합니다. 형광 현미경 검사관 동안, 샘플은 형광소에 의한 흡수를 위한 적당한 파장의 빛으로 조명됩니다. 광자 흡수 시, 플루오로포레는 "흥분"이라고 하며 흡수 과정은 "흥분"이라고 합니다. 형광국이 광자의 형태로 에너지를 포기하면 공정을 "방출"이라고 하며 방출된 광자는 형광이라고 합니다.
형광을 자극하는 데 사용되는 광선은 현미경의 객관적인 렌즈에 초점을 맞추고 최대 적으로 초점을 맞춘 "초점"에 수렴합니다. 초점 너머의 빛이 다시 갈라집니다. 진입 및 종료 빔은 초점에서 접촉하는 원두 쌍으로 시각화될 수 있습니다(그림 1, 왼쪽 패널 참조). 회절 현상은 빛의 광선이 얼마나 단단히 초점을 맞출 수 있는지에 제한을 가합니다 - 빔은 실제로 유한 크기의 지점에 초점을 맞춥니다. 두 가지 요인이 초점 지점의 크기를 결정합니다: 1) 빛의 파장, 2) 목표 렌즈의 광 수집 능력, 이는 그 숫자 조리개 (NA)를특징으로한다. 초점 "스팟"은 x-y 평면뿐만 아니라 z 방향으로확장되며 실제로는 초점 볼륨입니다. 이 초점 볼륨의 치수는 광학 이미징에서 달성할 수 있는 최대 해상도를 정의합니다. 광자의 수는 초점 부피 내에서 가장 크지만 초점 위와 아래에 있는 원적 광 경로에는 광자의 밀도가 낮습니다. 따라서 빛 경로의 모든 불소는 흥분 될 수 있습니다. 종래의 (와이드 필드) 상피 현미경 검사법에서, 초점 비행기 위와 아래형광에서 방출은 이미지 해상도와 대비를 감소시키는 초점 불소 형광("흐릿한 배경")을 기여하며, 그림 1에서 입증된 바와 같이, 빨간색 큐브는 평면 초점(빨간 별)의 위 형광 방출을 나타내는 것으로, 오른쪽 초점(빨간 별)의 우측 초점(오른쪽 초점)을 능가하는 것으로 간주합니다. 이 문제는 핀홀의 활용으로 인해 공초점 현미경 검사법에서 개선됩니다. (그림 2, 오른쪽 아래). 그림 3에 설명된 바와 같이 핀홀은 초점 위치에서 발생하는 배출이 검출기(왼쪽)에 도달할 수 있게 해주며, 초점이 맞지 않는 형광(오른쪽)이 검출기에 도달하지 못하도록 차단하여 해상도와 대비를 모두 향상시킵니다.
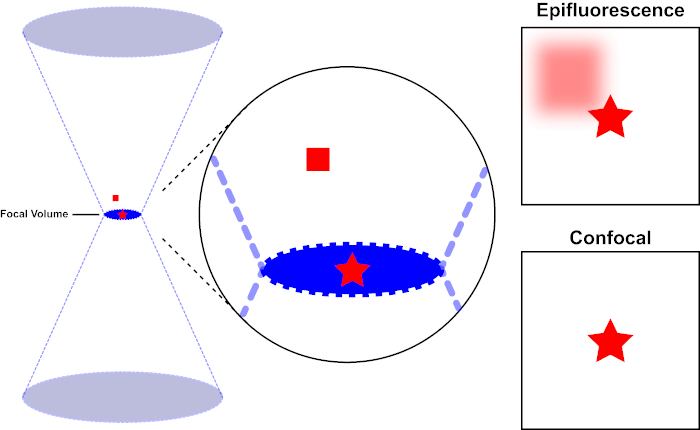
그림 1. 공초점 현미경 검사법과 피성 불피의 광학 해상도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
형광을 자극하는 데 사용되는 광선은 현미경의 객관적인 렌즈에 초점을 맞추고 초점 볼륨에서 수렴한 다음 발산 (왼쪽). 적색별은 적색 사각형이 초점 평면 위의 불소 방출을 나타내는 동안 이미지화되는 샘플의 초점 평면을 나타냅니다. 이 샘플의 이미지를 피광성 현미경을 사용하여 캡처할 때 초점이 맞지 않는 빨간색 사각형에서 방출하면 "흐릿한 배경"(오른쪽 상단)이 표시됩니다. 공초점 현미경은 초점 평면 외부에서 방출되는 빛의 검출을 방지하는 핀홀을 가지고 있어 "흐릿한 배경"(오른쪽 아래)을 제거합니다.
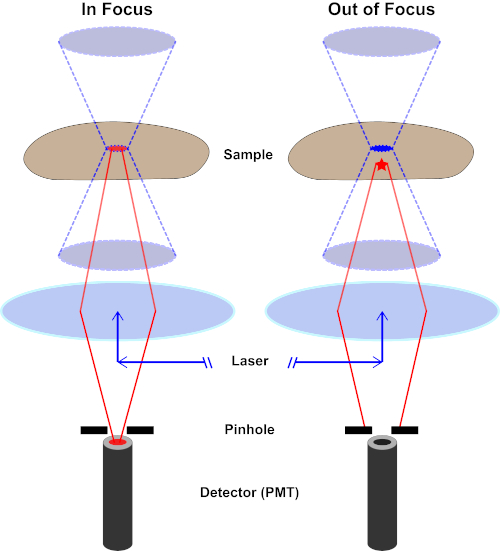
그림 2. 공초점 현미경 검사법의 핀홀 효과. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
흥분광의 가장 높은 강도는 렌즈(왼쪽, 붉은 타원형)의 초점에 있지만, 초점(오른쪽, 붉은 별)에 있지 않은 샘플의 다른 부분은 빛과 형광을 얻을 것이다. 이러한 초점이 닿지 않는 영역에서 발광이 감지기에 도달하는 것을 방지하기 위해 핀홀이 있는 스크린이 검출기 앞에 있습니다. 초점 평면에서 방출되는 초점 표시등(왼쪽)만 핀홀을 통과하여 검출기에 도달할 수 있습니다. 초점이 맞지 않는 라이트(오른쪽)는 핀홀로 차단되어 검출기에 도달하지 못합니다.
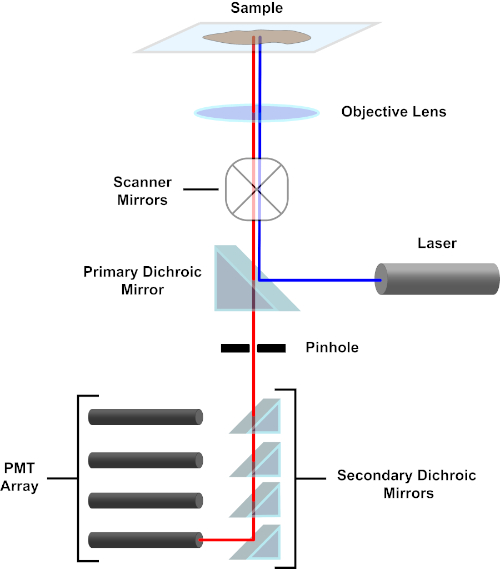
그림 3. 공초점 레이저 스캐닝 현미경의 주요 구성 요소. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
단순성을 위해, 공초점 현미경의 기계적인 설명은 니콘 이클립스 Ti A1R의 것으로 제한됩니다. 다른 공초점 현미경 사이 사소한 기술적 다름이 있을지도 모르지만, A1R은 공초점 현미경 기능을 설명하기 위한 좋은 모형으로 또한 봉사합니다. 다이오드 레이저의 배열에 의해 생성 된 흥분 광선은, 이미지되는 표본에 빛을 초점을 맞추고 목표에 기본 이차 거울에 의해 반영된다. 1차 이삭 미러는 다른 파장의 빛이 통과할 수 있도록 하면서 흥분 광을 선택적으로 반사합니다. 그런 다음 빛은 x-y 방식으로 표본을 가로 질러 광선을 쓸어 버리는 스캐닝 미러를 마주보고 한 번에 단일(x,y)픽셀을 조명합니다. 조명된 픽셀에서 형광에 의해 방출되는 형광은 객관적인 렌즈에 의해 수집되고 1차 이진거울을 통과하여 광증관(PMTs)의 배열에 도달한다. 이차 이차 이색 거울은 배출광을 적절한 PMT로 직접 지시합니다. 샘플에 의해 다시 분란된 흥분광은 1차 이색 거울에 의해 다시 시편을 향해 반사되어 검출광 경로에 진입하여 PMT에 도달하는 것을 방지한다(그림 3 참조). 이를 통해 비교적 약한 형광은 일반적으로 형광보다 더 강렬한 크기의 순서인 흥분 광 빔에서 산란된 빛에 의해 오염없이 정량화될 수 있습니다. 핀홀은 초점 부피 외부에서 빛을 차단하기 때문에 검출기에 도착하는 빛은 좁고 선택된 z-평면에서 나옵니다. 따라서 일련의 인접 z-평면으로부터 이미지를 수집할 수 있습니다. 이 일련의 이미지를 'z-스택'이라고도 합니다. 적절한 소프트웨어를 사용하여 z-스택을처리하여 시편의 3D 이미지를 생성할 수 있습니다. 공초점 현미경 검사법의 특별한 장점은 염색의 세포 소세포 국소화를 구별하는 기능입니다. 예를 들어, 종래의 형광 현미경 검사법(1, 2, 3)으로 매우 어려운 세포 내 염색으로부터 얼룩진 막 사이의 분화.
샘플 준비는 공초점 이미징의 중요한 측면입니다. 광학 현미경 기술의 강도는 살아있는 또는 고정 된 세포를 이미지화하는 유연성입니다. z-스택을 위해 획득해야 하는 이미지의 수, 세포 건강 유지의 어려움, 살아있는 세포 및 세포기관의 이동 으로 인해 3D 이미지를 생성하려고 시도할 때 고정 된 세포의 사용이 일반적입니다. 공초점 형광을 위한 세포를 고정하고 염색하는 절차는 면역 형광에 통상적으로 사용되는 것과 유사합니다. 챔버 슬라이드 또는 커버립에 배양 후, 세포는 세포 형태를 보존하기 위해 paraformaldehyde를 사용하여 고정됩니다. 비특이적 항체 결합은 소 혈청 알부민, 우유 또는 정상 혈청을 사용하여 차단된다. 이차 항체의 특이성을 유지하기 위해, 사용된 용액은 1차 항체가 생성된 동일한 종으로부터 시작되어서는 안된다. 세포는 관심있는 항원결합하는 1 차적인 항체로 배양됩니다. 여러 세포 표적에 라벨을 붙일 때, 1차 항체는 각각 다른 종에서 파생되어야 합니다. 항원태를 태그하는 항체는 그 때 불소-공해된 이차 항체에 의해 구속됩니다. 불소엽공-공주 된 이차 항체는 공초점 현미경에서 사용할 수있는 레이저 여기의 파장과 호환되도록 선택되어야한다. 여러 항원을 시각화할 때 형광의 발각/방출 스펙트럼은 충분히 달라야 미세한 분석에 의해 신호를 차별할 수 있습니다. 염색된 견본은 그 때 화상 진찰을 위한 슬라이드에 장착됩니다. 마운팅 배지는 광표백 및 시편 탈수방지를 위해 사용됩니다. 원하는 경우 핵 카운터스테인(예: DAPI 또는 Hoechst)을 포함하는 장착 배지를 사용할 수 있습니다(4).
다음 프로토콜에서, CD1d(LCD1)를 발현하기 위해 전감염된 마우스 섬유아세포는 CD1d 및 CD107a(LAMP-1)를 인식하는 항체로 염색하였다. CD1d는 지질 항원 제시 세포를 제시하는 항원 제시 세포의 표면에 존재하는 주요 조직 적합성 복합체 1 (MHC 1)와 같은 수용체입니다. LAMP-1 (리소소피 관련 막 단백질-1)은 주로 리소말 막에 존재하는 대막 단백질이다. 적절한 항원 프리젠 테이션을 위해, CD1d는 낮은 pH 리소소말 구획을 통해 인신 매매, 그래서 LAMP-1이 프로토콜에 대한 리소소말 구획의 마커로 사용되고있다. LCD1 세포를 상이한 종에서 생산한 안티 CD1d 및 항-LAMP-1을 통해 조사함으로써, 독특한 형광을 가진 이차 항체는 감광-1 양성 리소냐 구획에 존재하는 각 단백질의 국소화를 결정하는 데 사용될 수 있다.
Procedure
1. 재료
버퍼
- 세척 버퍼: 칼슘이나 마그네슘이 없는 멸균 인산염 완충식식염(PBS) 1X
- 고정 버퍼: PBS의 1% 파라포름알데히드
- 침투 버퍼: PBS에서 0.1% 트리톤 X-100
- 블로킹 버퍼: PBS의 소 세럼 알부민 1%
- 세포 성장 배지: DMEM10% 태아 소 혈청으로 보충 (FBS), 페니실린 /연쇄 절제술, 그리고 L-글루타민
설비
- 라미나르 플로우 후드
- 가습 인큐베이터 (37°C, 5% CO2)
- 공초점 레이저 스캐닝 현미경; 여기, 니콘 이클립스 Ti 레이저
재료 및 시약
- 챔버 세포 배양 슬라이드
- DAPI를 장착한 페이드 방지 마운팅 미디어(핵 염색용)
- 현미경 커버 유리
- 섬세한 작업 와이프
- 파이프토르 와 팁
분석 특정 시약
- 부착 세포 (1 차 세포 또는 세포주); 여기서, CD1d로 감염된 마우스 섬유아세포가 사용되었다(LCD1).
- 세포 표적을 검출하는 1차 항체; 여기서, 쥐 안티마우스 CD107a(LAMP-1) 및 마우스 항마우스 CD1d가 사용되었다.
- 1차 항체 동포형에 특이적인 플루오로포레-컨쥬게이드 이차 항체; 여기서 항쥐 IgG는 알렉사플루어(488)와 알렉사플루어(647)에 공주된 항마우스 IgG를 사용하였습니다.
2. 프로토콜
항체 염색 준비
파종 셀
- 성장 미디어에 대한 관심의 세포를 다시 중단합니다.
- 그런 다음, 4웰 챔버 슬라이드의 우물에 셀 서스펜션/잘 당 500 μL을 시드한다. (여기서, LCD1 세포는 성장 매체의 500 μL에서 2.5x105 셀/챔버에서 종자하였다. 종자 밀도는 세포주 마다 다를 수 있습니다).
- 37°C에서 5% CO2 인큐베이터에서 하룻밤 동안 챔버 슬라이드를 배양하여 세포가 유리에 부착할 수 있도록 합니다.
- 다음 날, 각 우물에서 미디어를 흡인한 다음 500 μL PBS로 셀 1X를 세척합니다.
고정
- 세포를 고치려면 각 우물에 500 μL 1 % 파라포름알데히드 용액을 추가하고 실온에서 15 분 동안 배양하십시오.
- 인큐베이션 후 파라포름알데히드를 적절한 유해 액체 폐기물 용기에 수거하십시오.
- 그런 다음 500 μL PBS로 세포를 3번 세척하여 고정물의 잔재를 제거합니다.
투과성
- 실온에서 15분 동안 500 μL permeabilization 버퍼/웰으로 배양하여 세포를 침투합니다.
- 그런 다음 PBS의 500 μL로 세포를 3번 짧게 세척합니다.
블로킹
- 4°C에서 1시간 동안 500 μL 차단 버퍼로 각 우물의 세포를 배양하여 비특이적 항체 결합을 차단합니다.
1차 항체 배양
- 슬라이드 챔버에서 차단 버퍼를 흡인합니다.
- 그런 다음 희석된 1차 항체 용액의 500 μL을 세포에 추가합니다. (여기서, 안티 CD107a(LAMP-1)는 1:500을 희석하고 안티 CD1d가 희석되지 않은(1H6 단클론 항체는 랜디 브루츠키에비츠 박사가 친절하게 제공하였다)를 희석하였다.
- 슬라이드를 4°C에서 하룻밤 동안 배양합니다.
참고: 둘 이상의 표적을 조사하는 경우 1차 항체가 다른 동종타입인지 확인하십시오. 권장된 항체 농도는 제조자 마다 다르며 사용하기 전에 적정해야합니다.
이차 항체 배양
- 우물에서 1 차적인 항체 용액을 흡인합니다.
- 500 μL PBS로 우물 챔버를 4 번 세척하십시오.
- 그런 다음 희석된 이차 항체 용액의 500 μL을 각각 양으로 첨가합니다. (여기서, 이차 항체-항마우스 IgG 알렉사플루어(647)와 안티래트 IgG 알렉사플루어(488)는 차단 완충제에서 1:2000을 희석하였다.)
- 어둠 속에서 1 시간 동안 실온에서 배양하십시오.
- 인큐베이션 후, 이차 항체 용액을 흡인한다.
- 500 μL PBS로 챔버를 4번 세척하여 결합되지 않은 이차 항체를 제거합니다.
참고: 권장된 항체 농도는 제조자마다 다르며 사용하기 전에 적정해야 합니다. 두 개 이상의 표적을 조사하는 경우, 이차 항체는 고유한 여기/방출 스펙트럼을 가진 다른 형광에 공인되어야 합니다. 또한 형광을 선택하는 동안 핵 카운터스테인 (즉 DAPI)의 흥분 / 방출을 명심하십시오. 플루오로포어 선택은 사용되는 공초점 현미경의 레이저 구성에 의해 영향을 받을 수 있다. 기계의 레이저 구성은 실험에 적합한 형광을 지시합니다.
3. 장착 커버스립
- 먼저 슬라이드에서 챔버를 조심스럽게 제거합니다.
- 그런 다음 슬라이드를 섬세한 작업 닦아 에 비스듬히 잡고 셀을 건드리지 않고 가장자리에서 유체를 제거합니다.
- 핵 얼룩 DAPI를 포함하는 안티페이드 마운팅 배지 1방울을 세포의 각 섹션에 추가합니다.
- 다음으로, 손끝을 사용하여 가장자리를 눌러 슬라이드 위에 20mm x 60mm 커버슬립을 놓습니다. (화상 진찰을 방해하기 때문에 세포 에 걸쳐 거품 형성을 피하십시오).
- 섬세한 작업 닦아 측면에 여분의 장착 매체를 닦아 일주일까지 실온에서 어둠 속에서 슬라이드를 저장합니다.
4. 공초점 이미징
공초점 레이저 스캐닝 현미경의 이미지 샘플. 그림 2에 표시된 데이터의 경우 Nikon Eclipse Ti A1R은 NIS 요소 고급 연구 소프트웨어와 함께 사용되었습니다. 다음 섹션에서는 앞서 언급한 소프트웨어를 사용하여 이미지를 캡처하는 절차에 대해 자세히 설명합니다.
- 세포 이미징을 시작하려면'국정원 소프트웨어 아이콘'을클릭하여'국정원 요소 고급 연구 소프트웨어'를엽니다.
- 다음으로 컨트롤 창에서'TiPad'탭을 클릭하고 이미징에 원하는 목표를 선택합니다. (여기, 처음 40 배 목표가 사용 되었습니다.).
- 슬라이드를 셀과 함께 스테이지에 로드하고 렌즈 아래에 중앙을 가두십시오.
- 이제'A1plus Compact GUI'탭에서 사용되는 형광에 적합한 레이저를 설정합니다. 기어 기호를 클릭하여 염료 및 스펙트럼 설정 메뉴를 열고 필요한 채널을 선택하고 각 채널에 대한 레이저를 설정합니다.
- 그런 다음 첫 번째 이진 미러 아래의 드롭다운 메뉴에서 적절한 배출을 선택합니다.
- 다음으로,'A1plus Compact GUI'창을 클릭하면'Ch.시리즈'를클릭하여 사용된 레이저가 동시에 또는 순차적으로 샘플에 발사할지 여부를 설정하는 라인 채널 시리즈를 설정합니다. (여기서는 채널 1부터 시작하여 채널 2, 다음 4로 순차 패스를 선택했습니다.)
- 그런 다음 상단에있는'화살표 팁'아이콘을 클릭하여 스캔을 시작합니다. 이 시점에서 이미징이 살아있는 동안 'A1plus Compact GUI'창에서 슬라이딩 스케일을 클릭하고 핀홀 크기를 수정하여 초점 표시등에서 제한을 보장합니다. (여기서 사용 가능한 가장 낮은 설정(0.5)이 사용되었습니다.
- 다음으로, 슬라이딩 스케일을 사용하여 잠재적인 배경 염색을 제한하면서 특정 염색을 감지할 수 있도록 하여 각 레이저 의'고전압'및'오프셋'설정을 적절한 수준으로 조정합니다. 양수 염색 샘플을 사용할 수 있는 경우 각 채널에 대해 이 샘플을 이미징하여 레이저 설정이 잡음 비율에 최적의 신호를 생성하도록 하십시오.
주의: 장시간 레이저 강도가 높으면 광표백이 발생할 수 있습니다. - 각 레이저에 대한 최적의 HV 및 오프셋 값을 설정한 후'ND 획득 탭'을클릭한 다음'Z'아이콘을 선택하여 z 계열의 매개 변수를 설정합니다. 다음으로, 샘플의 라이브 이미지를 획득하는 동안 먼저 이미지의 하단을 찾아'아래쪽'버튼을 클릭하여 하단을 설정한 다음 샘플의 위쪽 위치를 찾아'위쪽'버튼을 클릭합니다. 각 단계에 대해 필요한 단계 크기를 구체적으로 입력하거나 필요한 총 단계 수를 지정하여 단계 크기를 설정합니다.
- z 시리즈 매개 변수가 설정되면 이미지의 원하는 크기/픽셀 해상도를 선택합니다. 이렇게 하려면 'A1plus Compact GUI'창을 클릭 하 고' 크기' 아이콘 원하는 해상도를 선택 합니다. 이미지의 노이즈를 줄이기 위해 선택한 이미지 수를 평균으로'ø'기호 옆에 있는 드롭다운 메뉴를 선택할 수 있습니다.
- 이제 샘플 이미징을 시작하려면'ND 획득 메뉴'에'지금 실행'탭을 클릭합니다.
- 이미징이 완료되면'파일','저장'을클릭하여 이미지를 저장하여 확장'.nd2'로이미지 파일을 내보냅니다. 마지막으로 다른 각 샘플에 대한 프로세스를 반복합니다.
공초점 형광 현미경 검사는 항원에게 항체-컨쥬게이트 형광염염을 표시하고 형광 신호를 검출함으로써 세포 또는 조직 샘플에 관심 있는 단백질 또는 항원의 국소화를 위한 전문 이미징 기술이다. 그것은 객관적인 렌즈의 초점 평면에 배치 된 두 개의 핀홀의 도움으로, 넓은 필드 형광 현미경 검사보다 더 높은 공간 해상도를 제공합니다, 그것을 이름을 공초점 제공. 그것은 사용자가 세포 내 염색에서 염색 하는 표면 막 사이 분화 와 같은 세포 외 수준에서 얼룩을 시각화 할 수 있습니다.
공초점 현미경은 고전적인 형광 현미경과 유사한 기본 원리를 따릅니다. 광원에서 빔, 일반적으로 공초점에 대한 레이저, 이색 거울에 의해 반영되고 샘플에 객관적인 렌즈에 의해 초점을 맞췄다. 이 빛은 형광을 자극하여 다른 파장을 방출하며, 이는 객관적인 렌즈와 이색 거울을 통해 카메라 나 접안으로 다시 이동합니다.
공초점 현미경의 향상된 해상도는 주로 빛이 여기와 방출 광 경로에서 통과하는 매우 작은 구멍인 두 개의 핀홀이 있기 때문입니다. 핀홀은 전략적으로 객관적인 렌즈의 초점 평면에 배치됩니다. 이제 현미경 배열의 측면 뷰 회로도로 전환하여 광 경로를 검토해 보겠습니다. 여기 핀홀을 통과한 후, 발광빔은 초점에서 유래하는 효과를 가지며, 객관적인 렌즈가 빛을 샘플의 지점에 집중할 수 있게 한다. 이 초점에서 배출 빔은 배출 핀홀에 수렴하여 통과할 수 있습니다. 이제 흥분하는 동안, 초점 위와 아래 의 빛 경로 내의 형광도 약간 흥분됩니다. 초점에서 발생하는 방출 광이 핀홀을 통과하는 동안, 공사 핀홀 전후에 초점이 떨어진 지점에서 배출되는 것이 수렴되어 차단되어 배경 형광이 줄어듭니다.
흥분 방출 검출 주기는 관심 있는 지역의 각 이미징 지점에 대해 반복되어야 하며, 이는 몇 가지 다른 방법으로 수행될 수 있습니다. 예를 들어 레이저 스캐닝 공초점은 갈바노미터 스캐닝 미러를 사용하여 각광광을 다른 각도로 편향시킵니다. 따라서 XY 평면의 시편을 가로 질러 광선을 쓸어 넘습니다. 회전 디스크 공초점핀구멍배열이 있는 디스크를 사용하여 핀홀의 배열을 이동합니다. 이를 통해 사용자는 매번 샘플에 여러 개의 작은 이미징 점을 점등할 수 있으며 디스크가 회전할 때 전체 영역을 점진적으로 덮을 수 있습니다. 핀홀의 결과로 검출기의 XY 이미지는 좁은 Z 평면을 나타냅니다. 따라서 이미지는 일련의 연속 Z 평면에서 수집될 수 있으며, 종종 Z 스택이라고 합니다. 이러한 이미지에서 적절한 소프트웨어는 샘플에서 형광 신호 패턴의 3D 묘사를 생성할 수 있습니다.
이 프로토콜에서, 당신은 마우스 섬유아세포의 면역 염색을 관찰하고, 세포 표면 단백질과 리소소말 단백질을 분화하기 위해 공초점 현미경에 화상 진찰을 따를 것이다.
시작하려면 멸균 기술을 사용하여 잘 성장 매체의 500 마이크로 리터에 관심있는 세포를 다시 일시 중지 한 다음 4 웰 챔버 슬라이드의 우물에 씨앗을 넣습니다. 여기서, 우리는 항원 제시 분자, CD1d를 표현하기 위하여 전감염된 마우스 섬유아를 사용하고 있습니다. 세포가 유리를 부착할 수 있도록 챔버 슬라이드를 섭씨 37도에서 5% 이산화탄소 인큐베이터에 넣고 하룻밤 동안 배양합니다. 아침에는 각 우물에서 미디어를 흡인한 다음 몇 초 동안 PBS 500 마이크로리터로 세포를 한 번 씻습니다.
세포를 고치려면 각 우물에 1% 파라포름알데히드 용액의 500 마이크로리터를 추가하고 실온에서 15분 동안 배양합니다. 인큐베이션 후, 파라포름알데히드를 적절한 유해 액체 폐기물 용기로 수집한 다음 PBS로 세포를 세 번 세척하여 고정물의 잔해를 몇 초 간 제거합니다.
세포내 내항체 침투를 허용하려면 각 웰에 500마이크로리터의 투과성 버퍼를 추가하고 실온에서 15분 동안 벤치에 배양합니다. 투과화 후, PBS의 500 마이크로 리터로 세포를 세 번 짧게 씻으라. 다음으로, 각 우물에 500마이크로리터의 블로킹 버퍼를 추가하고, 비특이적 항체 결합을 방지하기 위해 섭씨 4도에서 1시간 동안 배양한다.
1 차적인 항체, 반대로 CD1d 및 반대로 LAMP-1, 적당한 작동 농도에서 준비합니다. 그런 다음, 우물에서 버퍼를 흡인하고 희석 된 1 차 항체 용액의 500 마이크로 리터로 각각의 우물의 세포를 덮은 다음 섭씨 4도에서 밤새 평평한 표면에 슬라이드를 배양합니다. 다음 아침, 이차 항체를 희석시키고, 이 경우 항마우스 및 항쥐 항체와 뚜렷한 형광 태그가 있는 항체를 적절한 작업 농도로 버퍼를 차단한다. 다음으로, 우물에서 1차 항체 용액을 흡인한 다음 PBS의 500 마이크로리터로 세포를 네 번 세척한다. 이어서, 희석된 이차 항체 용액의 500마이크로리터를 각각 양호에 넣고, 어둠 속에서 1시간 동안 실온에서 배양한다. 인큐베이션 후, 이차 항체 용액을 흡인하고 PBS의 500 마이크로리터로 우물을 4번 세척하여 무한이 다른 이차 항체를 제거한다.
최종 세척 후 샘플을 장착하려면 조심스럽게 분리하고 슬라이드에서 챔버를 제거합니다. 잔류 PBS를 제거하려면 슬라이드를 섬세한 작업 닦기 위에 비스듬히 잡고 셀을 건드리지 않고 가장자리에서 유체를 제거합니다. 초과 PBS가 제거되면 핵 얼룩 DAPI를 포함하는 페이드 장착 매체 1방울을 세포의 각 섹션에 추가합니다. 다음으로, 20-60밀리미터 커버슬립을 취하고, 손끝에서 커버슬립을 어느 가장자리에서 천천히 낮추기 시작하여 세포에 거품이 형성되는 것을 피하십시오. 슬라이드의 추가 마운팅 매체를 섬세한 작업 으로 닦아 내고 슬라이드를 실온에서 최대 1 주일 동안 어둠 속에서 저장하십시오.
셀 이미징을 시작하려면 먼저 바탕 화면의 NIS 소프트웨어 아이콘을 클릭합니다. 컨트롤 창에 들어가면 상단의 TiPad 탭을 클릭하고 이미징에 원하는 목표를 선택합니다. 그런 다음 슬라이드를 셀과 함께 스테이지에 로드하고 렌즈 아래에 중앙을 가두십시오. 다음으로, TiPad 탭 옆에 있는 A1plus 컴팩트 GUI 탭에서 사용되는 형광에 적합한 레이저를 설정합니다. 기어 기호를 클릭하여 염료 및 스펙트럼 설정 메뉴를 엽니다. 염료 및 스펙트럼 설정 메뉴가 열려 있으면 필요한 채널을 선택하고 각 채널에 대한 레이저를 설정합니다. 그런 다음 첫 번째 이색 거울 아래 드롭다운 메뉴에서 적절한 배출을 선택합니다. 다음으로, A1plus 컴팩트 GUI 창에서 Ch.시리즈를 클릭하여 사용된 레이저가 동시에 또는 순차적으로 샘플에 발사할지 여부를 설정하는 라인 채널 시리즈를 설정합니다.
그런 다음 상단의 화살표 팁 아이콘을 클릭하여 스캔을 시작합니다. 이 시점에서 이미징이 라이브인 동안 A1plus Compact GUI 창 아래에서 슬라이딩 스케일을 클릭하고 핀홀 크기를 수정하여 초점 이외 광을 제한합니다. 다음으로, 슬라이딩 스케일을 사용하여 잠재적인 배경 염색을 제한하면서 특정 염색을 감지하여 각 레이저의 고전압 및 오프셋 설정을 적절한 수준으로 조정합니다. 양수 염색 샘플을 사용할 수 있는 경우 각 채널에 대해 이 샘플을 이미징하여 레이저 설정이 최적의 신호 대 잡음 비율을 생성하도록 하십시오. 각 레이저에 대한 최적의 HV 및 오프셋 값을 설정한 후 ND 획득 탭을 클릭한 다음 Z 아이콘을 선택하여 z 계열의 매개 변수를 설정합니다.
다음으로 샘플의 라이브 이미지를 가져오는 동안 먼저 이미지의 맨 아래를 찾고 하단 단추를 클릭하여 아래쪽을 설정합니다. 그런 다음 샘플의 맨 위 위치를 찾아 상단 버튼을 클릭합니다. 각 단계에 대해 미크론에 선호하는 단계 크기를 구체적으로 입력하거나 필요한 총 단계 수를 지정하여 단계 크기를 설정합니다. 이미지의 원하는 크기/픽셀 해상도를 선택하려면 Aiplus Compact GUI 창을 클릭하고 크기 아이콘 아래에서 원하는 해상도를 선택합니다.
이미지의 노이즈를 줄이려면 선택한 이미지 수를 평균으로 테타 기호 옆에 있는 드롭다운 메뉴를 선택할 수 있습니다. 그런 다음 샘플 이미징을 시작하려면 ND 획득 메뉴의 Run Now 탭을 클릭합니다. 이미징이 완료되면 파일을 클릭하여 이미지를 저장한 다음 확장 도트 nd2로 이미지 파일을 내보냅니다. 마지막으로 다른 각 샘플에 대한 프로세스를 반복합니다.
이 실험에서, 표면 당단백질 유전자 CD1d를 발현하는 마우스 섬유아세포는 공초점 현미경에 고정, 면역염색 및 심이미지되었다. 이 이미지는 CD1d가 빨간색으로 얼룩진 40X 배율에서 Z 스택의 단일 섹션을 보여줍니다. 샘플은 녹색으로 리소소말 마커인 LAMP-1로 코스타화되었습니다. 핵 얼룩 DAPI는 세포의 핵을 보여주기 위하여 이용되었다.
세 개의 서로 다른 채널이 병합되는 합성 이미지에서 노란색의 모양은 빨간색과 녹색 채널의 겹침으로 인해 발생하며 CD1d 및 LAMP-1이 리소좀에서 공동 국한되는 영역을 나타냅니다. 하나의 색상만 있는 영역은 공동 지역화 없이 CD1d 또는 LAMP-1의 존재를 나타냅니다. 이 이미지는 z 스택에 캡처된 이미지로 구성된 셀의 3D 렌더링을 보여 주며 이 방법을 사용하면 이 셀 그룹의 측면 뷰를 구성할 수 있었습니다. 이 다음 이미지는 100X 배율에서 z 스택에서 슬라이스를 보여 주며, 이 두 단백질의 발현 패턴을 보다 자세하게 보여줍니다. 이미지 의 오른쪽에 있는 분홍색 윤곽 상자에는 이미지의 분홍색 선이 지정한 X 좌표의 단면이 표시되어 있으며, 이는 분홍색 선의 측면 보기를 나타냅니다. 마찬가지로 이미지 하단에 있는 파란색 윤곽 상자는 이미지의 파란색 선으로 지정된 y-좌표의 단면을 나타내며, 이는 파란색 선의 전면 뷰를 나타냅니다. z 스택 이미지의 3D 렌더링을 사용하면 사용자가 이미지를 3D로 볼 수 있으므로 모든 x, y 및 z 평면을 시각화할 수 있습니다. 이것은 세포 내의 다른 지역에서 다른 얼룩의 공동 지역화를 연구하기 위하여 이용될 수 있습니다.
Subscription Required. Please recommend JoVE to your librarian.
Results
이 실험에서, 표면 당단백질 유전자 CD1d를 발현하는 마우스 섬유아세포는 공초점 현미경에 고정, 면역염색 및 심이미지되었다. 상기 프로토콜을 사용하여 얻은 대표적인 이미지가 도 4에 도시된다. A의 맨 위 패널에서 각 개별 대상의 염색 패턴을 보여주는 단일 채널 이미지가 표시됩니다. 이러한 이미지는 캡처된 z 스택의 단일 섹션(슬라이스)으로 구성됩니다. 오른쪽 패널은 세포의 핵의 DAPI 염색을 보여줍니다. 중앙 패널은 빨간색으로 염색된 CD1d와 LAMP-1, 리소말 마커를 녹색으로 염색한 것으로 표시합니다. 왼쪽 패널은 세 개의 서로 다른 채널이 병합되는 합성 이미지입니다. 노란색의 모양은 빨간색과 녹색 채널의 겹침으로 인해 발생하며 CD1d 및 LAMP-1이 공동 지역화되는 영역을 나타냅니다. 염색 결과는 CD1d가 LAMP-1+ 내도 구획에 국한되어 있음을 확인합니다. 또한 하나의 색상만 있는 영역이 있어 공동 현지화 없이 CD1d 또는 LAMP-1의 존재를 나타냅니다. A의 하단 패널은 z 스택에 캡처된 이미지로 구성된 셀의 3D 렌더링을 보여 주어 있습니다.
패널 B는 100x 배율에서 z 스택에서 슬라이스를 나타내며, 이 두 단백질의 발현 패턴을 보다 자세하게 보여줍니다. 이미지 의 오른쪽에 있는 분홍색 윤곽 상자에는 이미지의 분홍색 선이 지정한 x 좌표의 단면이 표시되어 있으며, 이는 분홍색 선의 측면 보기를 나타냅니다. 마찬가지로 이미지 하단에 있는 파란색 윤곽 상자는 이미지의 파란색 선으로 지정된 y-좌표의 단면을 나타내며, 이는 파란색 선의 전면 뷰를 나타낸다. z 스택 이미지의 3D 렌더링을 사용하면 사용자가 이미지를 3D로 볼 수 있으므로 모든 x, y 및 z 평면을 시각화할 수 있습니다.

그림 4: CD1d 및 LAMP1의 염색. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
A, 상단 패널: LCD1 세포는 CD1d(빨간색) 및 LAMP-1(녹색, 리소말 구획의 마커)에 대한 항체로 고정, 투과성 및 염색하였다. DAPI(파란색, 핵을 시각화하는 데 사용). 병합(왼쪽 패널)은 CD1d가 LAMP-1 양수 후기 내도/리소소말 구획(노란색)에 국한되어 있음을 보여준다.
A, 하단 패널: 상단 패널에서 동일한 셀의 3D 렌더링. 이미지는 NIS Elements 고급 연구 소프트웨어를 사용하여 Nikon Eclipse Ti에서40배 의 오일 침지 목표를 사용하여 획득했습니다.
B: A에서와 같이 염색된 LCD1d 셀의 100x 이미지, 이미지 의 하단에 특정 y-좌표(파란색 선으로 표시된)에 대한 스택 정보(파란색 상자). 특정 x 좌표에 대한 스택 정보(분홍색 선으로 표시됨)는 이미지의 오른쪽에 표시됩니다(분홍색 상자).
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
공초점 형광 염색은 기존의 형광 현미경 검사법과 유사한 방식으로 제조되는 표본의 매우 높은 품질의 이미지를 초래하는 비교적 간단한 절차입니다. 간단히 말해서 샘플은 고정되고, 투과화된 다음 차단됩니다. 관심있는 단백질 또는 단백질에 대한 1 차 적인 항체는 결합할 수 있고, 그 때 형광소-컨쥬게이드 이차 항체는 염색을 시각화하기 위하여 이용됩니다. 공초점 형광 현미경 검사법은 연구의 많은 분야에서 응용 프로그램이 있습니다. 예를 들어, 관심 있는 단백질과 함께 세포 외 세포 소기관의 마커를 염색함으로써, 공초점 현미경 검사는 다양한 단백질의 세포 전 위치를 결정하는 데 사용될 수 있다. 기존의 형광 현미경 검사법과 비교하여, 공초점 화상 진찰은 단백질의 세포 표면 및 세포내 위치를 보다 효과적으로 구별할 수 있습니다. 또한, 공초점 화상 진찰은 또한 2개의 단백질이 세포 내의 공동 국소화하는지 결정하기 위하여 이용될 수 있습니다. 이 프로토콜에 설명되지는 않지만, 공초점 형광 현미경 검사는 또한 동적 변화를 검출하기 위하여 살아있는 세포에서 수행될 수 있습니다.

비디오 1: NIS Elements 고급 연구 소프트웨어에서 만든 비디오는 이미지의 3D 렌더링을 통해 이동하는 기능을 강조합니다. 이 비디오를 보려면 여기를 클릭하십시오 (다운로드하려면 마우스 오른쪽 클릭).
Subscription Required. Please recommend JoVE to your librarian.
References
- Claxton, N. S., Fellers, T. J. and Davidson, M. W. Laser scanning confocal microscopy. Department of Optical Microscopy and Digital Imaging, National High Magnetic Field Laboratory, Florida State University, 37 p., Unpublished (2010). Available at- http://www.vertilon.com/pdf/PP6207.pdf.
- Ojcius, D. M., Niedergang, F., Subtil, A., Hellio, R. and Dautry-Varsat, A. Immunology and the confocal microscope. Research in Immunology, 147 (3),175-88 (1996).
- Paddock, S. W. and Eliceiri K. W. Laser scanning confocal microscopy: history, applications, and related optical sectioning techniques. Methods in Molecular Biology, 1075, 9-47 (2014).
- Hoff. F. How to prepare your specimen for immunofluorescence microscopy. Philipps University Marburg, Institute of Cytobiology and Cytopathology, Germany. (2015) Available at- http://www.leica-microsystems.com.




