Overview
출처: 뮤니에 실베인1,2,3,퍼셰 티보1,2,3,소피 노볼트4,레이첼 골럽1,2,3
1 림프포포에이시스, 면역학학과, 파스퇴르 연구소, 파리, 프랑스
2 INSERM U1223, 파리, 프랑스
3 유니버시테 파리 디드로, 소르본 파리 시테, 셀룰레 파스퇴르, 파리, 프랑스
4 흐름 세포측정플리트에서, 세포측정및 바이오마커 UtechS, 번역 과학 센터, 파스퇴르 연구소, 파리, 프랑스
입양 세포 전달은 질병을 치료하거나 혈액 마비증과 같은 생물학적 과정을 연구하기 위해 환자 또는 연구 유기체로 세포를 도입하는 방법입니다. 입양 전송의 목적은 다양합니다. 그것은 기본 생물학뿐만 아니라 의학에서 사용할 수 있습니다 (1, 2). 마우스 모델에서, 전송된 세포의 이동 및 분포는 추적 시스템(세포 표면 마커, CFSE에 의한 염색 등)에 의해 연구되고 그 다음에 선행될 수 있다. 마우스 모형에 암 연구 결과에서는, 특정 세포 인구의 전송은 종양에 대하여 실험적인 처리로 이용될 수 있습니다. 이 기술에 대한 또 다른 예는 심한 면역 결핍 표현형을 가진 조사 마우스 또는 마우스에 골수 세포의 전송에 의해 키메라 마우스의 생성이다. 이 마우스 모형은 예를 들면 특정 세포 인구에 유전자 삭제의 충격을 평가하기 위하여 이용될 수 있습니다. 뼈 차용 세포의 전송은 또한 인간의 치료에 사용됩니다. 환자가 암 치료의 경우에 조사될 때, 골수의 입양 전송은 면역 계통 재구성을 허용합니다.
이 기술의 첫 번째 단계는 관심의 세포 인구를 얻는 것입니다. 이 인구를 격리하기 위해 선택한 기술은 대상 인구의 특이성 수준에 따라 달라집니다. 선택의 가장 큰 수준은 장기에 존재하는 모든 세포 집단이 취해지는 전체 기관입니다. 보다 정밀한 방법은 표적 세포 집단의 선택이며, 종종 하나의 세포 표면 마커에 의해 선택된다. 이 경우 셀을 정렬하는 이상적인 방법은 자기 정렬입니다. 마지막으로, 가장 엄격한 수준은 매우 특정 세포 집단을 정렬하는 여러 세포 표면 마커에 의해 세포의 선택입니다. 흐름 세포 분석 정렬은 이 선택 수준에 가장 인기 있는 방법입니다. 관심 의 인구가 얻어지면 호스트로 전송 할 수 있습니다. 입양 전송 전에 호스트와 기증자 사이의 호환성을 보장하는 것이 필수적입니다. 실제로, 전송 목표에 관계없이 호환성은 세포 거부없이 호스트에 의해 세포 채택을 보장하기 위해 중요합니다.
본 실습에서, CD45.2 마우스에서 비장세포를 CD45.1 Ragγc 마우스(림프구 부족)로 이송하여 채택세포 전달 기술을 입증하고 4일 후 유동 세포측정법을 사용하여 비장세포 전달을 확인한다(그림 1참조).
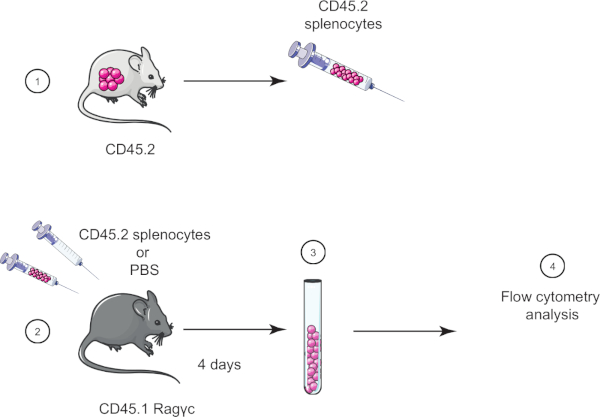
그림 1: 입양 전송의 회로도 표현. (1) 비장세포는 CD45.2 마우스로부터 분리되고 (2) CD45.1 Ragγc 마우스로 전송되며, 제어 마우스는 PBS만으로 주입된다. (3) 입양 전달 후 4일, 비장세포는 마우스로부터 회수되고 (4) 혈류 세포측정에 의해 분석된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Procedure
1. 준비
- 시작하기 전에 실험실 장갑과 적절한 보호 복을 착용하십시오.
- 먼저 세제로 모든 해부 도구를 살균한 다음 70%의 에탄올로 완전히 건조시하십시오.
- 2% 태아 종아리 혈청(FCS)을 함유한 행크의 균형 잡힌 소금 용액(HBSS)을 50mL준비한다.
2. 해부
- 이산화탄소 전달 시스템을 사용하여 저산소증으로 마우스를 안락사시합니다. supine 위치에 있는 해부 판에 안락사 마우스를 고정하고 가위와 집게를 사용하여 세로 복강경을 수행합니다.
- 집게를 사용하여 복부의 오른쪽에 있는 창자와 위를 이동하여 위장과 비장을 노출시합니다. 비장은 위장에 부착됩니다.
- 집게를 사용하여 조심스럽게 위에서 비장을 분리하고 HBSS 2 % FCS의 5 mL가 들어있는 페트리 접시에 놓습니다.
3. 면역 세포 격리
- 페트리 접시 위에 40 μm 세포 여과기에 비장을 놓습니다. 비장을 플런저로 분쇄하여 해리합니다.
- HBSS 2% FCS의 1mL로 플런서와 스트레이너를 헹구어 부착된 세포를 복구합니다.
- 해리된 비장과 유체를 15mL 원심분리기 튜브로 옮기.
- 페트리 접시를 HBSS 2% FCS 5밀리리터로 세척하고 액체를 15mL 튜브로 옮겨냅니다.
- 10°C에서 7분 동안 370 x g의 튜브를 원심 분리하고 펠릿을 피하는 상퍼를 폐기하십시오.
- 펠릿을 다시 중단하고 적혈구를 분해하기 위해 2mL의 칼륨 암모늄 염화물 파이펫을 위아래로 재놓습니다.
- 2 분 동안 기다렸다가 HBSS 2 % FCS를 재부유 된 펠릿에 추가하여 최대 14 mL의 부피를 얻습니다.
- 10°C에서 7분 동안 370 x g로 튜브를 다시 원심 분리합니다. 상체를 버리고 위아래로 파이펫을 하여 HBSS 2 % FCS의 5 mL에서 펠릿을 다시 놓습니다.
- 트라이판 블루 염색 분석기를 사용하여 세포를 계산하고 HBSS 2 % FCS의 적절한 부피를 사용하여 최종 세포 농도를 107 세포 / mL로 조정합니다.
4. 입양 이전
- 5mL 수집 튜브에서 얻어진 세포 현탁액 2mL를 전송합니다.
- 10°C에서 7분 동안 370 x g의 튜브를 원심 분리한 다음 상체를 폐기합니다.
- PBS의 2mL에서 펠릿을 다시 중단하고 10°C에서 7분 동안 370 x g의 튜브원심분리기.
- PBS의 200 μL에서 상수 및 재중단 펠릿을 폐기하십시오.
- 29G 바늘로 0.5 mL 주사기를 사용하여 200 μL의 세포 현탁액을 실험 마우스에 정맥내로 주입하여 레트로 궤도 혈액 부비동에 주입한다.
- 대조군으로서, 인산염 완충식염의 200 μL와 같은 혈액 부비동에 두 번째 마우스를 주입한다.
5. 세포 수확 및 염색
- 입양 전세 후 4일 후, 마우스를 안락사시키고 비장을 제거한다.
- 섹션 3에 설명된 대로 비장구를 수확하십시오.
- 각 마우스에서 세포 현탁액 100μL을 "제어"와 "전송"이라고 표시된 두 개의 FACS 튜브로 옮기습니다.
- 10°C에서 7분 동안 370 x g의 튜브를 원심 분리한 다음 초월제를 폐기합니다.
- 표 1에나열된 희석제에서 4개의 항체를 포함하는 혼합물을 준비한다.
| 항 체 | 플루오로크롬 | 희석 |
| CD45.1 | BV711 | 1/200 |
| CD45.2 | APCCy7 | 1/400 |
| CD4 | BV786 | 1/1600 |
| CD3 | BV421 | 1/200 |
표 1: 항체 혼합 조성. 농축 항체 형광 접합체 및 HBSS를 사용하여 4개의 항체 칵테일 준비.
- 각 튜브에 믹스 의 100 μL을 추가 한 다음 어둠 속에서 얼음에 20 분 동안 배양합니다.
- HBSS 2% FCS의 1mL을 추가한 다음 10°C에서 3분 동안 370 x g의 튜브를 원심 분리합니다.
- 슈퍼네티츠를 버리고 200μL의 HBSS 2% FCS에서 펠릿을 다시 중단한다.
- 다시 중단된 셀을 새 레이블이 지정된 FACS 튜브로 전송합니다.
- FACS 프로토콜에 도시된 바와 같이 유동 세포측정을 사용하여 CD45.2 양성 림프구의 존재를 평가합니다.
6. 데이터 분석
- "FlowJo"소프트웨어를 열고 각 튜브의 파일을"모든 샘플"창에서 드래그합니다.
- "전송된"파일을 두 번 클릭하여 Y 축및 측면 분산"FSC-A"를X 축에 미리 분산시키는 점 플롯에 해당 샘플에서 기록된 셀을 표시합니다.
- "다각형"을클릭하고 림프구를 선택하는 게이팅 전략을 만든 다음 세포 표면 마커 (CD45.1, CD45.2)를 사용하여 기증자 및 호스트 세포를 구별한 다음 CD45.2+ 셀 모집단 (CD3, CD4)을 특성화합니다.
- "컨트롤마우스"파일로 분석 단계를 반복합니다.
- 셀 채우기를 시각화하려면"레이아웃 편집기"를 클릭합니다.
- "전송된 셀"과"전송된 CD4 셀""전송된 "채우기"에서"전송"및"컨트롤"파일을"레이아웃 편집기 탭"으로드래그합니다.
- CD45.2+ 셀 및 CD4 림프구를 나타내는 도트 플롯이 나타납니다.
- CD45.2 전송된 셀은"전송된 마우스"도트 플롯에만 나타납니다.
입양 세포 전달은 관심있는 세포를 유기체로 도입하는 방법입니다. 그것은 다양 한 생물학적 메커니즘을 연구 하는 강력한 기술, 면역 세포의 특정 클래스의 행동을 포함 하 여. 또한, 입양 전이는 환자의 T세포를 추출하고, 암세포를 인식하고 파괴하기 위해 변경된 다음, 종양과 싸우기 위해 신체로 돌아갈 수 있는 골수 이식이나 암 치료를 필요로 하는 것과 같은 수많은 조건에 대한 유망한 새로운 치료법이다.
실험실에서 동물 모델은 종종 입양 전송을 연구하는 데 사용됩니다. 예를 들어, CD45.1 래그 감마-c 녹아웃 마우스는 많은 사이토카인을 위한 근본적인 수용체가 부족하며, 이는 조혈 줄기 세포를 림프구로 정상적인 분화하는 데 필수적이다. 그 결과, 녹아웃 마우스는 손상된 림프구 발달을 가지며 자연 살인자, 또는 NK, 세포, T 세포 또는 B 세포가 없습니다.
입양 전달은 비장과 같은 면역 세포의 고농도를 포함하는 기증자 마우스 조직을 먼저 수확함으로써 이러한 손상된 마우스로 누락 된 면역 세포를 도입하는 데 사용할 수 있습니다. 조직은 그 때 해리되고 면역 세포를 포함하여 비장 세포의 각종, 격리됩니다. 다음으로, 원치 않는 적혈구 또는 적혈구는, 염화 칼륨 분해 완충제 및 나머지 백혈구 또는 비백세포의 첨가를 통해 용액될 수 있고, 그 후 원심분리를 사용하여 세포 파편으로부터 분리된다.
마지막으로, 정제된 비장세포는 면역 손상된 마우스로 주입되어 이러한 세포의 기능에 대한 상세한 연구를 용이하게 합니다. 며칠 후, 입양 면역 세포 전달의 성공은 기증자 조직과 같은 방식으로 호스트 비백을 먼저 격리하고 준비함으로써 확인할 수 있습니다. 그런 다음, 이러한 세포는 FACS를 사용하여 검증및 정렬될 수 있도록 기증자 면역 세포 마커에 대해 표지된 항체를 사용하여 염색됩니다.
먼저 실험실 장갑과 적절한 보호 장비를 착용하십시오. 다음으로, 먼저 세제로 집게한 후 70%의 에탄올로 가위를 해부한 다음 깨끗한 종이 타월로 말리십시오. 50 밀리리터의 HBSS에 FCS 1밀리리터와 49밀리리터의 HBSS를 결합하여 2% 태아 송아지 세럼 또는 FCS로 행크의 균형 잡힌 소금 용액 또는 HBSS50 밀리리터를 준비합니다. 용액을 약 10회 위아래로 부드럽게 피펫팅하여 섞는다.
비장 B 림프구 분리를 위한 JoVE 비디오 프로토콜 FACS 기술에서 입증된 바와 같이 안락사 마우스를 해부하고 비장을 제거합니다. 면역 세포를 격리하려면 먼저 페트리 접시에 40 마이크로 미터 세포 여조기에 비장을 배치합니다. 비장을 플런저로 분쇄하여 접시에 담급됩니다. HBSS 2% FCS의 1 밀리리터로 플런서와 스트레이너를 헹구어 부착된 세포를 복구합니다. 그런 다음 페트리 접시에서 분리된 비장과 액체를 50밀리리터 원심분리기 튜브로 피펫합니다. 페트리 접시를 HBSS 2% FCS 5밀리리터로 세척하고 액체를 15 밀리리터 튜브로 옮겨냅니다.
10도에서 7분 동안 370배 g의 원심분리한 다음 펠릿을 방해하지 않도록 튜브를 조심스럽게 회수합니다. 이제 펠릿을 방해하지 않고 상체를 제거하고 적절한 폐기물 용기에 액체를 폐기하십시오. 그런 다음, 원심분리기 튜브와 파이펫에 암모늄 염화 칼륨 분해 버퍼 2밀리리터를 넣고 펠릿을 다시 중단하고 적혈구를 분해합니다. 2분 동안 기다린 다음 HBSS 2% FCS를 재부유펠릿에 추가하여 총 14밀리리터를 얻습니다. 원심분리를 반복합니다. 튜브를 조심스럽게 검색하고 상체를 폐기하십시오. 그런 다음, 5 밀리리터 HBSS 2% FCS에서 펠릿을 위아래로 피펫팅하여 재보페트합니다. 다음으로, 현탁액의 세포를 계산합니다. 5 마이크로리터의 트라이팬 블루를 셀 서스펜션 5마이크로리터에 넣고 파이펫팅으로 잘 섞습니다. 그런 다음 커버 글래스와 말라세즈 슬라이드 사이에 희석 된 셀 서스펜션 5 마이크로 리터 드롭을 부드럽게 증착합니다. 현미경이 40배배감으로 설정되면 세포 수를 계산합니다. HBSS 2% FCS의 적절한 부피를 추가하여 밀리리터당 7개의 세포로 세포 농도를 10으로 조정한다.
입양 전달을 시작하려면 셀 서스펜션의 2밀리리터를 5밀리리터 수집 튜브로 이송합니다. 10도에서 7분간 370g의 원심분리한 다음 상퍼를 폐기합니다. 다음으로, 인산염 완충식식염의 2밀리리터에 펠릿을 다시 중단하고 10°C에서 7분 동안 370배 g의 원심분리기에서 튜브를 다시 분리합니다. 상부체를 폐기합니다. 그런 다음, 인산염 완충식염의 200 마이크로 리터에서 펠릿을 다시 중단합니다. 29 게이지 바늘이 있는 0.5 밀리리터 주사기를 사용하여, 실험 마우스에 세포 현탁액 200 마이크로리터를 정맥내로 주입하여 레트로 궤도 혈액 부비동에 주입한다.
입양 전이 4일 후, 마우스를 안락사시키고 비장을 제거한다. 그런 다음, 섹션 3에 설명된 바와 같이 면역 세포를 수확한다. 다음으로, 각 마우스에서 세포 현탁액 100마이크로리터를 두 개의 FACS 튜브로 이송하여 제어및 이송한다. 10°C에서 7분간 370g의 튜브를 원심분리한 다음 초월체를 폐기합니다. 이제, 표 1에 열거된 희석에서 4개의 항체를 포함하는 혼합을 준비한다. 각 튜브에 믹스 100 마이크로리터를 넣고 어둠 속에서 얼음에 20분 동안 배양합니다. 다음으로 각 튜브에 HBSS 2% FCS1밀리리터를 추가한 다음 10°C에서 3분간 370배의 튜브를 원심분리합니다. 슈퍼나티를 폐기한 다음 200마이크로리터의 HBSS 2% FCS에서 펠릿을 다시 중단합니다. 다시 중단된 셀을 새 레이블이 부착된 FACS 튜브로 전송합니다. 이제 FACS 프로토콜에 표시된 대로 흐름 세포측정을 사용하여 CD45의 존재를 평가합니다. 2 개의 양수 림프구.
이제 CD45로부터 격리된 존재 CD45.2 림프구를 결정합니다. 호스트 비장 1개. 시작하려면 FlowJo 아이콘을 두 번 클릭하고 모든 샘플 창의 각 튜브에 대한 파일을 드래그합니다. 그런 다음 전송된 파일을 두 번 클릭하여 해당 샘플에서 기록된 셀을 x축및 사이드 분산 SSCA에 나타내는 점 플롯에 표시합니다. 다각형을 클릭하여 림프구 인구를 동그라미로 이동합니다. 새 하위 채우기 식별 창이 나타납니다. 확인을 클릭합니다. 이제 y축을 FSC-W로 설정하고 x축을 FSC-A로 설정합니다. 이전에 설명한 대로 다각형 도구를 사용하여 단일 셀 채우기를 선택합니다.
다음으로 동그라미를 한 채우기를 두 번 클릭하여 선택한 셀에 대한 새 창을 만듭니다. 새 창에서 X. T 아이콘을 클릭하고 축을 사용자 지정하여 플롯을 확대할 때 Y 및 CD45.1에서 CD45.2를 선택합니다. 다음으로 다각형을 클릭하여 CD45.2 양수 셀을 동그라미로 합니다. 하위 채우기 식별 창에서 셀 채우기 전송 셀의 이름을 지정하고 확인을 클릭합니다. 같은 창에서 사각형을 클릭하여 CD45.2 음성 셀을 선택합니다. 하위 채우기 식별 창에서 셀 채우기 호스트 셀의 이름을 지정하고 확인을 클릭합니다. 다음으로, CD45.2 동그라미 채우기를 두 번 클릭하여 채우기를 전송하여 선택한 셀에 대한 새 창을 만듭니다. 새 창에서 X에서 Y및 CD4에서 CD3를 선택합니다.
다음으로 다각형을 클릭하여 CD4 CD3 양수 셀을 동그라미로 이동합니다. 이 하위 채우기 식별 창에서 CD4 셀을 전송하는 셀 채우기의 이름을 지정합니다. 그런 다음 컨트롤 마우스 파일로 이전 분석 단계를 반복합니다. 마지막으로 셀 채우기를 시각화하려면 레이아웃 편집기를 클릭합니다. 전송된 셀과 전송된 CD4 셀 채우기를 전송된 파일에서 드래그하고 파일을 레이아웃 편집기 탭으로 드래그합니다. CD45.2 양수 및 CD4 림프구를 나타내는 도트 플롯이 나타납니다. CD45. 2 개의 전송된 셀은 전송된 마우스 점 플롯에만 나타납니다.
Subscription Required. Please recommend JoVE to your librarian.
Results
Ragγc 마우스는 주로 림프구가 부족한 변경된 면역 계통 조성물을 가지고 있습니다. 비장 세포의 입양 전달은 T 및 B 세포와 같은 부족한 인구의 도입을 허용합니다. 우리의 염색에는 숙주 및 기증자 세포를 각각 구별하기 위해 CD45.1 및 CD45.2세포 표면 마커를 포함하였다(그림2A). 또한 CD4 T세포(도 2B)와같은 Ragγc 마우스에 결석한 세포 집단을 강조하기 위한 다른 세포 표면 마커도 포함되었다. 예상대로, 제어 마우스는 CD45.2 양성셀(도2B,상단 패널)을 갖지 않았고 마우스를 이송하였다(그림2B,하단 패널, 전체 세포의 71.2%). 우리는 또한 전송된 세포 내의 CD4 T 세포를 구체적으로 검출할 수 있었습니다 (CD45.2 세포의 22.1%).

그림 2: 입양 이전의 대표적인 결과. (A) PBS(대조군)를 주입한 마우스로부터 CD45.2 세포의 히스토그램(dashed) 및 CD45.2 비장세포(test group)를 주입한 마우스(solid line). (b) PBS(상단 패널)로 주입된 대조군 마우스에서 CD45.2 양성 세포의 게이팅 전략 및 CD45.2 비장세포(하단 패널)로 주입된 마우스. 기증자 및 숙주 세포는 세포 표면 마커(CD45.1, CD45.2)를 사용하여 구별되며, CD45.2 양성 세포 집단이 특징입니다(CD3, CD4). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
입양 전이는 의학 분야에서 응용 프로그램과 함께 과학의 다른 분야에서 번역 기술입니다. 이 기술은 특정 세포 인구에 있는 단백질 결핍의 세포 이동 그리고 tropism 또는 부각을 연구하기 위하여 이용될 수 있습니다. 마지막 경우에, 특정 세포 집단이 본질적으로 결핍되는 특히 GMO 마우스를 다른 기술을 사용할 수 있습니다. 그러나, GMO 마우스를 얻기 위한 유전적 구조는 매우 복잡하고 긴 과정이 될 수 있다. 이 경우, 결핍 세포 집단의 입양 전달은 쉽고 빠릅니다.
입양 전송은 의학에서 직접 응용 프로그램이 있습니다. 예를 들면, 암 치료 도중 조사된 환자에 있는 골수 이식은 면역 계통을 재구성하기 위하여 이용됩니다. 최근에는 의료 분야에서 입양 전이의 다른 응용 프로그램이 사용되고 있습니다. 인공 T 세포 (CAR T 세포라고 함)는 일부 암을 인식하고 제거하도록 설계되었습니다. 또한 이러한 엔지니어링 된 세포는 호스트에 의한 거부 위험을 완화하기 위해 제작되었습니다. CAR T 세포의 전송은 현재 임상 시험에서 시험됩니다.
Subscription Required. Please recommend JoVE to your librarian.
References
- Restifo, N. P., Dudley, M. E. and Rosenberg., S. A. Adoptive immunotherapy for cancer: harnessing the T cell response. Nature reviews. Immunology, 12 (4): 269-281, (2012).
- Bonini, C., and Mondino, A. Adoptive T-cell therapy for cancer: The era of engineered T cells. European journal of immunology, 45 (9): 2457-69, (2015).




