Overview
资料来源: 穆尼尔·西尔万1,2,3,佩尔切特·蒂鲍特1,2,3,苏菲·诺沃4,雷切尔·戈卢布1,2,3
1法国巴黎巴斯德研究所免疫学系淋巴病系
2 INSERM U1223, 巴黎, 法国
3巴黎迪德罗大学,索邦巴黎城,大提琴巴斯德,巴黎,法国
4流式细胞测定,细胞学和生物标志物 UtechS,转化科学中心,巴斯德研究所,法国巴黎
采用细胞转移是一种将细胞引入患者或研究生物体以治疗疾病或研究生物过程(如造血细胞)的方法。收养转让的目的多种多样;它可用于基础生物学以及医学(1,2)。在小鼠模型中,可以研究转移细胞的迁移和分布,然后跟踪系统(细胞表面标记、CFSE染色等)。在小鼠模型的癌症研究中,特定细胞群的转移可用作肿瘤的实验治疗。这项技术的另一个例子是通过将骨髓细胞转移到辐照小鼠或患有严重免疫缺陷表型的小鼠,从而产生嵌合小鼠。例如,此小鼠模型可用于评估基因删除对特定细胞群的影响。骨借用细胞的转移也用于人体医疗。当患者在癌症治疗时被照射时,骨髓的接受转移允许免疫系统重组。
此技术的第一步是获得感兴趣的细胞群。选择隔离此人群的技术取决于目标人群的特异性水平。最大的选择水平是整个器官,其中所有细胞群存在于器官。更精确的方法是选择目标细胞群,通常由一个细胞表面标记选择。在这种情况下,对单元格进行排序的理想方法是通过磁性排序。最后,最严格的级别是通过几个细胞表面标记选择细胞来对非常具体的细胞群进行排序。流式细胞分集是这种选择级别最常用的方法。一旦获得感兴趣的人口,就可以将其转移到主机。在收养转移之前,必须确保宿主和捐赠者之间的兼容性。事实上,无论转移目标如何,兼容性对于确保宿主采用细胞而不排斥细胞至关重要。
在本实验练习中,我们演示了采用细胞转移技术,方法是将CD45.2小鼠的细胞转移到CD45.1 Rag_c小鼠(缺乏淋巴细胞),四天后使用流细胞测定确认细胞转移(参见图1).
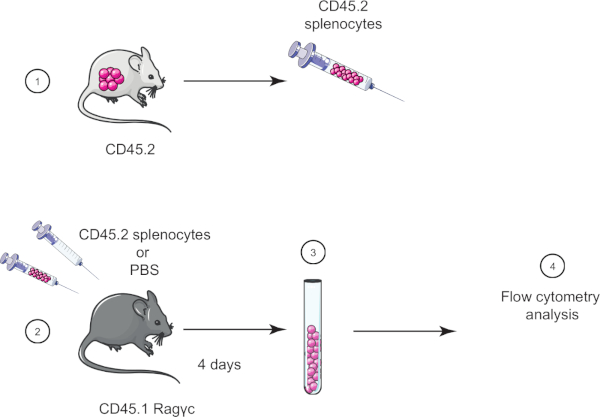
图1:收养转移的原理表。(1)从CD45.2小鼠中分离出孢子细胞,(2)在CD45.1 Rag_c小鼠中转移,仅给对照小鼠注射PBS。(3)收养转移后4天,从小鼠中恢复sssa细胞,(4)通过流动细胞学进行分析。请点击此处查看此图的较大版本。
Procedure
1. 准备
- 开始之前,戴上实验室手套和适当的防护服。
- 消毒所有解剖工具,首先用洗涤剂,然后用70%乙醇,然后彻底干燥。
- 准备 50 mL 的汉克平衡盐溶液 (HBSS) 含有 2% 胎儿小牛血清 (FCS)。
2. 解剖
- 使用二氧化碳输送系统,用缺氧对小鼠实施安乐死。将安乐死小鼠固定在上部位置的解剖板上,并使用剪刀和钳子进行纵向腹腔切除术。
- 使用钳子移动腹部右侧的肠道和胃,露出胃和脾脏。脾脏附着在胃上。
- 使用钳子小心地从胃分离脾脏,并将其放在含有 5 mL 的 HBSS 2% FCS 的培养皿上。
3. 免疫细胞隔离
- 将脾脏放在培养皿上的 40 μm 细胞滤网上。用柱塞压碎脾脏以将其分离。
- 用 1 mL 的 HBSS 2% FCS 对柱塞和滤网进行冲毛,以恢复粘附细胞。
- 将分离的脾脏和液体转移到15 mL离心管中。
- 用 5 毫升的 HBSS 2% FCS 清洗培养皿,并将液体转移到 15 mL 管中。
- 在 370 x g下在 10°C 下将管离心 7 分钟,并丢弃上清液,避免颗粒。
- 在 2 mL 氯化钾移液器中重新悬浮颗粒,以重新悬浮颗粒并赖解红细胞。
- 等待 2 分钟,并将 HBSS 2% FCS 添加到悬浮颗粒中,以获得高达 14 mL 的体积。
- 在 10°C 下,在 370 x g下再次将管离心 7 分钟。丢弃上清液,通过上下移液,将颗粒重新悬浮在 5 mL 的 HBSS 2% FCS 中。
- 使用锥蓝色染色测定对细胞进行计数,并使用适当的HBSS 2%FCS量将最终细胞浓度调整到107细胞/mL。
4. 收养转让
- 在 5 mL 收集管中传输 2 mL 的细胞悬浮液。
- 在 370 x g下在 10°C 下将管离心 7 分钟,然后丢弃上清液。
- 将颗粒重新悬浮在 2 mL 的 PBS 中,并在 370 x g下离心管,在 10°C 下 7 分钟。
- 在 200 μL 的 PBS 中丢弃上清液并重新悬浮颗粒。
- 使用带29G针头的0.5 mL注射器将200μL的细胞悬浮液静脉注射到实验小鼠的逆轨血鼻孔中。
- 作为对照,用200μL的磷酸盐缓冲盐水在同一血弦中注射第二只小鼠。
5. 细胞收获和染色
- 收养转移四天后,对小鼠实施安乐死并切除脾脏。
- 如第 3 节所述,收获 ssnocy 细胞。
- 将每只小鼠的100 μL细胞悬浮液转移到两个FACS管中,标有"控制"和"转移"。
- 在 370 x g下在 10°C 下将管离心 7 分钟,然后丢弃上生子。
- 在表1所列稀释液中准备含有四种抗体的混合物。
| 抗体 | 氟铬 | 稀释 |
| CD45.1 | BV711 | 1/200 |
| CD45.2 | APCCy7 | 1/400 |
| CD4 | BV786 | 1/1600 |
| CD3 | BV421 | 1/200 |
表1:抗体混合组合。使用浓缩抗体荧光结合剂和HBSS制备四种抗体鸡尾酒。
- 将100μL的混合加入到每个管子中,然后在黑暗中在冰上孵育20分钟。
- 加入 1 mL 的 HBSS 2%FCS,然后在 370 x g 下在 10°C 下将管离心 3 分钟。
- 丢弃上生子,在 200 μL 的 HBSS 2% FCS 中重新悬浮颗粒。
- 将重新悬浮的细胞转移到新的、标有 FACS 的管中。
- 使用流细胞测定法(如FACS协议所示)评估CD45.2阳性淋巴细胞的存在。
6. 数据分析
- 打开"FlowJo"软件,在"所有样本"窗口中拖动每个管的文件。
- 双击"传输"文件,在 Y 轴上显示正向散射"SSC-A"的点图上显示从该样本记录的单元格,在 X 轴上显示侧散射"FSC-A"。
- 点击"多边形"并创建一个门控策略来选择淋巴细胞,然后使用细胞表面标记(CD45.1,CD45.2)区分供体和宿主细胞,然后表征CD45.2+细胞群(CD3,CD4)。
- 使用"控制鼠标"文件重复分析步骤。
- 要可视化单元格填充,请单击"布局编辑器"。
- 将"转移的单元格"和"转移的CD4 单元格"从"传输"和"控制"文件拖到"布局编辑器选项卡"中。
- 将显示表示 CD45.2+细胞和 CD4 淋巴细胞的点图。
- CD45.2 传输的细胞应只出现在"转移鼠标"点图中。
采用细胞转移是一种将感兴趣的细胞引入生物体的方法。它是研究各种生物机制的有力技术,包括免疫细胞特定类别的作用。此外,收养转移是一种有前途的新疗法,适用于许多疾病,例如那些需要骨髓移植或癌症治疗的患者自己的T细胞可以提取,改变,以识别和摧毁癌细胞,以及然后回到身体来对抗肿瘤。
在实验室里,动物模型经常被用来研究收养转移。例如,CD45.1 Rag Gamma-c 敲除小鼠缺乏许多细胞因子的基本受体,这是造血干细胞正常分化为淋巴细胞所必需的。因此,敲除小鼠的淋巴细胞发育受损,没有自然杀伤剂,或NK,细胞,T细胞,或B细胞。
通过首先收获含有高浓度免疫细胞(如脾脏)的供体小鼠组织,收养转移可用于将缺失的免疫细胞引入这些受损的小鼠体内。然后组织分离,各种脾细胞,包括免疫细胞,被分离。其次,不需要的红细胞,或红血球,可以通过添加氯化铵钾解毒缓冲液进行解液,剩余的白细胞,或血细胞,然后使用离心从细胞碎片中分离出来。
最后,将纯化的小鼠注射到免疫功能低下小鼠中,促进对这些细胞功能的详细研究。几天后,通过首先以与供体组织相同的方式分离和制备宿主脾细胞,可以确认收养免疫细胞转移的成功。然后,这些细胞使用标记抗体对供体免疫细胞标记进行染色,以便使用 FACS 验证和分类它们。
首先,戴上实验室手套和适当的防护设备。接下来,先用洗涤剂洗一把钳子,然后用70%的乙醇清洗剪刀,然后用干净的纸巾擦干。将一毫升FCS与49毫升的HBSS在50毫升管中结合,用2%的胎儿小牛血清(FCS)制备50毫升汉克平衡盐溶液(HBSS)。通过轻轻上下移液约10次混合。
解剖小鼠并切除其脾脏,如用于脾B淋巴细胞分离的JoVE视频协议FACS技术所示。要分离免疫细胞,首先将脾脏放在培养皿中的40微米细胞过滤器上。用柱塞压碎脾脏,将其分离到盘子里。用 1 毫升的 HBSS 2% FCS 对柱塞和滤网进行冲剂,以恢复粘附细胞。然后,将分离的脾脏和液体从培养皿移入50毫升的离心管中。用 5 毫升的 HBSS 2% FCS 清洗培养皿,并将液体转移到 15 毫升管中。
在 370 次 g 下在 10 摄氏度下将管离心 7 分钟,然后小心取回管,以免干扰颗粒。现在,在不干扰颗粒的情况下去除上清液,并将液体丢弃在适当的废物容器中。然后,在离心管中加入两毫升氯化铵酸钾解毒缓冲液,上下移液器重新悬浮颗粒并赖解红细胞。等待两分钟,然后将 HBSS 2% FCS 添加到悬浮颗粒中,以获得 14 毫升的总价值。重复离心。小心取回管子并丢弃上清液。然后,通过上下移液,将颗粒重新悬浮在 5 毫升 HBSS 2% FCS 中。接下来,计算悬浮细胞的数量。将五微升的试青加入五微升的细胞悬浮液,并通过移液很好地混合。然后,轻轻地在盖玻璃和马拉塞兹幻灯片之间沉积五微升的稀释细胞悬浮液。将显微镜设置为 40 倍放大倍率时,计算细胞数。通过添加适当的HBSS 2%FCS,将细胞浓度调整到每毫升10至7个细胞。
要开始收养转移,将两毫升的细胞悬浮液转移到五毫升收集管。在370次g下在10摄氏度下将管子离心7分钟,然后丢弃上清液。接下来,将颗粒重新悬浮在两毫升磷酸盐缓冲盐水中,并在10摄氏度的温度下将管在370次g下离心7分钟。丢弃上清液。然后,在200微升磷酸盐缓冲盐水中重新悬浮颗粒。使用带有29口径针头的0.5毫升注射器,将200微升的细胞悬浮液静脉注射到实验小鼠的逆轨血坏液中。
收养转移四天后,对小鼠实施安乐死并切除脾脏。然后,如第三节所述,收获免疫细胞。接下来,将每只小鼠的100微升细胞悬浮液转移到两个贴有控制标签的FACS管中并转移。在370次g下在10摄氏度下将管子离心7分钟,然后丢弃上生子。现在,在表一所列稀释剂处准备一个含有四种抗体的混合物。将100微升的混合物加入每根管子,然后在黑暗中在冰上孵育20分钟。接下来,在每个管中加入一毫升HBSS 2%FCS,然后在10摄氏度的温度下以370次g将管离心3分钟。丢弃上生子,然后在 200 微升的 HBSS 2% FCS 中重新悬浮颗粒。将重新悬浮的细胞转移到新的标记的 FACS 管中。现在,使用 FACS 协议中所示的流式细胞测定法来评估 CD45 的存在。2阳性淋巴细胞。
现在,我们将确定从 CD45 中分离出的 CD45.2 淋巴细胞的存在。1 主脾脏。要开始,双击 FlowJo 图标,并拖动所有示例窗口中每个管的文件。然后,双击传输的文件,在点图上显示从该样本记录的单元格,该点图在 x 轴上显示向前散射 FSCA,在 y 轴上显示侧散射 SSCA。单击多边形以圈出淋巴细胞群。将显示一个新的子填充标识窗口。单击"确定"。现在,将 y 轴设置为 FSC-W,将 x 轴设置为 FSC-A。选择使用多边形工具的单个单元格填充,如前面所示。
接下来,双击圈填充,为所选单元格创建一个新窗口。在新窗口中,在 X 上的 Y 和 CD45.1 上选择 CD45.2。单击 T 图标并自定义轴以放大绘图。接下来,单击多边形以圈出 CD45.2 正细胞。在子填充标识窗口中,命名单元格群转移的单元格,然后单击"确定"。在同一窗口中,单击矩形以选择 CD45.2 负单元格。在子填充标识窗口中,命名单元格填充宿主单元格,然后单击"确定"。接下来,双击 CD45.2 圈填充、转移总体,为所选单元格创建一个新窗口。在新窗口中,选择 X 上的 Y 和 CD4 上的 CD3。
接下来,单击多边形以圈出 CD4 CD3 阳性细胞。在此子填充标识窗口中,命名已转移的细胞群 CD4 细胞。然后,使用控制鼠标文件重复前面的分析步骤。最后,要可视化单元格群,请单击布局编辑器。将传输的单元格和传输的 CD4 单元格从传输和控制文件拖动到布局编辑器选项卡中。将显示一个点图,表示 CD45.2 阳性细胞和 CD4 淋巴细胞。CD45.2 传输的单元格应仅出现在传输的鼠标点图中。
Subscription Required. Please recommend JoVE to your librarian.
Results
拉加克小鼠的免疫系统组成发生了变化,主要缺乏淋巴细胞。Ssacy细胞的接受转移允许引入缺乏的种群,如T和B细胞。我们的染色包括细胞表面标记CD45.1和CD45.2分别区分宿主细胞和供体细胞(图2A)。它还包括其他细胞表面标记,以突出拉格奇小鼠中不存在的细胞群,如CD4 T细胞(图2B)。如预期的那样,控制小鼠没有CD45.2阳性细胞(图2B,顶部面板)和转移鼠标(图2B,底部面板,占细胞总数的71.2%)。我们还可以专门检测转移细胞内的CD4 T细胞(CD45.2细胞的22.1%)。

图2:收养转让的代表性结果。(A)注射PBS(对照组)和注射CD45.2s细胞(测试组)(实线)的小鼠CD45.2细胞的直方图。(B)注射PBS(顶板)对照小鼠和注射CD45.2血细胞(底板)对照小鼠的CD45.2阳性细胞的注口策略。使用细胞表面标记(CD45.1,CD45.2)区分供体细胞和宿主细胞,然后CD45.2阳性细胞群特征(CD3,CD4)。请点击此处查看此图的较大版本。
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
收养转移是一种在不同科学领域的转化技术,在医学领域具有应用价值。该技术可用于研究特定细胞群中的细胞迁移和代谢或蛋白质缺乏发生率。在最后一种情况下,可以使用不同的技术,特别是特定细胞群内在缺陷的转基因小鼠。然而,基因结构获得转基因小鼠可能是一个非常复杂和漫长的过程。在这种情况下,缺乏细胞群的收养转移更容易和更快。
收养转移在医学上具有直接的应用。例如,在癌症治疗期间,辐照患者的骨髓移植用于重组免疫系统。最近,其他收养转移应用也被用于医疗领域。人工T细胞(称为CAR T细胞)旨在识别和消除某些癌症。此外,这些工程电池旨在降低宿主的排斥风险。CAR T细胞的转移目前正在临床试验中测试。
Subscription Required. Please recommend JoVE to your librarian.
References
- Restifo, N. P., Dudley, M. E. and Rosenberg., S. A. Adoptive immunotherapy for cancer: harnessing the T cell response. Nature reviews. Immunology, 12 (4): 269-281, (2012).
- Bonini, C., and Mondino, A. Adoptive T-cell therapy for cancer: The era of engineered T cells. European journal of immunology, 45 (9): 2457-69, (2015).




