Overview
Quelle: Meunier Sylvain1,2,3, Perchet Thibaut1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Einheit für Lymphopoiese, Institut für Immunologie, Pasteur Institute, Paris, Frankreich
2 INSERM U1223, Paris, Frankreich
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, Paris, Frankreich
4 Flow Cytometry Platfrom, Cytometry and Biomarkers UtechS, Center for Translational Science, Pasteur Institute, Paris, Frankreich
Der Adoptivzelltransfer ist eine Methode zur Einführung von Zellen in einen Patienten- oder Studienorganismus, um eine Krankheit zu behandeln oder einen biologischen Prozess wie Hämatopoese zu untersuchen. Die Ziele der Adoption sind vielfältig; es kann in der Grundlagenbiologie sowie in den medizinischen Wissenschaften eingesetzt werden (1, 2). In Mausmodellen können Migration und Verteilung übertragener Zellen untersucht und von einem Tracking-System (Zelloberflächenmarker, Färbung durch CFSE usw.) gefolgt werden. In Krebsstudien an Mausmodellen kann die Übertragung bestimmter Zellpopulationen als experimentelle Behandlung gegen Tumore eingesetzt werden. Ein weiteres Beispiel für diese Technik ist die Erzeugung von chimären Mäusen durch Übertragung von Knochenmarkzellen auf bestrahlte Mäuse oder Mäuse mit einem schweren Immundefizienz-Phänotyp. Dieses Mausmodell kann beispielsweise verwendet werden, um die Auswirkungen der Genlöschung auf eine bestimmte Zellpopulation zu bewerten. Transfer von Knochen-Leih-Zellen wird auch in der menschlichen medizinischen Behandlung verwendet. Wenn Patienten im Falle einer Krebstherapie bestrahlt werden, ermöglicht die Adoptivübertragung des Knochenmarks eine Rekonstitution des Immunsystems.
Der erste Schritt in dieser Technik ist es, die Zellpopulation von Interesse zu erhalten. Die gewählte Technik, um diese Population zu isolieren, hängt vom Grad der Spezifität der Zielpopulation ab. Die größte Auswahl ist das gesamte Organ, in dem alle im Organ vorhandenen Zellpopulationen aufgenommen werden. Eine genauere Methode ist die Auswahl einer Zielzellpopulation, die häufig durch eine Zelloberflächenmarkierung ausgewählt wird. Die ideale Methode zum Sortieren von Zellen in diesem Fall ist durch magnetische Sortierung. Schließlich ist die strengste Ebene die Auswahl von Zellen durch mehrere Zelloberflächenmarker, um sehr spezifische Zellpopulationen zu sortieren. Die Flow-Zytometrie-Sortierung ist die beliebteste Methode für diese Auswahlebene. Sobald eine Bevölkerung von Interesse erhalten ist, kann sie auf den Host übertragen werden. Vor der Adoption ist es wichtig, die Kompatibilität zwischen Host und Spender zu gewährleisten. In der Tat, unabhängig vom Übertragungsziel, Kompatibilität ist entscheidend, um Zellen Adoption durch den Host ohne Zellen Abstoßung zu gewährleisten.
In dieser Übungsübung im Labor demonstrieren wir die Adoptivzelltransfertechnik, indem wir Splenozyten von einer CD45.2-Maus in eine CD45.1 Ragc-Maus (fehlende Lymphozyten) übertragen und vier Tage später die Splenozytenübertragung mittels Durchflusszytometrie bestätigen (siehe Abbildung 1 ).
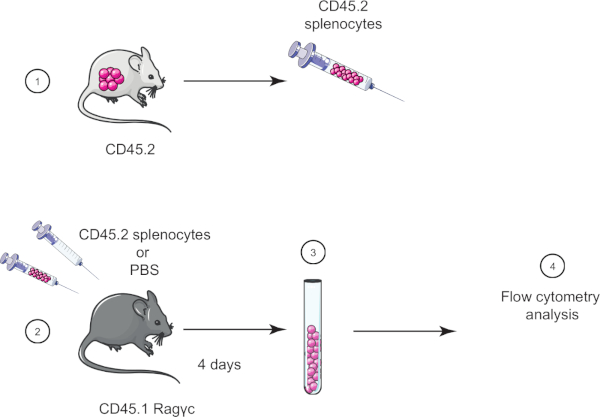
Abbildung 1: Schematische Darstellung der Adoptivübertragung. (1) Splenozyten werden von CD45.2-Mäusen isoliert und (2) in CD45.1 Ragc-Maus übertragen, Steuermaus wird nur mit PBS injiziert. (3) 4 Tage nach der Adoption werden Splenozyten von Mäusen zurückgewonnen und (4) durch Durchflusszytometrie analysiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Procedure
1. Vorbereitung
- Vor Beginn Laborhandschuhe und die entsprechende Schutzkleidung anziehen.
- Sterilisieren Sie alle Sezierwerkzeuge, zuerst mit einem Waschmittel und dann mit 70% Ethanol und dann gründlich trocknen.
- Bereiten Sie 50 ml von Hanks ausgewogener Salzlösung (HBSS) vor, die 2% fetales Kalbsserum (FCS) enthält.
2. Dissektion
- Mit einem Kohlendioxid-Zufuhrsystem, euthanisieren Sie die Maus durch Hypoxie. Sichern Sie die eingeschläferte Maus auf einer Sezierplatte in der Supine-Position und führen Sie eine Längs-Laparotomie mit Schere und Zange durch.
- Mit Zangen bewegen Sie den Darm und Magen auf der rechten Seite des Bauches, um den Magen und milden zu belichten. Die Milz ist am Magen befestigt.
- Mit Zangen die Milz vorsichtig vom Magen lösen und auf die Petrischale legen, die 5 ml HBSS 2% FCS enthält.
3. Immunzellisolierung
- Legen Sie die Milz auf ein 40 m Zellsieb über die Petrischale. Crush die Milz mit einem Kolben, um es zu dissoziieren.
- Stellen Sie die haftenden Zellen wieder her, indem Sie den Kolben und das Sieb mit 1 ml HBSS 2% FCS spülen.
- Übertragen Sie die dissoziierte Milz und die Flüssigkeit in ein 15 ml Zentrifugenrohr.
- Waschen Sie die Petrischale mit 5 MilliliterHBS 2% FCS und übertragen Sie die Flüssigkeit in das 15 ml Rohr.
- Zentrifugieren Sie das Rohr bei 370 x g für 7 min bei 10°C und entsorgen Sie den Überstand, um das Pellet zu vermeiden.
- Das Pellet in 2 ml Kaliumammoniumchloridpipet nach oben und unten wieder aufundstellen, um das Pellet wieder aufzuhängen und die Erythrozyten zu lysen.
- Warten Sie 2 min und fügen Sie HBSS 2% FCS zum resuspendierten Pellet hinzu, um das Volumen bis zu 14 ml zu erhalten.
- Zentrifugieren Sie das Rohr wieder bei 370 x g für 7 min bei 10°C. Entsorgen Sie den Überstand und setzen Sie das Pellet in 5 ml HBSS 2% FCS wieder auf, indem Sie nach oben und unten pfeifen.
- Zählen Sie die Zellen mit Trypan-Blau-Färbung-Assay und passen Sie die endgültige Zellkonzentration auf 107 Zellen/ml mit einem entsprechenden Volumen von HBSS 2% FCS an.
4. Adoptivtransfer
- Transfer 2 ml Zellsuspension in einem 5 ml Sammelrohr erhalten.
- Zentrifugieren Sie das Rohr bei 370 x g für 7 min bei 10°C und entsorgen Sie dann den Überstand.
- Das Pellet in 2 ml PBS wieder aufsetzen und das Rohr bei 370 x g für 7 min bei 10°C zentrieren.
- Überstand entsorgen und Pellet in 200 l PBS resuspendieren.
- Mit einer 0,5 ml Spritze mit einer 29G-Nadel injizieren Sie 200 l Zellsuspension in die experimentelle Maus intravenös in die retroorbitale Blutsinsinus.
- Als Kontrolle, injizieren Sie eine zweite Maus in die gleiche Blutsinsinus mit 200 L Phosphat gepufferte Saline.
5. Zellen Ernte und Färbung
- Vier Tage nach dem Adoptivtransfer, einschläfern Mäuse und entfernen Sie die Milz.
- Ernten Sie die Splenozyten wie in Abschnitt 3 beschrieben.
- Übertragen Sie 100 l Zellsuspensionen von jeder Maus in zwei FACS-Röhren, die mit "Steuerung" und "Übertragen" gekennzeichnet sind.
- Zentrifugieren Sie das Rohr bei 370 x g für 7 min bei 10°C und entsorgen Sie dann die Überräube.
- Bereiten Sie eine Mischung vor, die die vier Antikörper an den in Tabelle 1aufgeführten Verdünnungen enthält.
| Antikörper | Fluorochrom | verdünnung |
| CD45.1 | BV711 | 1/200 |
| CD45.2 | APCCy7 | 1/400 |
| CD4 | BV786 | 1/1600 |
| CD3 | BV421 | 1/200 |
Tabelle 1: Antikörper mischen Zusammensetzung. Vier Antikörper Cocktails Zubereitung mit konzentrierten Antikörper-fluoreszierenden Konjugaten und HBSS.
- Fügen Sie 100 l der Mischung zu jeder Röhre hinzu, und brüten Sie dann für 20 min auf Eis im Dunkeln.
- 1 ml HBSS 2%FCS hinzufügen und dann die Rohre bei 370 x g für 3 min bei 10°C zentrieren.
- Entsorgen Sie die Überräube und setzen Sie die Pellets in 200 l HBSS 2% FCS wieder aus.
- Übertragen Sie die resuspendierten Zellen in neue, markierte FACS-Röhren.
- Mit Flusszytometrie, wie im FACS-Protokoll gezeigt, bewerten Sie das Vorhandensein von CD45.2-positiven Lymphozyten.
6. Datenanalyse
- Öffnen Sie die "FlowJo" Software und ziehen Sie die Dateien für jede Röhre im Fenster "Alle Beispiele".
- Doppelklicken Sie auf die "übertragene" Datei, um die zellen zu zeigen, die von dieser Probe aufgezeichnet wurden, auf einem Punktdiagramm, das die Vorwärtsstreuung "SSC-A" auf der Y-Achse und die Seitenstreuung "FSC-A" auf der X-Achse anzeigt.
- Klicken Sie auf"Polygon" und erstellen Sie eine Gating-Strategie, um Lymphozyten auszuwählen, dann Spender- und Wirtszellen anhand von Zelloberflächenmarkern (CD45.1, CD45.2) zu unterscheiden und dann CD45.2+ Zellpopulation (CD3, CD4) zu charakterisieren.
- Wiederholen Sie die Analyseschritte mit der Datei"Steuermaus".
- Um eine Zellpopulation zu visualisieren, klicken Sie auf "Layout-Editor".
- Ziehen Sie die "übertragenen Zellen" und die "übertragenen CD4-Zellen" Population aus "übertragenen" und "Control" Dateien in die RegisterkarteLayout-Editor.
- Es wird ein Punktdiagramm angezeigt, das CD45.2+ Zellen und CD4-Lymphozyten darstellt.
- CD45.2 übertragene Zellen sollten nur im Punktdiagramm "übertragene Maus"angezeigt werden.
Der Adoptivzelltransfer ist eine Methode zur Einführung von Interessenszellen in einen Organismus. Es ist eine leistungsfähige Technik, um verschiedene biologische Mechanismen zu studieren, einschließlich der Wirkung bestimmter Klassen von Immunzellen. Darüber hinaus ist der Adoptivtransfer eine vielversprechende neuartige Behandlung für zahlreiche Erkrankungen, wie z. B. solche, die Knochenmarktransplantationen oder Krebsbehandlungen erfordern, bei denen die eigenen T-Zellen eines Patienten extrahiert, verändert werden können, um die Krebszellen zu erkennen und zu zerstören, und dann zum Körper zurückgekehrt, um Tumore zu bekämpfen.
Im Labor werden Tiermodelle häufig verwendet, um Den Adoptivtransfer zu untersuchen. Zum Beispiel fehlt es CD45.1 Rag gamma-c Knockout-Mäusen an fundamentalen Rezeptoren für viele Zytokine, die für die normale Differenzierung hämatopoetischer Stammzellen in Lymphozyten unerlässlich sind. Infolgedessen haben die Knockout-Mäuse eine beeinträchtigte Lymphozytenentwicklung und haben keinen natürlichen Killer, oder NK, Zellen, T-Zellen oder B-Zellen.
Der Adoptivtransfer kann verwendet werden, um die fehlenden Immunzellen in diese kompromittierten Mäuse einzuführen, indem zuerst Spendermausgewebe geerntet wird, das hohe Konzentrationen von Immunzellen wie der Milz enthält. Das Gewebe wird dann dissoziiert und eine Vielzahl von Milzzellen, einschließlich der Immunzellen, werden isoliert. Als nächstes können unerwünschte Erythrozyten oder rote Blutkörperchen über die Zugabe von Ammoniumchlorid-Kaliumlysingpufferlysiert werden und die verbleibenden weißen Blutkörperchen oder Splenozyten werden dann mittels Zentrifugation vom Zellmüll getrennt.
Schließlich werden die gereinigten Splenozyten in die immungeschwächten Mäuse injiziert, was detaillierte Studien der Funktionen dieser Zellen ermöglicht. Einige Tage später kann der Erfolg des Adoptivimmunzelltransfers durch erste Isolierung und Vorbereitung der Wirtsssel in der gleichen Weise wie das Spendergewebe bestätigt werden. Dann werden diese Zellen mit markierten Antikörpern gegen die Spender-Immunzellmarker gefärbt, so dass sie mit FACS verifiziert und sortiert werden können.
Zunächst laborhandschuhe und die entsprechende Schutzausrüstung anziehen. Als nächstes waschen Sie ein Paar Zangen und sezieren Schere zuerst mit einem Waschmittel und dann mit 70% Ethanol und dann trocknen Sie sie mit einem sauberen Papiertuch. Bereiten Sie 50 Milliliter von Hanks Balanced Salt Solution, oder HBSS, mit 2% Fetal Calf Serum, oder FCS, vor, indem Sie einen Milliliter FCS mit 49 Millilitern HBSS in einem 50-Milliliter-Rohr kombinieren. Mischen Sie die Lösung etwa 10 Mal, indem Sie die Lösung sanft nach oben und unten pfeifen.
Sezieren Sie die eingeschläferte Maus und entfernen Sie ihre Milz, wie im JoVE-Videoprotokoll FACS-Technologie für die Splenic B Lymphozyten-Trennung gezeigt. Um Immunzellen zu isolieren, legen Sie zuerst die Milz auf ein 40 Mikrometer Zellsieb in einer Petrischale. Crush die Milz mit einem Kolben, um es in die Schale zu dissoziieren. Stellen Sie die haftenden Zellen wieder her, indem Sie den Kolben und das Sieb mit 1 Milliliter HBSS 2% FCS spülen. Dann pipette die dissoziierte Milz und Flüssigkeit aus der Petrischale in ein 50 Milliliter Zentrifugenrohr. Waschen Sie die Petrischale mit 5 Milliliter HBSS 2% FCS und übertragen Sie die Flüssigkeit in das 15 Milliliter Rohr.
Zentrifugieren Sie das Rohr bei 370 mal g für sieben Minuten bei 10 Grad Celsius und holen Sie das Rohr dann vorsichtig ab, um das Pellet nicht zu stören. Entfernen Sie nun den Überstand, ohne das Pellet zu stören, und entsorgen Sie die Flüssigkeit in einem geeigneten Abfallbehälter. Dann fügen Sie zwei Milliliter Ammoniumchlorid Kaliumlysing Puffer in das Zentrifugenrohr und Pipette nach oben und unten, um das Pellet wieder aufzuhängen und die Erythrozyten zu lyse. Warten Sie zwei Minuten und fügen Sie dann HBSS 2% FCS zum resuspendierten Pellet hinzu, um einen Gesamtwert von 14 Millilitern zu erhalten. Wiederholen Sie die Zentrifugation. Holen Sie sich das Rohr sorgfältig und entsorgen Sie den Überstand. Dann, resuspendieren Sie das Pellet in 5 Milliliter HBSS 2% FCS durch Pipettieren nach oben und unten. Zählen Sie als Nächstes die Zellen in suspension. Fügen Sie fünf Mikroliter Trypan blau zu fünf Mikroliter Zellsuspension hinzu und mischen Sie sie gut durch Pipettieren. Dann legen Sie vorsichtig einen fünf Mikroliter Tropfen verdünnte Zellsuspension zwischen dem Deckglas und der Malassez-Rutsche ab. Wenn das Mikroskop auf 40-fache Vergrößerung eingestellt ist, zählen Sie die Anzahl der Zellen. Passen Sie die Zellkonzentration auf 10 auf die sieben Zellen pro Milliliter an, indem Sie das entsprechende Volumen von HBSS 2% FCS hinzufügen.
Um die Adoptivübertragung zu beginnen, übertragen Sie zwei Milliliter der Zellsuspension in ein Fünf-Milliliter-Sammelrohr. Zentrifugieren Sie das Rohr bei 370 mal g für sieben Minuten bei 10 Grad Celsius und entsorgen Sie dann den Überstand. Als nächstes setzen Sie das Pellet in zwei Milliliter Phosphat gepufferte Saline und Zentrifugieren Sie das Rohr bei 370 mal g für sieben Minuten bei 10 Grad Celsius. Entsorgen Sie den Überstand. Dann setzen Sie das Pellet in 200 Mikroliter Phosphat gepufferte Saline wieder aus. Mit einer 0,5-Milliliter-Spritze mit einer 29-Spur-Nadel injizieren Sie 200 Mikroliter Zellsuspension in die experimentelle Maus intravenös in den retroorbitalen Blutsinus.
Vier Tage nach dem Adoptivtransfer die Mäuse einschläfern und die Milz entfernen. Dann ernten Sie die Immunzellen, wie in Abschnitt drei beschrieben. Als nächstes übertragen Sie 100 Mikroliter Zellsuspension von jeder Maus in zwei FACS-Röhren, die mit der Steuerung beschriftet sind, und übertragen. Zentrifugieren Sie die Rohre bei 370 mal g für sieben Minuten bei 10 Grad Celsius und entsorgen Sie dann die Überräube. Bereiten Sie nun eine Mischung mit den vier Antikörpern an der in Tabelle eins aufgeführten Verdünnung vor. Fügen Sie 100 Mikroliter der Mischung in jede Röhre und dann für 20 Minuten auf Eis im Dunkeln inkubieren. Als nächstes fügen Sie einen Milliliter HBSS 2% FCS zu jedem Rohr hinzu und zentrifugieren Sie die Rohre dann bei 370 mal g für drei Minuten bei 10 Grad Celsius. Entsorgen Sie die Überräube und setzen Sie die Pellets in 200 Mikroliter HBSS 2% FCS wieder aus. Übertragen Sie die resuspendierten Zellen in neue markierte FACS-Rohre. Verwenden Sie nun die Durchflusszytometrie, wie im FACS-Protokoll gezeigt, um das Vorhandensein von CD45 zu bewerten. 2 positive Lymphozyten.
Nun werden wir das Vorhandensein von CD45.2-Lymphozyten bestimmen, die von der CD45 isoliert wurden. 1 Host Milz. Um zu starten, doppelklicken Sie auf das FlowJo-Symbol und ziehen Sie die Dateien für jede Röhre im gesamten Beispielfenster. Doppelklicken Sie dann auf die übertragene Datei, um die zellen, die von dieser Probe aufgezeichnet wurden, auf einem Punktdiagramm anzuzeigen, das Vorwärtsstreu-FSCA auf der x-Achse und DieSeitenstreuung SSCA auf der y-Achse anzeigt. Klicken Sie auf Polygon, um die Lymphozytenpopulationen zu umkreisen. Ein neues Subpopulations-Identifikationsfenster wird angezeigt. Klicken Sie auf OK. Legen Sie nun die y-Achse auf FSC-W und die x-Achse auf FSC-A fest. Wählen Sie die Einzelzellenpopulation mit dem Polygonwerkzeug aus, wie zuvor gezeigt.
Doppelklicken Sie anschließend auf die eingekreiste Grundgesamtheit, um ein neues Fenster für die ausgewählten Zellen zu erstellen. Wählen Sie im neuen Fenster CD45.2 auf dem Y und CD45.1 auf dem X. Klicken Sie auf das T-Symbol und passen Sie die Achse an, um das Diagramm zu vergrößern. Klicken Sie als Nächstes auf Polygon, um die CD45.2-positiven Zellen zu umkreisen. Benennen Sie im Identifikationsfenster für die Subpopulation die übertragenen Zellen der Zellen, und klicken Sie auf OK. Klicken Sie im selben Fenster auf Rechteck, um die negativen CD45.2-Zellen auszuwählen. Benennen Sie im Identifikationsfenster für die Subpopulation die Hostzellen der Zellenauffüllung, und klicken Sie auf OK. Doppelklicken Sie anschließend auf die cd45.2-Kreispopulation, die überübertragene Grundgesamtheit, um ein neues Fenster für die ausgewählten Zellen zu erstellen. Wählen Sie im neuen Fenster CD3 auf dem Y und CD4 auf dem X aus.
Klicken Sie als Nächstes auf Polygon, um die CD4 CD3-positiven Zellen zu umkreisen. Benennen Sie in diesem Anzeigefenster zur Identifizierung der Teilpopulation die übertragenen CD4-Zellen der Zellen. Wiederholen Sie dann die vorherigen Analyseschritte mit der Steuermausdatei. Um Ihre Zellenpopulationen zu visualisieren, klicken Sie schließlich auf Layout-Editor. Ziehen Sie die übertragenen Zellen und die übertragene CD4-Zellenpopulation aus übertragenen und steueren Sie Dateien auf die Registerkarte Layout-Editor. Es wird ein Punktdiagramm angezeigt, das CD45.2-positive Zellen und CD4-Lymphozyten darstellt. CD45. 2 übertragene Zellen sollten nur im übertragenen Mauspunktdiagramm angezeigt werden.
Subscription Required. Please recommend JoVE to your librarian.
Results
Ragc-Mäuse haben eine veränderte Zusammensetzung des Immunsystems, vor allem fehlt lymphozyten. Die Adoptivübertragung von Splenozyten ermöglicht die Einführung fehlender Populationen wie T- und B-Zellen. Unsere Färbung umfasste Zelloberflächenmarker CD45.1 und CD45.2, um Wirts- bzw. Spenderzellen zu unterscheiden (Abbildung 2A). Es umfasste auch andere Zelloberflächenmarker, um Zellpopulationen hervorzuheben, die in Ragc-Mäusen nicht vorhanden waren, wie z. B. CD4-T-Zellen (Abbildung 2B). Wie erwartet, hatte die Steuermaus keine CD45.2-positiven Zellen(Abbildung 2B, obere Panels) und übertragene Maus tat (Abbildung 2B, untere Panels, 71,2% der Gesamtzellen). Wir konnten auch speziell CD4-T-Zellen innerhalb übertragener Zellen (22,1% der CD45.2-Zellen) erkennen.

Abbildung 2: Repräsentative Ergebnisse der Adoptionsübertragung. (A) Histogramme von CD45.2-Zellen von Mäusen, die mit PBS (Kontrollgruppe) (gestrichelt) und Mäusen, die mit CD45,2-Splenozyten injiziert wurden (Testgruppe) (feste Linie) injiziert wurden. (B) Gating-Strategie von CD45.2-positiven Zellen in Kontrollmäusen, die mit PBS (Obere Panels) injiziert wurden, und Mäusen, die mit CD45.2-Splenozyten (untere Paneele) injiziert wurden. Spender- und Wirtszellen werden anhand von Zelloberflächenmarkern unterschieden (CD45.1, CD45.2), dann werden CD45.2-positive Zellpopulationen charakterisiert (CD3, CD4). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Der Adoptivtransfer ist eine translationale Technik in verschiedenen Bereichen der Wissenschaft, mit Anwendungen in der Medizin. Diese Technik kann verwendet werden, um Zellmigration und Tropismus oder Inzidenz von Proteinmangel in bestimmten Zellpopulationen zu untersuchen. Im letzten Fall können verschiedene Technologien eingesetzt werden, insbesondere GVO-Mäuse, bei denen bestimmte Zellpopulationen an sich mangelhaft sind. Die genetische Konstruktion zur Gewinnung von GVO-Mäusen kann jedoch ein sehr komplexer und langer Prozess sein. In diesem Fall ist die Adoptivübertragung der mangelhaften Zellpopulation einfacher und schneller.
Adoptivtransfers haben direkte Anwendungen in der Medizin. Zum Beispiel werden Knochenmarktransplantate bei bestrahlten Patienten während der Krebstherapie verwendet, um das Immunsystem zu rekonstituieren. In jüngster Zeit wurden andere Anwendungen der Adoptivübertragung im medizinischen Bereich eingesetzt. Künstliche T-Zellen (CAR-T-Zelle genannt) sind so konzipiert, dass sie einige Krebsarten erkennen und eliminieren. Darüber hinaus sind diese konstruierten Zellen so konstruiert, dass das Ablehnungsrisiko durch den Host gedämpft wird. Die Übertragung von CAR-T-Zellen wird derzeit in klinischen Studien getestet.
Subscription Required. Please recommend JoVE to your librarian.
References
- Restifo, N. P., Dudley, M. E. and Rosenberg., S. A. Adoptive immunotherapy for cancer: harnessing the T cell response. Nature reviews. Immunology, 12 (4): 269-281, (2012).
- Bonini, C., and Mondino, A. Adoptive T-cell therapy for cancer: The era of engineered T cells. European journal of immunology, 45 (9): 2457-69, (2015).




