Overview
Fonte: Meunier Sylvain1,2,3, Perchet Thibaut1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Unità di Linfopoiesi, Dipartimento di Immunologia, Istituto Pasteur, Parigi, Francia
2 INSERM U1223, Parigi, Francia
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, Parigi, Francia
4 Platfrom, Citometria a flusso e biomarcatori UtechS, Center for Translational Science, Pasteur Institute, Parigi, Francia
Il trasferimento di cellule adottive è un metodo per introdurre cellule in un paziente o in un organismo di studio al fine di trattare una malattia o studiare un processo biologico, come l'ematopoiesi. Gli obiettivi del trasferimento adottivo sono vari; può essere utilizzato in biologia fondamentale e nelle scienze mediche (1, 2). Nei modelli murini, la migrazione e la distribuzione delle cellule trasferite possono essere studiate e seguite da un sistema di tracciamento (marcatore della superficie cellulare, colorazione mediante CFSE, ecc.). Negli studi sul cancro su modelli murini, il trasferimento di specifiche popolazioni cellulari può essere utilizzato come trattamento sperimentale contro i tumori. Un altro esempio di questa tecnica è la creazione di topi chimerici mediante trasferimento di cellule del midollo osseo a topi irradiati o topi con un fenotipo di immunodeficienza grave. Questo modello murino può essere utilizzato per valutare l'impatto della delezione genica su una specifica popolazione cellulare, ad esempio. Il trasferimento di cellule di prestito osseo è anche usato nel trattamento medico umano. Quando i pazienti vengono irradiati in caso di terapia antitumorale, il trasferimento adottivo del midollo osseo consente la ricostituzione del sistema immunitario.
Il primo passo in questa tecnica è quello di ottenere la popolazione cellulare di interesse. La tecnica scelta per isolare questa popolazione dipende dal livello di specificità della popolazione target. Il più grande livello di selezione è l'intero organo, in cui vengono prese tutte le popolazioni cellulari presenti nell'organo. Un metodo più preciso è la selezione di una popolazione cellulare target, spesso selezionata da un marcatore di superficie cellulare. Il metodo ideale per ordinare le celle in questo caso è lo smistamento magnetico. Infine, il livello più rigoroso è la selezione delle cellule da parte di diversi marcatori di superficie cellulare per ordinare popolazioni cellulari molto specifiche. Lo smistamento della citometria a flusso è il metodo più popolare per questo livello di selezione. Una volta ottenuta la popolazione di interesse, può essere trasferita all'host. Prima del trasferimento adottivo è essenziale garantire la compatibilità tra ospite e donatore. Infatti, indipendentemente dall'obiettivo di trasferimento, la compatibilità è fondamentale per garantire l'adozione delle cellule da parte dell'ospite senza il rigetto delle cellule.
In questo esercizio di laboratorio, dimostriamo la tecnica di trasferimento cellulare adottivo trasferendo gli splenociti da un topo CD45.2 in un topo Ragγc CD45.1 (privo di linfociti) e quattro giorni dopo confermiamo il trasferimento degli splenociti usando la citometria a flusso (vedi Figura 1).
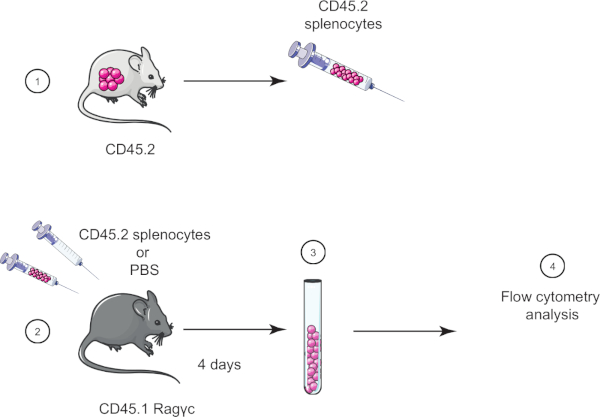
Figura 1: Rappresentazione schematica del trasferimento adottivo. (1) Gli splenociti sono isolati dai topi CD45.2 e (2) trasferiti nel topo CD45.1 Ragγc, il mouse di controllo viene iniettato solo con PBS. (3) 4 giorni dopo il trasferimento adottivo, gli splenociti vengono recuperati dai topi e (4) analizzati mediante citometria a flusso. Fare clic qui per visualizzare una versione più grande di questa figura.
Procedure
1. Preparazione
- Prima di iniziare, indossare guanti da laboratorio e gli indumenti protettivi appropriati.
- Sterilizzare tutti gli strumenti di dissezione, prima con un detergente e poi con etanolo al 70% e poi asciugare accuratamente.
- Preparare 50 ml di soluzione salina bilanciata di Hank (HBSS) contenente il 2% di siero fetale per vitelli (FCS).
2. Dissezione
- Utilizzando un sistema di rilascio di anidride carbonica, eutanasizzare il topo per ipossia. Fissare il topo eutanasizzato su una piastra di dissezione in posizione supina ed eseguire una laparotomia longitudinale usando forbici e pinza.
- Usando la pinza muovi l'intestino e lo stomaco sul lato destro dell'addome per esporre lo stomaco e la milza. La milza è attaccata allo stomaco.
- Usando una pinza staccare accuratamente la milza dallo stomaco e posizionarla sulla capsula di Petri contenente 5 ml di HBSS 2% FCS.
3. Isolamento delle cellule immunitarie
- Posizionare la milza su un colino cellulare da 40 μm sopra la capsula di Petri. Schiacciare la milza con uno stantuffo per dissociarla.
- Recuperare le cellule aderenti risciacquando lo stantuffo e il filtro con 1 mL di HBSS 2% FCS.
- Trasferire la milza dissociata e il fluido in un tubo centrifugo da 15 ml.
- Lavare la capsula di Petri con 5 millilitri di HBSS 2% FCS e trasferire il fluido nel tubo da 15 ml.
- Centrifugare il tubo a 370 x g per 7 min a 10°C ed eliminare il surnatante evitando il pellet.
- Risuscisci il pellet in 2 mL di pipetto di cloruro di ammonio di potassio su e giù per ricaspendare il pellet e lisi gli eritrociti.
- Attendere 2 min e aggiungere HBSS 2% FCS al pellet riaspenso per ottenere il volume fino a 14 mL.
- Centrifugare nuovamente il tubo a 370 x g per 7 min a 10°C. Scartare il surnatante e ricasospenare il pellet in 5 ml di HBSS 2% FCS tubando su e giù.
- Contare le cellule utilizzando il test di colorazione blu tripano e regolare la concentrazione cellulare finale a10 7 cellule / mL utilizzando il volume appropriato di HBSS 2% FCS.
4. Trasferimento adottivo
- Trasferire 2 mL di sospensione cellulare ottenuta in un tubo di raccolta da 5 mL.
- Centrifugare il tubo a 370 x g per 7 min a 10°C e poi scartare il surnatante.
- Spese di sospensione del pellet in 2 mL di PBS e centrifugazione del tubo a 370 x g per 7 min a 10°C.
- Scartare il pellet surnatante e spese in 200 μL di PBS.
- Utilizzando una siringa da 0,5 mL con un ago da 29G iniettare 200 μL di sospensione cellulare nel topo sperimentale per via endovenosa nel seno sanguigno retro-orbitale.
- Come controllo, iniettare un secondo topo nello stesso seno sanguigno con 200 μL di soluzione salina tamponata con fosfato.
5. Raccolta e colorazione delle cellule
- Quattro giorni dopo il trasferimento adottivo, eutanasizzare i topi e rimuovere la milza.
- Raccogliere gli splenociti come descritto nel paragrafo 3.
- Trasferire 100 μL di sospensioni cellulari da ciascun topo in due tubi FACS, etichettati come "controllo" e "trasferiti".
- Centrifugare il tubo a 370 x g per 7 min a 10°C e poi scartare i supernatanti.
- Preparare una miscela contenente i quattro anticorpi alle diluizioni elencate nella Tabella 1.
| Anticorpi | Fluorocromo | Diluizione |
| CD45,1 | BV711 · | 1/200 |
| CD45,2 | APCCy7 · | 1/400 |
| CD4 | BV786 · | 1/1600 |
| CD3 | BV421 · | 1/200 |
Tabella 1: Composizione della miscela di anticorpi. Preparazione di cocktail a quattro anticorpi utilizzando coniugati fluorescenti anticorpali concentrati e HBSS.
- Aggiungere 100 μL della miscela a ciascun tubo, quindi incubare per 20 minuti sul ghiaccio al buio.
- Aggiungere 1 mL di HBSS 2%FCS e quindi centrifugare i tubi a 370 x g per 3 minuti a 10°C.
- Scartare i supernatanti e ricasospenare i pellet in 200 μL di HBSS 2% FCS.
- Trasferire le celle riconsepense in nuovi tubi FACS etichettati.
- Utilizzando la citometria a flusso, come mostrato nel protocollo FACS, valutare la presenza di linfociti CD45.2 positivi.
6. Analisi dei dati
- Aprire il software "FlowJo" e trascinare i file per ogni tubo nella finestra " Tutti icampioni".
- Fare doppio clic sul file "trasferito" per visualizzare le celle registrate da quel campione su un dot plot che visualizza la dispersione in avanti "SSC-A" sull'asse Y e la dispersione laterale "FSC-A" sull'asse X.
- Fare clic su "poligono" e creare una strategia di gating per selezionare i linfociti, quindi distinguere le cellule donatrici e ospiti utilizzando marcatori di superficie cellulare (CD45.1, CD45.2) e quindi caratterizzare la popolazione cellulare CD45.2+ (CD3, CD4).
- Ripetere i passaggi di analisi con il file "control mouse".
- Per visualizzare una popolazione di celle, fare clic su "Editor di layout".
- Trascinare le "celle trasferite" e la popolazione di "celle CD4 trasferite" dai file "trasferiti" e "di controllo" nella scheda "Editor layout".
- Apparirà un dot plot che rappresenta le cellule CD45.2+ e i linfociti CD4.
- Le celle trasferite CD45.2 dovrebbero apparire solo nel dot plot "trasferito dal mouse".
Il trasferimento di cellule adottive è un metodo per introdurre cellule di interesse in un organismo. È una tecnica potente per studiare vari meccanismi biologici, tra cui l'azione di specifiche classi di cellule immunitarie. Inoltre, il trasferimento adottivo è un nuovo trattamento promettente per numerose condizioni, come quelle che richiedono trapianti di midollo osseo o trattamenti contro il cancro in cui le cellule T di un paziente possono essere estratte, alterate per riconoscere e distruggere le cellule cancerose e quindi restituite al corpo per combattere i tumori.
In laboratorio, i modelli animali sono spesso usati per studiare il trasferimento adottivo. Ad esempio, i topi knockout CD45.1 Rag gamma-c mancano di recettori fondamentali per molte citochine, che sono essenziali per la normale differenziazione delle cellule staminali ematopoietiche in linfociti. Di conseguenza, i topi knockout hanno uno sviluppo linfocitario compromesso e non hanno cellule natural killer, o NK, cellule, cellule T o cellule B.
Il trasferimento adottivo può essere utilizzato per introdurre le cellule immunitarie mancanti in questi topi compromessi, raccogliendo prima il tessuto di topo donatore contenente alte concentrazioni di cellule immunitarie, come la milza. Il tessuto viene quindi dissociato e una varietà di cellule della milza, comprese le cellule immunitarie, vengono isolate. Successivamente, gli eritrociti indesiderati, o globuli rossi, possono essere llisi tramite l'aggiunta di un tampone di lisi di potassio cloruro di ammonio e i restanti globuli bianchi, o splenociti, vengono quindi separati dai detriti cellulari utilizzando la centrifugazione.
Infine, gli splenociti purificati vengono iniettati nei topi immunocompromessi, facilitando studi dettagliati delle funzioni di queste cellule. Diversi giorni dopo, il successo del trasferimento delle cellule immunitarie adottive può essere confermato prima isolando e preparando le splenoncytes dell'ospite allo stesso modo del tessuto donatore. Quindi, queste cellule vengono colorate utilizzando anticorpi etichettati contro i marcatori delle cellule immunitarie del donatore in modo che possano essere verificate e ordinate utilizzando FACS.
Per iniziare, indossare guanti da laboratorio e l'equipaggiamento protettivo appropriato. Quindi, lavare un paio di pinza e sezionare le forbici prima con un detergente e poi con etanolo al 70% e quindi asciugarle con un tovagliolo di carta pulito. Preparare 50 millilitri di Hank's Balanced Salt Solution, o HBSS, con il 2% di siero fetale di vitello, o FCS, combinando un millilitro di FCS con 49 millilitri di HBSS in un tubo da 50 millilitri. Mescolare pipettando delicatamente la soluzione su e giù circa 10 volte.
Sezionare il topo eutanasizzato e rimuovere la milza come dimostrato nella tecnologia FACS del protocollo video JoVE per la separazione dei linfociti B della milza. Per isolare le cellule immunitarie, prima posizionare la milza su un filtro cellulare da 40 micrometri in una capsula di Petri. Schiacciare la milza con uno stantuffo per dissociarla nel piatto. Recuperare le cellule aderenti risciacquando lo stantuffo e il filtro con 1 millilitro di HBSS 2% FCS. Quindi, pipettare la milza dissociata e il fluido dalla capsula di Petri in un tubo centrifugo da 50 millilitri. Lavare la capsula di Petri con 5 millilitri di HBSS 2% FCS e trasferire il fluido nel tubo da 15 millilitri.
Centrifugare il tubo a 370 volte g per sette minuti a 10 gradi Celsius e poi recuperare il tubo con attenzione in modo da non disturbare il pellet. Ora, rimuovere il surnatante senza disturbare il pellet e scartare il liquido in un contenitore di rifiuti appropriato. Quindi, aggiungere due millilitri di tampone di lisi di potassio cloruro di ammonio al tubo della centrifuga e alla pipetta su e giù per risuscievole il pellet e lisi degli eritrociti. Attendere due minuti e quindi aggiungere HBSS 2% FCS al pellet riconsosciato per ottenere un valore totale di 14 millilitri. Ripetere la centrifugazione. Recuperare il tubo con attenzione ed scartare il surnatante. Quindi, risuscisci il pellet in 5 millilitri HBSS 2% FCS pipettando su e giù. Quindi, contare le celle in sospensione. Aggiungere cinque microlitri di tripano blu a cinque microlitri di sospensione cellulare e mescolare bene mediante pipettaggio. Quindi, depositare delicatamente una goccia di cinque microliti di sospensione cellulare diluita tra il vetro di copertura e il vetrino Malassez. Con il microscopio impostato su ingrandimento 40X, contare il numero di cellule. Regolare la concentrazione cellulare a 10 a sette cellule per millilitro aggiungendo il volume appropriato di HBSS 2% FCS.
Per iniziare il trasferimento adottivo, trasferire due millilitri della sospensione cellulare in un tubo di raccolta di cinque millilitri. Centrifugare il tubo a 370 volte g per sette minuti a 10 gradi Celsius e quindi scartare il surnatante. Quindi, risuscisci il pellet in due millilitri di soluzione salina tamponata con fosfato e centrifuga il tubo a 370 volte g per sette minuti a 10 gradi Celsius. Scartare il surnatante. Quindi, ricaspendare il pellet in 200 microlitri di soluzione salina tamponata con fosfato. Utilizzando una siringa da 0,5 millilitri con un ago calibro 29, iniettare 200 microlitri di sospensione cellulare nel topo sperimentale per via endovenosa nel seno sanguigno retro-orbitale.
Quattro giorni dopo il trasferimento adottivo, eutanasia dei topi e rimuovere la milza. Quindi, raccogliere le cellule immunitarie come descritto nella sezione tre. Quindi, trasferire 100 microlitri di sospensione cellulare da ciascun mouse in due tubi FACS etichettati come controllo e trasferiti. Centrifugare i tubi a 370 volte g per sette minuti a 10 gradi Celsius e quindi scartare i supernatanti. Ora, prepara una miscela contenente i quattro anticorpi alla diluizione elencata nella tabella uno. Aggiungere 100 microlitri della miscela a ciascun tubo e quindi incubare per 20 minuti sul ghiaccio al buio. Quindi, aggiungere un millilitro di HBSS 2% FCS a ciascun tubo e quindi centrifugare i tubi a 370 volte g per tre minuti a 10 gradi Celsius. Scartare i supernatanti e quindi ricaspenare i pellet in 200 microlitri di HBSS 2% FCS. Trasferire le celle riaspense in nuovi tubi FACS etichettati. Ora, utilizzare la citometria a flusso come mostrato nel protocollo FACS per valutare la presenza di CD45. 2 linfociti positivi.
Ora, determineremo la presenza di linfociti CD45.2 che sono stati isolati dal CD45. 1 milza ospite. Per iniziare, fai doppio clic sull'icona FlowJo e trascina i file per ciascun tubo nella finestra di tutti i campioni. Quindi, fare doppio clic sul file trasferito per visualizzare le celle registrate da quel campione su un dot plot che visualizza la dispersione in avanti FSCA sull'asse x e la dispersione laterale SSCA sull'asse y. Clicca sul poligono per cerchiare le popolazioni di linfociti. Viene visualizzata una nuova finestra di identificazione della sottopopolazione. Fare clic su OK. Ora, impostare l'asse y su FSC-W e l'asse x su FSC-A. Selezionare la popolazione di celle singole con lo strumento poligono, come dimostrato in precedenza.
Quindi, fare doppio clic sulla popolazione cerchiata per creare una nuova finestra per le celle selezionate. Nella nuova finestra, selezionare CD45.2 sulla Y e CD45.1 sulla X. Fare clic sull'icona T e personalizzare l'asse per ingrandire il plottaggio. Quindi, fare clic su poligono per cerchiare le celle positive CD45.2. Nella finestra di identificazione della sottopopolazione, assegnare un nome alle celle trasferite dalla popolazione cellulare e fare clic su OK. Nella stessa finestra, fare clic su rettangolo per selezionare le celle negative CD45.2. Nella finestra di identificazione della sottopopolazione, assegnare un nome alle celle host della popolazione cellulare e fare clic su OK. Quindi, fare doppio clic sulla popolazione cerchiata CD45.2, popolazione trasferita, per creare una nuova finestra per le celle selezionate. Nella nuova finestra, selezionare CD3 sulla Y e CD4 sulla X.
Quindi, fare clic su poligono per cerchiare le celle CD4 CD3 positive. In questa finestra di identificazione della sottopopolazione, assegnare un nome alle cellule CD4 trasferite dalla popolazione cellulare. Quindi, ripetere i passaggi di analisi precedenti con il file del mouse di controllo. Infine, per visualizzare le popolazioni di cellule, fare clic su Editor layout. Trascinare le celle trasferite e la popolazione di celle CD4 trasferite dai file trasferiti e di controllo nella scheda Editor layout. Apparirà un dot plot che rappresenta le cellule CD45.2 positive e i linfociti CD4. CD45. 2 le celle trasferite devono essere visualizzate solo nel grafico a punti del mouse trasferito.
Subscription Required. Please recommend JoVE to your librarian.
Results
I topi Ragγc hanno una composizione alterata del sistema immunitario, principalmente privi di linfociti. Il trasferimento adottivo di splenociti consente l'introduzione di popolazioni carenti come le cellule T e B. La nostra colorazione includeva marcatori di superficie cellulare CD45.1 e CD45.2 per distinguere rispettivamente le cellule ospiti e donatrici (Figura 2A). Ha anche incluso altri marcatori della superficie cellulare per evidenziare le popolazioni cellulari assenti nei topi Ragγc, come le cellule T CD4 (Figura 2B). Come previsto, il mouse di controllo non aveva celle CD45.2-positive(Figura 2B,pannelli superiori) e il mouse trasferito lo ha fatto(Figura 2B,pannelli inferiori, 71,2% delle celle totali). Potremmo anche rilevare specificamente le cellule T CD4 all'interno delle cellule trasferite (22,1% delle cellule CD45,2).

Figura 2: Risultati rappresentativi del trasferimento adottivo. (A) Istogrammi di cellule CD45.2 di topi iniettati con PBS (gruppo di controllo) (tratteggiato) e topi iniettati con splenociti CD45.2 (gruppo di prova) (linea solida). (B) Strategia di Gating di cellule CD45.2-positive in topi di controllo iniettati con PBS (pannelli superiori) e topi iniettati con splenociti CD45.2 (pannelli inferiori). Le cellule donatrici e ospiti si distinguono utilizzando marcatori di superficie cellulare (CD45.1, CD45.2), quindi viene caratterizzata la popolazione cellulare CD45.2-positiva (CD3, CD4). Fare clic qui per visualizzare una versione più grande di questa figura.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Il trasferimento adottivo è una tecnica traslazionale in diversi campi della scienza, con applicazioni in medicina. Questa tecnica può essere utilizzata per studiare la migrazione cellulare e il tropismo o l'incidenza della carenza proteica in specifiche popolazioni cellulari. In quest'ultimo caso, possono essere utilizzate diverse tecnologie, in particolare topi OGM in cui specifiche popolazioni cellulari sono intrinsecamente carenti. Tuttavia, la costruzione genetica per ottenere topi OGM può essere un processo molto complesso e lungo. In questo caso, il trasferimento adottivo della popolazione cellulare carente è più facile e veloce.
I trasferimenti adottivi hanno applicazioni dirette in medicina. Ad esempio, gli innesti di midollo osseo in pazienti irradiati durante la terapia del cancro vengono utilizzati per ricostituire il sistema immunitario. Recentemente, altre applicazioni di trasferimento adottivo sono state utilizzate in campo medico. Le cellule T artificiali (chiamate cellule T CAR) sono progettate per riconoscere ed eliminare alcuni tumori. Inoltre, queste celle ingegnerizzate sono costruite per smorzare il rischio di rigetto da parte dell'ospite. Il trasferimento di cellule T CAR è attualmente testato in studi clinici.
Subscription Required. Please recommend JoVE to your librarian.
References
- Restifo, N. P., Dudley, M. E. and Rosenberg., S. A. Adoptive immunotherapy for cancer: harnessing the T cell response. Nature reviews. Immunology, 12 (4): 269-281, (2012).
- Bonini, C., and Mondino, A. Adoptive T-cell therapy for cancer: The era of engineered T cells. European journal of immunology, 45 (9): 2457-69, (2015).




