Overview
Source: Jonathan F. Blaize1, Elizabeth Suter1, et Christopher P. Corbo1
1 Département des sciences biologiques, Wagner College, 1 Campus Road, Staten Island NY, 10301
L'évaluation quantitative des procaryotes peut être onéreuse compte tenu de leur abondance, de leur propension à une prolifération exponentielle, de la diversité des espèces au sein d'une population et de leurs besoins physiologiques spécifiques. À ce défi s'ajoute la nature en quatre phases dans laquelle les bactéries se reproduisent (lag, journal, stationnaire et mort). La capacité d'estimer avec précision la concentration de micro-organismes est nécessaire pour réussir l'identification, l'isolement, la culture et la caractérisation (6). À ce titre, les microbiologistes ont utilisé la dilution en série et diverses techniques de placage depuis plus d'un siècle pour quantifier de façon fiable la charge bactérienne et virale dans les environnements cliniques, industriels, pharmaceutiques et universitaires de laboratoire (2,4,6). Les descriptions de cette méthodologie sont apparues pour la première fois en 1883 lorsque le scientifique et médecin allemand Robert Koch a publié ses travaux sur les agents pathogènes (2). Souvent appelées le père de la bactériologie moderne, les techniques prénommées de Koch sont devenues l'étalon-or de l'énumération des micro-organismes, culturables ou autres, dans le monde entier.
La dilution en série est une réduction systématique d'une entité connue ou inconnue (un soluté, un organisme, etc.) par une re-suspension successive d'une solution initiale (solution0) en volumes fixes d'un diluant liquide (blancs). Ces blancs se composent généralement de 0,45% salin, bien que la composition peut être variée (7). Bien qu'un expérimentateur puisse choisir n'importe quel volume pour chaque diluant, il s'agit le plus souvent d'un multiple de 10, ce qui facilite la réduction logarithmique de l'échantillon. Par exemple, la solution0 contient un total de 100 cellules E. coli suspendues dans 10 ml de bouillon nutritif. Si 1 ml de solution0 est enlevé et ajouté à 9 ml de solution saline (diluant1),la nouvelle solution (solution1) contiendrait 1/10e de la concentration initiale d'E. coli. Dans cet exemple, la nouvelle solution (solution1) contiendrait 10 cellules E. coli. Répéter ce processus en supprimant 1 ml de la solution1 et en l'ajoutant à 9 ml de salin (diluant2) donnerait la solution2, contenant seulement une seule cellule E. coli. Étant donné que chaque nouvelle solution (9 mL de diluant et 1 ml de solution) contient un total de 10 mL, nous pouvons conclure que le facteur de dilution pour cette réduction est de 10 ou qu'il s'agissait d'une dilution en série 10 fois(figure 1). Puisque nous avons seulement commencé avec 100 cellules dans cet exemple et nous diluons par un facteur de 10, seulement deux étapes sont nécessaires pour atteindre la concentration minimale absolue de 1 cellule.
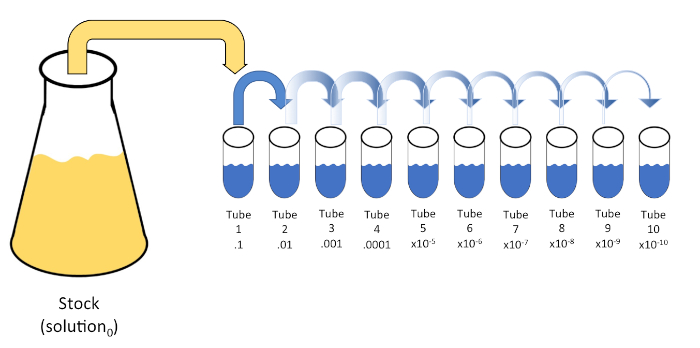
Figure 1 : Dilution en série d'une solution de stock. Un aliquot de 1 ml de la solution de stock (solution0) est ajouté au tube 1 qui contient 9 ml de 0,45% salin (dilent1); le produit de ce mélange est la solution1. Répétez en ajoutant 1 mL de la solution1 nouvellement créée et en l'ajoutant au tube 2. Aliquoting et la résuspension se poursuit de cette façon jusqu'à ce que le tube final est atteint, diluant la concentration du stock par un facteur de 10 chacun à chaque étape. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
La dilution en série est la technique la plus simple pour obtenir des concentrations gérables d'un organisme désiré et elle est complétée par des stries et des diffusions de boîtes de Pétri, seulement deux des nombreuses techniques de placage utilisées par les microbiologistes. Cet avantage de cette approche est que l'expérimentateur peut récolter des souches pures d'une seule espèce ou des souches séparées d'une population mixte (7). Le strage est accompli en introduisant un organisme à un milieu solide (généralement composé d'agarose) qu'il se développera sur si les éléments nutritifs appropriés sont disponibles. Balayer doucement une boucle d'inoculation stérile à travers le milieu (de sorte qu'une strie subtile reste) dans un modèle sinusoïdal rigide distribuera l'organisme proportionnellement à la fréquence de la forme d'onde de l'expérimentateur. Diviser le plat Petri en tiers ou en quarts (quadrant strie) et diminuer la fréquence de chaque strie à mesure qu'une nouvelle région du plat est entrée réduira graduellement le nombre de micro-organismes qui peuvent occuper cette région, produisant des colonies uniques au lieu d'un pelouse bactérienne non quantifiable. Le placage de propagation ne dilue pas en outre les échantillons; un épandeur de verre stérile est utilisé pour distribuer un aliquot de support de suspension sur un plat de pétri entier (figure 2). Les colonies qui poussent sur la plaque de propagation proviennent d'une seule cellule et chaque colonie sur le plat peut être comptée pour estimer le nombre d'unités de formation de colonies par millilitre (CFU) dans une suspension donnée, représentée comme CFU/mL (6) (Figure 3) Agar molle et réplique le placage sont des variations des techniques susmentionnées et permettent l'isolement du bactériophage et du criblage mutant, respectivement (1,7).
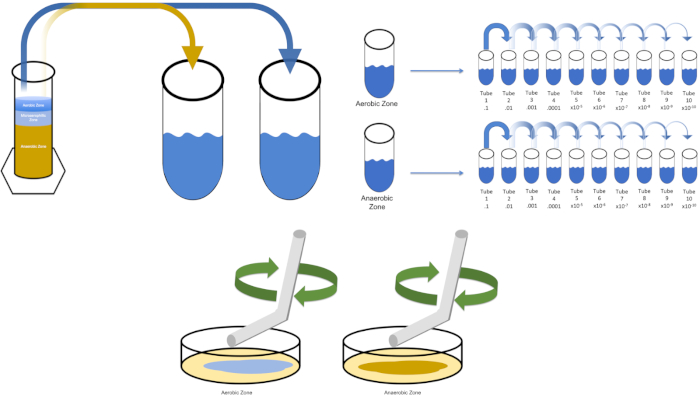
Figure 2 : Stries de plaques pour l'énumération bactérienne et l'isolement des souches. Étiquetez le fond d'un plat de pétri avec des informations d'identification (nom de la bactérie, date, média) et divisez-les en tiers. Après avoir sélectionné une dilution appropriée de l'échantillon de stock, prendre une boucle d'inoculation stérile (jetable ou enflammée) et la submerger le tube à essai (ici, T3). Soulevez légèrement le couvercle de la boîte de Pétri d'un côté de sorte que seule la boucle inoculation puisse accéder à l'agar. Glissez la boucle inoculée sur le dessus des médias d'une manière zig-zag en prenant soin de ne pas compromettre l'agar. Faites pivoter la plaque d'environ 1/3rd (118 degrés) et réduisez la fréquence des mouvements en zigzag. Tournez une dernière fois et réduisez une fois de plus la fréquence des zigzags. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
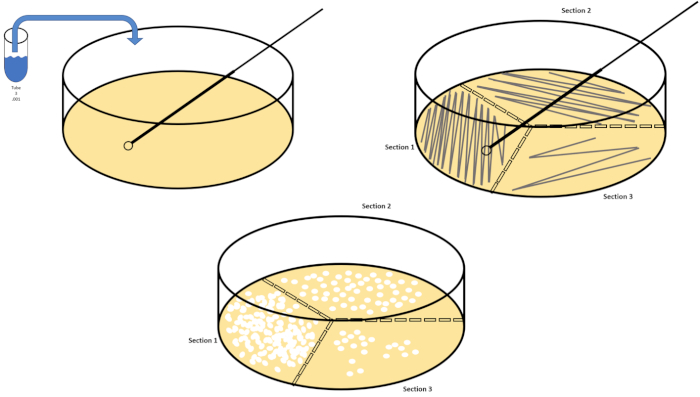
Figure 3 : Placage de propagation. 1 g de la zone aérobie a été resuspendu en T1, puis dilué en série. Un verre stérile ou une tige d'épandage jetable en plastique est utilisé pour distribuer de l'inoculum dans chaque plat. Ceci a été répété avec 1 g de la zone anaérobie. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Comme pour les dilutions en série, une échelle logarithmique est utilisée pour exprimer la concentration de l'organisation. Le nombre de colonies cultivées dans des boîtes de Pétri standard mesurant 100 mm x15 mm peut être énuméré manuellement (ou automatisé à l'aide du traitement computationnel) en identifiant des grappes isolées de croissance. Les comptes qui totalisent moins de 30 ou plus de 300 devraient être définis comme trop peu nombreux à compter (TFTC) ou trop nombreux pour être comptés (TNTC), respectivement. Dans le cas de ce dernier, une dilution en série doit être effectuée pour réduire la concentration avant de restreaking un nouveau plat de pétri. La moyenne du nombre de colonies autonomes identifiées à partir de trois boîtes de Pétri distinctes et la multiplication de la moyenne par le facteur de dilution donneront cFU/mL; tracer le journal10 de CFU/mL contre le temps révélera le temps de génération moyen de l'organisme (7).
Procedure
1. Mise en place
- Un diagramme de débit répertoriant tous les matériaux, le protocole expérimental et la méthode pour jeter les fournitures doivent être écrits dans un cahier de laboratoire et conservés près de l'espace de travail expérimental.
- Les espaces de travail doivent être stérilisés avec un antiseptique approprié (70 % d'éthanol) et l'expérimentateur devrait atténuer le risque de contamination en portant des vêtements de laboratoire propres qui les protègent également contre les anomalies d'exposition. Les vêtements appropriés comprennent, mais ne sont pas limités à une blouse de laboratoire, gants en latex ou nitrile, googles, respirateurs, et chaussures fermées. Il est essentiel de maintenir la technique aseptique en tout temps.
- Préparer 90 ml de 0,45% salin. À l'aide d'un cylindre gradué propre, mesurez 90 ml d'eau stérile et transférez-le sur une flacon Erlenmeyer propre étiqueté0,45% salin. Peser 0,405 g de chlorure de sodium (Sigma-Aldrich NaCl S9888) et l'ajouter au flacon étiqueté 0,45% salin. Tourbillonner à plusieurs reprises jusqu'à ce qu'aucun soluté reste visible.
- Une fois terminé, l'expérimentateur doit re-stériliser toutes les surfaces et jeter tous les organismes indésirables, les stocks de diluants, les boîtes de Pétri ou les boucles isolantes jetables selon les directives de l'OSHA. Les vêtements de laboratoire peuvent être enlevés avant de se laver les mains.
2. Préparation des médias
- Sélectionnez les supports qui conviennent à la culture d'un organisme désiré. Dans la plupart des scénarios, un bouillon permettrait une croissance bactérienne suffisante. Puisque les organismes d'un protocole de Winogradsky sont désirés ici, une colonne composée de carbonate de calcium, de soufre, de cellulose et de boue a été assemblée et laissée intacte pendant 7 jours. La colonne prénommée est séparée en sections aérobies, microaérophiles et anaérobies.
- Choisissez un milieu approprié pour le placage de l'organisme d'intérêt. La supplémentation des médias liquides avec l'agar de qualité de microbiologie est typiquement employée comme agent solidifiant. Lb moyen / agar est suffisant lors de la récolte des échantillons de régions aérobies, microaérophiliques et anaérobies de la colonne prénommée. Remarque : Les échantillons de la région microaphilique n'ont pas été prélevés pour cette procédure. Cependant, ces organismes devraient être cultivés dans des pots de bougie. L'introduction d'une bougie dans cette chambre de culture avant l'étanchéité crée un environnement à faible teneur en oxygène qui convient à la prolifération microaphilique.
- Puisque nous souhaitons préparer 250 ml, utiliser 500 ml (ou plus) flacons Erlenmeyer pour empêcher l'ébullition lors de l'autoclacage. Étiquetez un "Broth" et l'autre "Agar".
- Déterminez la quantité de supports nécessaires pour créer chaque solution en suivant les recommandations de concentration du fabricant. LB Agar, utilisé ici, est préparé en combinant 25g/L avec de l'eau ultrapure. Notre volume de 250 ml nécessite une solution de 6,25 LB Agar/250 ml d'eau. De même, LB Broth est préparé en combinant le même rapport de LB Broth et d'eau. Comme il n'est pas complété par un agent solidifiant, il ne durcira pas lorsqu'il est refroidi.
- Pesez les supports et mélangez-les avec de l'eau dans des proportions conformes aux recommandations du fabricant. Ajouter 6,25 g de LB Agar sur un flacon étiqueté « Agar », et 6,25 g de LB Broth à un flacon étiqueté « Broth ». Ajouter 250 ml d'eau ultrapure à chaque flacon.
- Envelopper le papier d'aluminium sur chaque flacon et utiliser un autoclave pour stériliser les supports pendant au moins 15 minutes à 121 oC, 15 psi.
- À l'aide d'un gant ou d'un tampon résistant à la chaleur, retirez les flacons de l'autoclave lorsque le cycle est terminé et placez-les dans un bain d'eau de 40 à 50 oC.
- Une fois la température appropriée atteinte, versez le contenu du flacon étiqueté «Broth» dans un Erlenmeyer de 250 ml, ou flacon à fond rond. Étiqueter le flacon de 250 ml "solution0".
- Obtenez des boîtes de Pétri stériles de 10, 100 mm x 15 mm et étiquetez-les avec la date, le nom, le type de support utilisé et la zone de colonne Winogradsky dont les organismes seront récoltés.
- Retirer le flacon étiqueté "Agar" du bain d'eau et commencer à verser dans chacun des 10 plats de pétri. Il ne faut pas ajouter plus de 15 ml à chaque plat. Ceci peut également être exécuté avec un pipettor et une pipette sérologique de 25 ml pour améliorer la précision. Utilisez une pointe de pipette stérile pour enlever les bulles présentes, puis couvrez avec les couvercles de plaque et laissez se solidifier toute la nuit.
3. Préparation diluante
- Préparer dix tubes à essai capables de stocker 20 ml ou plus dans un rack et les étiqueter T1-T10. Chaque numéro de tube est compatible avec le facteur de dilution qu'il correspond (c.-à-d. T4 1x10-4 ou 0,0001 ou 1/10 000e de concentration de stock).
- Pipet 9 ml de 0,45% salin dans chacun des 10 tubes à essai.
- Les blancs salins sont maintenant prêts à être stérilisés par autoclave. Utilisez du papier d'aluminium pour recouvrir chacun des 10 tubes à essai, puis transférez-les dans un support de tube à essai compatible autoclave. Stériliser pendant au moins 15 minutes à 121 oC, 15 psi.
- Retirer les blancs à l'aide de gants résistants à la chaleur et laisser refroidir. Couvrir et conserver à 4 oC jusqu'à ce que les tubes aient atteint la température ambiante ou au toucher.
4. Cultivation de l'organisme cible
- Inoculer la « solution0» avec une seule colonie à partir d'une plaque précédemment striée ou 50 l d'un stock congelé. Laissez le temps à l'organisme cible de se répliquer en plaçant la « solution0» inoculée dans un incubateur de 37 oC pendant la nuit en secouant (si nécessaire). (Remarque : Le flacon doit être recouvert pour éviter la contamination. Si l'organisme cible est aérobie, utilisez de la gaze stérile et des bouchons de coton pour prévenir la contamination. Si l'évaluation des régions de la colonne Winogradsky, il suffit de retirer 1 gramme de chaque zone désirée (aérobie et anaérobie aux fins de cette étude) et de suspendre à nouveau en T1 avant de passer à l'étape 5.3.
5. Dilution en série
- Obtenir le flacon étiqueté « bouillon nutritif » de l'incubateur et secouer vigoureusement.
- Pipet 1 mL de "solution0"dans le tube à essai étiqueté T1. Vortex T1. Si vous évaluez les explantations Winogradsky, pesez 1 gramme de la zone désirée et ajoutez-la à T1 avant le vortex. (Remarque : 1 mL est utilisé ici pour la simplicité - des volumes plus petits ou plus grands de diluant peuvent également être utilisés).
- Retirer 1 ml du tube à essai T1 et l'ajouter au tube à essai T2. Vortex T2.
- Retirer 1 ml du tube à essai T2 et l'ajouter au tube à essai T3. Vortex T3.
- Retirer 1 ml du tube à essai T3 et l'ajouter au tube à essai T4. Vortex T4.
- Retirer 1 ml du tube à essai T4 et l'ajouter au tube à essai T5. Vortex T5.
- Retirer 1 ml du tube à essai T5 et l'ajouter au tube à essai T6. Vortex T6.
- Retirer 1 ml du tube à essai T6 et l'ajouter au tube à essai T7. Vortex T7.
- Retirer 1 ml du tube à essai T7 et l'ajouter au tube à essai T8. Vortex T8.
- Retirer 1 ml du tube à essai T8 et l'ajouter au tube à essai T9. Vortex T9.
- Retirer 1 mL du tube à essai T9 et l'ajouter au tube à essai T10.
6. Spread Plating
- Pipet 100 l d'un échantillon dilué de T1 directement sur un plat de pétri. Cette étape peut être, mais n'a pas besoin d'être, répétée pour chaque tube.
- Obtenir une tige d'épandage stérile et jetable ou une flamme stériliser une tige de diffusion de verre. Dans le sens des aiguilles d'une montre/dans le sens inverse des aiguilles d'une montre, faites glisser la partie horizontale de la tige de propagation pour répartir également l'échantillon dans la boîte de Pétri.
- Répétez l'opération pour chaque zone de la colonne Winogradsky qui doit être évaluée.
- Incuber les plaques dans un incubateur à 37 oC pendant 24 heures. Pour les organismes anaérobies, utilisez une chambre anaérobie.
7. Streaking
- Sélectionnez une dilution appropriée de votre organisme cible. Par exemple, la solution4 donnera une dilution 1/10,000e de votre concentration initiale. En règle générale, les dilutions de 1/1 000e (T3/Solution), de 1/1 000 000e (T6/Solution6) et de 1/1 000 000 000e (T9/Solution9) sont évaluées pour énumérer les microbes.
- À l'aide d'une boucle d'isolation jetable en plastique stérile ou d'une boucle d'inoculation métallique réutilisable qui est sous le feu depuis au moins 10 secondes, plongez dans la solution désirée à partir de l'étape 5. Les boucles isolantes calibrées doivent transférer 0,01 ml. (Attention : Ne laissez pas la boucle en flammes contacter les bactéries immédiatement après avoir retiré de la chaleur)
- Soulevez légèrement le couvercle de la boîte de Pétri d'un côté de sorte que seule la boucle inoculation puisse accéder à l'agar. Glissez la boucle inoculée sur le dessus des médias d'une manière zig-zag en prenant soin de ne pas compromettre l'agar. Baisser le couvercle de la boîte.
- Utilisez une nouvelle boucle d'isolation jetable ou re-stérilisez votre boucle réutilisable.
- Faites pivoter la plaque d'environ 1/3rd (118 degrés) et réduisez la fréquence des mouvements en zigzag.
- Encore une fois, utilisez une nouvelle boucle jetable ou re-stériliser une boucle métallique avant de tourner une dernière fois et de réduire la fréquence en zigzag une fois de plus. Baisser le couvercle de la boîte.
- Répéter les étapes 7.2 - 7.6 jusqu'à ce qu'au moins trois boîtes de Pétri aient été stries pour trois dilutions différentes, à l'aide d'une nouvelle boucle jetable ou en réflammant une boucle réutilisable (Figure 2).
- Placer les boîtes de Pétri striées dans un incubateur à 37 oC pendant la nuit. Pour les organismes anaérobies, utilisez une chambre anérobique.
8. Analyse des données et résultats
- Les cultures ont été récoltées dans les zones oxiques et anoxiques d'une colonne Winogradsky de 7 jours. Ces zones conviennent respectivement aux anaeves hétérotrophes et oxydantes du fer.
- Les explants de colonnes ont été dilués en série avant de strier ou de se propager sur les plaques lb-agar.
- Streaking a révélé une population mixte de chacune des zones Winogradsky évaluée. Les plaques d'étalement ont produit des résultats similaires.
- Pour calculer l'UFC/mL ou l'UC/g, moyenne du nombre de colonies comptées à partir de trois plaques. Multipliez le nombre moyen de colonies par le facteur de dilution et divisez par la quantité indiquée. Par exemple, si une moyenne de 65 colonies était comptée sur des plaques inoculées avec 0,1 ml de solution6 (T6), la formule décrite précédemment équivaudrait à 650 000 000 CFU/mL.
- Les colonies isolées peuvent maintenant être choisies dans chaque plaque pour être utilisées dans des essais d'enrichissement afin de déterminer l'identité de l'espèce.
Parfois, afin d'identifier et d'étudier les bactéries, nous devons d'abord les isoler et les enrichir à partir d'un échantillon. Par exemple, les échantillons obtenus à partir d'une colonne Winogradsky sont mélangés, ce qui signifie qu'ils contiennent plusieurs espèces ou souches de bactéries, de sorte que l'étude d'une bactérie individuelle ou l'énumération des différents types présents peuvent être difficiles. À cette fin, des techniques de dilution et de placage en série sont généralement utilisées pour quantifier de façon fiable la charge bactérienne et isoler les colonies individuelles.
La dilution en série est un processus par lequel la concentration d'un organisme, les bactéries dans cet exemple, est systématiquement réduite par la résuspension successive dans les volumes fixes de diluant liquide. Habituellement, le volume du diluant est un multiple de 10 pour faciliter la réduction logarithmique de l'organisme échantillon. Par exemple, un gramme de sédimenteste est d'abord retiré de la zone d'intérêt de Winogradsky et ajouté à 10 millilitres d'un milieu liquide approprié. Ensuite, un millilitre de cette première dilution est ajouté à un autre tube contenant neuf millilitres de milieu. Le processus peut être répété jusqu'à ce que plusieurs concentrations différentes de bactéries ont été préparées. La dilution en série est la clé de l'énumération des bactéries dans cet exemple, puisque les échantillons mélangés d'une colonne Winogradsky contiennent un nombre inconnu, souvent important, de bactéries.
Ensuite, le placage et le placage de propagation permettent l'isolement et l'énumération des bactéries dans un échantillon, respectivement. Le strage est accompli en introduisant un échantillon dilué dans une section du milieu solide complétée par des éléments nutritifs, qui sont divisés en tiers. Cet inoculum est ensuite réparti sur chaque tiers de la plaque en zigzag. Comme différentes sections de la plaque sont striées, traversant de l'échantillon précédent qu'une seule fois, l'échantillon est réparti plus finement. Cela signifie que vous n'aurez peut-être besoin que de strier d'une dilution pour atteindre des colonies individuelles dans les sections ultérieures. Après l'incubation, les plaques stries permettent d'observations de la morphologie des colonies, des informations qui peuvent aider à différencier les différentes espèces bactériennes.
Alternativement, si l'objectif principal est l'énumération des bactéries dans le placage de propagation de l'échantillon peut être utilisé. Dans le placage de propagation, un aliquot d'un seul échantillon est réparti uniformément sur toute la surface du milieu solide. Typiquement, parce que nous ne connaissons pas les nombres bactériens dans l'échantillon mélangé, une plaque de propagation est faite pour chacune des dilutions ou un échantillon représentatif d'entre eux. Après l'incubation, l'énumération peut être effectuée à l'aide de ces plaques de propagation. Toutes les plaques dont le nombre de colonies est inférieur à 30 doivent être jetées, car les petits dénombrements sont sujets à une plus grande erreur. De même, tout dénombrement de plus de 300 devrait être éliminé parce que l'encombrement des colonies et le chevauchement peuvent conduire à une sous-estimation du nombre de colonies. Si le nombre de la colonie de chacun de ces plats restants est enregistré et multiplié par le facteur de dilution, puis divisé par le volume plaqué, cela donne à la colonie formant des unités, ou CfUs, par millilitre de suspension. Dans cette vidéo, vous apprendrez comment évaluer qualitativement et quantitativement un échantillon contenant une bactérie connue, et les communautés microbiennes contenues dans diverses régions d'une colonne Winogradsky par dilution en série, placage de propagation, et placage de stries.
Tout d'abord, mettez tout équipement de protection individuelle approprié, y compris une blouse de laboratoire, des gants et des lunettes. Ensuite, stérilisez l'espace de travail avec 70% d'éthanol et essuyez la surface. Ensuite, rassemblez deux flacons Erlenmeyer de 500 millilitres et étiquetez un bouillon et l'autre agar. Pour préparer la solution lb agar, mélanger environ 6,25 grammes de gélose LB, trois grammes d'agar technique, et 250 millilitres d'eau distillée dans la flasque étiquetée agar.
Ensuite, préparer le bouillon LB en combinant 2. 5 grammes de support LB et 100 millilitres d'eau distillée dans le bouillon étiqueté flacon. Après l'autoclacage des flacons, utilisez un gant résistant à la chaleur pour enlever les flacons de l'autoclave et placez-les dans un bain d'eau de 40 à 50 degrés Celsius. Une fois que les flacons sont de 50 degrés Celsius, préparer soigneusement trois aliquots de 100 millilitres de la solution de bouillon et étiqueter chaque solution aliquot zéro. Ensuite, rassemblez 10 boîtes stériles de petri et étiquetez-les avec la date, le nom, le type de support utilisé, et la zone de colonne de Winogradsky que les organismes seront récoltés à partir. Pipette 15 millilitres d'agar de la flacon d'agar dans chaque plat de Petri. Ensuite, utilisez la pointe de pipette pour enlever les bulles, remplacer les couvercles de plaque, et leur permettre de se solidifier sur le dessus du banc pendant la nuit.
Le lendemain, essuyez le dessus du banc avec 70% d'éthanol. Ensuite, étiquetez 10 tubes à essai de 20 millilitres T1 à T10 et placez-les dans un rack. Pipette neuf millilitres de 0,45% salin dans chaque tube. Maintenant, couvrez chacun des 10 tubes d'essai lâchement avec leurs bouchons et transférez-les à un support de tube à essai autoclave-compatible. Une fois le cycle terminé, retirer les blancs salins à l'aide de gants résistants à la chaleur et leur permettre de refroidir. Conservez les tubes à température ambiante jusqu'à ce qu'ils atteignent environ 22 degrés Celsius.
Pour cultiver un organisme cible connu, E. coli dans cet exemple, inoculer 100 millilitres de solution zéro avec une seule colonie d'une plaque précédemment strié. Ensuite, couvrez le tube et incubez-le pendant la nuit à 37 degrés Celsius. Pour évaluer les régions d'une colonne Winogradsky, ajouter environ un gramme de matière de la zone aérobie à T1 et resuspendre par vortexing. Ensuite, répétez ce processus avec un gramme de matériau de la zone anaérobie.
Retirez le tube contenant la solution zéro inoculée avec E. coli de l'incubateur et secouez-le. Ensuite, pipette un millilitre de la solution dans un tube à essai T1 et vortex à mélanger. Retirez un millilitre de solution de T1 et transférez-le à T2, vortexing pour mélanger. Répétez ce processus par tube T10. Pour évaluer les zones aérobies et anaérobies de la colonne Winogradsky, retirez un millilitre de solution de chacun des tubes T1 préalablement préparés et transférez-la aux tubes T2 appropriés. Ensuite, continuez les dilutions en série à travers les tubes T10 comme indiqué précédemment.
Pour étaler la plaque, pipette 100 microlitres de l'échantillon dilué de chaque tube T3 sur le plat de petri correspondant. Ensuite, utilisez une tige d'épandage stérile pour distribuer délicatement l'échantillon sur le plat de Petri et remplacer le couvercle de l'assiette. Répétez ce processus pour les dilutions T6 et T9, comme précédemment démontré. Incuber les plaques contenant des organismes aérobies dans un incubateur de 37 degrés Celsius pendant 24 heures. Incuber les plaques contenant des organismes anaérobies dans une chambre anaérobie fixée à 37 degrés Celsius pendant 24 heures. Le lendemain, retirez les plaques de dilution T3, T6 et T9 de l'incubateur et de la chambre anaérobie et transférez-les sur le banc. En travaillant avec une plaque à la fois, faites glisser une boucle inoculation stérile sur le dessus des médias en zigzag. Ensuite, remplacez le couvercle de la boîte à pétri. Ensuite, faites pivoter la plaque par 1/3 et stérilisez la boucle pour réduire la fréquence du motif en zigzag déjà fait. Encore une fois, après avoir stérilisé la boucle, faites pivoter la plaque de 1/3, réduisez la fréquence du motif en zigzag une dernière fois et remplacez le couvercle. Répétez cette méthode de stries pour les plaques restantes, comme indiqué précédemment. Ensuite, placez les plaques striées contenant des organismes aérobies dans un incubateur de 37 degrés Celsius pendant la nuit et les plaques striées contenant des organismes anaérobies dans une chambre anaérobie fixée à 37 degrés Celsius pendant la nuit.
Les cultures ont été récoltées dans les zones aérobies et anaérobies d'une colonne Winogradsky de sept jours. Ensuite, les cultures ont été diluées en série avant de strier et de se répandre sur des plaques d'agar LB. Streaking a révélé une population mixte de chacune des zones Winogradsky évaluées, et les plaques de propagation ont produit des résultats similaires. Une plaque strié d'une population mixte se traduira par des colonies bactériennes de différentes formes, tailles, textures et couleurs. En revanche, les plaques stries et répandues contenant l'organisme connu, E. coli, ont démontré une population homologue. En général, il est préférable de calculer les UFC par millilitre en utilisant le nombre moyen de colonies de trois plaques réparties avec le même échantillon et le même facteur de dilution. Multipliez le nombre moyen de colonies par le facteur de dilution et divisez par la quantité indiquée. Enfin, les colonies isolées choisies dans chaque plaque peuvent être utilisées dans d'autres essais d'enrichissement pour déterminer l'identité de l'espèce.
Applications and Summary
L'énumération bactérienne et l'isolement des souches par placage exigent des concentrations gérables d'organismes cibles. Le placage réussi est donc subordonné à une dilution en série. En tant que tel, les techniques susmentionnées restent la pierre angulaire de l'examen microbiologique et de l'expérimentation. Bien que simple par la conception, les facteurs de dilution et la technique de placage peuvent être modifiés par l'expérimentateur pour renforcer les résultats sans compromettre l'intégrité de chaque méthode. Tracer les quatre phases de la croissance bactérienne peut être utile lors de la caractérisation des microbes désirés. Ces phases, le décalage, le journal, l'stationnaire et la mort sont marqués par des changements dans la réplication bactérienne. La phase de décalage présente une croissance lente due à l'adaptation physiologique, la phase de notation est la période de prolifération maximale avec une augmentation exponentielle des cellules viables, la phase stationnaire est alors atteinte en raison des limitations environnementales et des accumulations de toxines, avant la phase de mort où le nombre de cellules commence à tomber. Ceci peut être accompli en diluant en série (ou en diluant en 1 étape pour éviter la confusion) Solution0 toutes les heures pendant un total de 8 heures, commençant à l'heure0 (La solution0 doit être retournée à un incubateur secouant après chaque dilution). Calculez le journal10 de CFU/ml pour un seul diluant du temps0 et tracez sur l'axe Y. Répétez ce calcul pour l'échantillon Temps1 (assurez-vous de calculer CFU/mL en utilisant le même facteur de dilution que Time0). Répétez jusqu'à chaque fois (Temps1-Temps8) sont tracés sur l'axe X.
References
- Allen, M.E., Gyure, R.A. (2013) An Undergraduate Laboratory Activity Demonstrating Bacteriophage Specificity. Journal of Microbial Biological Education 14: 84-92.
- Ben-David, A., Davidson, C.E. (2014) Estimation Method for Serial Dilution Experiments. Journal of Microbiological Methods 107:214-221.
- Goldman, E., Green, L.H. (2008) Practical Handbook of Microbiology.
- Koch, R. (1883) New Research Methods for Detection of Microcosms in Soil, Air and Water.
- Lederberg, J., Lederberg, E.M. (1952) Replica Plating and Indirect Selection of Bacterial Mutants. Journal of Bacteriology 63:399-406
- Pepper, I., Gerba, C., Ikner, L. (2019) Bacterial Growth Curve Analysis and its Environmental Changes. JoVE Science Education Database. Environmental Microbiology.
- Sanders., E.R. (2012) Aseptic Laboratory Technique: Plating Methods. JoVE 63:e3063.




