Overview
Fuente: Jonathan F. Blaize1, Elizabeth Suter1y Christopher P. Corbo1
1 Departamento de Ciencias Biológicas, Wagner College, 1 Campus Road, Staten Island NY, 10301
La evaluación cuantitativa de los prokaryotes puede ser onerosa dada su abundancia, propensión a la proliferación exponencial, diversidad de especies dentro de una población y necesidades fisiológicas específicas. Acomenda este desafío, está la naturaleza de cuatro fases en la que las bacterias se replican (retraso, registro, estacionario y muerte). La capacidad de estimar con precisión la concentración de microorganismos es necesaria para una identificación, aislamiento, cultivo y caracterización exitosas (6). Como tal, los microbiólogos han empleado la dilución en serie y diversas técnicas de chapado durante más de un siglo para cuantificar de forma fiable la carga bacteriana y viral en entornos clínicos, industriales, farmacéuticos y académicos de laboratorio (2,4,6). Las descripciones de esta metodología aparecieron por primera vez en 1883 cuando el científico y médico alemán Robert Koch publicó su trabajo sobre agentes causantes de enfermedades infecciosas (2). A menudo conocido como el padre de la bacteriología moderna, las técnicas de Koch se han convertido en el estándar de oro para la enumeración de microorganismos, cultivables o de otro tipo, en todo el mundo.
La dilución en serie es una reducción sistemática de una entidad conocida o desconocida (un soluto, organismo, etc.) mediante la resuspensión sucesiva de una solución inicial (solución0)en volúmenes fijos de un diluyente líquido (en blanco). Estos espacios en blanco suelen consistir en 0,45% de salina, aunque la composición puede ser variada (7). Mientras que un experimentador puede elegir cualquier volumen para cada diluyente, más a menudo es un múltiplo de 10, facilitando la reducción logarítmica de la muestra. Por ejemplo, la solución0 contiene un total de 100 células de E. coli suspendidas en 10 ml de caldo nutritivo. Si se retira 1 ml de la solución0 y se añade a 9 ml de solución salina (diluyente1), la nueva solución (solución1) contendría 1/10de la concentración inicial de E. coli. En este ejemplo, la nueva solución (solución1) contendría 10 células de E. coli. Repetir este proceso eliminando 1 ml de la solución1 y añadiéndola a otros 9 ml de solución salina (diluyente2)produciría la solución2,que contiene sólo una sola célula de E. coli. Dado que cada nueva solución (9 ml de diluyente + 1 ml de solución) contiene un total de 10 ml, podemos concluir que el factor de dilución para esta reducción es de 10 o que se trataba de una dilución serial de 10 veces(Figura 1). Puesto que sólo comenzamos con 100 células en este ejemplo y nos estamos diluyendo por un factor de 10, sólo se requieren dos pasos para alcanzar la concentración mínima absoluta de 1 célula.
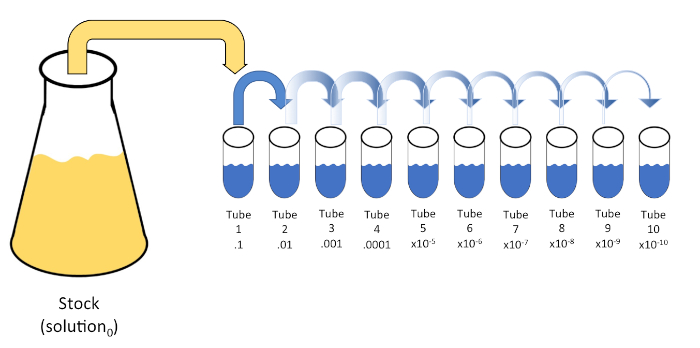
Figura 1: Dilución en serie de una solución de stock. Se añade una alícuota de 1 ml de la solución en stock (solución0) al tubo 1 que contiene 9 ml de solución salina al 0,45% (dilent1); el producto de esta mezcla es la solución1. Repita alístique1 ml de la solución recién creada1 y agregándola al tubo 2. La alícuota y la resuspensión continúan de esta manera hasta que se alcanza el tubo final, diluyendo la concentración de stock por un factor de 10 cada uno con cada paso. Haga clic aquí para ver una versión más grande de esta figura.
La dilución en serie es la técnica más sencilla para obtener concentraciones manejables de un organismo deseado y se complementa con el rayado y la propagación de la placa de petri, sólo dos de las muchas técnicas de chapado utilizadas por los microbiólogos. Este beneficio de este enfoque es que el experimentador puede cosechar cepas puras de una sola especie o cepas separadas de una población mixta (7). El rayado se logra introduciendo un organismo en un medio sólido (generalmente consistente en agarosa) sobre el que crecerá si se dispone de los nutrientes adecuados. Barrer suavemente un bucle inoculante estéril a través del medio (de modo que quede una racha sutil) en un patrón sinusoidal rígido distribuirá el organismo proporcionalmente a la frecuencia de la forma de onda del experimentador. Dividir la placa Petri en tercios o cuartos (racha de cuadrante) y disminuir la frecuencia de cada racha a medida que se introduce una nueva región del plato reducirá gradualmente el número de microorganismos que pueden ocupar esa región, produciendo colonias únicas en lugar de una césped bacteriano incuantificable. El revestimiento extendido no diluye además las muestras; un esparcidor de vidrio estéril se utiliza para distribuir una alícuota de medios de suspensión a través de un plato de petri completo(Figura 2). Las colonias que crecen en la placa de propagación surgen de una sola célula y cada colonia en el plato se puede contar para estimar el número de unidades formadoras de colonias por mililitro (CFU) en una suspensión dada, representada como CFU/mL (6)(Figura 3) Agar suave y réplica El revestimiento son variaciones de las técnicas antes mencionadas y permiten el aislamiento de bacteriófagos y cribado mutante, respectivamente (1,7).
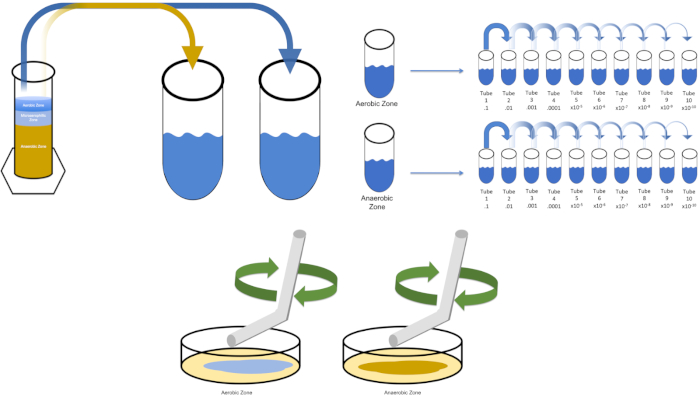
Figura 2: Rayado de placas para la enumeración bacteriana y aislamiento de deformación unitaria. Etiquete la parte inferior de una placa de petri con información de identificación (nombre de bacteria, fecha, medios) y divídala en tercios. Después de seleccionar una dilución adecuada de la muestra de stock, tome un bucle de inoculado estéril (desechable o flameado) y sumerja el tubo de ensayo (aquí, T3). Levante ligeramente la cubierta de la placa de petri en un lado para que sólo el bucle inoculado pueda acceder al agar. Deslice el bucle inoculante a través de la parte superior de los medios de comunicación de una manera en zig-zag teniendo cuidado de no comprometer el agar. Gire la placa aproximadamente 1/3rd (118o) y reduzca la frecuencia del movimiento en zig-zag. Gire una última vez y reduzca la frecuencia en zig-zag una vez más. Haga clic aquí para ver una versión más grande de esta figura.
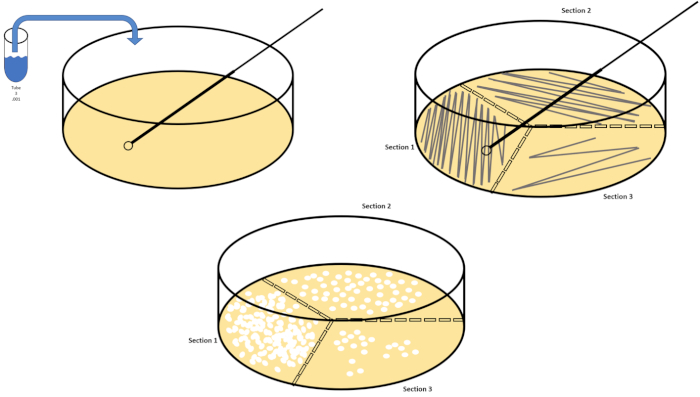
Figura 3: Extender el revestimiento. 1 g de la zona aeróbica se resuspendió en T1 y luego se diluyó en serie. Para distribuir el inóculo por cada plato se utiliza una varilla de esparcimiento desechable de vidrio estéril o plástico para distribuir el inóculo. Esto se repitió con 1 g de la zona anaeróbica. Haga clic aquí para ver una versión más grande de esta figura.
Al igual que con las diluciones en serie, se emplea una escala logarítmica para expresar la concentración del organismo. El número de colonias cultivadas en platos de petri estándar de 100 mm x 15 mm se puede enumerar manualmente (o automatizar con la ayuda del procesamiento computacional) mediante la identificación de racimos aislados de crecimiento. Cuenta que el total de menos de 30 o más de 300 debe definirse como demasiado pocos para contar (TFTC) o demasiado numerosos para contar (TNTC), respectivamente. En el caso de este último, se debe realizar una dilución en serie para reducir la concentración antes de volver a rayar una nueva placa de petri. Promediar el número de colonias autónomas identificadas a partir de tres platos de petri separados y multiplicar la media por el factor de dilución producirá CFU/ml; trazando el registro10 de CFU/ml contra el tiempo revelará el tiempo medio de generación del organismo (7).
Procedure
1. Configuración
- Un diagrama de flujo con una lista de todos los materiales, un protocolo experimental escalonado y un método para desechar suministros deben escribirse en un cuaderno de laboratorio y mantenerse cerca del espacio de trabajo experimental.
- Los espacios de trabajo deben esterilizarse con un antiséptico adecuado (70% etanol) y el experimentador debe mitigar el riesgo de contaminación mediante el uso de prendas de laboratorio limpias que también los protejan de anomalías de exposición. Las prendas adecuadas incluyen, entre otras, un abrigo de laboratorio, guantes de látex o nitrilo, googles, respiradores y zapatos cerrados. Es fundamental mantener la técnica aséptica en todo momento.
- Preparar 90 ml de 0,45% de salina. Usando un cilindro graduado limpio, mida 90 ml de agua estéril y transfiéralo a un matraz Erlenmeyer limpio etiquetado 0.45% solución salina. Pesar .405 g de cloruro sódico (Sigma-Aldrich NaCl S9888) y añadirlo al matraz etiquetado 0,45% de solución salina. Gire repetidamente hasta que no quede visible ningún soluto.
- Una vez completado, el experimentador debe volver a esterilizar todas las superficies y descartar cualquier organismo no deseado, existencias de diluyentes, platos de petri o bucles de inoculación desechables de acuerdo con las directrices de la OSHA. Las prendas de laboratorio se pueden quitar antes de lavarse las manos.
2. Preparación de medios
- Seleccione los medios que sean apropiados para el cultivo de un organismo deseado. En la mayoría de los escenarios, un caldo permitiría un crecimiento bacteriano suficiente. Dado que aquí se desean organismos de un protocolo Winogradsky, una columna que consiste en carbonato de calcio, azufre, celulosa y barro se ensambló y se dejó sin perturbaciones durante 7 días. La columna de nombre anterior se separa en secciones aeróbicas, microaerofílicas y anaeróbicas.
- Elija un medio apropiado para enchapar el organismo de interés. La suplementación de medios líquidos con agar de grado microbiológico se emplea típicamente como un agente solidificante. El medio/agar LB es suficiente cuando se cosechan muestras de regiones aeróbicas, microaerófilas y anaeróbicas de la columna con nombre anterior. Nota: Para este procedimiento no se cosecharon muestras de la región microaeroófila. Sin embargo, estos organismos deben ser cultivados en frascos de velas. La introducción de una vela a esta cámara de cultivo antes de sellar crea un ambiente de bajo oxígeno que es adecuado para la proliferación microaerofílica.
- Dado que deseamos preparar 250 ml, utilice frascos Erlenmeyer de 500 ml (o más) para evitar la ebullición al autoclave. Etiqueta un "Caldo" y el otro "Agar".
- Determine la cantidad de medios necesarios para crear cada solución siguiendo las recomendaciones de concentración del fabricante. El agar LB, utilizado aquí, se prepara combinando 25g/L con agua ultrapura. Nuestro volumen de 250 ml requiere una solución de 6,25 LB Agar/250 ml de agua. Del mismo modo, el caldo LB se prepara combinando la misma proporción de caldo LB y agua. Puesto que no se complementa con un agente solidificante, no se endurecerá cuando se enfríe.
- Pesar el medio y mezclarlo con agua en proporciones consistentes con las recomendaciones del fabricante. Agregue 6.25g de agar LB a un matraz etiquetado como "Agar", y 6.25g de caldo LB a un matraz etiquetado como "Broth". Añadir 250 ml de agua ultrapura a cada matraz.
- Envuelva la lámina de aluminio sobre cada matraz y utilice un autoclave para esterilizar los medios durante un mínimo de 15 minutos a 121oC, 15 psi.
- Con un guante o almohadilla resistente al calor, retire los matraces del autoclave cuando el ciclo esté completo y colóquelos en un baño de agua de 40-50 oC.
- Una vez alcanzada la temperatura adecuada, vierta el contenido del matraz etiquetado como "Broth" en un Erlenmeyer de 250 ml, o matraz de fondo redondo. Etiquetar el matraz de 250 ml "solución0".
- Obtenga 10, 100 mm x 15 mm de platos de petri estériles y etiquételos con la fecha, el nombre, el tipo de medio utilizado y la zona de columna de Winogradsky de la que se cosecharán los organismos.
- Retire el matraz etiquetado como "Agar" del baño de agua y comience a verter en cada uno de los platos de 10 petri. No se deben añadir más de 15 ml a cada plato. Esto también se puede realizar con un pipetador y una pipeta serológica de 25 ml para mejorar la precisión. Use una punta de pipeta estéril para eliminar las burbujas presentes, y luego cubra con las tapas de la placa y deje que se solidifique durante la noche.
3. Preparación diluyente
- Prepare diez tubos de ensayo capaces de almacenar 20 ml o más en un bastidor y etiquételos T1-T10. Cada número de tubo es coherente con el factor de dilución al que corresponde (es decir, T4 a 1x10-4 o 0,0001 o 1/10.000 de concentración de stock).
- Pipet 9 mL de 0.45% salina en cada uno de los 10 tubos de ensayo.
- Los espacios en blanco salinos ahora están listos para ser esterilizados por autoclave. Utilice papel de aluminio para cubrir cada uno de los 10 tubos de ensayo y luego transfieralos a un bastidor de tubo de ensayo compatible con autoclave. Esterilice durante un mínimo de 15 minutos a 121oC, 15 psi.
- Retire los espacios en blanco con guantes resistentes al calor y deje enfriar. Cubra y almacene a 4oC hasta que sea necesario cuando los tubos hayan alcanzado la temperatura ambiente, o cuando se enfríen al tacto.
4. Cultivo de organismo objetivo
- Inocular la "solución0"con una sola colonia a partir de una placa previamente rayada o de 50 ml de una culata congelada. Permita que el organismo objetivo se replique colocando la "solución0"inoculada en una incubadora de 37oC durante la noche con temblores (si es necesario). (Nota: El matraz debe estar cubierto para evitar la contaminación. Si el organismo objetivo es aeróbico, utilice gasas estériles y tapones de algodón para evitar la contaminación. Si evalúa las regiones de la columna Winogradsky, simplemente retire 1 gramo de cada zona deseada (aeróbico y anaeróbico a los efectos de este estudio) y vuelva a suspender en T1 antes de continuar con el paso 5.3.
5. Dilución en serie
- Obtenga el matraz etiquetado como "Caldo nutritivo" de la incubadora y agite vigorosamente.
- Pipet 1 mL de "solución0"en el tubo de ensayo etiquetado T1. Vórtice T1. Si evalúa los explantes de Winogradsky, pese 1 gramo de la zona deseada y agréguelo a La T1 antes del vórtice. (Nota: 1 mL se utiliza aquí para la simplicidad- volúmenes más pequeños o más grandes de diluyente también se pueden utilizar).
- Retire 1 ml del tubo de ensayo T1 y agréguelo al tubo de ensayo T2. Vórtice T2.
- Retire 1 ml del tubo de ensayo T2 y agréguelo al tubo de ensayo T3. Vórtice T3.
- Retire 1 ml del tubo de ensayo T3 y agréguelo al tubo de ensayo T4. Vortex T4.
- Retire 1 ml del tubo de ensayo T4 y agréguelo al tubo de ensayo T5. Vórtice T5.
- Retire 1 ml del tubo de ensayo T5 y agréguelo al tubo de ensayo T6. Vortex T6.
- Retire 1 ml del tubo de ensayo T6 y agréguelo al tubo de ensayo T7. Vortex T7.
- Retire 1 ml del tubo de ensayo T7 y agréguelo al tubo de ensayo T8. Vortex T8.
- Retire 1 ml del tubo de ensayo T8 y agréguelo al tubo de ensayo T9. Vortex T9.
- Retire 1 ml del tubo de ensayo T9 y agréguelo al tubo de ensayo T10.
6. Revestimiento de propagación
- Pipet 100 l de una muestra diluida de T1 directamente sobre una placa de petri. Este paso puede ser, pero no necesita ser, repetido para cada tubo.
- Obtener una varilla de propagación estéril y desechable o una llama esterilizar una varilla de esparcimiento de vidrio. En un movimiento en el sentido de las agujas del reloj/en el sentido contrario a las agujas del reloj, deslice la parte horizontal de la varilla de propagación para distribuir equitativamente la muestra dentro de la placa petri.
- Repita el proceso para cada zona de la columna Winogradsky que se va a evaluar.
- Incubar placas en una incubadora de 37oC durante 24 horas. Para organismos anaeróbicos, utilice una cámara anaeróbica.
7. Streaking
- Seleccione una dilución adecuada de su organismo objetivo. Por ejemplo, la solución4 producirá una dilución 1/10.000 de su concentración inicial. Normalmente, las diluciones de 1/1.000th (T3/Solution), 1/1.000.000th (T6/Solution6) y 1/1,000,000 th (T9/Solution9)se evalúan para enumerar microbios.
- Usando un lazo de inoculado desechable estéril de plástico o un bucle de inoculado de metal reutilizable que ha estado bajo fuego durante no menos de 10 segundos, sumerja en la solución deseada del paso 5. Los bucles de inoculación calibrados deben transferir 0,01 ml. (Precaución: No permita que el bucle flameado entre en contacto con las bacterias inmediatamente después de retirarse del calor)
- Levante ligeramente la cubierta de la placa de petri en un lado para que sólo el bucle inoculado pueda acceder al agar. Deslice el bucle inoculante a través de la parte superior de los medios de comunicación de una manera en zig-zag teniendo cuidado de no comprometer el agar. Baje la tapa del plato de petri.
- Utilice un nuevo bucle de inoculado desechable o vuelva a esterilizar su bucle reutilizable.
- Gire la placa aproximadamente 1/3rd (118o) y reduzca la frecuencia del movimiento en zig-zag.
- Una vez más, utilice un nuevo bucle desechable o vuelva a esterilizar un bucle de metal antes de girar una última vez y reduzca la frecuencia en zig-zag una vez más. Baje la tapa del plato de petri.
- Repita los pasos 7.2 - 7.6 hasta que se hayan rayado al menos tres platos de petri para tres diluciones diferentes, utilizando un nuevo bucle desechable o volviendo a poner en llamas un bucle reutilizable(Figura 2).
- Coloque platos de petri rayados en una incubadora de 37oC durante la noche. Para los organismos anaeróbicos, utilice una cámara anerobica.
8. Análisis de datos y resultados
- Los cultivos fueron cosechados de las zonas oxic y anóxicos de una columna Winogradsky de 7 días. Estas zonas son adecuadas para anaerobios heterotróficos y oxidantes de hierro, respectivamente.
- Los explantes de columna se diluyeron en serie antes de rayar o esparcirse en las placas de agar LB.
- Streaking reveló una población mixta de cada una de las zonas de Winogradsky evaluadas. Las placas de propagación produjeron resultados similares.
- Para calcular cFU/ml o CFU/g, promediar el número de colonias contadas a partir de tres placas. Multiplique el número medio de colonias por el factor de dilución y divida por la cantidad alícuota. Por ejemplo, si se contara un promedio de 65 colonias en placas inoculadas con 0,1 ml de solución6 (T6), la fórmula descrita anteriormente equivaldría a 650.000.000 de UFC/ml.
- Las colonias aisladas ahora se pueden elegir de cada placa para su uso en ensayos de enriquecimiento para determinar la identidad de las especies.
A veces, con el fin de identificar y estudiar las bacterias primero necesitamos aislarlas y enriquecerlas de una muestra. Por ejemplo, las muestras obtenidas de una columna de Winogradsky son mixtas, lo que significa que contienen múltiples especies o cepas de bacterias, por lo que estudiar una bacteria individual o enumerar los diferentes tipos presentes puede ser un reto. Con este fin, las técnicas de dilución en serie y chapado se emplean típicamente para cuantificar de forma fiable la carga bacteriana y aislar colonias individuales.
La dilución en serie es un proceso a través del cual la concentración de un organismo, bacterias en este ejemplo, se reduce sistemáticamente a través de la resuspensión sucesiva en volúmenes fijos de diluyente líquido. Por lo general, el volumen del diluyente es un múltiplo de 10 para facilitar la reducción logarítmica del organismo de la muestra. Por ejemplo, un gramo de sedimento se elimina primero de la zona de Winogradsky de interés y se añade a 10 mililitros de un medio líquido adecuado. Luego, un mililitro de esta primera dilución se añade a otro tubo que contiene nueve mililitros de medio. El proceso se puede repetir hasta que se hayan preparado varias concentraciones diferentes de bacterias. La dilución en serie es la clave para la enumeración de bacterias en este ejemplo, ya que las muestras mixtas de una columna Winogradsky contienen un número desconocido, a menudo grande, de bacterias.
A continuación, el revestimiento de rayas y el recubrimiento extendido permiten el aislamiento y la enumeración de bacterias dentro de una muestra, respectivamente. El rayado se logra introduciendo una muestra diluida en una sección del medio sólido complementado con nutrientes, que se divide en tercios. Este inóculo se extiende sobre cada tercio de la placa en un patrón en zig-zag. A medida que las diferentes secciones de la placa están rayadas, cruzando de la muestra anterior sólo una vez, la muestra se extiende más delgadamente. Esto significa que es posible que solo necesite rayar una dilución para lograr colonias individuales en las secciones posteriores. Después de la incubación, las placas rayadas permiten observaciones de la morfología de la colonia, información que puede ayudar a diferenciar entre diferentes especies bacterianas.
Alternativamente, si el objetivo principal es la enumeración de las bacterias en el revestimiento de propagación de la muestra se puede utilizar. En el recubrimiento extendido, una alícuota de una sola muestra se extiende uniformemente sobre toda la superficie del medio sólido. Típicamente, debido a que no sabemos los números bacterianos en la muestra mixta, se hace una placa de propagación para cada una de las diluciones o una muestra representativa de ellos. Después de la incubación, la enumeración se puede realizar utilizando estas placas de propagación. Cualquier placa con recuentode de colonias menos de 30 debe ser descartada, ya que los recuentos pequeños están sujetos a un error mayor. Del mismo modo, cualquier recuento de más de 300 debe descartarse porque el hacinamiento de las colonias y la superposición pueden conducir a la subestimación del recuento de colonias. Si el recuento de colonias de cada uno de estos platos restantes se registra y se multiplica por el factor de dilución, y luego se divide por el volumen chapado, esto produce las unidades formadoras de colonias, o UFC, por mililitro de suspensión. En este video, aprenderá cómo evaluar cualitativa y cuantitativamente una muestra que contiene una bacteria conocida, y las comunidades microbianas contenidas en varias regiones de una columna Winogradsky a través de dilución en serie, revestimiento extendido y revestimiento de rayas.
En primer lugar, ponte cualquier equipo de protección personal apropiado, incluyendo un abrigo de laboratorio, guantes y gafas. A continuación, esterilizar el espacio de trabajo con 70% de etanol y limpiar la superficie. A continuación, recoger dos frascos Erlenmeyer de 500 mililitros y etiquetar un caldo y el otro agar. Para preparar la solución de agar LB, mezcle aproximadamente 6,25 gramos de agar LB, tres gramos de agar técnico y 250 mililitros de agua destilada en el agar etiquetado con etiqueta.
A continuación, prepare el caldo LB combinando 2. 5 gramos de medios LB y 100 mililitros de agua destilada en el caldo etiquetado con matraz. Después de autoclave de los matraces, utilice un guante resistente al calor para eliminar los matraces del autoclave y colóquelos en un baño de agua celsius de 40 a 50 grados. Una vez que los matraces estén a 50 grados centígrados, prepare cuidadosamente tres alícuotas de 100 mililitros de la solución de caldo y etiquete cada solución alícuota cero. A continuación, reúna 10 platos de petri estériles y etiquételos con la fecha, el nombre, el tipo de medio utilizado y la zona de la columna Winogradsky de la que se cosecharán los organismos. Pipetear 15 mililitros de agar del matraz de agar en cada plato de petri. A continuación, utilice la punta de la pipeta para eliminar las burbujas, reemplazar las tapas de las placas y dejar que se solidifiquen en la parte superior del banco durante la noche.
Al día siguiente, limpie la parte superior del banco con 70% de etanol. A continuación, etiquete 10 tubos de ensayo de 20 mililitros T1 a T10 y colóquelos en un bastidor. Pipetear nueve mililitros de solución salina de .45% en cada tubo. Ahora, cubra cada uno de los 10 tubos de ensayo libremente con sus tapas y transfieralos a un bastidor de tubo de ensayo compatible con autoclave. Una vez completado el ciclo, retire los espacios en blanco de salina con guantes resistentes al calor y déjelos enfriar. Almacene los tubos a temperatura ambiente hasta que hayan alcanzado aproximadamente 22 grados centígrados.
Para cultivar un organismo objetivo conocido, E. coli en este ejemplo, inocular 100 mililitros de solución cero con una sola colonia de una placa previamente rayada. Luego, cubre el tubo e incuba rindelo durante la noche a 37 grados centígrados. Para evaluar las regiones de una columna Winogradsky, agregue aproximadamente un gramo de material de la zona aeróbica a T1 y resuspenda por vórtice. A continuación, repita este proceso con un gramo de material de la zona anaeróbica.
Retire el tubo que contiene la solución cero inoculada con E. coli de la incubadora y agítela. A continuación, pipetear un mililitro de la solución en un tubo de ensayo T1 y vórtice para mezclar. Retire un mililitro de solución de T1 y transfiéralo a T2, vórtice para mezclar. Repita este proceso a través del tubo T10. Para evaluar las zonas aeróbicas y anaeróbicas de la columna Winogradsky, retire un mililitro de solución de cada uno de los tubos T1 previamente preparados y transfiéralo a los tubos T2 apropiados. A continuación, continúe las diluciones en serie a través de los tubos T10 como se demostró anteriormente.
Para esparcir la placa, pipeta 100 microlitros de la muestra diluida de cada tubo T3 en la placa petri correspondiente. A continuación, utilice una varilla de esparcimiento estéril para distribuir suavemente la muestra en la placa de petri y reemplazar la tapa de la placa. Repita este proceso para las diluciones T6 y T9, como se ha demostrado anteriormente. Incubar las placas que contienen organismos aeróbicos en una incubadora de 37 grados Celsius durante 24 horas. Incubar las placas que contienen organismos anaeróbicos en una cámara anaeróbica establecida en 37 grados centígrados durante 24 horas. Al día siguiente retire las placas de dilución T3, T6 y T9 de la incubadora y la cámara anaeróbica y transfieralas a la parte superior del banco. Trabajando con una placa a la vez, deslice un bucle inoculante estéril a través de la parte superior del medio en un patrón en zig-zag. A continuación, sustituya la tapa de la placa de petri. A continuación, gire la placa por 1/3 y esterilizar el bucle para reducir la frecuencia del patrón en zig-zag previamente hecho. Una vez más, después de esterilizar el lazo, gire la placa por 1/3, reduzca la frecuencia del patrón en zig-zag una última vez y reemplace la tapa. Repita este método de rayado para las placas restantes, como se ha mostrado anteriormente. A continuación, coloque las placas rayadas que contienen organismos aeróbicos en una incubadora de 37 grados Celsius durante la noche y las placas rayadas que contienen organismos anaeróbicos en una cámara anaeróbica establecida en 37 grados centígrados durante la noche.
Los cultivos fueron cosechados de las zonas aeróbicas y anaeróbicas de una columna Winogradsky de siete días. Luego, los cultivos se diluyeron en serie antes de rayar y extenderse en placas de agar LB. El rayado reveló una población mixta de cada una de las zonas evaluadas de Winogradsky, y las placas de propagación produjeron resultados similares. Un plato rayado de una población mixta dará lugar a colonias bacterianas de diferentes formas, tamaños, texturas y colores. Por el contrario, las placas rayadas y esparcidas que contienen el organismo conocido, E. coli, demostraron una población homóloga. Generalmente, es mejor calcular las UFC por mililitro utilizando el recuento medio de colonias de tres placas repartidas con la misma muestra y factor de dilución. Multiplique el número medio de colonias por el factor de dilución y divida por la cantidad alícuota. Por último, las colonias aisladas elegidas de cada placa se pueden utilizar en ensayos de enriquecimiento adicionales para determinar la identidad de las especies.
Applications and Summary
La enumeración bacteriana y el aislamiento de cepas por chapado requieren concentraciones manejables de organismos objetivo. Por lo tanto, el blindaje exitoso está supeditado a la dilución en serie. Como tal, las técnicas antes mencionadas siguen siendo la piedra angular del examen microbiológico y la experimentación. Aunque simple por diseño, los factores de dilución y la técnica de chapado pueden ser modificados por el experimentador para reforzar los resultados sin comprometer la integridad de cada método. Trazar las cuatro fases del crecimiento bacteriano puede ser útil al caracterizar los microbios deseados. Estas fases, retraso, registro, estacionario y muerte, están marcadas por cambios en la replicación bacteriana. La fase de retraso presenta un crecimiento lento debido a la adaptación fisiológica, la fase log es el período de máxima proliferación que presenta un aumento exponencial en las células viables, la fase estacionaria se alcanza debido a limitaciones ambientales y acumulaciones de toxinas, antes de la fase de muerte donde el recuento celular comienza a caer. Esto se puede lograr diluyendo en serie (o diluyendo 1 paso para evitar confusiones) Solución0 cada hora durante un total de 8 horas, comenzando en el tiempo0 (la solución0 debe ser devuelta a una incubadora de agitación después de cada dilución). Calcule el registro10 de CFU/ml para un único diluyente de Tiempo0 y trace en el eje Y. Repita este cálculo para la muestra Tiempo1 (asegúrese de calcular CFU/ml utilizando el mismo factor de dilución que Tiempo0). Repita hasta que cada vez (Tiempo1-Tiempo8) se tracen en el eje X.
References
- Allen, M.E., Gyure, R.A. (2013) An Undergraduate Laboratory Activity Demonstrating Bacteriophage Specificity. Journal of Microbial Biological Education 14: 84-92.
- Ben-David, A., Davidson, C.E. (2014) Estimation Method for Serial Dilution Experiments. Journal of Microbiological Methods 107:214-221.
- Goldman, E., Green, L.H. (2008) Practical Handbook of Microbiology.
- Koch, R. (1883) New Research Methods for Detection of Microcosms in Soil, Air and Water.
- Lederberg, J., Lederberg, E.M. (1952) Replica Plating and Indirect Selection of Bacterial Mutants. Journal of Bacteriology 63:399-406
- Pepper, I., Gerba, C., Ikner, L. (2019) Bacterial Growth Curve Analysis and its Environmental Changes. JoVE Science Education Database. Environmental Microbiology.
- Sanders., E.R. (2012) Aseptic Laboratory Technique: Plating Methods. JoVE 63:e3063.




