Overview
מקור: עדדה אנדרסון1, רולף לוד1
1 המחלקה למדעים קליניים לונד, החטיבה לרפואת זיהומים, המרכז הביו-רפואי, אוניברסיטת לונד, 221 00 לונד, שוודיה
לכאורה בלתי אפשרי לקבוע, המגוון הביולוגי המיקרוביאלי הוא באמת מדהים עם כטריליון מינים דו-קיום (1,2). למרות אקלים קשה במיוחד, כמו הסביבה החומצית של הבטן האנושית (3) או האגמים התת-קרקעיים של אנטארקטיקה (4), עשויים להיות נשלטים על ידי מין מסוים, חיידקים נמצאים בדרך כלל בתרבויות מעורבות. מכיוון שכל זן עשוי להשפיע על צמיחתו של אחר (5), היכולת להפריד ולטפח מושבות "טהורות" (המורכבות מסוג אחד בלבד) הפכה חיונית במסגרות קליניות ואקדמיות כאחד. תרביות טהורות מאפשרות בדיקות גנטיות ופרוטומיות נוספות (7), ניתוח של טוהר המדגם, ואולי ראוי לציון יותר, זיהוי ואפיון של חומרים זיהומיים מדגימות קליניות.
לחיידקים יש מגוון רחב של דרישות גדילה ויש סוגים רבים של מדיה תזונתית שנועדו לקיים הן את המינים הלא תובעניים והן את המינים הערמומיים (8). מדיה צמיחה יכול להיות מוכן או בצורה נוזלית (כמו מרק) או בדרך כלל מבוסס אגר (סוכן gelling נגזר אצות אדומות) צורה מוצקה. בעוד חיסון ישיר למרק נושא את הסיכון ליצירת אוכלוסייה חיידקית מגוונת גנטית או אפילו מעורבת, ציפוי ופסים מחדש יוצרים תרבות טהורה יותר שבה לכל תא יש מבנה גנטי דומה מאוד. טכניקת לוח הפסים מבוססת על דילול מתקדם של מדגם (איור 1),במטרה להפריד תאים בודדים זה מזה. כל תא בר קיימא (המכונה להלן יחידה ליצירת מושבה, CFU) המתקיים על ידי התקשורת והסביבה המיועדת לכך יכול למצוא לאחר מכן מושבה מבודדת של תאי בת באמצעות ביקוע בינארי. למרות שיעורי המוטציה המהירים בתוך קהילות חיידקים, קבוצת תאים זו נחשבת בדרך כלל כלנית. קצירה ופס מחדש של אוכלוסייה זו כתוצאה מכך מבטיחה כי העבודה הבאה כרוכה רק סוג חיידקי אחד.
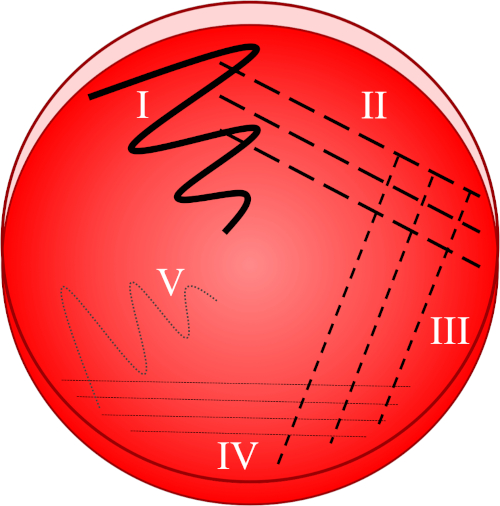
איור 1: לוח פסים מבוסס על דילול הדרגתי של המדגם המקורי. I) האינוקולום מפוזר בתחילה באמצעות תנועת זיג-זג, ויוצר אזור עם אוכלוסיית חיידקים צפופה יחסית. II-IV) פסים נמשכים מהאזור הקודם, באמצעות לולאת חיסון סטרילית בכל פעם, עד שמגיעים לרביע הרביעי. V) תנועת זיג-זג סופית המופנית לכיוון אמצע הצלחת יוצרת אזור שבו ההסתה מדוללת במידה ניכרת, ומאפשרת למושבות להופיע נפרדות זו מזו.
ניתן לשלב את טכניקת לוח הפסים גם עם השימוש במדיה סלקטיבית ו/או דיפרנציאלית. מדיום סלקטיבי יעכב את צמיחתם של אורגניזמים מסוימים(למשל באמצעות תוספת של אנטיביוטיקה) בעוד מדיום דיפרנציאלי יסייע אך ורק להבחין זה מזה(למשל באמצעות המוליזה על לוחות אגר הדם).
בבסיס כל העבודה במיקרוביולוגיה עומד השימוש בטכניקות אספטיות (סטריליות). כל תרבות חיידקית צריכה להיחשב פוטנציאל פתוגניים שכן קיים סיכון של צמיחה לא מכוונת של זנים בוגדניים, היווצרות תרסיס וזיהום של ציוד / כוח אדם. כדי למזער סיכונים אלה, כל כלי התקשורת, הפלסטיק, המתכת והזכוכית מעוקרים בדרך כלל באמצעות הפעלה אוטומטית לפני ואחרי השימוש, מה שמכפיף אותם לאדים רוויים בלחץ גבוה בסביבות 121 מעלות צלזיוס שמחסל ביעילות את כל התאים המתמשכים. חלל העבודה מחוטא בדרך כלל באמצעות אתנול הן לפני, והן לאחר מכן, להשתמש. חלוק מעבדה וכפפות תמיד שחוקים במהלך העבודה עם חומרים זיהומיים.
Procedure
1. ערוך
- יש להתייחס לכל החיידקים כאילו הם מסוכנים. תמיד ללבוש חלוק מעבדה וכפפות, לקשור את השיער הארוך, ולהבטיח כי כל פצעים מוגנים היטב במיוחד.
- הכן את חלל העבודה על ידי עיקורו באמצעות 70% אתנול.
- ודא כי לוחות אגר, פתרונות מדגם וקופסה של לולאות חיסון פלסטיק מעוקרות מראש או לולאת מתכת בתוספת להבת Bunsen, קרובים בהישג יד. לולאות פלסטיק חד פעמיות בדרך כלל מעוקרות מראש. לולאות מתכת צריך להיות טבול 70% אתנול, ולאחר מכן מוחזק ליד האזור הכחול של להבת Bunsen מחומם עד חם לוהט. אפשר לחוט להתקרר על ידי הרמת המכסה של הצלחת (רק מעט כדי למנוע זיהום) והקשה עליו כנגד המדיום המוצק.
- סיים כל הליך עם עיקור חוזר ונשנה של חלל העבודה ושטיפה /עיקור יסודי של הידיים ופרקי כף היד.
2. פרוטוקול
- הכנת מדיה
- זהה והכן מדיום מוצק (המכיל בדרך כלל 1.5% (w/v) אגר) שיחזיק את המינים/זן החיידקיים המנוצלים. מערבבים את המדיום בבקבוק המסוגל להכיל נפח כפול מהנפח הסופי כדי למנוע גלישה בעת הפעלה אוטומטית.
- לחטא את התקשורת על ידי הצבת הבקבוק, עם מכסה מהודק למחצה, ב autoclave להגדיר 121 מעלות צלזיוס במשך 20 דקות.
- סגור את המכסה כראוי ברגע שהבקבוק יוסר מההקלבה האוטומטית. אם יש להשתמש במדיה בקרוב, מניחים את הבקבוק באמבט מים מוגדר ל 45 מעלות צלזיוס כדי לשמר אותו במצב נוזלי. אגר יהיה להתמצק בכל דבר פחות מ 32-40 מעלות צלזיוס, ומאוחר יותר ניתן לחמם מחדש (בדרך כלל באמצעות מיקרוגל) לנקודת התכה ב 85°C.
- הכנת לוחות תרבות
- סמנו את הבסיס של מנות פטרי סטריליות (בדרך כלל 100 x 15 מ"מ) בצד או בתחתית עם שם הנסיין, התאריך וסוג המדיה.
- יוצקים 20-25 מ"ל של מדיום תרבות אגר 45 מעלות צלזיוס (שהוכן בעבר) לכל אחת מהצלחות המסומנות. אם קצף מופיע לאורך הקצוות, זה צריך להיות מוסר במהירות באמצעות pipette רגיל טיפ סטרילי.
- מיד מניחים את כל המכסים בחזרה על הכלים כדי למנוע זיהום.
- אפשר אגר להתמצזק במשך כ 2 שעות בטמפרטורת החדר או לילה ב 4°C. לאחר שנקבע, לוחות תרבית חיידקים יש לאחסן לאחר מכן הפוך ב 4°C כדי למזער את ה עיבוי על פני השטח הבינוני.
- ציפוי פסים
- תטביעו לולאה סטרילית לתוך ההודום הרצוי ולפזרו מיד את המדגם שנאסף על הרביע הראשון של הצלחת באמצעות תנועת זיג-זג(איור 1, I).
- סגור את המכסה וחטא מחדש את לולאת החיסון או לאסוף לולאה סטרילית חד פעמית חדשה.
- הפוך 3-4 משיכות מקרין מהרביע הראשון (המכיל אוכלוסיית חיידקים צפופה יחסית) לכיוון הרביע השני של הצלחת (איור 1, II).
- סגור את המכסה וחטא מחדש את לולאת החיסון או בטל את הלולאה החד פעמית ואסוף אחד סטרילי חדש.
- חזור על פס זה של 3-4 משיכות מהשנייה לרביע השלישי, ולאחר מכן מהרביע השלישי לרביע, באמצעות לולאה סטרילית בכל פעם (איור 1, III - IV).
- באמצעות לולאה סטרילית, לעשות משיכה אחת אחרונה בתבנית זיג-זג מהרביע הרביעי לכיוון אמצע הצלחת (איור 1, V). השכיחות החיידקית תהיה נמוכה יותר באזור זה, באופן אידיאלי מאפשר מושבות בודדות להיות הוקם מתא אם יחיד, קיימא.
- סגור את המכסה ו (אם נדרש על ידי מינים חיידקיים) לאטום עם parafilm כדי למנוע זרימת אוויר.
- בהתאם למין /זן חיידקי, מניחים את צלחת התרבות למעלה-למטה בסביבה מתאימה ודגור עד למושבות חיידקים גלויות (מושבות מופרדות יכולות להופיע בכל אזור של הצלחת כמו הריכוז הראשוני עשוי להשתנות).
- כדי ליצור אוכלוסיית חיידקים כלנית, פס החוצה צלחת אחרת, החלפת inoculum מצופה על הלוח המקורי עבור תאים מבודדים ממושבה אחת של הלוח המקורי.
על צלחת פטרי, אם חיידק יחיד עובר סבבים מרובים של רבייה א-מינית, זה יוביל להיווצרות של מושבה כלנית. עם זאת, קבלת חיידק יחיד מדגם מעורב, כגון השעיית קרקע, יכול להיות קשה. אם לוקחים לולאה אחת של התרבות ההטרוגנית הזו, היא יכולה להכיל עד טריליון חיידקים בודדים. כדי להפיץ כל כך הרבה חיידקים על פני השטח של צלחת אגר ולקבל מושבה אחת, אפילו באמצעות דפוס זיג-זג, הלולאה תצטרך להיגרר ברציפות על פני השטח של מספיק לוחות להגדיר זה לצד זה כדי להקיף את כל האי ליברטי. ברור, מדענים לא באמת להשתמש כל כך הרבה לוחות. במקום זאת, הם משתמשים בטכניקה שנקראת ציפוי פסים.
טכניקת צלחת הפס מבוססת על דילול מתקדם של דגימה חיידקית, והיא מבוצעת על פני השטח המוצקים של צלחת פטרי אחת. ראשית, משטח המדיה מחולק חזותית לחמישה חלקים על-ידי הקצאת ארבעה שברים של ההיקף כארבעת המקטעים הראשונים, ומרכז הצלחת כחמישי. זה ייצור ביעילות חמש צלחות מדיה מתוך צלחת פטרי אחת. לאחר מכן, באמצעות לולאה של inoculum הרצוי, החלק הראשון הוא פסים באמצעות דפוס זיג-זג. לאחר מכן, או לולאה חד פעמית חדשה משמשת, או במקרה של לולאת חוט, הוא מעוקר עם מבער Bunsen, בוער אותו עד שהוא חם אדום לאורך החוט. שימוש זה בלולאה חדשה, או לולאת עיקור להבה, מסיר את כל תאי החיידקים הנותרים, ומסייע בדילול החיידקים. הלולאה החמה מקוררת באוויר למשך מספר שניות לפני שהיא נגררת דרך החלק הראשון כדי ליצור שלושה עד ארבעה קווים נפרדים, שכל אחד מהם נושא רק שבריר של חיידקים לתוך החלק השני. החלקים הנותרים מפוספסים באותו אופן, באמצעות לולאה סטרילית בכל פעם, ועובר יחיד דרך הפס הקודם.
באמצעות מחזור זה של פסים וחיטוי, ריכוז החיידקים בכל סעיף עוקב צריך להיות מדולל, כך החלק הסופי מכיל רק כמה חיידקים במיקום נפרד. עם הדגירה, חיידקים נפרדים אלה מתרבים כדי לייצר מושבות כלניות מבודדות של תאי בת, המכונים יחידות יוצרות מושבה, או יחידות יוצרות מושבה. אלה ניתן לקצור מחדש פסים כדי להבטיח כי העבודה הבאה כרוכה רק סוג חיידקי אחד, המכונה תרבות טהורה. בנוסף לבידוד מושבות בודדות מתרבית חיידקים מעורבים, טכניקת ציפוי הפס משמשת גם לבחירת זנים ספציפיים למדיה, לקביעת מורפולוגיה של מושבת חיידקים או לזיהוי מינים חיידקיים שונים. בסרטון זה, אנו מדגימים כיצד לבודד מושבות חד-בקטריאליות מהשעיית דגימה מעורבת של חיידקים באמצעות טכניקת ציפוי פסים.
בתור התחלה, לבש כפפות מעבדה וחלוק מעבדה. לאחר מכן, לעקר את סביבת העבודה באמצעות 70% אתנול. לאחר מכן, בחר מדיום מתאים שיחזיק את המינים החיידקיים המנוצלים או המתח ויתחיל להכין את המדיה. כאן, אגר LB משותף מוכן על ידי שקילה של עשרה גרם של מועשר מראש, אבקת מדיה ו 7.5 גרם של אגר. מוסיפים את הרכיבים המיובשים במשקל לבקבוק זכוכית המסוגל להחזיק כפול מהנפח הסופי כדי למנוע הצפה. לאחר מכן, מוסיפים 500 מיליליטר של מים לבקבוק, וכובע אותו חצי חזק. לחטא את התקשורת על ידי הצבת הבקבוק ב autoclave להגדיר 121 מעלות צלזיוס במשך עשרים דקות. לאחר ההשלמה, השתמש בכפפות חסיני חום או כרית חמה כדי להסיר את המדיה מהמכונה ולאחר מכן מיד לסובב את פקק הבקבוק כדי לסגור אותו בחוזקה.
לשימוש באותו יום, תן לתקשורת להתקרר על ידי הנחת הבקבוק באמבט מים מחומם לכ 45 מעלות צלזיוס, כדי לשמר את התקשורת במצב נוזלי. לחלופין, ניתן להשאיר את המדיה בטמפרטורת החדר לאחסון במצב מוצק. בעת הצורך, מיקרוגל הבקבוק עם המכסה פתוח מעט כדי להמיס את המדיה, ולאפשר לתקשורת להתקרר באמצעות אמבט מים 45 מעלות צלזיוס.
לאחר מכן, לקחת שרוול של מנות פטרי סטריליות, ועם סמן קבוע, לתייג אותם עם החוקר ושמות התקשורת, כמו גם את התאריך. לאחר מכן, להעביר את הנפח הנדרש של מדיה לתוך כלי סטרילי, ולהוסיף אנטיביוטיקה או רכיבים רגישים אחרים במידת הצורך. כאן, 50 מיליליטר של מדיה מעורבב עם 100 microliters של Kanamycin לריכוז סופי של 25 מיקרוגרם למיליליטר. מערבול את הצינור כדי להבטיח הפצה שווה של הרכיבים שנוספו ברחבי המדיה. לאט, כדי למנוע היווצרות בועה, לשפוך 20 עד 25 מיליליטר של כ 45 מעלות צלזיוס תרבות בינונית לתוך כל אחת הצלחות. אם מופיעות בועות או קצף, יש להסיר במהירות באמצעות פיפטה רגילה וטיפ סטרילי. לאחר מכן, מיד להחליף את כל המכסים כדי למנוע זיהום. אפשר אגר להתמצץ בטמפרטורת החדר לפחות שעתיים או לילה. לאחר התגבשות, לאחסן את לוחות התרבות הפוך בארבע מעלות צלזיוס כדי למזער את ה עיבוי על פני השטח של המדיום.
כדי פס התרבות של בחירה, הראשון לקחת צלחת תרבות נקייה ולהסיר את המכסה. עבודה מהירה, להטביע לולאה חד פעמית, סטרילי לתוך inoculum הרצוי ולאחר מכן מיד ספוגית הלולאה מעל הרביע הראשון של הצלחת באמצעות תנועת זיג-זג. החלף את המכסה של המנה, להשליך את לולאת החיסון המשומשת ולאחר מכן לבחור לולאה סטרילית חדשה. באמצעות הלולאה החדשה, לעשות שלוש עד ארבע משיכות חוצה את קו הספוגית המקורי מקרין מהרביע הראשון, אשר צריך להכיל אוכלוסיית חיידקים צפופה יחסית לתוך הרביע השני. סגור את המכסה פעם נוספת והשלך את הלולאה. עם לולאה חדשה, חזור על פעולה זו שוב, אבל הפעם פסים מן השני לתוך הרביע השלישי. לאחר מכן, עם לולאה חדשה שוב, לעשות פס נוסף מהשלישי לחלק הרביעי של הצלחת. לבסוף, עם לולאה חדשה, לעשות משיכה אחת אחרונה בתבנית זיג-זג מהרביע הרביעי לכיוון מרכז הצלחת. השכיחות החיידקית תהיה נמוכה יותר באזור זה, באופן אידיאלי מאפשר מושבות בודדות להיות הוקמו מתא אם יחיד קיימא.
החלף את מכסה הצלחת, ואם מתאים למין החיידקים, לאטום את הצלחת עם סרט para כדי למנוע זרימת אוויר. להפוך את צלחת התרבות כדי למנוע טפטופי עיבוי, ולאחר מכן למקם בטמפרטורה מתאימה לצמיחה. כאן, אינקובטור מוגדר 37 מעלות צלזיוס. אפשר לצלחת לדגור עד שמושבות חיידקים נראות לעין. כדי ליצור אוכלוסיית חיידקים כלנית, בחר מושבה נפרדת אחת מצלחת זו. עכשיו, עם הלולאה הסטרילית, לגעת במושבת היעד, וכמו קודם, לעשות פס ברביע הראשון של צלחת חדשה. ממשיכים לעקר לסירוגין את הלולאה ולפס את שאר הרבעים של הצלחת כפי שהודגם בעבר, ומסתיימות בזיג-זג למרכז. סוגרים את הצלחת ומניחים אותה לדגור עד שנוצרות מושבות נפרדות. ברגע שמושבות אלה גדלות, הן בדרך כלל מייצגות זנים כלנית טהורים.
לוח הרצף הראשוני עשוי להכיל מושבות שמקורן בתאים ממינים חיידקיים שונים או תאים עם מבנה גנטי שונה, בהתאם לטוהר המדגם. באמצעות בידוד מאוחר יותר של מושבה אחת, שבה כל היחידות נגזרות מתא אם משותף, הליך הפס השני מייצר אוכלוסייה חיידקית קלונית יחסית, המתאימה להמשך אפיון או חיסון למרק.
Subscription Required. Please recommend JoVE to your librarian.
Results
לוחית הרצף הראשונית עשויה להכיל מושבות שמקורן בתאים בעלי מבנה גנטי שונה או (בהתאם לטוהר המדגם) ממיני חיידקים שונים (איור 2A).
באמצעות בידוד מאוחר יותר של מושבה אחת, שבה כל היחידות נגזרות מתא אם משותף, הליך הפסים השני מייצר אוכלוסייה חיידקית קלונית יחסית, המתאימה להמשך אפיון או חיסון למרק (איור 2B).

איור 2: ניתן ליצור תרבות טהורה מדגם מעורב באמצעות בידוד של מושבה מבודדת אחת. A) צמיחה של תא חיידקי יחיד (CFU) יצרה מושבת כלונסאות, מופרדת מאלה של מינים וזנים אחרים. CFU זה שימש לפסים הבאים על צלחת חדשה B) צלחת שנייה, שבה אוכלוסיית החיידקים מורכבת אך ורק של תאים הנגזרים CFU הראשוני.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
היכולת להשיג ולטפח מושבת חיידקים טהורה היא חיונית, הן במסגרות קליניות והן במסגרות אקדמיות. ציפוי פסים מאפשר בידוד של אוכלוסיית תאים קלוניים יחסית, שמקורם ב- CFU משותף, שעשוי לעניין במיוחד במהלך האבחון או לאפיון נוסף של הבידוד. דגימה מפוספסת על מדיום מודי מתאים על בסיס אגר ודגרה עד שהמושבות הופכות גלויות. מושבה מבודדת נקצרת לאחר מכן ומוצמדת מחדש על צלחת שנייה.
Subscription Required. Please recommend JoVE to your librarian.
References
- The Human Microbiome Project C. Structure, Function and Diversity of the Healthy Human Microbiome. Nature. 486:207-214. (2012)
- Locey KJ, Lennon JT. Scaling laws predict global microbial diversity. Proceedings of the National Academy of Sciences. 113 (21) 5970-5975 (2016)
- Skouloubris S, Thiberge JM, Labigne A, De Reuse H. The Helicobacter pylori UreI protein is not involved in urease activity but is essential for bacterial survival in vivo. Infection and Immunity. 66:4517-21. (1998)
- Mikucki JA, Auken E, Tulaczyk S, Virginia RA, Schamper C, Sørensen KI, Doran PT, Dugan H, Foley N. Deep groundwater and potential subsurface habitats beneath an Antarctic dry valley. Nature Communications. 6:6831. (2015)
- Mullineaux-Sanders C, Suez J, Elinav E, Frankel G. Sieving through gut models of colonization resistance. Nature Microbiology. 3:132-140. (2018)
- Fournier PE, Drancourt M, Raoult D. Bacterial genome sequencing and its use in infectious diseases. Lancet Infectious Diseases. 7:711-23 (2007)
- Yao Z, Li W, Lin Y, Wu Q, Yu F, Lin W, Lin X. Proteomic Analysis Reveals That Metabolic Flows Affect the Susceptibility of Aeromonas hydrophila to Antibiotics. Scientific Reports. 6:39413 (2016)
- Medina D, Walke JB, Gajewski Z, Becker MH, Swartwout MC, Belden LK. Culture Media and Individual Hosts Affect the Recovery of Culturable Bacterial Diversity from Amphibian Skin. Frontiers in Microbiology. 8:1574 (2017)




