Overview
资料来源:安德鲁·范阿尔斯特1,瑞安农M.勒维克1,纳塔利娅·马丁1,维克多·迪丽塔1
1密歇根州立大学微生物学和分子遗传学系,美国密歇根州东兰辛分校
生长曲线提供了有关细菌生长动力学和细胞生理学的宝贵信息。它们使我们能够确定细菌在可变生长条件下的反应,并为给定细菌定义最佳生长参数。原型增长曲线通过四个增长阶段前进:滞后、指数、静止和死亡 (1)。
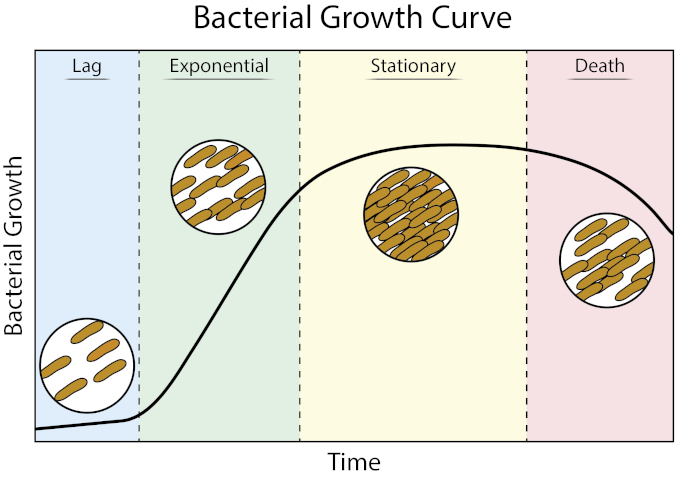
图1:细菌生长曲线。在批量培养中生长的细菌通过四个生长阶段:滞后、指数、静止和死亡。滞后期是细菌达到能够快速细胞生长和分裂的生理状态的时间段。指数阶段是细胞生长和分裂速度最快的阶段,在此期间,DNA复制、RNA转录和蛋白质生产均以恒定、快速的速度发生。固定阶段的特点是由于营养限制和/或有毒中间积累,细菌生长减慢和停滞。死亡期是细胞溶血由于严重营养限制而发生的阶段。
滞后期是细菌达到能够快速细胞生长和分裂的生理状态的时间段。出现这种滞后的原因是细菌需要时间来适应新的环境。一旦必要的细胞成分在滞后阶段产生,细菌进入指数增长阶段,DNA复制、RNA转录和蛋白质生产都发生
Procedure
1. 设置
- 所需的实验室材料:液体介质、凝固琼脂介质、Erlenmeyer烧瓶、15 mL试管、磷酸盐缓冲盐水(PBS)、细菌细胞扩散器、70%乙醇和分光光度计。所有溶液和玻璃器皿在使用前都必须消毒。
- 使用 70% 乙醇进行消毒,为工作站做好准备。在 Bunsen 燃烧器附近工作,以防止介质污染。
- 使用细菌时,应使用适当的个人防护设备和无菌技术。使用细菌培养物时,需要实验室外套和手套。
- 缓冲剂、溶液和试剂的配方
- 磷酸盐缓冲盐水 (PBS) (8)。
- 卢里亚-贝尔塔尼兄弟 (LB) (9)。
2. 议定书
- 媒体准备
- 识别生长介质,用于培养细菌,并在单独的可高压灭菌瓶中制备液体肉汤和固体琼脂(1.5% w/v琼脂)培养基。在这里,LB肉汤和LB琼脂为大肠杆菌的生长做好了准备。
- 在设置为 121°C 的高压灭菌器中,用半紧固盖对介质进行消毒 35 分钟。
- 对于琼脂介质,在高压灭菌后,放入设置为 50°C 的水浴中 30 分钟冷却。冷却后,将 20-25 mL 琼脂胶培养基倒入 100x15mm 圆形培养皿中。在使用前,让板在室温下设置24小时。
- 细菌的初始制备
- 从冷冻库存中,条纹细菌在选定的介质琼脂上分离,以获得单菌群分离物。在允许为所选细菌生长条件下孵育。在这里,大肠杆菌在LB琼脂上条纹,在37°C过夜(16-18小时)孵育。
- 使用无菌接种回路,从条纹板中选择单个菌落,在15 mL试管中接种4 mL液体介质,并在所选细菌允许的条件下生长。在这里,大肠杆菌在37°C下生长,在210rpm的转速下摇动过夜(16-18小时)。
- 增长曲线设置
- 生长瓶制备
- 高压灭菌器适当大小埃伦迈耶烧瓶。通常使用 1:5 的介质与总烧瓶体积的比率。在这里,100 mL LB 介质用于 500 mL 烧瓶。
- 使用血清学移液器,将无菌介质转移到 Erlenmeyer 烧瓶。
- 稀释系列制备
- 标签 15 mL 试管: -1, -2, -3, -4, -5, -6, -7, -8 和 -9, 将 9mL PBS 分布到每个。这些数字对应于用于计算 CFU/mL 的稀释系数。每个收集时间点都需要一组新的管。(图2)
- 阿加板制备
- 带有收集时间和稀释系数的标签板。对于每个时间点,每个稀释都有一个板。
- 生长瓶制备
- 增长曲线协议
- 媒体接种
- 使用步骤 2.2.2 中准备的隔夜液体培养液,用 1:1000 容量的培养液为烧瓶介质接种。在这里,100 μL 隔夜液体培养剂添加到 100 mL LB 介质中。
- 旋转介质以均匀分布细菌。
- 时点集合
- 生长条件设置
- 在为给定细菌选择的实验生长条件下放置烧瓶。对于快速生长的细菌,应经常使用时间点,对于生长缓慢的细菌,可以以较长的间隔进行。在这里,大肠杆菌在37°C下生长,以每分钟210转(rpm)摇动,每1小时采集一次时间点。
- 光学密度 (OD600) 测量
- 在每个时间点,包括起始时间点(t = 0),提取1 mL的细菌培养物,并分配到分光光度计比色皿中。
- 擦拭比色皿,并将光密度记录在 600 nm 波长。如果光学密度读数大于 1.0,则使用 900 μL 新介质稀释 100 μL 培养物 1:10,记录光学密度,并将此值乘以 10 进行 OD600 测量。
- 殖民地形成单元 (CFU/mL) 测量
- 在每个时间点,提取1 mL的细菌培养物,并放入含有9 mL PBS的-1玻璃试管中。
- 对于稀释系列,从 -1 管将 1 mL 从 -1 管向下所有稀释管转移到 -9,每次传输后涡旋。(图2)
- 对于每次稀释,将100 μL的细胞悬浮液分给相应标记的固体介质琼脂板。(图2)
- 使用在乙醇中灭菌、通过 Bunsen 燃烧器火焰并通过接触琼脂表面冷却的细胞扩张器,将 100 μL 的细胞悬浮液扩散,直到琼脂板表面变干。
- 在支持细菌生长的温度下倒置孵育扩散板。在这里,大肠杆菌在37°C孵育。
- 孵育后,一旦出现可见的菌落,计算每个板块上的细菌菌落数量,并记录这些值以及每个时间点所有板的相关稀释系数。
- 生长条件设置
- 媒体接种
3. 数据分析和结果
- 光密度 (OD600) 增长曲线图
- 在半对数尺度上绘制光学密度 (OD600) 与时间。(图3)
- 菌落形成单元 (CFU/mL) 生长曲线图
- 对于每个时间点,选择菌落计数在 30-300 细菌范围内的稀释板。将菌群计数数乘以稀释系数,再乘以 10,因为 100 μL 差差在计算 CFU/mL 时被视为额外的 1:10 稀释。

- 在半日志尺度上绘制殖民地形成单位与时间。(图4)
- 对于每个时间点,选择菌落计数在 30-300 细菌范围内的稀释板。将菌群计数数乘以稀释系数,再乘以 10,因为 100 μL 差差在计算 CFU/mL 时被视为额外的 1:10 稀释。
- 相关光学密度和菌落形成单元
- 在小于或等于 1.0 OD600 的 OD600 读数的线性刻度上绘制菌落成形单元与光学密度,因为 OD600 和 CFU/mL 之间的关系在 1.0 OD600 之后的精确度较低。此处绘制了前六个时间点。(图5)
- 生成显示方程和 R2值的线性回归趋势线。
- 确定细菌翻倍时间
- 使用菌落形成单位生长曲线图,在指数相中,在图形上识别两个点,它们之间的斜率最陡,以计算倍增时间。
- 计算加倍时间

- • 时间= t2 - t1,其中t1 = 时间点 1 和t2 = 时间点 2
-
 ,其中b = t2的细菌数,B = t1的细菌数,n = 代数的细菌数。 派生自:
,其中b = t2的细菌数,B = t1的细菌数,n = 代数的细菌数。 派生自: .
- 使用:

细菌通过称为细胞分裂的过程繁殖,导致两个相同的子细胞。如果生长条件有利,细菌数量将呈指数级增长。
细菌生长曲线绘制培养物中的细菌量作为时间的函数。典型的生长曲线通过四个阶段进行:滞后阶段、指数相、固定相和死亡阶段。滞后阶段是细菌到达一种可以迅速生长和分裂的状态所需的时间。在此之后,细菌过渡到指数阶段,其特点是细胞快速生长和分裂。在此阶段,细菌培养的指数增长率可以表示为倍增时间,这是细菌在特定条件下繁殖的最快速度。下一个阶段是固定阶段,细菌细胞生长停滞,由于环境营养枯竭,生长和死亡率甚至达到平衡。最后,细菌进入死亡阶段。这是细菌生长急剧下降和严重的营养消耗导致细胞的溶化。
两种技术可用于量化培养中细菌的数量,并绘制生长曲线。第一种是通过殖民地形成单位,或CFU。为了获得 CCF,在常规时间点执行一到十个系列的九稀释。本例中的第一种稀释剂为负数,含有9mL的PBS和1mL的细菌培养物。导致 1:10 稀释系数。然后,将1mL的溶液转移到下一管,负2,产生1:100稀释系数。这个过程通过最后一个管,负九,导致最终稀释系数为1:10亿。在此之后,每个稀释100微升被镀。然后孵育板,并计算克隆菌落。在 30 到 300 个菌落之间生长的给定时间点的稀释板用于计算该时间点的每毫升 CCF。
测量细菌浓度的第二种常用方法是光学密度。与介质空白相关的文化光密度可以通过分光光度计立即测量。通常,600 纳米的波长(也称为 OD600)用于这些测量,这些测量会随着细胞密度的增加而增加。虽然光学密度不如CCF,但它很方便,因为它可以即时获得,并且需要的试剂相对较少。这两种技术可以一起使用来创建一个标准曲线,该曲线可以更准确地近似于培养物的细菌细胞计数。在本视频中,您将学习如何从大肠杆菌的时序稀释中获得CCF和OD600测量值。然后,使用 CFU 和 OD600 测量值分别绘制两个增长曲线,然后由标准曲线关联。
在处理细菌时,使用适当的个人防护设备(如实验室外套和手套)并遵循适当的无菌技术非常重要。
之后,用70%乙醇对工作站进行消毒。首先,在单独的高压灭菌瓶中制备 LB 肉汤和 LB 固体琼脂介质。部分关闭瓶盖后,在设定温度为 121 摄氏度的高压灭菌器中对介质进行消毒 35 分钟。接下来,让琼脂介质在设定在50摄氏度的水浴中冷却30分钟。冷却后,将 20 至 25 mL 倒入每个培养皿中。在此之后,让板在室温下设置 24 小时。
为了准备一个殖民地分离物,以后将被用于产生液体细菌培养物,请使用先前冷冻的库存和适当的条纹电镀技术,将大肠杆菌条纹在LB琼脂上分离。在37摄氏度的温度下孵育一夜之间。在此之后,冷却琼脂上的火焰灭菌接种回路,然后从带条纹的板上选择单个菌落。在 15 mL 试管中接种 4 mL 的液体介质。然后,在37摄氏度的温度下生长大肠杆菌,在210rpm下摇动。
要设置生长曲线中使用的1:1000体积的细菌培养物,首先获得一个500 mL Erlenmeyer烧瓶的高压灭菌。然后,使用 50 mL 血清学移液器将 100 mL 无菌介质转移到烧瓶。接下来,连续将 9 个 15 ml 试管标记为 1 到 9。这些数字对应于用于计算菌落形成单位或 CFU 的稀释系数。然后,将 9 mL 的 1X PBS 添加到每个管中。在此之后,用相应的时间点和将生长的稀释因子标记准备好的琼脂板。在大肠杆菌的这个例子中,在起始时间点之后,每小时服用一次时间点。使用先前制备的隔夜液体大肠杆菌培养基,在高压灭菌管 500 mL Erlenmeyer 烧瓶中接种培养基,培养体积为 1:1000。旋转介质以均匀分布细菌。
遮蔽分光光度计后,用无绒擦拭清洁比色皿。接下来,将 1 mL 的培养体放入比色皿中,并将其放入分光光度计,以获得点零时培养的光学密度。然后,在37摄氏度的温度下生长大肠杆菌,在210rpm下摇动。在每个时间点后零点,从烧瓶中取出另外1 mL的细菌培养物,并重复光学密度测量。如果光学密度读数大于 1.0,则用 900 微升的新鲜介质稀释 100 微升细菌培养,然后再次测量光学密度。对于 OD 600 测量,此值可以乘以 10。
要获得每个时间点的菌落形成单位测量,请在每个时间点从烧瓶中再提取 1 mL 的细菌培养物。将细菌培养物放入负一试管和涡旋中混合。然后,首先将负一管中的1 mL转移到负二管和涡旋中混合,从而执行稀释系列。将 1 mL 从负 2 管转移到负三管和涡旋混合。继续这个串行转移下来所有的稀释管到负九管。将100微升的细胞悬浮液放在相应的标签板上,用于每次稀释。对于每一次稀释,对乙醇中的细胞扩散器进行消毒,通过Bunsen燃烧器火焰将其传递,然后通过接触远离接种的琼脂表面来冷却。然后,使用细胞扩张器分散细胞悬浮液,直到琼脂板表面变干。在37摄氏度的温度下孵育这些板块。一旦出现可见的菌落,计算每个盘子上的细菌菌落数量。在每个时间点记录每个板的这些值及其相关的稀释系数。
要创建 OD 600 增长曲线,在确保所有数据点正确输入到表中后,选择所有时间点及其相应数据。要生成菌落形成单位生长曲线图,请选择每个时间点的菌落计数在 30 到 300 细菌范围内的稀释板。将菌落计数数乘以稀释系数,再乘以 10。这是因为在计算每毫升的菌落形成单位时,100微升的分布被认为是额外的1:10稀释。在此之后,在半日志尺度上绘制殖民地形成单位与时间。
这些分别采用OD 600和CFU测量的地块可以提供有关大肠杆菌生长动力学的宝贵信息。光学密度和菌落形成单元可以相关,因此可以从 OD 600 测量中估计每毫升的 CCF,从而在将来的实验中节省时间和材料。
为此,在 OD 600 读数小于或等于 1 的线性刻度上,根据光学密度绘制菌落成形单元。0. 在此之后,以 Y = MX + B 格式生成线性回归趋势线,其中 M 是斜率,B 为 y 截距。右键单击数据点并选择添加趋势线和线性。然后,选中此框以在图表上显示公式,并在图表上显示 R 平方值。R 平方值是数据与拟合回归线匹配程度的统计度量。在此示例中,前 6 个时间点在 x 轴上绘制 OD 600,y 轴上每毫升的 CCF。在未来具有相同生长条件的实验中,这些斜率和 y 截距值可以插入此方程中,以从 OD 600 读数中估计 CCF。接下来,查看形成单位增长曲线图的殖民地。在指数相中,确定两个时间点之间的斜率最陡。要计算倍增时间,首先计算所选时间点之间的时间变化。然后,使用此处所示的方程计算代数变化。此处,小写 b 是时间点 3 处的细菌数量,大写 B 是时间点 2 的细菌数。最后,将时间变化除以代代变化。在此示例中,加倍时间为 0。26小时或15分19秒比较不同实验治疗的倍数,使我们能够确定特定细菌物种的最佳生长条件。因此,具有最低双倍时间的治疗将是测试条件的最佳选择。
Subscription Required. Please recommend JoVE to your librarian.
Results
菌群形成单位和光学密度的图是可视化生长动力学的两种方法。通过确定 CFU/mL 和 OD600 之间的关系,光学密度图还提供了 CFU/mL 随时间的估计值。导致最短倍增时间的条件被认为是特定细菌生长的最佳条件。
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
生长曲线对于了解细菌的生长动力学和生理学有价值。它们使我们能够确定细菌在可变生长条件下的反应,并为给定细菌定义最佳生长参数。菌落形成单位和光密度图都包含有价值的信息,描述了滞后阶段的持续时间,达到的最大细胞密度,并允许计算细菌倍增时间。生长曲线还允许在相同的生长条件下对不同细菌进行比较。此外,光学密度提供了一种标准化初始接种的方法,提高了其他实验中的一致性。
在设计增长曲线实验时,需要考虑使用哪种方法。作为生成生长曲线的首选方法,菌落形成单位图更准确地反映了批次培养中的可行细胞计数。菌落形成单位图还允许测量细菌生长的条件,否则会干扰光学密度测量。然而,这是一个更耗时的过程,需要广泛使用试剂,必须手动执行。光学密度图不太准确,仅提供菌落形成单位的估计值,需要为每个独特的细菌生成标准曲线。光学密度主要用于方便,因为它省时少,不需要很多试剂来工作。对光学密度最有吸引力的是,分光光度培养箱可以自动生成生长曲线,大大增加可立即测试的培养条件数量,并无需不断参与培养。
Subscription Required. Please recommend JoVE to your librarian.
References
- R. E. Buchanan. 1918. Life Phases in a Bacterial Culture. J Infect Dis 23:109-125.
- CAMPBELL A. 1957. Synchronization of cell division. Bacteriol Rev 21:263-72.
- Wang P, Robert L, Pelletier J, Dang WL, Taddei F, Wright A, Jun S. 2010. Robust growth of Escherichia coli. Curr Biol 20:1099-103.
- Goldman E, Green LH. 2015. Practical Handbook of Microbiology, Third Edition. CRC Press.
- Ben-David A, Davidson CE. 2014. Estimation method for serial dilution experiments. J Microbiol Methods 107:214-221.
- Koch AL. 1968. Theory of the angular dependence of light scattered by bacteria and similar-sized biological objects. J Theor Biol 18:133-156.
- Sezonov G, Joseleau-Petit D, D'Ari R. 2007. Escherichia coli physiology in Luria-Bertani broth. J Bacteriol 189:8746-9.







 ,其中b = t2的细菌数,B = t1的细菌数,n = 代数的细菌数。 派生自:
,其中b = t2的细菌数,B = t1的细菌数,n = 代数的细菌数。 派生自: