Overview
מקור: אנדרו ג'יי ואן אלסט1, ריאנון מ. לה-ווק1, נטליה מרטין1, וויקטור ג'יי דיריטה1
1 המחלקה למיקרוביולוגיה וגנטיקה מולקולרית, אוניברסיטת מדינת מישיגן, מזרח לנסינג, מישיגן, ארצות הברית
עקומות גדילה מספקות מידע רב ערך על קינטיקה של גדילה חיידקית ופיזיולוגיה של תאים. הם מאפשרים לנו לקבוע כיצד חיידקים מגיבים בתנאי גדילה משתנים, כמו גם להגדיר פרמטרי צמיחה אופטימליים עבור חיידק נתון. עקומת צמיחה ארכיטיפית מתקדמת דרך ארבעה שלבים של צמיחה: פיגור, מעריכי, נייח ומוות (1).
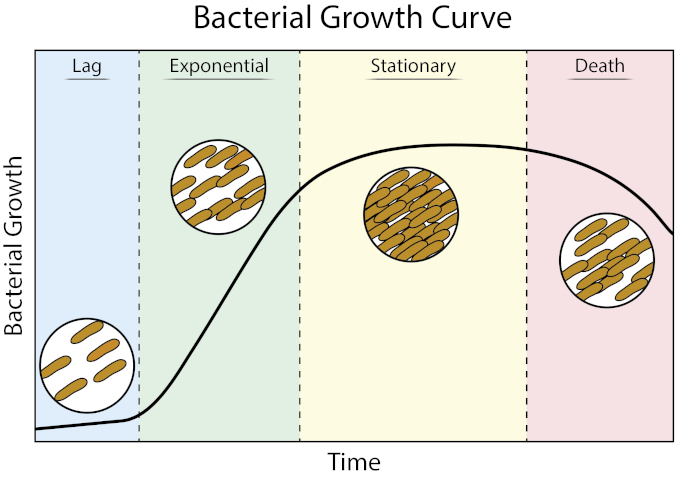
איור 1: עקומת גדילה חיידקית. חיידקים הגדלים בתרבות האצווה מתקדמים בארבעה שלבים של צמיחה: עיכוב, מעריכי, נייח ומוות. שלב ההשהיה הוא פרק הזמן שלוקח לחיידקים להגיע למצב פיזיולוגי המסוגל לצמיחה וחלוקה מהירה של תאים. שלב מעריכי הוא השלב של צמיחת תאים וחלוקה המהירים ביותר שבמהלכו שכפול DNA, שעתוק RNA וייצור חלבונים מתרחשים כולם בקצב קבוע ומהיר. שלב נייח מאופיין בהאטה ורמה של צמיחה חיידקית עקב מגבלה תזונתית ו/או הצטברות ביניים רעילה. שלב המוות הוא השלב שבו מתרחשת תמה של תאים כתוצאה ממגבלות תזונתיות חמורות.
שלב ההשהיה הוא פרק הזמן שלוקח לחיידקים להגיע למצב פיזיולוגי המסוגל לצמיחה וחלוקה מהירה של תאים. עיכוב זה מתרחש מכיוון שלוקח זמן לחיידקים להסתגל לסביבה החדשה שלהם. לאחר שהרכיבים התאיים הדרושים נוצרים בשלב ההשהיה, החיידקים נכנסים לשלב המעריכי של הצמיחה שבו שכפול DNA, שעתוק RNA וייצור חלבונים מתרחשים כולם בקצב קבוע ומהיר (2). קצב צמיחת התאים המהירים וחלוקתם במהלך השלב המעריכי מחושב כזמן ייצור, או זמן הכפלה, והוא הקצב המהיר ביותר שבו החיידקים יכולים לשכפל בתנאים הנתונים (1). זמן ההכפלה יכול לשמש כדי להשוות תנאי גדילה שונים כדי לקבוע מי נוח יותר עבור צמיחה חיידקית. שלב הגידול המעריכי הוא מצב הגידול הרב ביותר לשחזור, שכן פיזיולוגיה של תאי חיידקים עקבית בכל האוכלוסייה (3). שלב נייח עוקב אחר השלב המעריכי שבו רמות צמיחת התאים. שלב נייח מובא עקב דלדול מתזונה ו/או הצטברות של מתווכים רעילים. תאים חיידקיים ממשיכים לשרוד בשלב זה, אם כי קצב השכפול וחלוקת התאים מצטמצם באופן דרסטי. השלב האחרון הוא מוות, שבו דלדול מתזונה חמור מוביל לתדלוק של תאים. התכונות של עקומת הצמיחה המספקות את המידע הרב ביותר כוללות את משך שלב ההשהיה, זמן ההכפלה וצפיפות התא המרבית אליה הגיעה.
כימות של חיידקים בתרבית אצווה ניתן לקבוע באמצעות יחידות יוצרות מושבה ומדידות צפיפות אופטית. ספירה לפי יחידות יוצרות מושבה (CFU) מספקת מדידה ישירה של ספירת תאים חיידקיים. יחידת המדידה הסטנדרטית עבור CFU היא מספר החיידקים הניתנים לתחנות הקיימים לכל 1 מ"ל של תרבות (CFU / mL) שנקבעו על ידי דילול סדרתי וטכניקות ציפוי מתפשטות. עבור כל נקודת זמן, מבוצעת סדרת דילול של 1:10 של תרבות האצווה ו- 100 מיקרול של כל דילול מפוזרים באמצעות מפזר תאים.
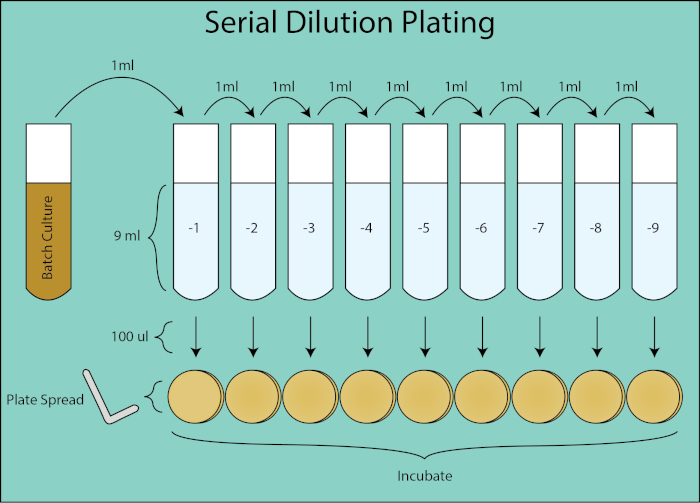
איור 2. שרטוט ציפוי דילול סדרתי. זרימה כללית ל ציפוי דילול מתרבות האצווה. תרבות האצווה מדוללת באופן סדרתי 1:10 על-ידי העברת 1 מ"ל של הדילול הקודם לצינור הבא המכיל 9 מ"ל PBS. מכל צינור דילול, 100 μl הוא מפוזר מצופה באמצעות מפיץ צלחת שהוא דילול נוסף של 1:10 כפי שהוא 1/10את הנפח של נפח 1 מ"ל בעת חישוב CFU / mL. צלחות הם דגירה והספירה פעם מושבות כלנית לגדול על הצלחות.
לאחר מכן הלוחות דוגרים בן לילה ומושבות כלונסאות נפרמות. לוח הדילול שצמח 30-300 מושבות משמש לחישוב CFU / mL עבור נקודת הזמן הנתונה (4, 5). וריאציה סטוכסטית בספירת המושבות מתחת לגיל 30 כפופה לשגיאה גדולה יותר בחישוב של CFU / mL וספירת מושבות הגדולות מ -300 ניתן להמעיט בערכן עקב צפיפות וחפיפה במושבה. באמצעות גורם הדילול עבור הצלחת הנתונה, ניתן לחשב את ה- CFU של תרבות האצווה עבור כל נקודת זמן.
צפיפות אופטית נותנת קירוב מיידי של ספירת תאים חיידקיים נמדד באמצעות ספקטרופוטומטר. הצפיפות האופטית היא מדד לספיגה של חלקיקי אור העוברים דרך 1 ס"מ של תרבות ומזוהים על ידי חיישן פוטודיודה (6). הצפיפות האופטית של תרבית נמדדת ביחס לתקשורת ריקה ומתגברת ככל שצפיפות החיידקים גדלה. עבור תאים חיידקיים, אורך גל של 600 ננומטר (OD600) משמש בדרך כלל בעת מדידת צפיפות אופטית (4). על ידי יצירת עקומה סטנדרטית הנוגעת ליחידות יצירת מושבה וצפיפות אופטית, ניתן להשתמש במדידת הצפיפות האופטית כדי להעריך בקלות את ספירת תאי החיידקים של תרבית אצווה. עם זאת, מערכת יחסים זו מתחילה להידרדר כבר 0.3 OD600 כמו תאים מתחילים לשנות צורה לצבור מוצרים חוץ תאיים במדיה, המשפיעים על קריאת הצפיפות האופטית כפי שהוא מתייחס CFU (7). שגיאה זו הופכת בולטת יותר במהלך שלבי נייח ומוות.
כאן, Escherichia coli גדל מרק לוריא-ברטאני (LB) ב 37 מעלות צלזיוס במהלך 30 שעות (7). הן עקומות צמיחה CFU / mL והן עקומות צמיחה בצפיפות אופטית נוצרו, כמו גם העקומה הסטנדרטית הנוגעת לצפיפות אופטית ל- CFU.
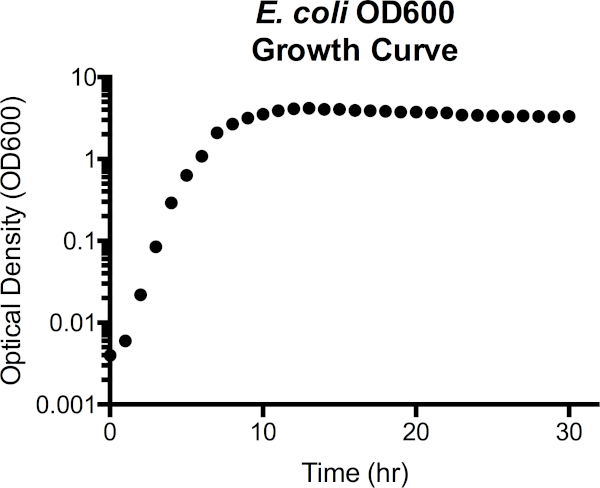
איור 3. Escherichia coli צפיפות אופטית באורך גל 600 ננומטר (OD600) עקומת גדילה. ערכי צפיפות אופטית נלקחו ישירות מהספקטרופוטומטר לאחר ריקון עם מדיית LB סטרילית. ערכי OD600 הגדולים מ- 1.0 דוללו 1:10 על-ידי שילוב של תרבות 100 מיקרול עם 900 μl LB טרי, נמדד שוב ולאחר מכן הוכפל ב- 10 כדי להשיג את הערך OD600. שלב זה נלקח כמו הדיוק במדידה של ספקטרופוטומטר מופחת בצפיפות תאים גבוהה. מהעיקול, שלב ההשהיה משתרע על 1h של צמיחה, מעברים לשלב מעריכי מ 2h ל 7h, ואז מתחיל לרמה, נכנס לשלב נייח. שלב המוות אינו מעבר מוחלט, עם זאת, כמו צפיפות אופטית בהדרגה מתחיל לרדת לאחר 15h.

איור 4. עקומת הצמיחה של מושבת Escherichia coli ליצירת יחידה למיליליטר (CFU/mL). ערכי CFU/mL עבור כל נקודת זמן חושבו מתוך לוח הדילול שהכיל 30-300 מושבות. מהעיקול, שלב ההשהיה משתרע על פני כ-2h של צמיחה, מעברים לשלב מעריכי מ-2h ל-7h, ואז מתחילים לרמה, נכנסים לשלב נייח. שלב המוות אינו מעבר מוחלט, עם זאת, כמו CFU / mL בהדרגה מתחיל לרדת לאחר 15 שעות משיא של 2 x 109 לכ 5 x 108 ב 30 שעות.
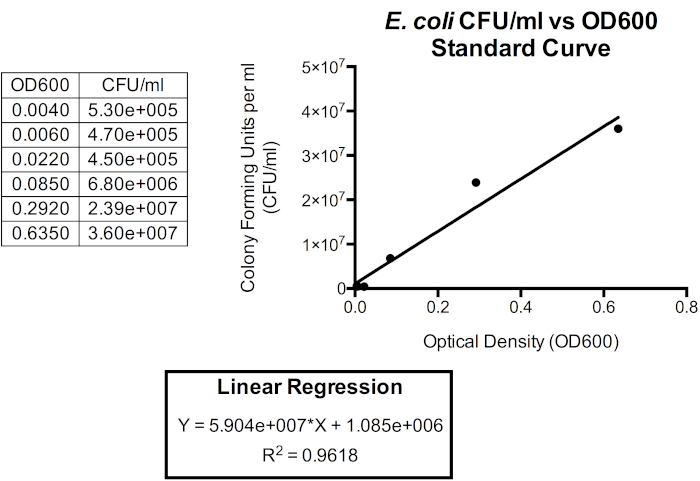
איור 5. עקומת תקינה עבור CFU/mL לעומת OD600. רגרסיה ליניארית יכולה לשמש כדי לקשר יחידות אלה, כך צפיפות אופטית עשויה לשמש צפיפות תאים חיידקי משוער. ניתן להשתמש בצפיפות אופטית כדי לספק קירוב מיידי של CFU / mL של תרבות האצווה. כאן, רק שש נקודות הזמן הראשונות מותוותות מכיוון שהקשר בין OD600 ל- CFU/mL פחות מדויק מעבר ל- 1.0 OD600 כאשר צורת התא ומוצרים חוץ-תאיים מתחילים להצטבר כאשר החיידקים נכנסים לשלב נייח, המתרחש זמן קצר לאחר שהגיעו ל- 1.0 OD600. שינויים בצורת התא ובמוצרים חוץ תאיים במדיה משפיעים על קריאת הצפיפות האופטית ולכן הקשר בין צפיפות אופטית למספר החיידקים בתרבות מושפע גם הוא.
זמן ההכפלה נקבע גם הוא להיות 15 דקות ו -19 שניות. מנתונים אלה, ניתן לדמיין את יכולת הצמיחה ב- LB עבור E. coli ולהשתמש בה להשוואה בין מדיה או חיידקים שונים.
Procedure
1. הגדרת
- חומרי מעבדה נדרשים: מדיה נוזלית, מדיית אגר מוצקה, צלוחיות ארלנמאייר, מברכות 15 מ"ל, תמיסת מלח חוצצת פוספט (PBS), מפיץ תאים חיידקיים, 70% אתנול וספטרופיוטומטר. יש לעקר את כל הפתרונות וכלי הזכוכית לפני השימוש.
- הכן את תחנת העבודה על ידי עיקור עם 70% אתנול. לעבוד ליד מבער בונזן כדי למנוע זיהום של מדיה.
- בעת עבודה עם חיידקים, ציוד מגן אישי מתאים וטכניקה אספטית יש להשתמש. חלוק מעבדה וכפפות נדרשים בעת עבודה עם תרביות חיידקים.
- מתכונים למאגרים, פתרונות ות reagents
- תמיסת מלח חוצץ פוספט (PBS) (8).
- לוריא-ברטאני מרק (LB) (9).
2. פרוטוקול
- הכנת מדיה
- זהה את מדיה הצמיחה שבה לגדל את החיידקים ולהכין הן מרק נוזלי אגר מוצק (1.5% w / v אגר) מדיה בבקבוקים autoclavable נפרדים. כאן, מרק LB אגר LB היו מוכנים לצמיחה של Escherichia coli.
- לחטא את המדיה עם מכסה מהודק למחצה ב autoclave להגדיר 121 °C (55 °F) במשך 35 דקות.
- עבור מדיה אגר, לאחר autoclaving, מניחים באמבט מים להגדיר 50 °C (50 °F) במשך 30 דקות כדי להתקרר. לאחר התקררות, יוצקים 20-25 מ"ל אגר מדיה לתוך 100x15mm עגול פטרי מנות. אפשרו לצלחות לקבוע 24 שעות בטמפרטורת החדר לפני השימוש.
- הכנה ראשונית של חיידקים
- ממלאי קפוא, חיידקי פסים לבידוד על אגר מדיה נבחר כדי לקבל מבודדי מושבה אחת. דגירה בתנאי גדילה המותרים לחיידקים הנבחרים. כאן, E. coli הוא פסים על אגר LB והוא דגירה ב 37 °C (16-18h).
- באמצעות לולאת חיסון סטרילית, בחר מושבה אחת מצלחת הפס ולחסן מדיה נוזלית 4 מ"ל במבחנה של 15 מ"ל ולגדול בתנאים המותרים לחיידקים שנבחרו. כאן, E. coli גדל ב 37 °C (50 °F) עם רועד ב 210 סל"ד לילה (16-18h).
- כיוונון עקומת גדילה
- הכנת בקבוקון צמיחה
- בקבוקוני ארלנמייר בגודל מתאים. בדרך כלל, נעשה שימוש ביחס של 1:5 בין מדיה לאמצעי האחסון הכולל של הבקבוקון. כאן, 100 mL LB מדיה משמש בקבוקון 500 מ"ל.
- באמצעות פיפטה סרולוגית, להעביר מדיה סטרילית לבקבוק ארלנמייר.
- הכנת סדרת דילול
- תוויות 15 מ"ל מבחנות: -1, -2, -3, -4, -5, -6, -7, -8, ו -9, הפצת PBS 9mL לכל אחד. מספרים אלה תואמים לגורם הדילול המשמש לחישוב CFU/mL. יש צורך בערכה חדשה של צינורות עבור כל נקודת זמן של איסוף. (איור 2)
- הכנת צלחת אגר
- תוויות לוחיות עם זמן איסוף וגורם דילול. עבור כל נקודת זמן תהיה צלחת אחת עבור כל דילול.
- הכנת בקבוקון צמיחה
- פרוטוקול עקומת גדילה
- חיסון מדיה
- באמצעות תרבות נוזלית לילה שהוכנה כחלק מצעד 2.2.2, לחסן את התקשורת הבקבוקון עם 1:1000 נפח של תרבות. כאן, 100 μL תרבות נוזלית לילה מתווסף מדיה 100 mL LB.
- מערבבים את התקשורת כדי להפיץ באופן שווה את החיידקים.
- אוסף נקודות זמן
- כיוונון תנאי צמיחה
- מניחים בקבוקון בתנאי גדילה ניסיוניים שנבחרו עבור החיידקים הנתון. נקודות זמן יש לקחת לעתים קרובות עבור חיידקים הגדלים במהירות וניתן לקחת במרווחי זמן ארוכים יותר עבור חיידקים הגדלים לאט. כאן, E. coli גדל ב 37 °C עם רועד ב 210 מהפכות לדקה (סל"ד) ונקודות זמן נלקח כל שעה אחת.
- מדידת צפיפות אופטית (OD600)
- בכל נקודת זמן, כולל נקודת הזמן ההתחלתית (t = 0), לסגת 1 מ"ל של תרבית חיידקים ולחלק לתוך cuvette ספקטרופוטומטר.
- נגב את הקובט נקי ורשום את הצפיפות האופטית אורך גל של 600 ננומטר. אם קריאת הצפיפות האופטית גדולה מ- 1.0, דלל 100 μL של תרבות 1:10 עם מדיה טרייה של 900 μL, תעד את הצפיפות האופטית והכפל ערך זה ב- 10 עבור מדידת OD600.
- מדידת יחידת יצירת מושבה (CFU/mL)
- בכל נקודת זמן, לסגת 1 מ"ל של תרבות חיידקים ולחלק לתוך מבחן זכוכית -1 המכיל 9 מ"ל של PBS.
- עבור סדרת הדילול, להעביר באופן סדרתי 1 מ"ל מהצינור -1 למטה כל צינורות דילול אל -9, מערבולת לאחר כל העברה. (איור 2)
- עבור כל דילול, לחלק 100 μL של השעיית תא לצלחת אגר מדיה מוצקה שכותרתו בהתאמה. (איור 2)
- באמצעות מפזר תאים כי כבר מעוקר אתנול, עבר דרך להבת מבער Bunsen, מקורר על ידי נגיעה על פני השטח של אגר, להפיץ את 100 μL של השעיית התא עד פני השטח של צלחת אגר מתייבש.
- לדגור על לוחות ההתפשטות הפוכים בטמפרטורה התומכת בצמיחת החיידקים. כאן, E. coli הוא דגירה ב 37°C.
- לאחר הדגירה, ברגע שמושבות נראות לעין מתעוררות, לספור את מספר מושבות החיידקים על כל צלחת ולתעד ערכים אלה יחד עם גורם הדילול הקשורים שלהם עבור כל הלוחות בכל נקודת זמן.
- כיוונון תנאי צמיחה
- חיסון מדיה
3. ניתוח נתונים ותוצאות
- צפיפות אופטית (OD600) נתח עקומת גדילה
- התווה את הצפיפות האופטית (OD600) לעומת הזמן בסולם חצי יומן. (איור 3)
- מושבה יוצר יחידה (CFU / מ"ל) עקומת גדילה התוויה
- עבור כל נקודת זמן, בחר את לוח הדילול שבו ספירת המושבה נפלה בטווח של 30-300 חיידקים. הכפל את מספר ספירת המושבות בגורם הדילול ולאחר מכן ב- 10 כאשר התפשטות 100 μL נחשבת דילול נוסף של 1:10 בעת חישוב CFU/ mL.

- התווה את יחידות יצירת המושבה לעומת זמן בקנה מידה של יומן למחצה. (איור 4)
- עבור כל נקודת זמן, בחר את לוח הדילול שבו ספירת המושבה נפלה בטווח של 30-300 חיידקים. הכפל את מספר ספירת המושבות בגורם הדילול ולאחר מכן ב- 10 כאשר התפשטות 100 μL נחשבת דילול נוסף של 1:10 בעת חישוב CFU/ mL.
- הנוגעים לצפיפות אופטית ויחידות יוצרות מושבה
- התווה את יחידות יצירת המושבה לעומת צפיפות אופטית בקנה מידה ליניארי עבור קריאות OD600 פחות או שווה ל- 1.0 OD600 מכיוון שהקשר בין OD600 ל- CFU/mL פחות מדויק מעבר ל- 1.0 OD600. כאן, שש נקודות הזמן הראשונות זוממות. (איור 5)
- צור קו מגמה של רגרסיה ליניארית המציג את המשוואה ואת ערך R2.
- קביעת זמן הכפלת חיידקים
- באמצעות התוויית עקומת הצמיחה של היחידה היוצרת מושבה, במהלך שלב מעריכי, זהה שתי נקודות בגרף עם השיפוע התלול ביותר ביניהן כדי לחשב את זמן ההכפלה.
- חישוב זמן ההכפלה

- ΔTime = t 2 - t1, כאשר t1 = נקודת זמן 1 ו- t2 = נקודת זמן 2
-
 כאשר b = מספר החיידקים ב- t2, B = מספר החיידקים ב- t1, ו- n = מספר הדורות., נגזר מ:
כאשר b = מספר החיידקים ב- t2, B = מספר החיידקים ב- t1, ו- n = מספר הדורות., נגזר מ: .
- חשב זמן הכפלה באמצעות:

חיידקים מתרבים בתהליך שנקרא חלוקת תאים, אשר גורם לשני תאי בת זהים. אם תנאי הצמיחה נוחים, אוכלוסיות חיידקים יגדלו באופן אקספוננציאלי.
עקומות צמיחה חיידקיות מתווה את כמות החיידקים בתרבית כפונקציה של זמן. עקומת צמיחה טיפוסית מתקדמת דרך ארבעה שלבים: שלב השהיה, שלב מעריכי, שלב נייח ושלב מוות. שלב הפיגור הוא הזמן שלוקח לחיידקים להגיע למצב שבו הם יכולים לגדול ולהתחלק במהירות. לאחר מכן, החיידקים עוברים לשלב המעריכי, המאופיין בצמיחה מהירה של תאים וחלוקה. קצב הצמיחה המעריכית של תרבית החיידקים בשלב זה יכול לבוא לידי ביטוי כזמן ההכפלה, הקצב המהיר ביותר שבו חיידקים יכולים להתרבות בתנאים מסוימים. השלב הנייח מגיע בהמשך, שבו רמות צמיחת תאים חיידקיים ושיעורי הצמיחה והמוות אפילו בחוץ עקב דלדול חומרים מזינים סביבתיים. לבסוף, החיידקים נכנסים לשלב המוות. זה המקום שבו צמיחה חיידקית יורדת בחדות דלדול מיז'ן חמור מוביל lysing של תאים.
שתי טכניקות יכולות לשמש כדי לכמת את כמות החיידקים הקיימים בתרבות ולתכנן עקומת גדילה. הראשון של אלה הוא באמצעות יחידות יוצרות מושבה, או יחידות CFUs. כדי להשיג CFUs סדרה אחת עד עשר של תשעה דילול מבוצע בנקודות זמן רגילות. הראשון של דילול אלה, שלילי אחד בדוגמה זו, מכיל 9mL של PBS ו 1mL של התרבות החיידקית. התוצאה היא 1:10 גורם דילול. לאחר מכן, 1mL של פתרון זה מועבר לצינור הבא, מינוס שתיים, וכתוצאה מכך גורם דילול 1:100. תהליך זה ממשיך דרך הצינור האחרון, מינוס תשע, וכתוצאה מכך גורם דילול סופי של 1:1 מיליארד. לאחר מכן, 100 מיקרוליטרים של כל דילול מצופה. לאחר מכן הלוחות דוגרים ומושבות הציפורן נספרות. לוח הדילול לנקודת זמן נתונה שגדלה בין 30 ל -300 מושבות משמשת לחישוב CFUs למיליליטר עבור נקודת זמן זו.
השיטה הנפוצה השנייה למדידת ריכוז חיידקים היא הצפיפות האופטית. הצפיפות האופטית של תרבות ניתן למדוד באופן מיידי, ביחס ריק מדיה, עם ספקטרופוטומטר. בדרך כלל אורך גל של 600 ננומטר, המכונה גם OD600, משמש למדידות אלה, אשר להגדיל כמו צפיפות התא עולה. בעוד צפיפות אופטית היא פחות מדויקת מאשר CFUs, זה נוח כי זה יכול להיות מושגת באופן מיידי ודורש ריאגנטים מעטים יחסית. ניתן להשתמש בשתי הטכניקות יחד כדי ליצור עקומה סטנדרטית שמקנה באופן מדויק יותר את ספירת התאים החיידקיים של תרבית. בסרטון וידאו זה, תלמד כיצד להשיג CFUs ומדידות OD600 מדידות מדלל סדרתי מתוזמן של E. coli. לאחר מכן, שתי עקומות צמיחה באמצעות מדידות CFU ו- OD600, בהתאמה, יותנו לפני שהן קשורות על-ידי עקומה סטנדרטית.
בעת עבודה עם חיידקים, חשוב להשתמש בציוד המגן האישי המתאים כגון חלוק מעבדה וכפפות ולבחון טכניקה אספטית נכונה.
לאחר מכן, לחטא את תחנת העבודה עם 70% אתנול. ראשית, להכין את מרק LB ומדיית אגר מוצק LB בבקבוקים autoclaveable נפרדים. לאחר סגירה חלקית של כובעי הבקבוקים, לעקר את התקשורת ב autoclave להגדיר 121 מעלות צלזיוס במשך 35 דקות. לאחר מכן, אפשרו למדיית אגר להתקרר באמבט מים שנקבע ל-50 מעלות צלזיוס למשך 30 דקות. לאחר התקררות, יוצקים 20 עד 25 מ"ל לתוך כל צלחת פטרי. לאחר מכן, אפשרו לצלחות להגדיר במשך 24 שעות בטמפרטורת החדר.
כדי להכין את מבודדי המושבה הבודדת כי מאוחר יותר ישמשו כדי לייצר תרבית חיידקים נוזלית, להשתמש במלאי קפוא בעבר וטכניקת ציפוי פס נכונה כדי פס E. coli לבידוד על אגר LB. לדגור על המנה ב 37 מעלות צלזיוס לילה. לאחר מכן, לקרר לולאת חיסון מעוקר להבה על אגר לפני בחירת מושבה אחת מן הלוח מפוספס. לחסן 4 מ"ל של מדיה נוזלית במבחנה 15 מ"ל. לאחר מכן, לגדל את E. coli ב 37 מעלות צלזיוס לילה עם רועד ב 210 סל"ד.
כדי להגדיר את נפח 1:1000 של תרבית חיידקים שישמש בעקומת הצמיחה, תחילה לקבל בקבוק 500 מ"ל Erlenmeyer autoclaved. לאחר מכן, השתמש פיפטה סרולוגית 50 מ"ל להעביר 100 מ"ל של מדיה סטרילית לבקבוקון. לאחר מכן, תווית תשע מבחנה 15 מ"ל ברציפות כאחד עד תשע. מספרים אלה תואמים לגורם הדילול שישמש לחישוב יחידת יצירת המושבה, או CFU. לאחר מכן, הוסף 9 מ"ל של PBS 1X לכל צינור. לאחר מכן, לתייג את לוחות אגר מוכן עם נקודות הזמן המתאימות וגורמי דילול כי יגדל. בדוגמה זו עם E. coli, לאחר נקודת זמן ההתחלה, נקודות זמן נלקחות אחת לשעה. באמצעות תרבות E. coli נוזלית שהוכנה בעבר, לחסן את התקשורת בבקבוקון ארלנמאייר 500 מ"ל אוטומטי עם 1:1000 נפח של תרבות. מערבבים את התקשורת כדי להפיץ באופן שווה את החיידקים.
לאחר ריקון ספקטרופוטומטר, לנקות את cuvette עם לנגב ללא מוך. לאחר מכן, לחלק 1 מ"ל של התרבות לתוך cuvette ולהניח אותו לתוך ספקטרופוטומטר כדי להשיג את הצפיפות האופטית של התרבות בנקודת זמן אפס. לאחר מכן, לגדל את E. coli ב 37 מעלות צלזיוס עם רועד ב 210 סל"ד. בכל נקודת זמן לאחר נקודת אפס, לסגת עוד 1 מ"ל של תרבית חיידקים מהבקבוקון ולחזור על מדידת הצפיפות האופטית. אם קריאת הצפיפות האופטית גדולה מ-1.0, לדלל 100 מיקרוליטרים של תרבית חיידקים עם 900 מיקרוליטרים של מדיה טרייה ואז למדוד את הצפיפות האופטית פעם נוספת. ניתן להכפיל ערך זה ב- 10 עבור מדידת OD 600.
כדי להשיג את מדידת יחידת יצירת המושבה עבור כל נקודת זמן, למשוך 1 מ"ל נוסף של תרבית חיידקים מן הבקבוקון בכל נקודת זמן. מחלקים את תרבית החיידקים לתוך המבחנה השלילית והמערבולת לערבב. לאחר מכן, בצע את סדרת הדילול על ידי העברת 1 מ"ל תחילה מן הצינור השלילי אחד לתוך שני צינור שלילי מערבולת לערבב. העבר 1 מ"ל מהצינור השני השלילי לצינור השלישי השלילי והמערבולת לערבב. תמשיך את ההעברה הסדרתית הזו במורד כל צינורות הדילול לצינור מינוס 9. יש לפזר 100 מיקרוליטרים של השעיית תאים על הצלחת המסומנת בהתאמה לכל דילול. עבור כל דילול, לחטא מפזר תא באתנול, להעביר אותו דרך להבת מבער Bunsen, ולקרר אותו על ידי נגיעה על פני השטח של אגר הרחק מן החסן. לאחר מכן, השתמש במפיץ התאים כדי להפיץ את השעיית התא עד פני השטח של צלחת אגר מתייבש. לדגור על הלוחות הפוכים ב 37 מעלות צלזיוס. לאחר שמושבות גלויות מתעוררות, לספור את מספר מושבות חיידקים על כל צלחת. הקלט ערכים אלה ואת גורמי הדילול המשויכים להם עבור כל צלחת בכל נקודת זמן.
כדי ליצור עקומת צמיחה OD 600, לאחר הבטחת כל נקודות הנתונים מוזנות כראוי לתוך טבלה, בחר את כל נקודות הזמן ואת הנתונים המתאימים שלהם. כדי ליצור מושבה היוצרת חלקת עקומת גדילה של יחידה, בחר את לוח הדילול שבו ספירת המושבה נפלה בטווח של 30 עד 300 חיידקים עבור כל נקודת זמן. הכפל את מספר ספירת המושבות בגורם הדילול, ולאחר מכן בעשר. הסיבה לכך היא התפשטות 100 microliters נחשב דילול נוסף 1:10 בעת חישוב מושבה יצירת יחידות למיליליטר. לאחר מכן, התווה את יחידות יצירת המושבה לעומת זמן בסולם יומן למחצה.
חלקות אלה המיוצרות עם מדידות OD 600 ו- CFU, בהתאמה, יכולות לספק מידע רב ערך על קינטיקה של צמיחה E. coli. ניתן להעריך את הצפיפות האופטית ויחידות יצירת המושבה, כך שניתן להעריך את ה- CFUs למיליליטר ממדידות OD 600, תוך חיסכון בזמן ובחומרים בניסויים עתידיים.
כדי לעשות זאת, התווה את יחידות יצירת המושבה כנגד הצפיפות האופטית בקנה מידה ליניארי עבור קריאות OD 600 פחות או שווה ל- 1. 0. לאחר מכן, ליצור קו מגמה רגרסיה ליניארית בפורמט Y = MX + B, כאשר M הוא השיפוע ו- B הוא יירוט y. לחץ באמצעות לחצן העכבר הימני על נקודות הנתונים ובחר הוסף קו מגמה וליניארי. לאחר מכן, סמן את התיבה כדי להציג את המשוואה בתרשים ולהציג את הערך הריבועי R בתרשים. הערך בריבוע R הוא המדידה הסטטיסטית של מידת ההתאמה של הנתונים לקו הרגרסיה המותאם. בדוגמה זו, 6 נקודות הזמן הראשונות מותוותות עם OD 600 על ציר x ו- CFUs למיליליטר בציר y. בניסויים עתידיים עם אותם תנאי צמיחה, ניתן לחבר ערכי שיפוע ו- y-יירוט אלה למשוואה זו כדי להעריך CFUs מקריאות OD 600. לאחר מכן, הביטו במושבה היוצרת את חלקת עקומת הצמיחה של היחידה. במהלך השלב המעריכי, זהה שתי נקודות זמן עם השיפוע התלול ביותר ביניהן. כדי לחשב את זמן ההכפלה, חשב תחילה את השינוי בזמן בין נקודות הזמן שנבחרו. לאחר מכן, חשב את השינוי בדורות באמצעות המשוואה המוצגת כאן. כאן, מארז b התחתון הוא מספר החיידקים בנקודת זמן 3 ומדרגה עליונה B היא מספר החיידקים בנקודת זמן 2. לבסוף, לחלק את השינוי בזמן על ידי השינוי בדורות. בדוגמה זו, זמן ההכפלה הוא 0. 26 שעות או 15 דקות ו-19 שניות. השוואת זמני הכפלה על פני טיפול ניסיוני שונה מאפשרת לנו לזהות את תנאי הצמיחה הטובים ביותר עבור מינים חיידקיים מסוימים. לכן, הטיפול עם זמן ההכפלה הנמוך ביותר יהיה האופטימלי ביותר של התנאים שנבדקו.
Subscription Required. Please recommend JoVE to your librarian.
Results
חלקות של יחידות יוצרות מושבה וצפיפות אופטית הן שתי דרכים לדמיין קינטיקה של צמיחה. על-ידי קביעת הקשר בין CFU/mL ל- OD600, מתווה הצפיפות האופטית מספק גם הערכה של CFU/mL לאורך זמן. תנאים המביאים לזמן ההכפלה הקצר ביותר נחשבים אופטימליים לצמיחת החיידקים הנתון.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
עקומות גדילה הן בעלות ערך להבנת קינטיקה הצמיחה והפיזיולוגיה של החיידקים. הם מאפשרים לנו לקבוע כיצד חיידקים מגיבים בתנאי גדילה משתנים, כמו גם להגדיר את פרמטרי הצמיחה האופטימליים עבור חיידק נתון. יחידות יוצרות מושבה ותיתות צפיפות אופטית מכילות מידע רב ערך המתאר את משך שלב ההשהיה, צפיפות התאים המרבית אליה הגיעו ומאפשרות חישוב זמן הכפלה חיידקי. עקומות צמיחה מאפשרות גם השוואה בין חיידקים שונים באותם תנאי גדילה. בנוסף, צפיפות אופטית מספקת אמצעי לתקנון inoculums הראשוני, שיפור עקביות בניסויים אחרים.
קביעת הגישה שבה יש להשתמש בעת תכנון ניסוי עקומת צמיחה דורשת התחשבות. כשיטה המועדפת ליצירת עקומות צמיחה, התוויות יחידות יוצרות מושבה משקפות בצורה מדויקת יותר את ספירת התאים הקיימים בתרבות האצווה. חלקות יחידת יצירת מושבה מאפשרות גם למדידת צמיחה חיידקית בתנאים שאחרת יפריעו למדידת צפיפות אופטית. עם זאת, זהו תהליך שגוזל זמן רב יותר, הדורש שימוש נרחב של ריאגנטים, ויש לבצעו באופן ידני. התוויות צפיפות אופטית פחות מדויקות ומספקות רק הערכה של יחידות יוצרות המושבה, הדורשות יצירת עקומה סטנדרטית עבור כל חיידק ייחודי. צפיפות אופטית משמשת בעיקר לנוחותו מכיוון שהיא גוזלת הרבה פחות זמן ואינה דורשת ריאגנטים רבים לביצוע. מה שהכי אטרקטיבי לצפיפות אופטית, הוא כי חממות ספקטרופוטומטריות יכולות ליצור באופן אוטומטי עקומות צמיחה, להגדיל במידה ניכרת את מספר תנאי התרבות שניתן לבדוק בבת אחת ולבטל את הצורך להשתתף כל הזמן בתרבות.
Subscription Required. Please recommend JoVE to your librarian.
References
- R. E. Buchanan. 1918. Life Phases in a Bacterial Culture. J Infect Dis 23:109-125.
- CAMPBELL A. 1957. Synchronization of cell division. Bacteriol Rev 21:263-72.
- Wang P, Robert L, Pelletier J, Dang WL, Taddei F, Wright A, Jun S. 2010. Robust growth of Escherichia coli. Curr Biol 20:1099-103.
- Goldman E, Green LH. 2015. Practical Handbook of Microbiology, Third Edition. CRC Press.
- Ben-David A, Davidson CE. 2014. Estimation method for serial dilution experiments. J Microbiol Methods 107:214-221.
- Koch AL. 1968. Theory of the angular dependence of light scattered by bacteria and similar-sized biological objects. J Theor Biol 18:133-156.
- Sezonov G, Joseleau-Petit D, D'Ari R. 2007. Escherichia coli physiology in Luria-Bertani broth. J Bacteriol 189:8746-9.







 כאשר b = מספר החיידקים ב- t2, B = מספר החיידקים ב- t1, ו- n = מספר הדורות., נגזר מ:
כאשר b = מספר החיידקים ב- t2, B = מספר החיידקים ב- t1, ו- n = מספר הדורות., נגזר מ: