Overview
מקור: אנה בלכברג1, רולף לוד1
1 המחלקה למדעים קליניים לונד, החטיבה לרפואת זיהומים, המרכז הביו-רפואי, אוניברסיטת לונד, 221 00 לונד שבדיה
הידע על האינטראקציות בין אנטיביוטיקה לחיידקים חשוב בהבנת האופן שבו חיידקים מפתחים עמידות לאנטיביוטיקה. בשנת 1928, אלכסנדר פלמינג גילה פניצילין, אנטיביוטיקה המפעילה את תפקודה האנטיבקטריאלי על ידי הפרעה להתחדשות דופן התא (1). אנטיביוטיקה אחרת עם מנגנוני פעולה מגוונים התגלו לאחר מכן, כולל תרופות המעכבות שכפול DNA ותרגום חלבונים בחיידקים; עם זאת, לא פותחו אנטיביוטיקה חדשה בשנים האחרונות. העמידות לאנטיביוטיקה הנוכחית גדלה, וכתוצאה מכך מחלות זיהומיות חמורות שלא ניתן לטפל בהן ביעילות (2). כאן, אנו מתארים מספר שיטות להערכת עמידות לאנטיביוטיקה באוכלוסיות חיידקים. כל אחת מהשיטות האלה עובדת, ללא קשר למנגנון הפעולה של האנטיביוטיקה המשמשת, כי מוות חיידקי הוא התוצאה הנמדדת. עמידות לאנטיביוטיקה מופצת לא רק במהירות במיוחד באמצעות הגדרות בית החולים, אלא גם ברחבי החברה. על מנת לחקור אמצעי התנגדות כאלה, פותחו שיטות שונות כולל מבחן אפסילומטר (מבחן E) ומבחן דילול מרק (3).
מבחן E הוא שיטה מבוססת היטב והוא כלי חסכוני המכמת נתוני ריכוז מעכבות מינימלי (MIC), הריכוז הנמוך ביותר של מיקרוביאלית המעכבת צמיחה גלויה של מיקרואורגניזם. בהתאם לזן החיידקי והאנטיביוטיקה המשמשת, ערך המיקרופון יכול להשתנות בין תת מיקרוגרם / מ"ל >1000 מיקרוגרם / מ"ל (4). הבדיקה האלקטרונית מתבצעת באמצעות רצועת פלסטיק המכילה שיפוע אנטיביוטי מוגדר מראש, המוטבע בסולם הקריאה MIC ב- μg/ mL. רצועה זו מועברת ישירות על מטריצת אגר כאשר מוחל על צלחת אגר מחוסנת. לאחר הדגירה, אזור עיכוב אליפטי סימטרי נראה לאורך הרצועה כמו צמיחה חיידקית נמנעת. מיקרופון מוגדר על ידי אזור העיכוב, שהוא נקודת הקצה שבה האליפסה מצטלבים עם הרצועה. שיטה נפוצה נוספת לקביעת MIC היא שיטת דילול המיקרו-ברות. דילול Microbroth משלב ריכוזים שונים של חומר מיקרוביאלית הוסיף למדיום מרק המכיל חיידקים מחוסנים. לאחר הדגירה, MIC מוגדר הריכוז הנמוך ביותר של אנטיביוטיקה המונע צמיחה גלויה (5). זוהי גם שיטה כמותית וניתן להחיל אותה על מספר חיידקים. חסרונות של שיטה זו כוללים את האפשרות של שגיאות בעת הכנת הריכוזים של ריאגנטים ואת המספר הגדול של ריאגנטים הנדרשים לניסוי. מדידת עמידות לאנטיביוטיקה היא הכרחית הן מנקודת מבט קלינית והן מבחינה מחקרית, ושיטות במבחנה אלה של חקירת התנגדות נדונות ומציגות לראווה להלן.
ניתן ליישם את פרופיל ההתנגדות לחיידק מסוים על מנת לייעל את הטיפול האנטיביוטי כדי לקבוע אם המטופל יפיק תועלת מטיפול משולב לעומת טיפול יחיד. לשימוש ביותר מאנטיביוטיקה אחת בבת אחת, חובה לדעת את האינטראקציות שלהם זה עם זה ואם יש להם אפקט תוסף, סינרגטי או עוין. אפקט תוסף ניתן לראות כאשר ההשפעה המשותפת של האנטיביוטיקה שווה את העוצמה של אנטיביוטיקה בודדים הניתנים במינון שווה. סינרגיה בין אנטיביוטיקה, לעומת זאת, קיימת כאשר ההשפעה המשותפת של האנטיביוטיקה חזקה יותר מאשר אם התרופה תינתן לבד (6). החלת שילובים של טיפול מיקרוביאלי משמשת כדי למנוע את התרחשות ההתנגדות מיקרוביאלית ובכך לשפר את ההשפעה של הטיפול האנטיביוטי הפרטני (7). ידע באנטגוניזם חשוב גם כדי למנוע שימוש מיותר בשילובים מיקרוביאליים. מתודולוגיית הבדיקה האלקטרונית מציעה דרכים פשוטות ומספר דרכים לקבוע סינרגיה ואנטגוניזם אפשריים בין סוכנים מיקרוביאליים שונים. על מנת להתמודד עם התפשטות של פתוגנים עמידים לאנטיביוטיקה, ידע על מנגנונים סינרגטיים ואנטגוניסטיים אפשריים של אנטיביוטיקה מסוימת חשוב וכתוצאה מכך יעילות קלינית ונאבקים בעמידות רב-דרוגית.
ניתן לחלק את קביעת סינרגיה באמצעות בדיקות אלקטרוניות לשתי גישות רחבות: בדיקות צולבות ולא צולבות. בעוד ששני מבחני הסינרגיה מסתמכים על הידע הקודם של ערכי MIC בודדים, שתי הגישות שונות במקצת במתודולוגיה ובגישה המושגית. בבדיקת סינרגיה לא צולבת, האנטיביוטיקה הראשונה בזוג שנבדקה מונחת על צלחת אגר מחוסנת בחיידקים. לאחר מתן אפשרות לאנטיביוטיקה מהרצועה הראשונה להחדיר את הצלחת (למשל לאחר שעה), הרצועה מוסרת ורצועה חדשה המכילה את האנטיביוטיקה השנייה ממוקמת בדיוק באותו מקום כמו הראשון, תוך הקפדה למקם את שני ערכי המיקרופון הבודדים זה על גבי זה. לאחר מכן ניתן לנתח את אזור העיכוב המתקבל כמתואר לעיל, וסינרגיה מחושבת בהתבסס על המשוואה 1.
משוואה 1 - ריכוזי מעכבי שברים (FIC)
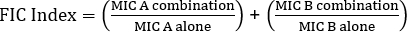
ערכים >0.5 מדגימים סינרגיה.
תוך מתן תגמול לבוחן עם לוחות קלים לניתוח, השיטה היא קצת מייגע וגוזל זמן רב עקב שינוי רצועות, כמו גם את הצורך להשתמש בשתי צלחות לכל ניסוי. במקום זאת, לעתים קרובות משתמשים במבחן צולב. במקום להוסיף את שתי רצועות ה- E-test השונות לאחר מכן זו על גבי זו (לאחר הסרת הראשונה), שתיהן ממוקמות בו-זמנית אך בצורה של צלב (זווית של  90°), כאשר שני ערכי המיקרופון שנקבעו בעבר יוצרים את זווית 90°. בגישה זו יש צורך רק צלחת אחת לכל מבחן סינרגיה, כמו גם פחות עבודה, מה שהופך אותו לבחירה מועדפת למרות היותו קצת יותר קשה לנתח. ניתן לדמיין את ערכי המיקרופון החדשים בגישה המשולבת של האנטיביוטיקה כאזרי העיכוב המותאמים, ולאחר מכן ניתן לקבוע סינרגיה על ידי משוואה 1.
90°), כאשר שני ערכי המיקרופון שנקבעו בעבר יוצרים את זווית 90°. בגישה זו יש צורך רק צלחת אחת לכל מבחן סינרגיה, כמו גם פחות עבודה, מה שהופך אותו לבחירה מועדפת למרות היותו קצת יותר קשה לנתח. ניתן לדמיין את ערכי המיקרופון החדשים בגישה המשולבת של האנטיביוטיקה כאזרי העיכוב המותאמים, ולאחר מכן ניתן לקבוע סינרגיה על ידי משוואה 1.
במקום להשתמש בגישה של צלחת אגר, גישה microbroth לעתים קרובות יכול להיות מועדף בשל הגמישות הגבוהה יותר שלה (למשל היכולת לבחור ריכוזים ספציפיים של אנטיביוטיקה מחוץ לגבולות של רצועת בדיקה אלקטרונית). יתר על כן, בדיקות microbroth מוצעים להיות רגישים יותר בשל הפצה זוגית של אנטיביוטיקה בתמיסה נוזלית, לא בהתאם לניתוק בתוך שלב מוצק (צלחת אגר). בארות במיקרו-לוחית של 96 בארות יתחסנו עם מספר מוגדר של חיידקים (106 cfu/mL: ריכוז חיידקים ניתן להעריך על ידי מדידות OD600 ננומטר, תקני עכוז, או על ידי הפצת דגימות ציפוי מ 10x דילול סדרתי חיידקי), ואנטיביוטיקה בדילולים שונים תתווסף לבארות. באופן דומה, לרצועות E-test MIC נקבע כצומת (טוב / נקודה) עם הריכוז הנמוך ביותר של אנטיביוטיקה מעכב צמיחה גלויה של חיידקים.
מטרה ניסיונית
- הפרויקט שלהלן מתאר אסטרטגיות לקביעת ערכי MIC של פניצילין G וג'נטמיצין של קבוצת סטרפטוקוקוס G על ידי שתי שיטות שונות, E-test ודילול מיקרו-ברוט. עבור E-test, לוחות אגר מולר-הינטון מחוסנים עם קבוצת סטרפטוקוקוס G שימשו בשילוב עם רצועות הדרגתיות של פניצילין G ו / או גנטמיצין; בעוד מרק MH עם 50% דם סוס lysed ו 20 מ"ג / מ"ל β-NAD שימשו עם אנטיביוטיקה מסיסה יחד עם קבוצת סטרפטוקוקוס G בגישה microbroth.
חומרים
- מושבות חיידקים על צלחת אגר דם, מאוחסנות <7 ימים ב 4°C
- לוחות אגר דם
- 0.5 תקן מקפרלנד
- 1% בק"ק2
- 1% H2SO4
- צינור תמיסת מלח (2 מ"ל)
- אפליקטור עם קצה כותנה
- צלחות אגר מולר-הינטון (לוחות MHA)
- מרק MH עם 50% דם סוס lysed ו 20 מ"ג / מ"ל β-NAD (MH-F)
- פניצילין/גנטמיצין (או אנטיביוטיקה מעניינת) (BioMerieux, מרסי ל'אטואל, צרפת, שוודיה)
- פניצילין/גנטמיצין אנטיביוטיקה (או אנטיביוטיקה מעניינת (אבקה/פתרון))
הערה: המדיה הספציפית המשמשת לצמיחת חיידקים עשויה להשתנות עבור מינים שונים.
Procedure
1. בדיקות אפסילומטר (בדיקות אלקטרוניות)
-
הגדרת
- ללבוש כפפות וחלוק מעבדה
- הכן את סביבת העבודה על ידי עיקורו באמצעות 70% אתנול
- לאסוף מולר-הינטון צלחות אגר (לוחות MHA)
-
הכנת תקן עגמת מקפרלנד מס' 0.5
- הכן פתרון של 1% של בריום כלוריד (BaCl2):
יש להוסיף 1 גרם בריום כלוריד נטול מים (BaCl2)במים מזוקקים ב-100 מ"ל. מערבולת היטב. - הכן פתרון של 1% של חומצה גופרתית (H2SO4):
הוסף 1 מ"ל של H מרוכז2SO4 ב 99 מ"ל של מים מזוקקים. מערבולת היטב. - הכן תקן עכוז מקפרלנד מס ' 0.5:
50 μL BaCl2 פתרון ב 5 מ"ל של 1% H2SO4 פתרון. מערבולת הפתרון היטב כדי לקבל השעיה עגבת. - שמור על תקן עכוז מקפרלנד מס' 0.5 בצינור מכוסה בנייר כסף. יש לאחסן ב-25°C למשך 6 חודשים לכל היותר. מערבולת גם לפתרון הומוגני לפני השימוש.
- הכן פתרון של 1% של בריום כלוריד (BaCl2):
-
הכנת לוחות MHA
- לגרד סטרפטוקוקוס קבוצה G חיידקים מצלחת אגר דם באמצעות לולאה סטרילית. מערבבים לתוך 1mL של תמיסת מלח, מערבולת להשעיה של החיידקים.
- השווה את ההשעיה לתקן מקפרלנד מס '0.5 כדי להשיג את אותה עכום על מנת שיהיה לו גודל אינוקולום זהה במהלך הניסויים. התאם את הריכוז באמצעות תמיסת מלח או חיידקים נוספים.
- לחסן את לוחות MHA באמצעות אפליקטור כותנה סטרילי. ספוגית הצלחת בעדינות כדי לכסות את פני השטח. המשך באחת משלוש השיטות המתוארות להלן (1.4-1.6).
-
בדיקת עמידות לאנטיביוטיקה אחת. קבוצת סטרפטוקוקוס G, התנגדות לפניצילין G או גנטמיצין
- הניחו רצועת מבחן אלקטרוני (פניצילין G או גנטמיצין) במרכז צלחת MHA(איור 1 A,B).
- דגירה במשך 18-20 שעות, 37°C.
- קרא את התוצאות. מיקרופון נמדד כאזור העיכוב שחוצה את רצועת הבדיקה האנטיביוטית המדורגת(איור 1 C,D).

איור 1: מבחן אלקטרוני יחיד. מיקום של רצועת בדיקה אלקטרונית של A) פניצילין G ו- B) גנטמיצין על צלחת אגר מולר הינטון מכוסה במושבות חיידקיות של קבוצה G סטרפטוקוצ'י לפני (A ו- B) ואחרי (C ו- D) דגירה לילה ב 37 ° C 5% CO2. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
-
סינרגיה בוחנת גישה צולבת. קבוצת סטרפטוקוקוס G, התנגדות לפניצילין G וג'נטמיצין.
- מניחים שתי רצועות בדיקה אלקטרונית עם אנטיביוטיקה שונה (למשל פניצילין G וגנטמיצין) על צלחת MHA מחוסנת במבנה צולב.
- לקבלת התוצאות המדויקות ביותר, כוון למקם את הצלב בזווית של כ-90° בצומת בין המאזניים בערכי המיקרופון שלהם, שנקבעו בעבר בבדיקת עמידות לאנטיביוטיקה בודדת (איור 2 A).
- שים לב כי ברגע שהרצועות ממוקמות על צלחת אגר, הם לא צריכים להיות מועברים, שכן כמה אנטיביוטיקה אולי כבר נספג על ידי הצלחת. לכן, מתאים יותר לשמור על הרצועות בזווית מעט לא נכונה (למשל 85°) ועד 1-2 מ"מ מערך המיקרופון בפועל. מומלץ להפעיל את הניסוי משולש כדי להפחית את הבעיה.
- דגירה במשך 18-20 שעות, 37°C.
- קרא את התוצאות. MIC נמדד כאזור העיכוב שחוצה את רצועת הבדיקה האנטיביוטית המדורגת בכל רצועת מבחן אלקטרוני בהתאמה (איור 2 B).
- השתמש בנוסחה עבור ריכוז מעכבי שברים (FIC) (משוואה 1) כדי לקבוע סינרגיה.
- מניחים שתי רצועות בדיקה אלקטרונית עם אנטיביוטיקה שונה (למשל פניצילין G וגנטמיצין) על צלחת MHA מחוסנת במבנה צולב.

איור 2: זיהוי סינרגיזם - בדיקה צולבת. תוצאות של בדיקת סינרגיה מיקרוביאלית של מיקרופון של פניצילין G וג'נטמיצין על קבוצת סטרפטוקוקוס G לפני (A)ואחרי (B) דגירה לילה ב 37 ° C 5% CO2. זווית של 90° נוצרת בין שני ערכי MIC בודדים (פניצילין G: 0.094 מיקרוגרם / מ"ל, גנטמיצין: 8 מיקרוגרם / מ"ל). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
-
סינרגיה בודקת גישה לא צולבת. קבוצת סטרפטוקוקוס G, התנגדות לפניצילין G וג'נטמיצין.
- מקם את רצועת הבדיקה האלקטרונית במרכז צלחת MHA(איור 3 A,D).
- סמן היכן היה ערך ה- MIC שנקבע בעבר בכל רצועה.
- דגירה במשך שעה בטמפרטורת החדר.
- יש להשליך את רצועת הבדיקה האלקטרונית עבור כל צלחת MHA(איור 3 B,E).
- מקם את רצועת הבדיקה האלקטרונית השנייה (המכילה אנטיביוטיקה שונה) על שטח הרצועה שהוסרה מוקדם יותר בהתאמה, כך שערכי המיקרופון שלהם יתאימו לסימן ומיושרים.
- דגירה במשך 18-20 שעות, 37°C.
- קרא את התוצאות. מיקרופון נמדד כאזור העיכוב שחוצה את רצועת הבדיקה האנטיביוטית המדורגת בכל רצועת מבחן אלקטרוני בהתאמה (איור 3 C, F).
- על מנת לקבוע סינרגיה, הנוסחה לריכוז מעכבי שברים (FIC) משמשת (משוואה 1).

איור 3: זיהוי סינרגיזם - בדיקה לא צולבת. תוצאות של בדיקת סינרגיה מיקרוביאלית של MIC של פניצילין G וג'נטמיצין על סטרפטוקוקוס קבוצה G. A) רצועת גנטמיצין (8 מיקרוגרם / מ"ל מרוכז) על גבי קבוצת סטרפטוקוקוס חיידקים G, B) הסרת רצועת גנטמצין, C) משולב גנטמיצין / פניצילין G רצועת (0.094 מיקרוגרם / מ"ל מרוכז) על גבי קבוצת סטרפטוקוקוס חיידקים G, D) פניצילין G רצועה (0.094 מיקרוגרם / מ"ל מרוכז), E) הסרת רצועת פניצילין G, F) רצועת פניצילין G / גנטמיצין משולבת (8 מיקרוגרם / מ"ל מרוכז) על גבי חיידקי קבוצת סטרפטוקוקוס G. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
2. בדיקת מרק
-
הגדרת
- ללבוש כפפות וחלוק מעבדה
- הכן את סביבת העבודה על ידי עיקורו באמצעות 70% אתנול
- לאסוף 15mL מרק MH עם 50% דם סוס lysed ו 20 מ"ג / מ"ל β-NAD (MH-F)
-
(אופציונלי) ביצוע בדיקה אלקטרונית [פרוטוקול 1] כדי לקבוע את המיקרופון באמצעי מוצק
- בעוד אופציונלי, ידע כזה יאפשר עיצוב ניסיוני טוב יותר (למשל ריכוזי אנטיביוטיקה שנוספו יכול להיות מתוכנן להקיף את ערך MIC שנקבע מהצלחת), שיפור הסיכויים של ניסוי מוצלח.
-
מכין תימוכין חיידקי. כאמור לעיל, ריכוז חיידקים ניתן להעריך על ידי מדידות OD nm או תקני עכוז מקפרלנד
-
שיטת OD600 ננומטר
- להשיג השעיה חיידקית עם ריכוז חיידקי מבוסס
- לדלל את התרבות מרק MH-F כדי להשיג OD600 של 0.003
-
שיטת העקשנות של מקפרלנד
- שים 15 מ"ל מרק MH-F בצינור סטרילי.
- לחסן את מרק MH-F עם חיידקים (מצלחת) לרמת מקפרלנד. מערבולת הפתרון במרץ. יוצקים את הפתרון לצלחת פטרי סטרילית.
-
שיטת OD600 ננומטר
-
הכנת אנטיביוטיקה
- לקבוע את הריכוז של אנטיביוטיקה הרצוי
- זהה את ערך המיקרופון ממבחן E (לדוגמה 0.125 מיקרוגרם /מ"ל עבור פניצילין G ו- 8 מיקרוגרם / מ"ל עבור גנטמיצין)
- הכפל את ערך MIC צלחת אגר ב 24-27, המתאים ארבע-שבע 2x דילול טורי. זה יהיה הריכוז ההתחלתי של אנטיביוטיקה. (לדוגמה עבור פניצילין G, שבעה דילול טורי 2x: 0.125 מיקרוגרם / מ"ל x 27 = 16 מיקרוגרם / מ"ל; עבור גנטמיצין, ארבעה דילול טורי 2x 8 מיקרוגרם / מ"ל x 24 = 128 מיקרוגרם / מ"ל
- הכפל את הערך ההתחלתי הרצוי 100x על מנת לקבוע ליצור ריכוז מלאי של אנטיביוטיקה (למשל מניות של 1.6 מ"ג / מ"ל פניצילין G ו 12.8 מ"ג / מ"ל גנטמיצין)
- הכן ריכוז מלאי אנטיביוטי פי 100 בהתאם
- להמיס את האנטיביוטיקה במים autoclaved 10mL, ומערבולת כדי ליצור פתרון מלאי (למשל 16 פניצילין G ו 128 מ"ג גנטמיצין כדי ליצור את המניות לעיל)
- לקבוע את הריכוז של אנטיביוטיקה הרצוי
-
הוספת חיידקים לבארות מיקרו-לוח
- Aliquot 200 מרק MH-F המכיל אינוקולום חיידקים לבארות ב -3 השורות הראשונות של צלחת microtiter 96 טוב לניסוי משולש.
-
הוסף אנטיביוטיקה לבארות מיקרו-לוח
- הוסף 200 מרק MH-F נוסף של μL עם חיידקים לעמודה הראשונה של בארות (A1, B1, C1) כדי להביא את הנפח הכולל ל 400 μL.
- הוסף 4 μL של ריכוז מלאי של אנטיביוטיקה לעמוד הראשון של בארות. מאז המדגם מכיל 400 μL זה יגרום דילול 100x של האנטיביוטיקה.
- ליצור דילול סדרתי 2x על ידי העברת 200 חיידקים μL / אנטיביוטיקה מ A1 ל- A2, כל הדרך A11. הצינור במרץ בין הדילולים. חזור על השלב עבור שורות נוספות.
- הסר 200 μL מהעמודה 11 כך אמצעי האחסון הסופי בכל בארות הם 200 μL.
- השאירו את העמודה האחרונה (A12, B12, C12) ללא אנטיביוטיקה, כפקדים.
-
קביעת ערכי מיקרופון
- לדגור על צלחת microtiter 96-well במשך 24 שעות ב 37°C מבלי לרעוד.
- ערך המיקרופון מוגדר כבאר האחרונה בסדרת הדילול שלא מציגה צמיחה נראית לעין של חיידקים (איור 4). עם זאת, ניתן לתת אמון בערך זה רק אם גודל ההסתמכות המקורי היה נכון.

איור 4: קביעת מיקרופון על ידי דילול מרק. מיקרופון מוגדר כאן כבאר האחרונה שמציגה בהירות (ללא צמיחה של חיידקים) לפני שהיא משנה את העקרנות. שורה הן כפילויות של ערך המיקרופון של פניצילין G ושורה הן כפילויות של ערך המיקרופון של גנטמיצין, הן לעומת איזולט של קבוצת סטרפטוקוקוס G. A) תוצאה ניסיונית בפועל, ב) פרשנות סכמטית של הערכים מ- A (אפור = ללא צמיחה; לבן = צמיחה). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: הליך סכמטי של סדרת דילול לספירת ריכוז החיידקים המקורי. דילול בוצעו כמתואר (20 μL מדולל ב 180 μL עבור סדרת דילול 10x), ולאחר מכן 10 μL מן השורות A-H מצופים על שתי לוחות אגר דם נפרדים כפי שצוין. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
-
קביעת גודל ההסתה המקורי
הערה: בדיקות מיקרו-ברות רגישות מאוד לגודל ההנוקולום המקורי שבו נעשה שימוש. גודל אינוקולום מוגזם ייתן תוצאה חיובית כוזבת, שכן האנטיביוטיקה שנוספה לא תוכל לעכב את הצמיחה יותר ביחס זה. לכן, זה קריטי כדי לוודא כמה חיידקים נוספו microwells. בעוד שהנתונים לא יהיו זמינים בנקודת הניסוי (בשל הצורך בדגורה של 24 שעות) הוא ישמש כבקרה. אם מספר החיידקים המוספים נמצא בטווח הריכוז המוצהר, ניתן לסמוך על ערכי המיקרופון. אם ההנמקולום היה גבוה מדי או נמוך מדי, יש לחזור על הניסוי.-
לדלל את החיידקים באופן סדרתי
- הכן צלחת microtiter 96 היטב כדי לדלל את ריכוז החיידק המקורי על מנת לקבוע את גודל inoculum. האופטימלי הוא נפח של 200 μL עם 105-6 חיידקים. כדי לבצע את הדילולים, הראשון aliquot 180 μL סטרילי PBS לכל באר B-H (ב משולש 1-3).
- לאחר מכן, להוסיף 100 μl של פתרון חיידקי A (משולש 1-3).
- ליצור דילול סדרתי 10x (במשולש) על ידי העברת 20 חיידקים μl מ A ל- B, pipet במרץ. חזור על השלבים עבור C-H.
-
צלחת דילול חיידקי לקביעת גודל inoculum
- סמנו לוחות אגר דם לפי איור 5.
- העבר 10 μL מהה בדילול הסדרתי לצלחת לפי איור 5.
- לדגור על הצלחת ב 37°C במשך 20-24 שעות.
-
קבע את גודל האינוקולום החיידקי
- ספרו את מספר החיידקים בנקודות בתוך 5-50 מושבות(איור 6).
- חשב את גודל inoculum הראשוני על ידי חישוב הממוצע של דגימות משולש, להכפיל על ידי גורם דילול (למשל 10x עבור דגימות B, 100x עבור דגימות C, 1000x עבור דגימות D, וכו ') ולאחר מכן על ידי 100 כדי לפצות על נפח התצפית של 10 μL, וכתוצאה מכך גודל inoculum cfu / mL. אם ההסתמכות היא בתוך 105-6 cfu/mL ניתן לתת אמון בנתוני ה- MIC.
-
לדלל את החיידקים באופן סדרתי

איור 6: קביעת גודל ההסתה. חיידקים שחוסנו על פי איור 5 דוגר במשך 20-24 שעות ב 37 מעלות צלזיוס ולאחר מכן נספרו. לשורה D יש מספר טוב של מושבות לספור (למשל 5-50). דגימות ב- A אינן מדוללות, B מדולל 10x, C מדולל 100x, ו- D מדולל 1000x, ורק 10 μL מצופה בכל נקודה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
רגישות לאנטיביוטיקה מוגדרת כרגישות של חיידק לאנטיביוטיקה וניתן למדוד אותה באמצעות בדיקת דילול מרק או בדיקת אפסילומטר, הנקראת גם בדיקת E.
בשיטת דילול המרק, מספר מתוקנן של חיידקים מתווספים למדיית גדילה המכילה דילול אנטיביוטי סדרתי. אם רגישים, החיידקים לא יכולים לגדול בריכוזים אנטיביוטיים גבוהים יותר, אך ממשיכים להתרבות בריכוזים האנטיביוטיים הנמוכים יותר, מה שגורם למדיה להפוך לעכירה. הריכוז האנטיביוטי הנמוך ביותר שבו החיידקים כבר לא יכולים לשרוד או להתרבות מכונה ריכוז מעכב מינימלי, או MIC, ערך של אנטיביוטיקה עבור החיידקים נתון.
בבדיקה אלקטרונית, רצועת פלסטיק ספוגה בשיפוע מוגדר מראש של אנטיביוטיקה מוחלת על מדשאה טרייה של חיידקים על אגר מולר-הינטון, או MH-A, צלחת פטרי. האנטיביוטיקה מתפזרת אל תוך התקשורת אגר, שם הוא נלקח על ידי החיידקים. אם רגישים, החיידקים לא יכולים להתרבות וימותו, ויוצרים אזור ברור סביב E-strip, אשר מכונה אזור עיכוב הצמיחה. בנקודה שבה הצמיחה מצטלבים עם רצועת E, הערך המתאים בסולם נותן את ערך המיקרופון של האנטיביוטיקה.
לעתים קרובות אנטיביוטיקה משמשים בשילוב כדי למנוע את הופעתם של זנים עמידים לאנטיביוטיקה של חיידקים. התוצאה היא לעתים קרובות אפקט סינרגטי ולא תוסף. סינרגטי פירושו כי ההשפעה המשולבת של שתי אנטיביוטיקה גדולה מסך הפעילות האישית שלהם. עם זאת, ההשפעה נחשבת משמעותית רק כאשר ערך המיקרופון של שילוב האנטיביוטיקה יורד פי שניים לפחות. קריטריון זה מוערך על-ידי חישוב ריכוז המעכבים החלקי, או FIC, אינדקס. על ידי סיכום היחס של המיקרופון של כל אנטיביוטיקה בשילוב עם המיקרופון של כל אנטיביוטיקה בנפרד, מדד FIC פחות מ 0.5 מצביע על סינרגיה.
סינרגיה אנטיביוטית ניתן למדוד באמצעות שתי שיטות מבוססות מבחן אלקטרוני: בדיקה לא צולבת או בדיקה צולבת. בבדיקה לא צולבת, ראשית, רצועות ה- E לשתי אנטיביוטיקות שונות עם ערכי MIC קבועים מראש מוחלות על שתי צלחות נפרדות. לאחר שהאנטיביוטיקה התפזרה למדיום, הסרפות ה- E המקוריות והרצועות האלקטרוניות לאנטיביוטיקה החלופית ממוקמות כך שקשקשי המיקרופון שלהם מונחים בדיוק מעל סולמות המיקרופון של הרצועות הקודמות. בבדיקה צולבת, שהיא גרסה מהירה יותר של הבדיקה הלא צולבת, הרצועות האלקטרוניות של שתי האנטיביוטיקות ממוקמות יחד במבנה צולב, כך שקשקשי סימני המיקרופון שלהם יוצרים זווית של 90 מעלות בצומת. לאחר הדגירה בשתי הטכניקות, ערך המיקרופון של כל אנטיביוטיקה בשילוב עם האנטיביוטיקה האחרת נקרא בנקודה שבה אזור עיכוב הצמיחה מצטלב עם קצה רצועת E. לאחר מכן, מחושב אינדקס ה- FIC.
וידאו זה מדגים כיצד לקבוע את הערך MIC של אנטיביוטיקה נתונה עבור חיידק נתון באמצעות בדיקת E ובדיקת דילול מרק מיקרו. תוכלו גם ללמוד כיצד לקבוע סינרגיה בין שתי אנטיביוטיקות באמצעות בדיקה צולבת ובדיקה לא צולבת.
ראשית, לבשו כל ציוד מגן אישי מתאים, כולל כפפות מעבדה וחלוק מעבדה. לאחר מכן, לחטא את שטח העבודה באמצעות 70% אתנול. לאחר מכן, לאסוף 15 מיליליטר של מרק מילר-הינטון סטרילי עם 50% דם סוס lysed ו 20 מיליגרם למיליליטר בטא-nicotinamide. וחמש עד שמונה צלחות אגר מולר-הינטון. עכשיו, כדי להכין תקן עכורות מקפרלנד מספר 0.5, למדוד 9.95 מיליליטר של 1% פתרון חומצה גופרתית. לאחר מכן, להוסיף 50 microliters של 1% פתרון בריום כלוריד לתמיסת חומצה גופרתית. מערבולת הפתרון היטב כדי להשיג השעיה עגומה. מכסים את הצינור בנייר אלומיניום ומניחים אותו בצד. לאחר מכן, לחלק מיליליטר אחד של תמיסת מלח לתוך צינור 15 מיליליטר.
השתמש בלולאה סטרילית כדי לגרד מדגם של צמיחת החיידקים מצלחת הבדיקה החיידקית שלך, כאן, קבוצת סטרפטוקוקוס G. לאחר מכן, מניחים את הלולאה עמוסת החיידקים בתמיסת המלח, מערבבים בעדינות, ואז מערבולת היטב את הצינור. עכשיו, למקם את ההשעיה החיידקית ואת תקני עכורות מקפרלנד זה לצד זה ולהשוות אותם עבור שקימות עכורה. מוסיפים מושבות מלוחות או חיידקיות נוספות עד שעגרות ההשעיה החיידקית תואמת את זו של התקן. לאחר קבלת החוצפה הרצויה, טובלים אפליקטור קצה כותנה סטרילי לתוך ההשעיה החיידקית. כדי לחסן את צלחת MH-A, ספוגית את כל פני השטח של הצלחת בעדינות עם תנועת זיגזג. לאחר מכן, סמן את הצדדים התחתונים של הלוחות בשם החיידקים והתאריך.
כדי להתחיל, להוציא פניצילין G E-מבחן רצועת מבחן, מחזיק אותו על ידי הקצה עם מלקחיים. מניחים בעדינות את הרצועה במרכז צלחת ה-MH-A הטרייה ומחלפים את המכסה. בדוגמה זו, אנטיביוטיקה שנייה, גנטמיצין, נבדק גם. לכן, תהליך מיקום הרצועה חוזר על עצמו עם הצלחת השנייה ורצועת מבחן E גנטמיצין. כדי לקבוע את התוצאות של מבחן E, לאסוף את הצלחת הראשונה המכילה את רצועת פניצילין G E-test. עכשיו, לקבוע את הנקודה שבה אזור העיכוב מצטלב עם רצועת האנטיביוטיקה. קרא את הערך המספרי המתאים בקנה המידה. ערך זה מייצג את ערך המיקרופון של פניצילין G. קבע את ערך ה- MIC עבור גנטמיצין באותו אופן.
בתור התחלה, לחסן צלחת MH-A עם חיידקי זן G קבוצת סטרפטוקוקוס. סמן את תחתית הצלחת בשם החיידקים, האנטיביוטיקה לשימוש והתאריך. עכשיו, למקם רצועת בדיקה אלקטרונית לאנטיביוטיקה של עניין במרכז הצלחת. לאחר מכן, החזק את רצועת הבדיקה השנייה בזווית של 90 מעלות לרצועה הראשונה ואתר את סימן המיקרופון שלה. הנח בעדינות את רצועת ה- E השנייה מעל הראשונה בנקודה שבה שני ערכי המיקרופון מצטלבים. לאחר הרצועות ממוקמות, לא להזיז אותם. לאחר מכן, לדגור על הצלחות ב 37 מעלות צלזיוס במשך 18 עד 20 שעות.
לאחר חנק שתי צלחות MH-A, עם חיידקי זן G קבוצת סטרפטוקוקוס, מניחים רצועת בדיקה אלקטרונית לאנטיביוטיקה אחת על פני צלחת אחת. לאחר מכן, מניחים רצועת בדיקה אלקטרונית לאנטיביוטיקה האחרת על הצלחת השנייה כפי שהודגם. באמצעות לולאת חיסון פלסטיק, לסמן את ערך המיקרופון של כל אנטיביוטיקה על פני השטח של הצלחת המתאימה שלה. לאחר מכן, לכסות את הצלחות ודגור אותם בטמפרטורת החדר במשך שעה אחת. לאחר מכן, השתמש במלקחיים כדי להסיר את רצועות E. לאחר מכן, לאסוף את אחת הצלחות ורצועת בדיקה אלקטרונית עבור אנטיביוטיקה אחרת. החזק את רצועת ה- E-test מעל ההטבעה שהותירה הרצועה הראשונה ואתר את הנקודה שבה ערך ה- MIC ברצועת E מיישר קו עם הקו המסומן. הניחו בעדינות את הרצועה בנקודה מצטלבים זו. חזור על תהליך זה עבור הצלחת השנייה ודגרה שתי הצלחות ב 37 מעלות צלזיוס במשך 18 עד 20 שעות.
ראשית, להשיג השעיה חיידקית עם ריכוז חיידקי הוקמה לדלל את התרבות במרק MHF כדי להשיג OD600 של 0.003. לאחר מכן, לשקול 16 מיליגרם של פניצילין G ו 128 מיליגרם של גנטמיצין. מעבירים כל אנטיביוטיקה יבשה במשקל 215 מיליליטר. מוסיפים 10 מיליליטר של מים מזוקקים לכל אחד מהצינורות החרוטיים ומערבבים היטב על ידי מערבולת. תייג את הצינורות עם שם אנטיביוטיקה וריכוז.
ביצוע בדיקת ההסמכה בשלושה, הוסף 400 מיקרוליטרים של פתרון החיידקים העובדים לבארות הראשונות של שלוש שורות של צלחת מיקרוטיטר 96 היטב. לאחר מכן, להוסיף 200 microliters של פתרון חיידקי עובד מרק MHF לבארות של שלוש השורות. עכשיו, כדי ליצור דילול אנטיביוטי סדרתי כפול, תחילה להוסיף ארבעה microliters של מלאי אנטיביוטי לבאר הראשונה, יצירת דילול פי 100. ברצף, להעביר 200 microliters של פתרון חיידקים-אנטיביוטיים לכל באר, החל מהבאר הראשונה דרך השני עד האחרון היטב בכל שורה, להבטיח ערבוב נכון על ידי pipetting פעמיים עד שלוש פעמים לאחר כל העברה. השלך את 200 המיקרוליטרים האחרונים של פתרון חיידקי-אנטיביוטי.
כדי לקבוע את התוצאות של בדיקת דילול מיקרו מרק עבור פניצילין G, ראשית לאתר את בארות המציגים צמיחה חיידקית גלויה, המצוין על ידי חוסר עכור. מבארות אלה, לזהות את הבאר עם הריכוז האנטיביוטי הנמוך ביותר. זה מייצג את ערך המיקרופון של פניצילין G עבור החיידקים שנבדקו. ערך המיקרופון של גנטמיצין ניתן לקבוע באמצעות אותה מעש וטכניקה.
כדי לקבוע את התוצאות של הבדיקה הלא צולבת, לאסוף את הצלחת הראשונה, אשר מכיל רצועת פניצילין G E. לאחר מכן, לקבוע את הנקודה שבה אזור עיכוב הצמיחה מצטלב עם רצועת האנטיביוטיקה. הערך המתאים בסולם מייצג את ערך ה- MIC עבור פניצילין G בשילוב עם גנטמיצין. בדוגמה זו, ערך המיקרופון בשילוב הוא 0.064 מיקרוגרם למיליליטר.
עכשיו, לאסוף את הלוח השני, אשר מכיל את רצועת gentamicin E, ולקבוע את ערך MIC בשילוב כפי שהודגם בעבר. כדי להעריך את ההשפעה של שילוב, תחילה לחשב את ריכוז מעכבי שבר או FIC עבור פניצילין G על ידי חלוקת המיקרופון בשילוב על ידי המיקרופון של האנטיביוטיקה בלבד. חזור על תהליך זה עבור גנטמיצין. לאחר מכן, חשב את אינדקס ה- FIC באמצעות המשוואה המוצגת כאן. הפחתה כפולה בערך ה-MIC בשילוב מניבה ערך מדד FIC קטן או שווה ל- 0.5 ומדגימה סינרגיה בין פניצילין G לג'נטמיצין. במקרה זה, ערך ה- FIC המחושב הוא 1.18 הגדול מ- 0.5. לכן, התוצאות אינן מראות סינרגיה בין פניצילין G וגנטמיצין נגד זן G קבוצת סטרפטוקוקוס.
כדי לקבוע את התוצאות של הבדיקה הצולבת, תחילה לקבוע את הנקודה שבה אזורי עיכוב הצמיחה מצטלבים עם רצועות E בהתאמה. קרא את הערך המספרי בכל רצועת בדיקה אלקטרונית התואמת לנקודת הצטלבות זו. ערכים אלה מייצגים את ערך המיקרופון בשילוב עבור פניצילין G וגנטמיצין. לאחר מכן, כדי להעריך את השפעת השילוב, חשב את אינדקס ה- FIC באמצעות המשוואה המוצגת כאן. בדוגמה זו, ערך ה- FIC המחושב הוא 1.18, הגדול מ- 0.5. משמעות הדבר היא כי פניצילין G ו גנטמיצין אינם פועלים בסינרגיה נגד זן G קבוצת סטרפטוקוקוס.
Subscription Required. Please recommend JoVE to your librarian.
Results
ערכי מיקרופון במבחן E
ערכי MIC בודדים זוהו באיור 1 כ- 0.094 מיקרוגרם/מ"ל עבור פניצילין G ו- 8 מיקרוגרם/מ"ל עבור גנטמיצין. עבור בדיקות סינרגיה, שניהם הדגימו ערך MIC עבור פניצילין G של 0.064 מיקרוגרם / מ"ל (איורים 2, 3), בעוד גנטמיצין היה MIC 4 מיקרוגרם / mL עבור בדיקות צולבות ולא צולבות. שים לב לפער קל בין בדיקות הצלב לבין בדיקות שאינן צולבות עלולה להתרחש עקב זמני הדגירה השונים של הרצועות בשתי ההגדרות.
חישוב סינרגיה
המשוואה עבור FIC היא:
 = 1.18 >0.5 (ללא סינרגיה)
= 1.18 >0.5 (ללא סינרגיה)
קביעת מיקרופון במרק
עננות של בארות הצביעה על צמיחה חיידקית, ולכן לא התרחש עיכוב. הבאר הברורה הראשונה עם פניצילין G (איור 4) הכילה פניצילין G של 0.12 מיקרוגרם/מ"ל, ומכאן שזה היה ערך המיקרופון. עבור גנטמיצין הבאר הברורה הראשונה הייתה נוכחת ב 8 מיקרוגרם / mL גנטמיצין. ערך הפניצילין G היה מעט גבוה יותר מאשר בעת שימוש במבחן E, בשל הרזולוציה הגבוהה יותר של הרצועה (למשל בהתבסס על דילול סדרתי של גורם 1.5x, לא גורם 2x).
גודל תנוקולום
כדי לקבוע את גודל האינוקולום, נעשה שימוש בגישה המתוארת באיור 5 וב- 6. מושבות נספרו בשורת D (דילול 1000x), והוסיפו עד 7, 8 ו-8 בסדרת המשולשת עם ערך ממוצע של 7.67 יחידות ערך. מספר המושבות neeed להיות מוכפל עם גורם דילול (למשל 1000x), כמו גם עם 100 כדי לקבל cfu / mL, נותן גודל inoculum של כ 8 x 105, גם בתוך גודל inoculum היעד של 105-6 cfu / mL.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
עמידות לאנטיביוטיקה היא בעיה בריאותית כלל עולמית. על מנת לקבוע מנגנוני התנגדות של חיידקים, שיטות בדיקה לסינרגיה ואנטגוניזם עם אנטיביוטיקה שונה היא קריטית. שיטת הבדיקה האלקטרונית מהירה, קלה לשכפול, וניתן להשתמש בה כדי לחקור כל פוטנציאל סינרגטי של טיפולים משולבים. ניתן להעריך גם את שיטת דילול המרק כדי לחזות פעילות חיידקית. על מנת לחקור את מנגנוני ההתנגדות של חיידקים שונים, הידע של אינטראקציות אנטיביוטיות סינרגטיות ואנטגוניסטיות הוא חיוני. שילוב אנטיביוטיקה עשוי להיות אסטרטגיה כדי להגביר את יעילות הטיפול להתמודד עם עמידות לאנטיביוטיקה. בבדיקות שבוצעו כאן, הצלחנו לקבוע את ערכי המיקרופון של פניצילין G וג'נטמיצין עבור קבוצת G סטרפטוקוקוס. הוכחנו גם כי שתי האנטיביוטיקות אינן מציגות השפעות סינרגטיות, ולכן לא תהיה אפשרות טיפול מועדפת לזיהומים כאלה.
Subscription Required. Please recommend JoVE to your librarian.
References
- Tan SY, Tatsumura Y. Alexander Fleming (1881-1955): Discoverer of penicillin. Singapore Medical Journal. 56 (7):366-7. (2015)
- Aminov RI. A brief history of the antibiotic era: lessons learned and challenges for the future. Frontiers in Microbiology. 1:134. (2010)
- Pankey GA, Ashcraft DS, Dornelles A. Comparison of 3 E-test (®) methods and time-kill assay for determination of antimicrobial synergy against carbapenemase-producing Klebsiella species. Diagnostic Microbiology and Infectious Disease. 77 (3):220-6. (2013)
- EUCAST: European Committee On Antimicrobial Susceptibility Testing (www.eucast.org).
- Wiegand I, Hilpert K, Hancock RE. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature Protocols. 3 (2):163-75. (2008)
- Doern CD, When does 2 plus 2 equal 5? A review of antimicrobial synergy testing. Journal of Clinical Microbiology. 52 (12):4124-28. (2014)
- Worthington RJ, Melander C. Combination approaches to combat multi-drug resistant bacteria. Trends in Biotechnology. 31 (3):177-84. (2013)




