Overview
Source: Rhiannon M. LeVeque1, Natalia Martin1, Andrew J. Van Alst1, et Victor J. DiRita1
1 Department of Microbiology and Molecular Genetics, Michigan State University, East Lansing, Michigan, États-Unis d'Amérique
Les bactéries sont diverses micro-organismes que l'on trouve presque partout sur Terre. De nombreuses propriétés aident à les distinguer les unes des autres, y compris, mais sans s'y limiter, le type, la forme et l'arrangement de Gram, la production de capsules et la formation de spores. Pour observer ces propriétés, on peut utiliser la microscopie légère; cependant, certaines caractéristiques bactériennes (par exemple la taille, le manque de coloration et les propriétés réfractives) font qu'il est difficile de distinguer les bactéries uniquement avec un microscope léger (1, 2). La coloration des bactéries est nécessaire pour distinguer les types bactériens par microscopie légère. Les deux principaux types de microscopes légers sont simples et composés. La principale différence entre eux est le nombre de lentilles utilisées pour amplifier l'objet. Les microscopes simples (par exemple une loupe) n'ont qu'une lentille pour grossir un objet, tandis que les microscopes composés ont plusieurs lentilles pour améliorer le grossissement (figure 1). Les microscopes composés ont une lentille objective près de l'objet qui recueille la lumière pour créer une image de l'objet. Ceci est ensuite amplifié par l'oculaire (lentille oculaire) qui agrandit l'image. La combinaison de la lentille objective et de l'oculaire permet un grossissement plus élevé que l'utilisation d'une seule lentille. Typiquement, les microscopes composés ont plusieurs lentilles objectives de différents pouvoirs pour permettre un grossissement différent (1, 2). Ici, nous discuterons de la visualisation des bactéries avec des taches Gram, taches Capsule, et les taches Endospore.

Figure 1 : Microscope composé typique. Les parties les plus importantes du microscope sont étiquetées.
La tache Gram, développée en 1884 par le bactériologiste danois Hans Christian Gram (1), différencie les bactéries en fonction de la composition de la paroi cellulaire (1, 2, 3, 4). En bref, un frottis bactérien est placé sur une lame de microscope, puis fixé à la chaleur pour adhérer les cellules à la diapositive et les rendre plus facilement accepter des taches (1). L'échantillon fixé à la chaleur est taché de Violet de Cristal, transformant les cellules pourpres. La glissière est rincée avec une solution d'iode, qui fixe le Violet de Cristal à la paroi cellulaire, suivie d'un décoloreur (un alcool) pour laver toute violet de cristal non fixe. Dans la dernière étape, une contre-tache, Safranin, est ajoutée aux cellules de couleur rouge (figure 2). Les bactéries Gram-positives tachent le pourpre en raison de la couche épaisse de peptidoglycan qui n'est pas facilement pénétrée par le décoloreur ; Les bactéries Gram-négatives, avec leur couche peptidoglycan plus mince et leur teneur en lipides plus élevée, se décolorent avec le décolorant et sont contre-tachées en rouge lors de l'ajout de Safranin (figure 3). La coloration Gram est utilisée pour différencier les cellules en deux types (Gram-positif et Gram-négatif) et est également utile pour distinguer la forme cellulaire (sphères ou cocci, tiges, tiges courbes et spirales) et l'arrangement (cellules simples, paires, chaînes, groupes et clusters) (1, 3) .
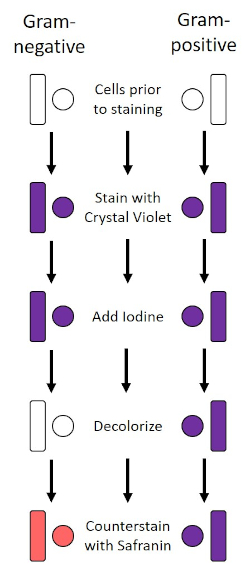
Figure 2 : Schéma du protocole de coloration de gram. La colonne de gauche montre comment les bactéries Gram-négatives réagissent à chaque étape du protocole. La colonne de droite montre comment les bactéries Gram-positives réagissent. On y voit également deux formes de cellules bactériennes typiques : les bacilles (ou tiges) et les cocci (ou sphères).
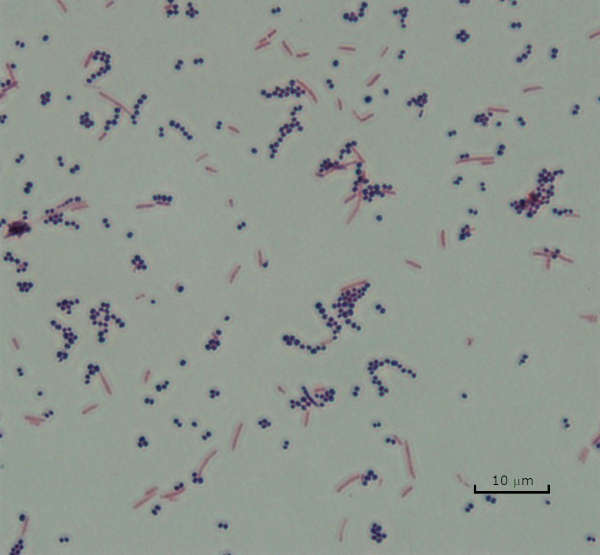
Figure 3 : Résultats de la coloration de Gram. Une tache de Gram d'un mélange de Staphylococcus aureus (Cocci pourpre Gram-positif) et Escherichia coli (gram-négatifs tiges rouges).
Certaines bactéries produisent une couche externe visqueuse extracellulaire appelée capsule (3, 5). Les capsules sont des structures protectrices avec diverses fonctions, y compris mais sans s'y limiter à l'adhérence aux surfaces et à d'autres bactéries, à la protection contre la dessiccation et à la protection contre la phagocytose. Les capsules sont généralement composées de polysaccharides contenant plus de 95 % d'eau, mais certaines peuvent contenir des polyalcools et des polyamines (5). En raison de leur composition la plupart du temps non-ionique et de la tendance à repousser des taches, les méthodes simples de coloration ne fonctionnent pas avec la capsule ; au lieu de cela, la coloration de capsule utilise une technique négative de coloration qui tache les cellules et l'arrière-plan, laissant la capsule comme halo clair autour des cellules (1, 3) (figure 4). La coloration de capsule implique le barbouillage d'un échantillon bactérien dans une tache acide sur une glissière de microscope. Contrairement à la coloration Gram, le frottis bactérien n'est pas fixé à la chaleur lors d'une tache capsule. La fixation de la chaleur peut perturber ou déshydrater la capsule, ce qui entraîne de faux négatifs (5). En outre, la fixation de la chaleur peut rétrécir les cellules résultant en une compensation autour de la cellule qui peut être confondue comme une capsule, conduisant à de faux positifs (3). La tache acide colore le fond de diapositive ; tout en faisant un suivi avec une tache de base, Crystal Violet, colore les cellules bactériennes elles-mêmes, laissant la capsule intacte et apparaissant comme un halo clair entre les cellules et le fond de diapositive (figure 5). Traditionnellement, l'encre de L'Inde a été utilisée comme tache acide parce que ces particules ne peuvent pas pénétrer dans la capsule. Par conséquent, ni la capsule ni la cellule n'est souillée par l'encre de l'Inde; au lieu de cela, l'arrière-plan est taché. Congo Rouge, Nigrosin, ou Eosin peut être utilisé à la place de l'encre de l'Inde. La coloration des capsules peut aider les médecins à diagnostiquer les infections bactériennes lorsqu'ils examinent les cultures à partir d'échantillons de patients et à orienter le traitement approprié des patients. Les maladies courantes causées par les bactéries encapsulées comprennent la pneumonie, la méningite et la salmonellose.
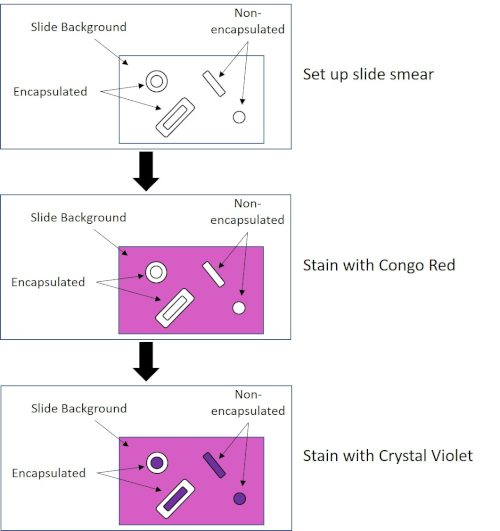
Figure 4 : Schéma du protocole de coloration des capsules. Le panneau supérieur affiche le frottis de diapositive avant toute application de tache. Le panneau du milieu montre comment la diapositive et les bactéries s'occupent de la tache primaire, Congo Red. Le panneau final montre comment la diapositive et les bactéries s'occupent de la contre-tache, Crystal Violet.
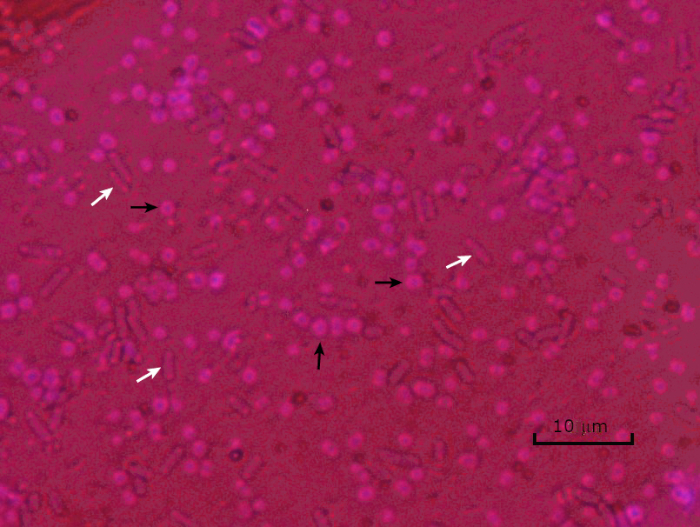
Figure 5 : Résultats de la coloration des capsules. Coloration capsule d'Acinetobacter baumannii encapsulé (dénoté avec des flèches noires) et d'Escherichia coli non encapsulé (dénoté avec des flèches blanches). Notez que l'arrière-plan est sombre et que les cellules A. baumannii sont tachées de pourpre. La capsule autour des cellules A. baumannii est évidente comme un halo, tandis que E. coli n'a pas de halo.
Dans des conditions défavorables (par exemple limitation des nutriments, températures extrêmes ou déshydratation), certaines bactéries produisent des endospores, des structures métaboliquement inactives qui résistent aux dommages physiques et chimiques (1, 2, 8, 9). Les endospores permettent à la bactérie de survivre à des conditions difficiles en protégeant le matériel génétique des cellules; une fois que les conditions sont favorables à la croissance, les spores germent et la croissance bactérienne continue. Les endospores sont difficiles à tacher avec des techniques de coloration standard parce qu'elles sont imperméables aux colorants généralement utilisés pour la coloration (1, 9). La technique couramment utilisée pour tacher les endospores est la méthode Schaeffer-Fulton (figure 6), qui utilise la tache primaire Malachite Green, une tache soluble dans l'eau qui se lie relativement faiblement au matériel cellulaire, et la chaleur, pour permettre à la tache de se briser à travers le cortex de la spore (figure 7). Ces étapes colorent les cellules de plus en plus (appelées cellules végétatives dans le contexte de la biologie de l'endospore), ainsi que les endospores et les spores libres (celles qui ne se trouvent plus dans l'ancienne enveloppe cellulaire). Les cellules végétatives sont lavées à l'eau pour enlever Malachite Green; les endospores conservent la tache due au chauffage du vert de Malachite dans la spore. Enfin, les cellules végétatives sont contre-tachées avec Safranin pour visualiser (figure 8). La coloration des endospores aide à différencier les bactéries en anciens spores et en anciens non-spore, ainsi qu'à déterminer si les spores sont présentes dans un échantillon qui, s'il est présent, pourrait entraîner une contamination bactérienne lors de la germination.
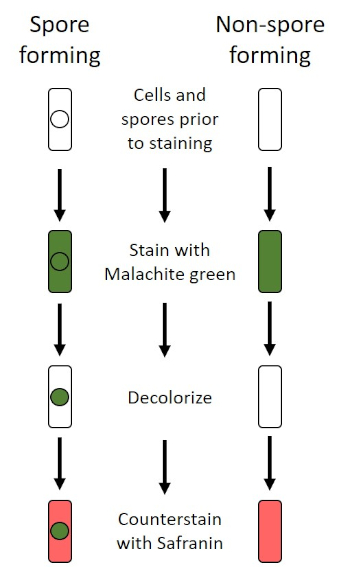
Figure 6 : Schéma du Protocole de coloration endospore. La colonne de gauche montre comment les bactéries formant des spores réagissent à chaque étape du protocole. La colonne de droite montre comment les bactéries qui ne forment pas les spores réagissent.
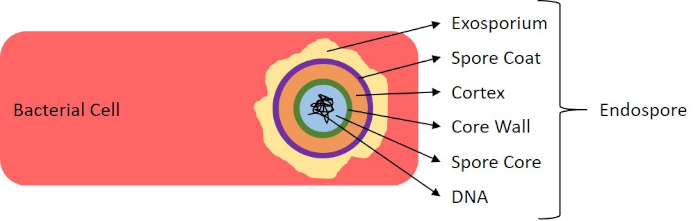
Figure 7 : Diagramme de la structure d'Endospore. Cellule bactérienne contenant un endospore avec les diverses structures de spores étiquetées.
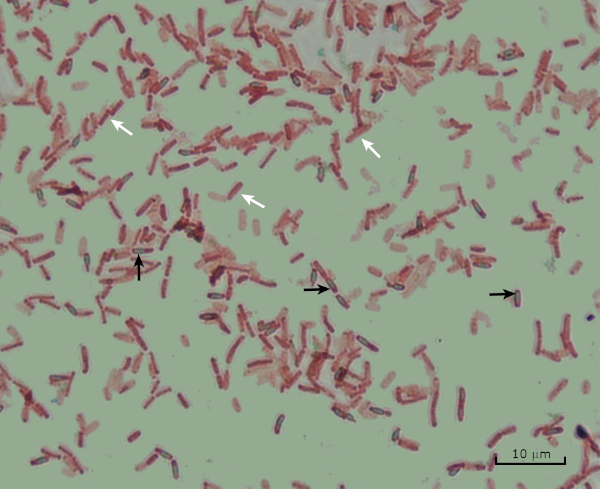
Figure 8 : Résultats de la coloration des endospores. Une coloration typique des endospores de Bacillus subtilis. Les cellules végétatives (démarquées par les flèches blanches) sont tachées de rouge, tandis que les endospores (dénotées avec les flèches noires) sont teintées de vert.
Procedure
1. Gram Staining
-
arrangement
- Portez des gants et une blouse de laboratoire non inflammable, car les colorants tacheront les mains et les vêtements.
- Un brûleur Bunsen est utilisé pour chauffer fixer les bactéries. Faites preuve de prudence lorsque vous travaillez avec des flammes; attacher les cheveux longs.
- Des réactifs à taches Gram disponibles dans le commerce seront utilisés.
- Nettoyez les lames de microscope avec des lingettes de laboratoire.
-
protocole
- Pipet 10 'L phosphate tamponné salin ou bouillon de culture sur la diapositive.
- Enduisez une colonie bactérienne dans le liquide pour produire une mince couche uniforme.
Note: N'utilisez pas de cultures de plus de 24 heures, car les bactéries trop âgées pourraient avoir des changements dans leur paroi cellulaire qui affecteront les résultats de la tache Gram (1, 4). - Glissade complètement sèche à l'air.
- Une fois séchées, la chaleur fixe les bactéries en passant glisser à travers la flamme (côté bactéries vers le haut) 4-5 fois.
Note: Ne tenez pas la glissière dans la flamme trop longtemps ou vous pouvez déformer les cellules bactériennes (1). - Travailler au-dessus de l'évier, maintenir le niveau de ladiapositive et appliquer gram's Crystal Violet pour couvrir complètement les bactéries fixées à la chaleur, laisser reposer 45 secondes.
- Rincer l'excès de violette de cristal en tenant la glissière à un angle et en giclant un flux d'eau doux et indirect sur la glissière et en la laissant couler sur les bactéries tachées. Ne pas gicler de l'eau directement sur les bactéries.
- En maintenant à nouveau le niveau de la diapositive, appliquez la solution d'iode de Gram pour couvrir complètement les bactéries tachées, laisser reposer 45 secondes.
- Rincer l'excès d'iode comme dans l'étape 1.2.6 ci-dessus.
- Tout en maintenant la glissière à un angle, ajouter quelques gouttes de Décoloreur sur la diapositive, en la laissant ruisseler sur les bactéries tachées jusqu'à ce que le ruissellement est clair; généralement, environ 5 secondes. Rincer immédiatement à l'eau comme à l'étape 1.2.6 ci-dessus.
Note: Il s'agit d'une étape cruciale dans le protocole. Permettre au Décoloreur de ruisseler trop longtemps ou pas assez longtemps se traduira par de fausses taches de Gram (4). - En maintenant à nouveau le niveau de glissement, appliquer la Safranine de Gram pour couvrir complètement les bactéries, laisser reposer 45 secondes.
- Rincer l'excès de Safranin comme dans l'étape 1.2.6 ci-dessus.
- Blot, ne frottez pas, l'excès d'eau de la diapositive à l'aide de serviettes en papier.
- Examiner la diapositive sur le microscope à l'aide d'une immersion à l'huile avec un objectif 100X.
-
Résultats et analyse de données
- Les bactéries Gram-positives tacheront le violet.
- Les bactéries Gram-négatives tacheront le rouge.
- La forme (cocci, bacilles, tiges courbes, spirales) des bactéries sera visible.
- L'arrangement des cellules bactériennes (cellules simples, cellules appariées, chaînes de cellules, clusters, regroupements) sera visible.
2. Staining capsule
-
arrangement
- Portez des gants et une blouse de laboratoire car les colorants tachent les mains et les vêtements.
- Pour préparer une solution de violette de cristal de 1 %, mélanger 0,25 gramme de violette de cristal avec de l'eau distillée de 25 ml jusqu'à dissolution.
- Pour préparer la solution Congo Red 1%, mélanger 0,25 gramme Congo Red avec 25 ml d'eau distillée jusqu'à dissolution.
- Nettoyez les glissières avec des lingettes de laboratoire.
-
protocole
- Placer 10 L Congo Red sur toboggan.
- À l'aide d'une pointe de pipet, enduire une colonie bactérienne dans le colorant pour produire une fine couche uniforme.
- Glissez complètement sèche à l'air avec mélange de colorant/cellule, 5-7 minutes.
Note: Ne chauffez pas la correction car le chauffage peut déshydrater ou déformer la capsule. - Inonder le frottis de 1% de violette de cristal pendant 1 minute.
- Rincer la tache excédentaire en maintenant la glissière à un angle et en giclant un flux d'eau doux et indirect sur la glissière et en la laissant couler sur les bactéries tachées. Ne pas gicler de l'eau directement sur les bactéries.
- Maintenez la glissière à un angle de 45 degrés jusqu'à ce qu'elle soit complètement séchée à l'air.
- Examiner le frottis sur le microscope sous immersion à l'huile avec un objectif 100X.
-
Résultats et analyse de données
- Les cellules bactériennes tacheront le violet.
- L'arrière-plan de la glissière tachera l'obscurité.
- Les capsules seront un halo clair autour des cellules sur un fond sombre.
3. Staining Endospore (méthode Schaeffer-Fulton)
-
arrangement
- Portez des gants et des blouses de laboratoire non inflammables pour protéger les mains et les vêtements contre les colorants et les flammes.
- Un brûleur Bunsen est utilisé pour chauffer fixer les bactéries. Faites preuve de prudence lorsque vous travaillez avec des flammes; attacher les cheveux longs.
- Pour préparer 0,5% Malachite Solution verte, mélanger 0,125 grammes Malachite Green avec 25 ml d'eau distillée jusqu'à dissolution.
- Utilisez la solution de réactif Safranin de Gram disponible dans le commerce.
- Nettoyez les glissières avec des lingettes de laboratoire.
-
protocole
- Pipet 10 'l phosphate tamponné salline (PBS) ou bouillon de culture sur la diapositive.
- En utilisant la technique aseptique, enduire une colonie bactérienne dans le liquide pour produire une mince couche uniforme.
Note: Les endospores ne se forment généralement pas dans les jeunes cellules, donc la culture est recommandée pour être entre 18 et 36 heures (9). - Glissade complètement sèche à l'air.
- Fixer la chaleur en passant la glissière (côté bactéries vers le haut) à travers la flamme 4-5 fois.
- Pour aider à contenir le colorant, placez un morceau de papier de lentille (coupé pour s'adapter au frottis bactérien) au-dessus du frottis fixe de chaleur.
- Saturate papier d'objectif avec la solution vert de Malachite.
- Placez la glissière sur le dessus du bécher d'eau bouillante sur une plaque chaude, et la glissière à vapeur pendant 5 minutes, en gardant le papier de lentille humide en ajoutant plus de colorant une goutte à la fois au besoin.
Note: Évitez la surchauffe et le dessèchement de la solution de colorant. - Retirer la glissière du bécher, retirer et jeter le papier de lentille, laisser refroidir la glissière 2 minutes.
- Tenir la glissière à un angle, rincer soigneusement en giclant un flux d'eau doux et indirect sur la glissière, ce qui lui permet de s'écouler sur le frottis.
- Maintenir le niveau de la glissade, le frottis d'inondation avec Safranin, laisser reposer 1 minute.
- Rincer à l'excès de Safranin comme dans l'étape 3.2.9 ci-dessus.
- Laisser sécher à l'air.
- Examiner la diapositive au microscope sous immersion à l'huile avec un objectif 100X.
-
Résultats et analyse de données
- Les spores tacheront le vert.
- Les cellules végétatives tacheront en rouge.
- Certaines cellules végétatives contiennent des spores; les cellules tacheront en rouge, tandis que les endospores tacheront vert.
Les bactéries sont des organismes vivants microscopiques qui ont de nombreuses caractéristiques distinctives telles que la forme, l'arrangement des cellules, si oui ou non ils produisent des capsules, et si elles forment des spores. Ces caractéristiques peuvent toutes être visualisées par la coloration et l'aide à l'identification et à la classification de différentes espèces bactériennes.
Pour examiner les deux premières caractéristiques de la forme et de l'arrangement cellulaires, nous pouvons utiliser une technique simple appelée coloration Gram. Ici, la violette cristalline est appliquée sur les bactéries, qui ont été fixées à la chaleur sur une glissière. Un décolorateur est alors appliqué et toutes les bactéries avec une couche peptidoglycan épaisse tacheront le violet, car cette couche n'est pas facilement pénétrée par le décoloreur. Ces bactéries sont appelées Gram positive.
Gram bactéries négatives ont une couche peptidoglycan plus mince et va décolorer le décolorant, perdant la couleur pourpre. Cependant, ils tacheront le rouge-rose quand une tache de compteur de safranin e est ajoutée, qui se lie à une couche de lipopolysaccharide sur leur extérieur. Une fois tachées, les cellules peuvent être observées pour la morphologie, la taille et l'arrangement, comme dans les chaînes ou les grappes, ce qui contribue davantage à la classification et à l'identification.
Une autre technique utile dans la boîte à outils du microbiologiste est la tache de capsule, utilisée pour visualiser les capsules externes qui entourent certains types de cellules bactériennes. En raison de la composition non ionique des capsules et de la tendance à repousser les taches, les méthodes simples de coloration ne fonctionneront pas. Au lieu de cela, une technique de coloration négative est utilisée, qui tache d'abord le fond avec un colorant acide, comme le rouge du Congo, avant que les cellules bactériennes sont tachées de violette de cristal. Cela laisse n'importe quelle capsule présente comme un halo clair autour des cellules.
La dernière technique de coloration majeure couverte ici peut aider à déterminer si les bactéries étudiées forment des spores. Dans des conditions défavorables, certaines bactéries produisent des endospores, des structures dormantes, dures et non reproductrices, dont la fonction première est d'assurer la survie des bactéries par des périodes de stress environnemental, comme des températures extrêmes ou la déshydratation. Cependant, toutes les espèces bactériennes ne font pas d'endospores, et elles sont difficiles à tacher avec des techniques standard parce qu'elles sont imperméables à de nombreux colorants. La méthode Schaeffer-Fulton utilise la tache vert malachite, qui est appliquée sur les bactéries fixées à une diapositive. La glissière est ensuite lavée à l'eau avant d'être tachée de safranin. Les cellules végétatives apparaîtront rouge rosé, tandis que toutes les endospores présentes apparaîtront vertes. Dans cette vidéo, vous apprendrez à effectuer ces techniques communes de coloration bactérienne, puis examiner les échantillons de coloration à l'aide de la microscopie légère.
Pour commencer la procédure, attachez les cheveux longs et mettez l'équipement de protection individuelle approprié, y compris une blouse de laboratoire et des gants.
Ensuite, nettoyez une lame de microscope fraîche avec une lingette de laboratoire. Ensuite, pipette 10 microlitres de 1X phosphate tamponné saline sur la première diapositive. Ensuite, utilisez une pointe de pipette stérile pour sélectionner une seule colonie bactérienne de la plaque d'agar LB. Enduisez la colonie bactérienne dans le liquide pour produire une couche mince et uniforme. Fixez la glissière sur le dessus du banc et laissez-la sécher complètement.
Une fois séché, allumez un brûleur Bunsen pour réchauffer les bactéries. À l'aide de pinces, passer la glissière à travers la flamme du brûleur à plusieurs reprises, avec le côté des bactéries vers le haut, en prenant soin de ne pas tenir la glissière dans la flamme trop longtemps, ce qui peut fausser les cellules.
Maintenant, en travaillant sur l'évier, maintenez le niveau de ladiapositive et appliquez plusieurs gouttes de violette de cristal de Gram pour couvrir complètement le frottis bactérien et puis, placez la glissière sur le banc pour se tenir debout pendant 45 secondes. Ensuite, maintenez la glissière à un angle, et giclez doucement un jet d'eau sur le dessus de la glissière, en prenant soin de ne pas gicler le frottis bactérien directement. Maintenant, en maintenant le niveau de diapositive à nouveau, appliquer la solution d'iode de Gram pour couvrir complètement les bactéries tachées et puis, laissez-le reposer pendant encore 45 secondes. Ensuite, rincez soigneusement l'iode de la diapositive, comme indiqué précédemment. Tout en maintenant la glissière à un angle, ajouter quelques gouttes de décolorateur de Gram à la diapositive, lui permettant de couler sur les bactéries tachées, juste jusqu'à ce que le ruissellement est clair, pendant environ 5 secondes. Immédiatement, rincer à l'eau comme indiqué précédemment. Cela limitera la décoloration excessive du frottis. Ensuite, en maintenant le niveau de diapositive à nouveau, appliquer la contre-tache de safranine de Gram pour couvrir complètement les bactéries tachées. Après 45 secondes, rincer délicatement la safranine de la glissière avec de l'eau, comme indiqué précédemment, puis éponger avec des essuie-tout.
Enfin, ajoutez une goutte d'huile d'immersion directement à la diapositive, puis examinez la diapositive à l'aide d'un microscope léger avec une lentille objective à l'huile 100X.
Pour commencer ce protocole de coloration, d'abord mettre sur le bon équipement de protection individuelle, puis, assurez-vous que les lames de verre qui seront utilisés sont propres.
Ensuite, préparez les solutions. Pour faire 1% de violette cristalline solution, mélanger 0,25 grammes de poudre de violette cristalline avec 25 millilitres d'eau distillée, et le vortex jusqu'à dissolution. Ensuite, préparer 1% Congo solution rouge en mélangeant 0,25 grammes de poudre rouge du Congo avec 25 millilitres d'eau distillée et le vortex jusqu'à dissolution. Maintenant, pipette 10 microlitres de la solution rouge Congo sur la diapositive. À l'aide d'une pointe de pipette propre et stérile, sélectionnez une seule colonie bactérienne dans la plaque d'agar LB. Ensuite, enduire la colonie bactérienne dans le colorant pour produire une mince couche uniforme. Sécher complètement à l'air la glissière bactérienne pendant 5-7 minutes. Une fois la lame sèche, inonder le frottis avec suffisamment de 1% de violette cristalline pour couvrir le frottis et laisser s'asseoir pendant 1 minute. Maintenant, maintenez la glissière à un angle et giclez doucement un jet d'eau sur le dessus de la glissière, en prenant soin de ne pas gicler les bactéries directement. Continuer à tenir la glissière à un angle de 45 degrés jusqu'à ce qu'elle soit complètement séchée à l'air. Enfin, ajoutez une goutte d'huile d'immersion directement à la diapositive, puis examinez la diapositive à l'aide d'un microscope léger avec un objectif d'huile 100X.
Pour effectuer la coloration endospore, d'abord, préparer une solution verte malachite de 0,5% en mélangeant 0. 125 grammes de poudre verte de malachite avec 25 millilitres d'eau distillée, puis vortex la solution jusqu'à dissolution. Ensuite, pipette 10 microlitres de 1X PBS sur le centre de la diapositive. Ensuite, utilisez une pointe de pipette stérile pour sélectionner une seule colonie bactérienne de la plaque d'agar LB. Enduisez les bactéries dans le liquide pour produire une couche mince et uniforme. Maintenant, placez la glissière sur le dessus du banc, et laissez-la sécher complètement à l'air. Une fois séché, allumez un brûleur Bunsen pour réchauffer les bactéries. Passer la glissière à travers la flamme du brûleur bleu à plusieurs reprises, avec le côté des bactéries face vers le haut. Ensuite, une fois la lame refroidie, placez un morceau de papier prédécoupé sur le frottis fixe de chaleur. Ensuite, tourner sur une plaque chauffante au réglage le plus élevé, et porter un bécher d'eau à ébullition.
Saturate le papier de lentille avec la solution vert malachite et, à l'aide de pinces, placez la diapositive sur le dessus du bécher d'eau bouillante à la vapeur pendant 5 minutes. Gardez le papier de l'objectif humide en ajoutant plus de colorant, une goutte à la fois, au besoin. Ensuite, à nouveau à l'aide de pinces, ramasser la diapositive du bécher et enlever et jeter le papier de l'objectif. Laisser refroidir la lame pendant 2 minutes. En travaillant au-dessus de l'évier, tenez la glissière à un angle et giclez doucement un jet d'eau sur le dessus de la glissière. Maintenant, maintenez le niveau de diapositive et appliquez la safranine pour couvrir complètement la diapositive. Ensuite, laissez-le reposer pendant 1 minute. Ensuite, maintenez la diapositive à un angle et rincez comme indiqué précédemment. Laisser sécher la glissière à l'air sur le dessus du banc. Enfin, ajoutez une goutte d'huile d'immersion directement à la diapositive, puis examinez la diapositive avec un microscope léger, avec un objectif d'huile 100X.
Dans le protocole de coloration Gram, deux taches de couleur différentes peuvent en résulter. La coloration pourpre foncée indique que les bactéries sont Gram-positives, et qu'ils ont conservé la tache de violette de cristal. En revanche, la coloration rose-rougeâtre est une caractéristique des bactéries Gram-négatives, qui seront plutôt colorées par la tache de compteur de safranin. En outre, différentes formes et arrangements de bactéries peuvent être visualisés après la coloration Gram. Par exemple, il est possible de différencier cocci, ou bactéries rondes, de Bacillus en forme de tige, ou d'identifier les bactéries qui forment des brins, par rapport à celles qui s'agrégent généralement sous forme d'amas, ou qui se produisent individuellement.
Dans une image de microscope tachée de capsule, les cellules bactériennes seront typiquement souillées pourpre, et l'arrière-plan de la glissière devrait être sombrement souillé. Sur ce fond sombre, les capsules de la bactérie, si elles sont présentes, apparaîtront comme un halo clair autour des cellules.
Enfin, dans la coloration endospore, les cellules végétatives seront tachées de rouge par la tache de compteur de safranin. Si les endospores sont présentes dans l'échantillon, celles-ci conserveront la tache vert malachite, et apparaîtront de couleur bleu-vert.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Les bactéries ont des caractéristiques distinctives qui peuvent faciliter leur identification. Certaines de ces caractéristiques peuvent être observées par la coloration et la microscopie légère. Trois techniques de coloration utiles pour observer ces caractéristiques sont Gram coloration, coloration Capsule, et Endospore coloration. Chaque technique identifie différentes caractéristiques des bactéries et peut être utilisée pour aider les médecins à recommander des traitements pour les patients, à identifier les contaminants potentiels dans les échantillons ou les produits alimentaires, et à vérifier la stérilité de l'échantillon.
Subscription Required. Please recommend JoVE to your librarian.
References
- Black, J. G. Microbiology Principles and Explorations, 4th edition. Prentice-Hall, Inc., Upper Saddle River, New Jersey. (1999)
- Madigan, M. T. and J. M. Martinko. Brock Biology of Microorganisms, 11th edition. Pearson Prentice Hall, Upper Saddle River, New Jersey. (2006).
- Leboffe, M. J., and B. E. Pierce. A Photographic Atlas for the Microbiology Laboratory, 2nd ed. Morton Publishing Company, Englewood, Colorado. (1996).
- Smith, A. C. and M. A. Hussey. Gram stain protocols. Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.2886. (2005).
- Hughes, R. B. and A. C. Smith. Capsule Stain Protocols Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.3041. (2007).
- Anthony, E. E. Jr. A note on capsule staining. Science 73(1890):319-320 (1931).
- Finegold, S. M., W. J. Martin, and E. G. Scott. Bailey and Scott's Diagnostic Microbiology, 5th edition. The C. V. Mosby Company, St. Louis, Missouri. (1978).
- Gerhardt, P., R. G. E. Murray, W. A. Wood, and N. R. Krieg. Methods for general and molecular bacteriology. ASM Press, Washington, DC. (1994).
- Hussey, M. A. and A. Zayaitz. Endospore Stain Protocol. Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.3112. (2007).




