Overview
Quelle: Natalia Martin1, Andrew J. Van Alst1, Rhiannon M. LeVeque1, und Victor J. DiRita1
1 Department of Microbiology and Molecular Genetics, Michigan State University
Bakterien haben die Fähigkeit, genetisches Material (DeoxyriboNucleic Acid, DNA) in einem Prozess auszutauschen, der als horizontaler Gentransfer bekannt ist. Die Einbeziehung exogener DNA bietet einen Mechanismus, mit dem Bakterien neue genetische Merkmale erwerben können, die es ihnen ermöglichen, sich an sich verändernde Umweltbedingungen anzupassen, wie das Vorhandensein von Antibiotika oder Antikörpern (1) oder Molekülen, die in natürlichen Lebensräumen gefunden werden (2). Es gibt drei Mechanismen des horizontalen Gentransfers: Transformation, Transduktion und Konjugation (3). Hier konzentrieren wir uns auf transformation, die Fähigkeit von Bakterien, freie DNA aus der Umwelt zu nehmen. Im Labor hat der Transformationsprozess vier allgemeine Schritte: 1) Vorbereitung kompetenter Zellen, 2) Inkubation kompetenter Zellen mit DNA, 3) Wiederherstellung der Zellen und 4) Beschichtung der Zellen für das Wachstum der Transformanten (Abbildung 1).
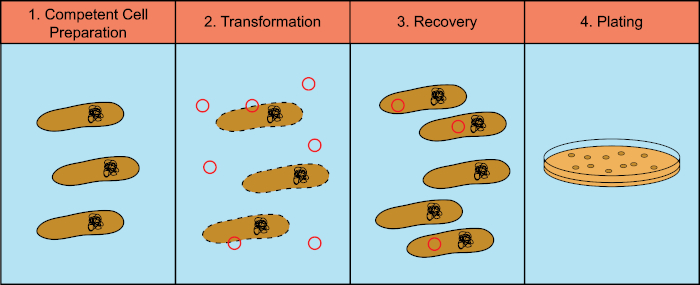
Abbildung 1: Allgemeine Schritte des Transformationsprozesses. Der Transformationsprozess besteht aus vier allgemeinen Schritten: 1) Vorbereitung kompetenter Zellen, 2) Inkubation mit DNA, 3) Wiederherstellung der Zellen und 4) Beschichtungszellen für das Wachstum der Transformanten.
Damit die Transformation stattfindet, müssen sich die Empfängerbakterien in einem Zustand befinden, der als Kompetenz bekannt ist. Einige Bakterien haben die Fähigkeit, natürlich kompetent als Reaktion auf bestimmte Umweltbedingungen zu werden. Jedoch, viele andere Bakterien werden nicht kompetent natürlich, oder die Bedingungen für diesen Prozess sind noch unbekannt. Die Fähigkeit, DNA in Bakterien einzuführen, hat eine Reihe von Forschungsanwendungen: mehrere Kopien eines DNA-Moleküls von Interesse zu erzeugen, eine große Menge an Proteinen auszudrücken, als Bestandteil in Klonverfahren, und andere. Aufgrund des Wertes der Transformation zur Molekularbiologie gibt es mehrere Protokolle, die darauf abzielen, Zellen künstlich kompetent zu machen, wenn Bedingungen für natürliche Kompetenz unbekannt sind. Zwei Hauptmethoden werden verwendet, um künstlich kompetente Zellen vorzubereiten: 1) durch chemische Behandlung von Zellen und 2) Die Zellen elektrischen Impulsen aussetzen (Elektroporation). Erstere verwendet je nach Verfahren unterschiedliche Chemikalien, um Anziehungskraft zwischen der DNA und der Zelloberfläche zu erzeugen, während letztere elektrische Felder verwendet, um Poren in der bakteriellen Zellmembran zu erzeugen, durch die DNA-Moleküle eindringen können. Der effizienteste Ansatz für die chemische Kompetenz ist die Inkubation mit divalenten Kationen, insbesondere Kalzium (Ca2+)(4,5) Calcium-induzierte Kompetenz ist das Verfahren, das hier beschrieben wird (6). Diese Methode wird hauptsächlich für die Transformation von Gram-negativen Bakterien verwendet, und das wird der Schwerpunkt dieses Protokolls sein.
Das Verfahren der chemischen Umwandlung umfasst eine Reihe von Schritten, in denen Zellen Kationen ausgesetzt sind, um chemische Kompetenz zu induzieren. Auf diese Schritte folgt anschließend eine Temperaturänderung - Hitzeschock -, die die Aufnahme fremder DNA durch die zuständige Zelle begünstigt (7). Die bakteriellen Zellhüllen sind negativ geladen. Bei gramnegativen Bakterien wie Escherichia coliist die äußere Membran aufgrund des Vorhandenseins von Lipopolysaccharid (LPS) negativ geladen (8). Dies führt zur Abstoßung der ähnlich negativ geladenen DNA-Moleküle. In der chemischen Kompetenzinduktion neutralisieren positiv geladene Calciumionen diese Ladungsabstoßung und ermöglichen die DNA-Absorption auf die Zelloberfläche (9). Die Kalziumbehandlung und Inkubation mit DNA erfolgt auf Eis. Anschließend wird eine Inkubation bei höheren Temperaturen (42°C), dem Hitzeschock, durchgeführt. Dieses Temperaturungleichgewicht begünstigt die DNA-Aufnahme weiter. Bakterielle Zellen müssen sich in der mittleren exponentiellen Wachstumsphase befinden, um der Hitzeschockbehandlung standzuhalten; in anderen Wachstumsstadien sind die Bakterienzellen zu empfindlich gegenüber der Hitze, was zu einem Verlust der Lebensfähigkeit führt, was die Transformationseffizienz deutlich verringert.
Für die Transformation können verschiedene DNA-Quellen verwendet werden. Typischerweise werden Plasmide, kleine kreisförmige, doppelsträngige DNA-Moleküle, für die Transformation in den meisten Laborverfahren in E. coli verwendet. Damit Plasmide nach der Transformation in der Bakterienzelle erhalten bleiben können, müssen sie einen Ursprung der Replikation enthalten. Dadurch können sie unabhängig vom bakteriellen Chromosom in der Bakterienzelle repliziert werden. Nicht alle Bakterienzellen werden während des Transformationsvorgangs transformiert. So ergibt die Transformation eine Mischung aus transformierten Zellen und nicht transformierten Zellen. Um zwischen diesen beiden Populationen zu unterscheiden, wird eine Selektionsmethode verwendet, um die Zellen zu identifizieren, die das Plasmid erworben haben. Plasmide enthalten in der Regel wählbare Marker, d. h. Gene, die eine Eigenschaft kodieren, die einen Vorteil für das Wachstum verleiht (d. h. Resistenz gegen ein Antibiotikum oder eine Chemikalie oder Rettung aus einer Wachstumsauxotrophie). Nach der Transformation werden Bakterienzellen auf selektiven Medien plattiert, was nur das Wachstum der transformierten Zellen ermöglicht. Im Falle von Zellen, die mit einem Plasmid transformiert werden, das eine Resistenz gegen ein bestimmtes Antibiotikum verleiht, werden die selektiven Medien Wachstumsmedien sein, die dieses Antibiotikum enthalten. Verschiedene Methoden können verwendet werden, um zu bestätigen, dass die in den selektiven Medien angebauten Kolonien Transformanten sind (d.h. das Plasmid eingebaut haben). Beispielsweise können Plasmide aus diesen Zellen mit Plasmidpräparationsmethoden (10) zurückgewonnen und verdaut werden, um die Plasmidgröße zu bestätigen. Alternativ kann Kolonie-PCR verwendet werden, um das Vorhandensein des Plasmids von Interesse zu bestätigen (11).
Ziel dieses Experiments ist es, chemisch kompetente E. coli DH5-Zellen unter Verwendung einer Anpassung des Calciumchloridverfahrens (12) vorzubereiten und mit dem Plasmid pUC19 zu transformieren, um die Transformationseffizienz zu bestimmen. Der E. coli-Stamm DH5 ist ein häufig verwendeter Stamm in molekularbiologischen Anwendungen. Aufgrund seines Genotyps, insbesondere des recA1 und des endA1,ermöglicht dieser Stamm eine erhöhte Insert-Stabilität und verbessert die Qualität der Plasmid-DNA in nachfolgenden Präparaten. Da die Transformationseffizienz mit zunehmender Größe der DNA abnimmt, wurde das Plasmid pUC19 in diesem Protokoll wegen seiner geringen Größe (2686 bp) verwendet (siehe https://www.mobitec.com/cms/products/bio/04_vector_sys/standard_cloning_vectors.html für eine Vektorkarte). pUC19 verleiht Resistenz gegen Ampicillin und somit war dies das Antibiotikum, das zur Selektion verwendet wurde.
Procedure
Dieses Protokoll beschreibt die Herstellung und Umwandlung des kompetenten E. coli DH5 mit Hilfe einer Anpassung des Calciumchloridverfahrens (12).
1. Einrichtung
-
ausrüstung
- Spektrophotometer
- Sorval zentrifuge (oder gleichwertig)
- Benchtop Zentrifuge
- Wärmeblock oder Wasserbad
- Orbital Shaker
- Stationärer Inkubator
- Gelgussschale
- Gut Kämme
- Spannungsquelle
- Gel-Box
- UV-Lichtquelle
- mikrowelle
-
Lösungen und Reagenzien
- Luria-Bertani (LB) Brühe (10 g Kaseinenzymhydrolysat, 5 g Hefeextrakt und 5 g Natriumchlorid in 1000 mlH2O)
- Super optimale Brühe mit Katabolitenrepression (SOC): (2% (w/v) Trypton, 0,5% (w/v) Hefeextrakt, 10 mM NaCl, 2,5 mM KCl, 10 mM MgCl2, 10 mM MgSO4und 20 mM Glukose)
- CaCl2-MgCl2 (80 mM MgCl2, 20 mM CaCl2) Lösung.
- M CaCl2 Lösung (wenn Zellen sofort transformiert werden) oder 0,1M CaCl2 Lösung mit 10% (v/v) Glycerin (wenn Zellen für die zukünftige Verwendung eingefroren werden).
- LB AgarPlatten
- LB Agar selektive Platten (für dieses Experiment, da das verwendete Plasmid konfers Ampicillin-Resistenz, LB-Agar-Platten mit Ampicillin 100 g/ml verwendet wurden)
- E. coli DH5-Stamm
- Plasmid pUC19 DNA (100 pg/ l)
- QIAprep Spin Miniprep Kit (Qiagen)
- Hind III-Restriktionsenzym
- 1 kb plus DNA-Leiter
- Niedriger Schmelzpunkt Agarose
- 1X TAE Puffer (40 mM Tris Base, 20 mMM Essigsäure und 1mM EDTA)
- Ethidiumbromid (10mg/ml)
-
Allgemeine Sicherheitshinweise
E. coli DH5 wird als Biosafety Level 1 (BSL1) klassifiziert. Mikroben in dieser Kategorie stellen bei gesunden Erwachsenen wenig bis gar keine Infektionsgefahr dar. Eine sorgfältige Manipulation des Mikroorganismus ist jedoch erforderlich.
WICHTIG alle Schritte in diesem Protokoll müssen mit aseptischen Techniken und auf Eis oder 4°C Temperaturen durchgeführt werden, sofern nicht angegeben.
2. Protokoll
- Aus einem gefrorenen Vorrat an E. coli DH5 (gefroren in 20% Glycerin aus einer über Nacht kultur in LB angebaut) streifen Bakterien für die Isolierung auf einer LB Agarplatte. Inkubieren Bei 37°C über Nacht (16-20 Stunden).
- Impfen Sie eine einzelne Kolonie in 3 ml LB-Brühe in einer Röhre. Schütteln bei 210 Rpm bei 37°C über Nacht (16-20 Stunden).
- Messen Sie die OD600 der Übernachtungskultur. Verwenden Sie die Nachtkultur, um 100 ml LB-Brühe in einem 1-Liter-Kolben zu einem OD600=0.01 zu impfen. Bebrüte die Kultur kräftig (210 Rpm) bei 37°C und überwacht OD600 im Spektralphotometer alle 15-20 min, bis die Kultur OD600=0,35 (ca. 3 Stunden) erreicht.
HINWEIS: Damit die Transformation effizient ist, müssen sich Bakterienzellen in einer mittleren exponentiellen Wachstumsphase befinden. Die maximale Anzahl der Zellen muss 108 Zellen/ml betragen, was für die meisten Stämme von E. coli OD600=0.4 entspricht. Die Verwendung des Spektralphotometers ermöglicht die Messung des OD600, wodurch festgestellt werden kann, dass sich die Zellen in der entsprechenden Wachstumsphase befinden. Wenn dieses Protokoll für andere Bakterienstämme verwendet wird, ist eine Kalibrierung erforderlich, um die Anzahl der Kolonien zu bestimmen, die Einheiten zu bestimmten OD600-Werten bilden, um diese Korrelation zu bestimmen. - Übertragen Sie die 50 ml der Kultur auf jede der 2 eiskalten Polypropylen-Zentrifugenflaschen. Die Flaschen 20 min auf Eis legen, um sie abzukühlen.
- Die Zellen durch Zentrifugation bei 2700g (4100 U/min in einem Sorval GSA Rotor) für 10 min bei 4°C wiederherstellen.
- Entfernen Sie den Überstand. Entleeren Sie die letzten Medienspuren, indem Sie die Flasche kopfüber auf ein Pad oder Papiertuch legen.
- Setzen Sie jedes bakterielle Pellet in 30 ml einer CaCl2-MgCl2 (80 mM MgCl2, 20 mM CaCl2) eiskalte Lösung aus. Zuerst 5 ml der Lösung hinzufügen, vorsichtig wirbeln, bis sich das Pellet vollständig aufgelöst hat, und dann die restlichen 25 ml Lösung hinzufügen.
- Wiederholen Sie Schritt 2.4.
- Wiederholen Sie Schritt 2.5.
- Wenn kompetente Zellen direkt umgewandelt werden, setzen Sie jedes bakterielle Pellet in 2 ml einer ca.2 (0,1 m) eiskalten Lösung aus, indem Sie die Rohre vorsichtig wirbeln. Wenn das Pellet mit dieser Methode nicht resuspendiert wird, resuspendieren Sie durch sanftes Pipettieren nach oben und unten (Vermeidung von Blasenbildung).
Alternativ können die kompetenten Zellen eingefroren und zur späteren Verwendung gelagert werden. Um gefrorene Bestände kompetenter Zellen zu zuzubereiten, setzen Sie das Pellet in 2 ml einer 0,1 Mio.CaCl2-Lösung mit 10 % (v/v) Glycerin wieder aus. Diese Lösung muss eiskalt sein. Aliquot-Zellsuspension in eiskalte 1,5 ml Polypropylenröhren (160 l pro Röhre). Kompetente Zellen sofort in einem Trockeneis/Ethanolbad einfrieren. Rohre in einen -70°C Gefrierschrank übertragen. - Um die CaCl2-behandeltenZellen zu transformieren, übertragen Sie 50 l kompetente Zellen auf jeweils 2 1,5 ml Polypropylen-Röhrchen. Fügen Sie die 1 l (100 pg) pUC19 Plasmid-DNA in eines der Röhrchen hinzu und lassen Sie die zweite Röhre ohne DNA (negative Kontrolle). Mischen Sie sanft (Blasenbildung vermeiden). 30 min auf Eis bebrüten.
HINWEIS: Bei der Transformation sollten nicht mehr als 50 ng DNA in einem Volumen von 10 l oder weniger verwendet werden. - Übertragen Sie die Rohre auf den Wärmeblock und inkubieren Bei 42°C für 45 s genau.
HINWEIS: Hitzeschock ist ein kritischer Schritt. Temperatur oder Inkubationszeit nicht überschreiten. - Rohre leicht auf Eis übertragen. Inkubieren Sie für 2 min.
- Fügen Sie 950 L SOC-Medien hinzu und inkubieren Sie die Röhren 1 Stunde bei 37°C, damit sich die Bakterien erholen und den im Plasmid kodierten antibiotikaresistenten Marker ausdrücken können.
- Verdünnung von 10 l der Zellsuspension in 1000 l in SOC (1/100 Verdünnung) und 100 l der Zellsuspension in 1000 l in SOC (1/10 Verdünnung). Platte 100 l der Verdünnungen sowie die Kontrolle auf selektive Platten und mit einem Spachtel verteilen. In der Regel ergibt die Beschichtung von 100 l einer Verdünnung von 1/100 und 1/10 eine ausreichende Anzahl von koloniebildenden Einheiten (cfu) pro Platte. Idealerweise sollte diese Zahl zwischen 30-300 cfu liegen, so dass es genügend Kolonien gibt, aber voneinander getrennt sind. Die Anzahl der cfu hängt jedoch von der Transformationseffizienz ab (siehe Abschnitt Datenanalyse und Ergebnisse).
- Inkubieren Sie die Platten bei 37°C. Transformierte Kolonien sollten in 12-16 Stunden erscheinen (dieser Bereich hängt von der Zellstamm- und Selektionsmethode ab). Keine Kolonien sollten in der negativen Kontrolle wachsen.
- Zählen Sie die für die Transformation erhaltene cfu/platte (Tabelle 1).
- Um zu überprüfen, ob die Transformanten das pUC19-Plasmid enthalten, wird ein Plasmidpräparat und eine anschließende Verdauung durchgeführt. Zu diesem Zweck eine einzelne Kolonie in 3 ml LB-Brühe in einer Röhre impfen. Schütteln bei 210 Rpm bei 37°C über Nacht (16-20 Stunden).
- Bereiten Sie ein Plasmid-Präparat mit dem QIAprep Spin Miniprep Kit nach den Anweisungen des Herstellers vor.
- Verdauen Sie die 1 g gereinigte pUC19 mit dem Restriktionsenzym HindIII bei 37°C für 1 Stunde.
HINWEIS: Für diesen Schritt kann jedes Enzym verwendet werden, das die mehrfache Klonstelle pUC19 schneidet.
| teil | betrag |
| 10X Einschränkung Digest-Puffer | 2,5 l |
| Plasmid pUC19 | 1 g |
| Hind Ⅲ | 1 l |
| H2O | 20,5 l (bis 25 l) |
- Führen Sie eine Molekulargewichtsleiter, verdaute pUC19-DNA und die gleiche Menge an unverdauter pUC19-DNA in einem 1% Agarose-Gel, das 1 g/ml Ethidiumbromid enthält, 1 Stunde lang bei 95 V.
HINWEIS: Zeit und Spannung variieren je nach verwendeter Ausrüstung. - Visualisieren Sie Gel unter UV-Licht. Vergleichen Sie die Größe der verdauten und unverdauten pUC19-DNA (Abbildung 2) (siehe Abschnitt Datenanalyse und Ergebnisse).
Fahren Sie mit den erforderlichen Schritten fort, um die Transformation entsprechend dem Ziel jedes einzelnen Transformationsexperiments zu überprüfen.

Abbildung 2: Verdauung der wiedergewonnenen Plasmid-DNA aus transformierten DH5-Zellen. Plasmid-DNA wurde aus transformierten DH5-Zellen, die mit HindIII verdaut, in einem 1% Agarose-Gel verdaute und mit einer UV-Quelle visualisiert wurden (Schritte 2.19 bis 2.22), wiederhergestellt.
3. Datenanalyse und Ergebnisse
Um die Transformationseffizienz zu berechnen, ein Indikator dafür, wie gut die Zellen die extrazelluläre DNA aufgriffen, müssen die kolonien gezählt werden, die bei der Transformation erhalten wurden:
| verdünnung | Cfu |
| 1/100 | 34 |
| 1/10 | 246 |
Tabelle 1: Koloniebildnereinheiten (cfu) aus Transformationsexperiment gezählt.
Die Transformationseffizienz (TE) ist ein Maß für die Anzahl der cfu, die sich aus der Umwandlung von 1 g Plasmid in ein bestimmtes Volumen kompetenter Zellen ergibt. Viele Parameter beeinflussen die Transformationseffizienz: Plasmidgröße, Zellgenotyp, Wachstumsstadium bei der Kompetenzvorbereitung, Transformationsmethoden usw.). Bei der Berechnung des TE ist es wichtig zu berücksichtigen, welche Verdünnung (falls vorhanden) vor der Beschichtung durchgeführt wurde, und sie in die Berechnung der Gesamtzahl der Cfu einzubeziehen. Die Transformationseffizienz (TE) wird mit der folgenden Gleichung berechnet:

Teilen Sie zunächst den Cfu durch die DNA, in diesem Beispiel 0,0001 g. Dividieren Sie dann das Ergebnis durch den Verdünnungsfaktor. In diesem Beispiel wurde eine Verdünnung von 1/10 und 100 l einer 1 ml-Lösung plattiert (Verdünnung: 1/10 x 100 l /1000 l =0,01).

Bakterien sind bemerkenswert anpassungsfähig und ein Mechanismus, der diese Anpassung erleichtert, ist ihre Fähigkeit, externe DNA-Moleküle aufzunehmen. Eine Art von DNA, die Bakterien aufnehmen können, wird als Plasmid bezeichnet, ein kreisförmiges Stück DNA, das häufig nützliche Informationen enthält, wie Antibiotikaresistenzgene. Der Prozess der Veränderung von Bakterien durch neue genetische Informationen aus einer externen Quelle wird als Transformation bezeichnet. Die Transformation kann leicht im Labor mit Escherichia coli oder E. colidurchgeführt werden.
Um transformiert zu werden, müssen E. coli-Zellen zunächst kompetent gemacht werden, was bedeutet, dass sie DNA-Moleküle aus ihrer Umgebung aufnehmen können. Das Protokoll dazu ist überraschend einfach, eine kurze Inkubation der Zellen in einer Calciumchloridlösung. Diese Inkubation bewirkt, dass die Zellen für DNA-Moleküle durchlässig werden. Nachdem die Zellen durch Zentrifugation pelletiert wurden, wird der Überstand entfernt. Die Plasmid-DNA wird nun den zuständigen Zellen zugesetzt. Nach der Inkubation der Zellen mit DNA wird die Mischung kurz auf 42 Grad Celsius erhitzt, gefolgt von einer schnellen Abkühlung auf Eis. Dieser Hitzeschock bewirkt, dass die DNA über die Wand und die Membranen der Zelle übertragen wird. Die Zellen werden dann in frischen Medien inkubiert. Dann werden die Bakterien auf 37 Grad platziert, damit sie ihre Membranen wieder versiegeln und resistente Proteine ausdrücken können.
Die Zellen, die die Plasmide aufgenommen haben, kopieren die DNA originalgetreu und geben sie an ihre Nachkommen weiter und geben alle Proteine aus, die von ihr kodiert werden könnten, einschließlich Antibiotikaresistenzvermittlern. Diese Resistenzgene können als wählbare Marker verwendet werden, um Bakterien zu identifizieren, die erfolgreich transformiert wurden, weil Zellen, die das Plasmid nicht aufgenommen haben, das Resistenzgenprodukt nicht ausdrücken. Das bedeutet, dass nur Zellen wachsen, die das Plasmid aufgenommen haben, wenn die Zellen auf einem festen Medium plattiert sind, das das entsprechende Antibiotikum enthält. Die Transformation der Zellen in einer wachsenden Kolonie kann weiter bestätigt werden, indem diese Zellen über Nacht in flüssigen Medien kultiviert werden, um die Ausbeute zu erhöhen, bevor die DNA aus der Probe extrahiert wird. Sobald die DNA isoliert ist, kann ein diagnostisches Restriktionsenzym-Digest durchgeführt werden. Da Restriktionsenzyme DNA an vorhersehbaren Stellen schneiden, sollte das Ausführen dieser Digests auf einem Gel ein vorhersagbares Muster aufweisen, wenn das gewünschte Plasmid erfolgreich transformiert wurde. Wenn z. B. pUC19 mit dem Restriktionsenzym HindIII hergestellt und geschnitten wird, sollte ein einzelnes Band von 2686 Nukleotiden auf dem Gel zu sehen sein.
In diesem Labor transformieren Sie den E. coli-Stamm DH-5 Alpha mit pUC19 und bestätigen dann die erfolgreiche Transformation durch DNA-Gelelektrophorese.
Bevor Sie mit dem Eingriff beginnen, ziehen Sie die entsprechende persönliche Schutzausrüstung an, einschließlich laborierter Kleidung und Handschuhe. Als nächstes sterilisieren Sie den Arbeitsbereich mit 70% Ethanol.
Bereiten Sie nun chemisch kompetente Zellen vor, indem Sie eine Schleife voller Bakterien auf eine sterile LB-Agarplatte ablagern und die Bakterien mit einer neuen Schleife sättigen. Dann bebrüten Sie die Platte bei 37 Grad Celsius über Nacht. Am nächsten Tag die Bankplatte wieder mit 70% Ethanol sterilisieren und die Platte aus dem Inkubator entfernen.
Impfen Sie eine einzelne, gut isolierte Kolonie in 3 Milliliter LB-Brühe in einem Rohr mit einer sterilen Schleife. Dann wachsen Die Kultur bei 37 Grad Celsius über Nacht, mit Schütteln bei 210 RPM. Messen Sie am nächsten Tag die optische Dichte der Übernachtungskultur mit einem Spektralphotometer. Dann 100 Milliliter LB-Brühe in einen Ein-Liter-Kolben geben und mit der Nachtkultur bei einer optischen Dichte von 0 impfen. 01. Bebrüte nun die Kultur bei 37 Grad Celsius mit Schütteln und prüfe die OD600 alle 15 bis 20 Minuten, bis die Kultur die mittelexponentielle Wachstumsphase erreicht.
Nach ca. drei Stunden 50 Milliliter der Kultur auf zwei eiskalte Polypropylenflaschen übertragen. Dann legen Sie die Flaschen wieder auf Eis für 20 Minuten zu kühlen. Als nächstes, erholen Sie die Zellen durch Zentrifugation. Entsorgen Sie die Überräube und legen Sie die Flaschen auf einem Papiertuch auf den Kopf. Als nächstes das bakterielle Pellet in fünf Millilitere eiskalte Calciumchlorid-Magnesiumchloridlösung wieder aufsetzen und vorsichtig wirbeln, bis sich das Pellet vollständig aufgelöst hat. Dann fügen Sie weitere 25 Milliliter der Lösung auf das gelöste bakterielle Pellet. Setzen Sie das andere bakterielle Pellet wieder aus, wie zuvor gezeigt. Danach wiederholen Sie die Zentrifugation, und entfernen Sie die Überstande.
Wenn die zuständigen Zellen direkt transformiert werden, setzen Sie jedes bakterielle Pellet in zwei Millilitern einer eiskalten 0,1 Molkalziumchloridlösung wieder auf, indem Sie die Schläuche vorsichtig wirbeln. Um das Transformationsverfahren zu beginnen, übertragen Sie 50 Mikroliter kompetenter Zellen auf zwei beschriftete 1,5 Milliliter Polypropylenröhren. Fügen Sie dann einem der Röhren einen Mikroliter pUC19-Plasmid-DNA hinzu. Mischen Sie sanft, Vermeiden Blasenbildung, und inkubieren beide Rohre für 30 Minuten auf Eis. Nach der Inkubation die Rohre in einen Wärmeblock geben und 45 Sekunden lang bei 42 Grad Celsius brüten. Die Rohre sofort auf Eis übertragen und zwei Minuten bebrüten. Fügen Sie nun 950 Mikroliter SOC-Medien in jede Röhre und inkubieren Sie sie für eine Stunde bei 37 Grad Celsius, damit sich die Bakterien erholen können, und drücken Sie den antibiotikaresistenten Marker aus, der im Plasmid kodiert ist.
Um eine Verdünnung von 1 bis 100 herzustellen, fügen Sie 990 Mikroliter SOC-Medien und 10 Mikroliter Zellsuspension in ein 1,5-Milliliter-Rohr ein. Dann machen Sie eine 1 bis 10 Verdünnung durch Zugabe von 900 Mikroliter SOC-Medien und 100 Mikroliter Zellsuspension zu einem 1,5 Milliliter-Rohr. Als nächstes 100 Mikroliter der verdünnten Zellsuspensionen und 100 Mikroliter der Negativkontrolle auf separate selektive Platten, die Ampicillin enthalten, mit einem Streuer und bebrüten die Platten 12 bis 16 Stunden bei 37 Grad Celsius. Zählen Sie nach der Inkubation die koloniebildenden Einheiten oder KBE pro Platte, die durch Transformation erhalten wurden, und erfassen Sie diese Daten. Um zu überprüfen, ob die Transformanten das pUC19-Plasmid haben, wählen Sie eine einzelne, gut isolierte Kolonie aus einer Platte mit einer sterilen Schleife und führen Sie sie in ein Rohr mit 3 MilliliterN LB-Brühe ein. Dann bebrüten die Kultur bei 37 Grad Celsius mit Schütteln, über Nacht. Verwenden Sie am nächsten Tag ein DNA-Mini-Vorbereitungskit, um DNA aus 3 Millilitern der Kultur zu isolieren, gemäß den Anweisungen des Herstellers. Nach Abschluss der DNA-Mini-Vorbereitung verdauen Sie das 1 Mikrogramm gereinigtes pUC19 mit einem Restriktionsenzym bei 37 Grad Celsius für 1 Stunde. Laden Sie nun 20 Mikroliter einer Molekulargewichtsleiter, 1 Mikrogramm verdauter Plasmid-DNA und 1 Mikrogramm unverdauter Plasmid-DNA in aufeinander folgende Brunnen eines 1% Agarose-Gels, das 1 Mikrogramm pro Milliliter Ethidiumbromid enthält. Dann laufen Sie das Gel für 1 Stunde bei 95 Volt. Schließlich visualisieren Sie das Gel mit einem UV-Beleuchtung.
In diesem Experiment wurden e. coli DH5 Alpha chemisch kompetente Zellen mittels einer Anpassung des Calciumchloridverfahrens hergestellt und dann mit dem Plasmid pUC19 transformiert, um die Transformationseffizienz zu bestimmen. Um die Transformationseffizienz zu berechnen, verwenden Sie die aufgezeichneten KBE-Zahlen für die 1 in 100 und 1 in 10 Verdünnungen, und alle anderen Verdünnungen mit KBE zählt zwischen 30 und 300. Erstens wird die aufgezeichnete KBE-Zahl, 246 in diesem Beispiel, durch die Menge der DNA geteilt, .0001 Mikrogramm hier, die plattiert wurde. Dann wird diese Zahl durch den Verdünnungsfaktor dividiert, der verwendet wird, um die Umwandlungseffizienz in KBE pro Mikrogramm zu geben. In diesem Beispiel wurde eine Verdünnung von 1 bis 10 und 100 Mikroliter einer 1-Milliliter-Lösung plattiert, was einen endgültigen Verdünnungsfaktor von 0,01 ergibt. In der unverdauten Plasmidspur kann die kreisförmige DNA als zwei oder drei verschiedene Bänder unterschiedlicher Helligkeit erscheinen. Dies liegt daran, dass die kreisförmige, ungeschnittene DNA in mehreren verschiedenen Konformationszuständen existieren kann, z. B. in übereinander geschraubten, offenen Kreisen oder linearer, und jede dieser DNA bewegt sich mit unterschiedlichen Raten durch das Gel. Die Analyse der wiedergewonnenen Plasmid-DNA-Verdauung ergab, dass das verwendete Plasmid eine erwartete Größe von pUC19 DNA hat, 2.686 Basenpaare.
Subscription Required. Please recommend JoVE to your librarian.
Results
Obwohl TE von vielen Faktoren abhängig ist, ergeben nicht-kommerzielle, kompetente Zellpräparate wie dieser normalerweise 106 bis 107 Transformanten pro Mikrogramm Plasmid. Daher ergab diese Zubereitung mit einem TE = 2,46 x 108 cfu/g einen TE, der weit über den erwarteten Bereich hinausging. Zusätzliche Protokolle stehen zur Verfügung, um überkompetente Zellen herzustellen, wenn für eine bestimmte Anwendung höhere Transformationseffizienzen erforderlich sind (13).
Die Analyse der Verdauung der aus den transformierten Zellen gewonnenen Plasmid-DNA ergab, dass dieses Plasmid die erwartete Größe der pUC19-DNA (2686 bp) hat.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Transformation ist eine leistungsfähige Methode zur Einführung von exogener DNA in Bakterienzellen, die für viele molekularbiologische Anwendungen im Labor von entscheidender Bedeutung ist. Darüber hinaus spielt es eine wichtige Rolle in der Natur, indem es Bakterienzellen erlaubt, genetisches Material auszutauschen, was zu einer erhöhten genetischen Variation führen und den Erwerb verschiedener nützlicher Merkmale für das Überleben unter einer Vielzahl von Bedingungen ermöglichen könnte. Viele Bakterienstämme kodieren die Gene, die für die natürliche Kompetenz erforderlich sind. Die Bedingungen, unter denen diese Gene induziert werden, sind jedoch noch unbekannt. Weitere Forschung ist erforderlich, um diese Bedingungen zu bestimmen.
Subscription Required. Please recommend JoVE to your librarian.
References
- Croucher, N. J. et al. Rapid pneumococcal evolution in response to clinical interventions. Science. 331 (6016):430-434. (2011)
- Borgeaud, S. et al. The type VI secretion system of Vibrio cholerae fosters horizontal gene transfer. Science. 347(6217):63-67. (2015)
- Burmeister, A. R. Horizontal Gene Transfer. Evol Med Public Health. 2015 (1):193-194. (2015)
- Weston A, Brown MG, Perkins HR, Saunders JR, Humphreys GO. Transformation of Escherichia coli with plasmid deoxyribonucleic acid: calcium-induced binding of deoxyribonucleic acid to whole cells and to isolated membrane fractions. J Bacteriol. 145 (2):780-7. (1981)
- Dagert M, Ehrlich SD. Prolonged incubation in calcium chloride improves the competence of Escherichia coli cells. Gene. 6 (1):23-8. (1979)
- Asif A, Mohsin H, Tanvir R, and Rehman Y. Revisiting the Mechanisms Involved in Calcium Chloride Induced Bacterial Transformation. Front Microbiol. 8:2169. (2017)
- Panja S, Aich P, Jana B, Basu T. How does plasmid DNA penetrate cell membranes in artificial transformation process of Escherichia coli? Mol Membr Biol. 25 (5):411-22. (2008)
- Silhavy, TJ, Kahne D, Walker S. The Bacterial Cell Envelope. Cold Spring Harb Perspect Biol. 2 (5): a000414. (2010)
- Panja S, Aich P, Jana B, Basu T. (2008) Plasmid DNA binds to the core oligosaccharide domain of LPS molecules of E. coli cell surface in the CaCl2-mediated transformation process. Biomacromolecules. 9 (9):2501-9.
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Plasmid Purification. JoVE, Cambridge, MA. (2018)
- Bergkessel M and Guthrie C. Colony PCR. Methods in Enzymology. 529: 299-309. (2013)
- Sambrook J and Russell DW. Molecular Cloning A Laboratory Manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY.Protocol 25 (1.116-118). (2001)
- Wirth R, Friesenegger A, Fiedler S. Transformation of various species of gram-negative bacteria belonging to 11 different genera by electroporation. Molecular & General Genetics. 216 (1): 175-7. (1989)




