Overview
Fuente: Alexander S. Gold1, Tonya M. Colpitts1
1 Departamento de Microbiología, Escuela de Medicina de la Universidad de Boston, Laboratorios Nacionales de Enfermedades de Infecciones Emergentes, Boston, MA
Descubierto por primera vez por Lederberg y Tatum en 1946, la conjugación es una forma de transferencia de genes horizontal entre bacterias que se basa en el contacto físico directo entre dos células bacterianas (1). A diferencia de otras formas de transferencia de genes, como la transformación o la transducción, la conjugación es un proceso natural en el que el ADN se secreta de una célula donante a una célula receptora de manera unidireccional. Esta direccionalidad y la capacidad de este proceso para aumentar la diversidad genética de las bacterias ha dado a la conjugación la reputación como una forma de "mate" bacteriano, que se cree que ha contribuido en gran medida al reciente aumento de los antibióticos resistentes bacterias (2, 3). Mediante el uso de presiones selectivas, por ejemplo el uso de antibióticos, la conjugación ha sido manipulada para su uso en el entorno de laboratorio, lo que la convierte en una poderosa herramienta para la transferencia horizontal de genes entre bacterias, y en algunos casos de bacterias a levaduras, plantas y animales células (4). Aparte de las aplicaciones en el laboratorio, la transferencia del gen de la bacteria-eucariota por conjugación es una emocionante vía de transferencia de ADN con una multitud de posibles aplicaciones biotécnicas e implicaciones naturales (5).
Se cree que la conjugación funciona mediante un "mecanismo de dos pasos" (6). En primer lugar, antes de que se pueda transferir cualquier ADN, la célula donante debe hacer contacto directo de célula a célula con el receptor. Este proceso se ha caracterizado mejor en bacterias gramnegativas, la más estudiada de las cuales es Escherichia coli. El contacto célula a célula se establece mediante la presencia de una compleja red de filamentos extracelulares en el donante conocido como sex pilus, un elemento conjugado codificado por el gen transferible conocido como factor F (fertilidad) (7, 8). Además de establecer el contacto entre el donante y el receptor, varias proteínas se transportan a través del pilus sexual al citoplasma receptor, formando un conducto del sistema de secreción tipo IV (T4SS) entre las dos células, una estructura necesaria para el segundo paso de conjugación, transferencia de ADN (6). Al combinar esta función del sex pilus con la replicación del círculo rodante del ADN, la célula donante es capaz de transferir ADN en forma de un elemento transposable, como un plásmido o transposón, al receptor mediante un modelo de "disparo y bomba" (6). En este caso, el "disparo" es el transporte de la proteína piloto, con ADN vinculado, por el T4SS a la célula receptora, y el "bomba" es el transporte activo de ADN al receptor, un proceso que depende del T4SS y catalizado por el acoplamiento de proteínas (6). La maquinaria utilizada en este proceso se compone de un origen de la secuencia de transferencia (oriT), que debe ser proporcionada por el ADN en cis y genes trans, que codifican una relaxasa, complejo de formación de pares de parejas, y proteína de acoplamiento tipo IV, y puede estar presente en cis o trans (9). Esta relajara corta el sitio nic dentro de la secuencia de oriT y se une covalentemente al extremo de 5' de la hebra transferida para producir el relajante, un complejo de ADN-relaxasa de una sola cadena con otras proteínas auxiliares (9). Una vez formado, el relajantese se conecta al complejo de formación del par de apareamiento, a través de la proteína de acoplamiento tipo IV, que permite la transferencia del complejo ssDNA-relaxasa a las células receptoras por el T4SS (10). Una vez en el citoplasma del receptor, el ADN puede integrarse en el genoma del receptor o existir por separado en forma de plásmido, cualquiera de los cuales permite la expresión de sus genes.
En este experimento, se utilizó la cepa de donante de conjugación ampliamente utilizada E. coli WM3064 para transferir la codificación genética para la resistencia a la ampicilina a la cepa receptora E. coli J53. Mientras que ambas cepas de las bacterias gramnegativas eran resistentes a la tetraciclina, sólo la cepa de donante WM3064 tenía el gen de la resistencia a la ampicilina, codificado en el vector de transbordador pWD2-oriT, y era auxotrópico al ácido diaminopimélico (DAP) (11-13). Este experimento consistió en dos pasos principales, la preparación de cepas de donantes y receptores, seguido según la transferencia del gen de resistencia a la ampicilina del donante al receptor por conjugación (Figura 1).
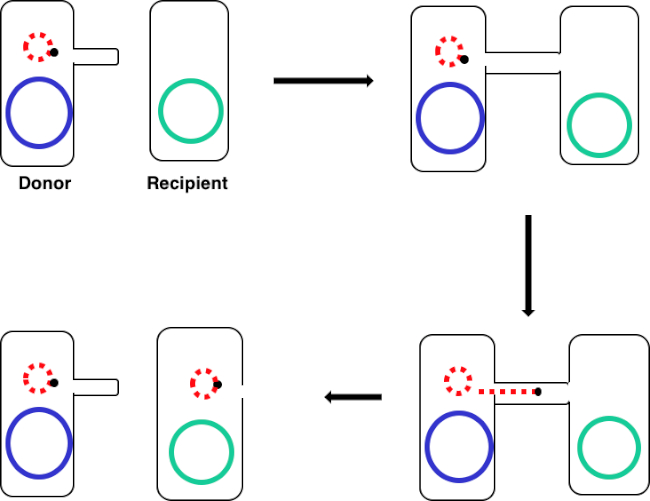
Figura 1: Esquema de conjugación. Este esquema muestra la transferencia exitosa de un plásmido, solo un ejemplo de un elemento de ADN transposable, de una célula donante a una célula receptora mediante conjugación. Tras el contacto con la célula receptora por la célula donante a través del sex pilus, el plásmido se replica mediante la replicación del círculo rodante, se mueve a través del complejo multiproteico que une las dos células y forma un nuevo plásmido de longitud completa en la célula receptora.
Al incubar una mezcla de células receptoras y donantes, y luego enchapar sucesivamente estas células en presencia de tetraciclina y DAP, esto permitió la transferencia exitosa del gen de resistencia a la ampicilina. Sucesivamente células de chapado cultivadas a partir de esta mezcla en presencia de tetraciclina y ampicilina, eliminaron todas las células del donante debido a la falta de DAP y cualquier célula receptora que no haya obtenido el gen de resistencia a la ampicilina, produciendo una cepa J53 estrictamente receptora bacterias que adquirieron resistencia a la ampicilina (Figura 2). Una vez realizada, la transferencia exitosa del gen de resistencia a la ampicilina fue confirmada por PCR. Dado que la conjugación tuvo éxito, la cepa J53 de E. coli contenía pWD2-oriT y era resistente a la ampicilina, y la codificación genética para esta resistencia es detectable por PCR. Sin embargo, de no tener éxito no habría habido detección del gen de resistencia a la ampicilina y la ampicilina seguiría funcionando como un antibiótico eficaz contra la cepa J53.
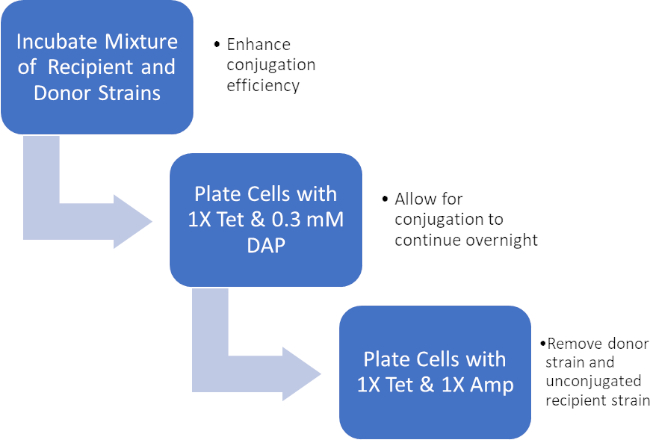
Figura 2: Esquema de protocolo. Este esquema muestra una visión general del protocolo presentado.
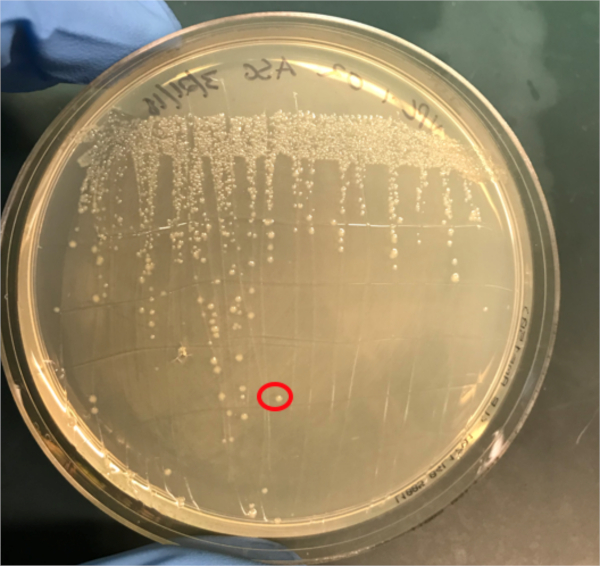
Figura 3A: La confirmación de la conjugación exitosa por PCR. A) Las existencias de congelador de las muestras de control conjugadas y negativas fueron rayadas en placas de agar y se seleccionó una colonia (roja) para el aislamiento del ADN.
Procedure
1. Configuración
- Autoclave aproximadamente 1L de medio Luria-Bertani (LB). Este LB estéril se utilizará para hacer aproximadamente 5 ml de LB que contengan 0,3 mM de ácido diaminopimelico (DAP).
- Recoger las siguientes placas: placas de agar LB con 1X Tet y 0.3 mM DAP, placas de agar LB con 1X Tet solamente, y placas de agar LB con 1X Amp/Tet solamente.
- Asegúrese de que un poco de glicerol y una caja de puntas de pipeta de plástico preesterilizadas estén cerca.
- Antes de comenzar cualquier trabajo que involucre microbios, esterilice el espacio de trabajo con 70% de etanol. Use siempre el equipo de protección personal necesario, incluyendo una capa de laboratorio y guantes.
- Una vez terminado, esterilizar todas las superficies y guantes con 70% de etanol y lavarse las manos.
2. Preparación de la tensión del donante y del receptor
- Preparar cultivos bacterianos de 5 ml del donante y las cepas receptoras y cultivarlas durante la noche a 37 oC con aireación y agitación a 220 rpm. La cepa del donante debe cultivarse en LB con 0,3 mM DAP.
- Gire hacia abajo 1 ml de ambos cultivos (3000 rpm durante 5 minutos) y lave las células con PBS.
- Resuspenda las células en 500 sl de solución salina tamponada de fosfato (PBS).
3. Conjugación
- Combinar 50 l de células receptoras con 50 l de células de donante en un tubo de microcentrífuga y mezclar mediante pipeteo.
- Incubar la mezcla celular durante 1 hora a 37oC. Esto mejorará la eficiencia de la conjugación antes y durante el siguiente paso de chapado.
- Pipet 100 l de la mezcla de células en una placa de agar con 1X Tet y 0,3 mM DAP. No se extienda sobre la placa.
- Pipet 100 l de cultivo de celda receptora en una placa de agar con 1X Tet y 0,3 mM DAP. No se extienda sobre la placa.
- Incubar ambas placas durante la noche a 37oC.
- Raspar la mezcla de células de conjugación y el cultivo de la célula receptora con un rascador de células estériles. Transfiera las células al tubo de microcentrífuga estéril y resuspenda las células en 1 ml de PBS.
- Vortex las células y girar suavemente hacia abajo (3000 rpm durante 5 minutos).
- Resuspenda las celdas en 1 ml de PBS.
- Placar la mezcla de células de reacción de conjugación en una placa de agar LB con 1X Amp/Tet solamente. En esta placa, sólo se espera que crezcan las bacterias receptoras que obtuvieron con éxito el gen de resistencia del amplificador a través de la conjugación.
- Placa relparte las células receptoras a una placa de agar LB con 1X Tet solamente. En esta placa, sólo se espera que crezcan las bacterias receptoras no conjugadas, que no tienen el gen de resistencia amperio.
- Incubar las placas durante la noche a 37oC.
- Recoger colonias individuales de ambas placas y utilizarlas para cultivar cultivos nocturnos en 5 ml de medios (37 oC con aireación a 220 rpm).
4. Aislamiento de ADN
- Aísle el ADN de los cultivos previamente preparados utilizando 4,5 ml del volumen de cultivo total por minipreparación de ADN.
- Para ello, eluir el ADN usando 35 l de agua libre de nucleasas.
- El ADN puro generará una relación de absorbancia (A260/280)de aproximadamente 1,8.
- Utilice los 0,5 ml restantes de cada cultivo para preparar las existencias de glicerol haciendo una mezcla de 1:1 de cultivo bacteriano y 100% glicerol.
- Almacene las existencias del congelador a -80 oC.
5. Confirmación de la Conjugación de Transferencia de Plásmido por PCR
- Preparar dos mezclas maestras de PCR, cada una con un conjunto diferente de imprimaciones hacia adelante y hacia atrás, una dirigida a un segmento de par base 500 dentro del gen de resistencia a la ampicilina y la otra dirigida a un segmento dentro de un gen de limpieza.
- Las imprimaciones genéticas de limpieza se diseñaron para amplificar un segmento de ADN dentro de la codificación del gen bacteriano para la gengensa b (14) del ADN.
- Se utilizaron los siguientes volúmenes de reactivos para preparar 90 ml de cada mezcla maestra:
7,5 ml de imprimación delantera de 10 m
7,5 ml de imprimación inversa de 10 m
75 l de mezcla maestra de PCR 2X
- Preparar las siguientes seis reacciones de PCR utilizando una mezcla maestra de 15 l, 10 ng de ADN de plantilla y agua libre de nucleasas hasta un volumen final de 25 l.
Reacción de conjugación INTRODUCciones de ADN y ampicilina
Reacción de conjugación ADN y imprimaciones de limpieza
Primers de ADN y ampicilina de control negativo
El ADN de control negativo y las imprimaciones de limpieza
Sin introducciones de ADN y ampicilina
Sin ADN ni imprimaciones de limpieza - Transfiera estas reacciones a una máquina PCR con el bloque precalentado a 98 C y comience el termocycling en las siguientes condiciones:
98 oC durante 30 segundos
25-35 ciclos de 98oC durante 5-10 segundos, 45-72oC durante 10 a 30 segundos y 72oC durante 15-30 segundos por kb
72 oC durante 5-10 minutos
Sostener a 4 oC - Cargue las seis reacciones de PCR en un gel de agarosa del 1% y corra a 150 V durante unos 20 minutos.
- Visualice el producto de PC utilizando un iluminador UV.
Las células bacterianas, como E. coli,son capaces de transferir información genética de célula a célula. La conjugación difiere de otros mecanismos de transferencia de ADN, como la transducción o la transformación, en el que requiere contacto físico entre las células.
Para proceder, la conjugación requiere una célula donante que exprese la fertilidad, o factor F, y una célula receptora sin ella, una célula Menos F. El proceso requiere dos pasos. El primero es el establecimiento de contacto directo de célula a célula. Para ello, la célula donante genera una estructura filamentosa extracelular llamada sex pilus. Se llama esto ya que la conjugación es una forma de apareamiento para la reproducción asexual de bacterias, pero cabe señalar que no es verdadera reproducción sexual ya que no se intercambian gametos y no se forman descendencia.
El segundo paso es la entrega de ADN a la célula receptora. Después de que el sex pilus establece el contacto entre dos células, se construye un conducto llamado sistema de secreción tipo IV que permite la transferencia de ADN. La célula donante comienza entonces a replicar el ADN extracromosómico que se transferirá seleccionado en función de la presencia de un elemento genético conocido como OriT u origen de la transferencia. Un extremo del ADN recién replicado se introduce en el conducto a través de la unión a proteínas de ADN. A medida que el ADN se replica aún más, se bombea a través del canal, facilitado por un complejo de proteínas codificadas por genes situados cerca del OriT. Una vez que el ADN se transfiere completamente, formará un plásmido cromosómico adicional, o puede integrarse en el cromosoma de la célula receptora. Cualquiera que sea el punto final del ADN transferido, los genes que codifica serán expresados. Esta expresión génica se puede utilizar para confirmar la conjugación exitosa.
Por ejemplo, considere un escenario en el que la cepa del donante expresa resistencia a la ampicilina y lo transmite en el ADN conjugado a la bacteria receptora, pero la cepa receptora también tiene un gen de resistencia a la tetraciclina que no está presente en el donante. En este caso, cuando las células están chapadas en medios LB que contienen tetraciclina y ampicilina, las colonias deben crecer sólo a partir de bacterias conjugadas con éxito, que expresarán ambos fenotipos de resistencia. Para confirmar aún más la conjugación exitosa, se puede cosechar ADN plásmido de estas colonias y luego se puede amplificar una sección de ADN específica del plásmido transferido utilizando la reacción en cadena de la polimerasa, o PCR. Cuando el producto PCR se ejecuta con un gel de electroforesis junto con una escalera de tamaños estándar, un fragmento de PCR de un tamaño conocido debe ser visible en el gel, lo que confirma aún más la conjugación exitosa. En este experimento, se utilizará un plásmido para transferir el gen de resistencia a la ampicilina a través de la conjugación de una cepa de donante a una cepa receptora resistente a la tetraciclina. Después de esto, para confirmar la conjugación, la mezcla de conjugación se incubará en una placa que contiene ambos antibióticos dejando sólo las bacterias transformadas. Por último, la conjugación exitosa se confirmará aún más con la PCR.
Antes de iniciar el procedimiento, ponte el equipo de protección personal adecuado, incluyendo una capa de laboratorio y guantes. A continuación, esterilizar el espacio de trabajo con 70% de etanol para limpiar la superficie.
En este procedimiento, el gen de resistencia a la ampicilina se transferirá de la cepa WM3064 de E. coli a la cepa J53 de E. coli mediante conjugación. La cepa de donante WM3064 es resistente a la tetraciclina y a la ampicilina y requiere ácido diaminopimelico, o DAP, para crecer. La cepa receptora J53 sólo es resistente a la tetraciclina y no requiere DAP para crecer. Esto significa que las células conjugadas con éxito deben ser resistentes a la tetraciclina y la ampicilina y pueden crecer sin DAP.
Preparar el cultivo de cepa de donante inoculando cinco mililitros de LB que contienen 0,3 milimoles de DAP con un trozo de la población de glicerol de cepa de donante congelado. A continuación, prepare la cepa receptora inoculando cinco mililitros de caldo LB sin DAP con un trozo de la cepa congelada de glicerol. Cultivar estos cultivos durante la noche a 37 grados centígrados con aireación y temblor a 220 RPM en una incubadora temblorosa. Una vez que los cultivos han crecido a una Do 600 de dos, retire un mililitro de cultivo de cada uno y colóquelo en dos nuevos tubos de microcentrífuga separados de 1,5 mililitros. Luego, centrifugar estas alícuotas a 3000 RPM durante cinco minutos para peletizar las células bacterianas. Deseche el sobrenadante y lave cada pellet con 250 microlitros de 1X PBS. Centrifugar las muestras de nuevo y, después de desechar el sobrenadante, resuspender cada pellet en 500 microlitros de PBS.
Para comenzar el procedimiento de conjugación, primero combine 50 microlitros de células receptoras con 50 microlitros de células donantes en un tubo de microcentrífuga de 1,5 mililitros y mezcle pipeteando hacia arriba y hacia abajo suavemente. A continuación, pipeta 100 microlitros del cultivo de células receptoras en otra placa de tetraciclina 1X que contenga DAP. A continuación, prepare su control negativo pipeteando 100 microlitros del cultivo de células receptoras solo en una placa de agar no selectiva que contenga DAP. Luego, incubar las placas de conjugación y control negativo durante la noche a 37 grados centígrados.
Al día siguiente, tomar un rascador de células estériles y cosechar células de la placa de conjugación mediante la recolección de colonias. A continuación, transfiera las colonias a un tubo estéril de 1,5 mililitros de microcentrífuga que contenga un mililitro de 1X PBS. Repita este proceso para recoger las celdas receptoras de la otra placa.
Después de esto, vórtice las muestras para mezclar. Después de mezclar, transfiera los tubos a una centrífuga para peletizar suavemente las células. Deseche el sobrenadante, luego lave los gránulos celulares en un mililitro de PBS y vórtice los tubos para resuspender las células. Revuelva las células centrifugando. Deseche el sobrenadante de nuevo y vuelva a suspender ambos pellets celulares en un mililitro de PBS. Ahora, usando una punta de pipeta estéril, placa 100 microlitros de la mezcla de células de reacción de conjugación en una placa de agar LB sin DAP que contiene 1X tetraciclina y 1X ampicilina. Repita el método de chapado utilizando 100 microlitros de una dilución de diez veces de la misma mezcla celular en PBS en otra placa de agar LB sin DAP que contenga 1X tetraciclina y 1X ampicilina.
Por último, pipeta 100 microlitros de la mezcla de células de control negativas en una sola placa de agar LB con 1X tetraciclina solamente. Después de la incubación durante la noche a 37 grados centígrados, las colonias deben ser visibles. Usando una punta de pipeta estéril, escoja una sola colonia de la placa de reacción de conjugación y agréguela a un tubo que contenga cinco mililitros de medios selectivos de LB que contengan ambos antibióticos. Luego, repita el aislamiento de la colonia seleccionando una sola colonia de la placa celular receptora. Cultivar estos cultivos durante la noche a 37 grados centígrados con aireación a 220 RPM.
Al día siguiente, limpie la parte superior del banco con 70% de etanol y retire las placas de la incubadora. Utilice un mini kit de preparación de ADN para aislar el ADN de 4. 5 mililitros de cada cultivo de acuerdo con las instrucciones del fabricante. Después de completar la mini preparación del ADN, eluda el ADN usando 35 microlitros de agua libre de nucleasas. Por último, utilice el 0 restante. 5 mililitros de cada cultivo para preparar existencias de glicerol de un mililitro añadiendo 0,5 mililitros de 100% de glicerol para una dilución uno a uno. Coloque estas alícuotas a menos 80 grados Centígrados para su almacenamiento hasta que sea necesario.
Para confirmar la conjugación exitosa por PCR, primero prepare una mezcla maestra de PCR añadiendo 75 microlitros de mezcla maestra de PCR 2X a un tubo de microcentrífuga. A continuación, agregue 7,5 microlitros cada uno de una imprimación delantera de 10 micromolares y una imprimación inversa de 10 micromolares diseñada para amplificar el gen de resistencia a la ampicilina del plásmido. A continuación, prepare una segunda mezcla maestra de PCR añadiendo 75 microlitros de mezcla maestra de PCR 2X a un tubo de microcentrífuga y luego agregando 7,5 microlitros cada uno de una imprimación delantera de 10 micromolares y una imprimación inversa micromolar de 10 molares diseñada para amplificar un gen de limpieza, en este caso ADN gyrase B.
Ahora, agregue 15 microlitros de la primera mezcla maestra a un tubo PCR y luego agregue 10 nanogramos, aproximadamente dos microlitros de la plantilla de ADN experimental al mismo tubo. Lleve la reacción a un volumen final de 25 microlitros con agua libre de nucleasas. Repita estos pasos para producir las cinco reacciones restantes, de modo que los tubos contengan los componentes que se muestran aquí. Ahora, transfiera estas reacciones a un termociclador con el bloque precalentado a 98 grados Celsius y luego inicie el programa. Después de completar el PCR, retire los tubos de la máquina. A continuación, cargue dos microlitros de cada reacción mezclados con dos microlitros de colorante de carga y cuatro microlitros de un marcador de peso molecular en pozos consecutivos de un gel de agarosa del 1%. Ajuste el gel para que funcione a 150 voltios durante 20 minutos. Por último, visualice el gel con un iluminador UV.
En este experimento, se confirmó la transferencia exitosa del gen de resistencia a la ampicilina a través de la conjugación a través de la PCR. Aquí, se debe observar una banda de aproximadamente 500 pares base de tamaño en el pozo que contiene el ADN conjugado y los imprimadores de ampicilina, así que dos en este ejemplo. Un gen de limpieza, la gen de la gen de la gen de la gen del ADN B, se cargó en los pozos tres y cinco con ADN conjugado y ADN de células receptoras, respectivamente. Las bandas observadas en estos pozos actúan como un control positivo para asegurar que la plantilla de ADN estuviera presente y que la PCR tuviera éxito. No se deben observar bandas en el pozo que contiene la reacción para el ADN de las células receptoras y el par de imprimación de ampicilina, bien cuatro en este ejemplo, porque las células receptoras no son resistentes a la ampicilina. Además, no se deben observar bandas en las reacciones que carecen de ADN de plantilla, pozos seis y siete aquí. Si se cumplen estas condiciones, esto confirmará la transferencia exitosa del gen de resistencia a la ampicilina, confiriendo resistencia a la ampicilina de la cepa WM3064 de E. coli a la cepa J53 de E. coli.
Subscription Required. Please recommend JoVE to your librarian.
Results
Si la conjugación tuvo éxito, se observará un producto PCR de banda de par base 500 en el pozo en el que se cargó la reacción 1 de PCR (bien #2 en la Figura 3B), mientras que no se observará ninguna banda en el pozo en el que se cargó la reacción 3 de PCR (Bien #4 en la Figura 3B). La presencia de esta banda confirma la transferencia exitosa del gen de resistencia a la ampicilina, confiriendo así la resistencia a la ampicilina a la cepa J53 de E. coli.

Figura 3B: La confirmación de la conjugación exitosa por PCR. B) El análisis de PCR se realizó utilizando ADN aislado de la colonia selecta. El contenido de cada pozo es el siguiente: 1) escalera de ADN, 2) Introducciones de ADN de conjugación y ampicilina, 3) Introducciones de ADN y limpieza de conjugación, 4) Introducciones de ADN y ampicilina de control negativo, 5) Introducciones de ADN y limpieza de control negativo, 6) Sin ADN y cebismo de limpieza, anteltinas, y 7) Sin ADN y imprimaciones de control negativas. La presencia de un producto PCR de banda de par base de 500 puntos de reacción PCR 1 (pozo 2), y la falta de este producto de la reacción de PCR 3 (bien 4), confirma la conjugación exitosa.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
La conjugación es un proceso natural de transferencia de genes horizontal que se basa en el contacto directo de célula a célula de una célula donante y una célula receptora. Este proceso se comparte entre todo tipo de bacterias y ha sido fundamental en la evolución bacteriana, sobre todo en la resistencia a los antibióticos. En el laboratorio, la conjugación se puede utilizar como un método eficaz de transferencia de genes que es mucho menos disruptivo en comparación con otras técnicas. Fuera del laboratorio, la capacidad de transferir ADN de bacterias a eucariotas a través de la conjugación ofrece una nueva y emocionante vía de terapia génica y la comprensión de las implicaciones de estas transferencias de genes naturales, por ejemplo, la relación entre infección bacteriana y el cáncer, es un área de investigación que está surgiendo rápidamente.
Subscription Required. Please recommend JoVE to your librarian.
References
- Lederberg J, Tatum, E.L. Gene recombination in Escherichia coli Nature. 1946;158:558.
- Holmes R.K. J, M.G. Genetics: Exchange of Genetic Information. 4th Edition ed. Baron S, editor. Galveston, TX: University of Texas Medical Branch at Galveston; 1996.
- Cruz F, Davies, J. Horizontal gene transfer and the origin of species: lessons from bacteria. Trends in Microbiology. 2000;8:128-33.
- Llosa M, Cruz, F. Bacterial conjugation: a potential tool for genomic engineering. Ressearch in Microbiology. 2005;156:1-6.
- Lacroix B, Citovsky, V. Transfer of DNA from Bacteria to Eukaryotes. mBio. 2016;7(4):1-9.
- Llosa M, et al. Bacterial conjugation: a two-step mechanism for
- DNA transport. Molecular Microbiology. 2002;45:1-8.
- Grohmann E, Muth, G., Espinosa, M. Conjugative Plasmid Transfer in Gram-Positive Bacteria. Microbiology and Molecular Biology Reviews. 2003;67:277-301.
- Firth N, Ippen-Ihler, K, Skurray, RA. Structure and function of the F factor and mechanism of conjugation. Escherichia coli and salmonella: cellular and molecular biology. 1996;2:2377-401.
- Smillie C, Garcillan-Barcia MP, Francia MV, Rocha EPC, De La Cruz F. Mobility of Plasmids. Microbiology and Molecular Biology Reviews. 2010;74(3):434-52.
- Cascales E. Definition of a Bacterial Type IV Secretion Pathway for a DNA Substrate. 2004;304(5674):1170-3.
- Wang P, Yu Z, Li B, Cai X, Zeng Z, Chen X, et al. Development of an efficient conjugation-based genetic manipulation system for Pseudoalteromonas. Microbial Cell Factories. 2015;14(1):11.
- Yi H, Cho YJ, Yong D, Chun J. Genome Sequence of Escherichia coli J53, a Reference Strain for Genetic Studies. Journal of Bacteriology. 2012;194(14):3742-3.
- Baumann RLB, E. H.; Wiseman, J. S.; Vaal, M.; Nichols, J. S. Inhibition of Escherichia coli Growth and Diaminopimelic Acid Epimerase by 3-Chlorodiaminopimelic Acid. Antimicrobial Agents and Chemotherapy 1988;32:1119-23.
- Rocha D, Santos, CS, Pacheco LG. Bacterial reference genes for gene expression studies by RT-qPCR: survey and analysis. Antonie Van Leeuwenhoek. 2015;108:685-93.




