Overview
Fonte: Laboratorio del Dr. Zhongqi He - Dipartimento dell'Agricoltura degli Stati Uniti
Acidi e basi sono sostanze in grado di donare protoni (H+) e ioni idrossido (OH-), rispettivamente. Sono due estremi che descrivono le sostanze chimiche. Mescolare acidi e basi può annullare o neutralizzare i loro effetti estremi. Una sostanza che non è né acida né basica è neutra. I valori di concentrazione di protoni ([H+]) per la maggior parte delle soluzioni sono scomodamente piccoli e difficili da confrontare in modo che sia stata introdotta una quantità più pratica, il pH. Il pH era originariamente definito come il logaritmo decimale del reciproco della concentrazione molare dei 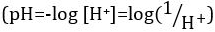 protoni, ma è stato aggiornato al logaritmo decimale del reciproco dell'attività degli ioni
protoni, ma è stato aggiornato al logaritmo decimale del reciproco dell'attività degli ioni 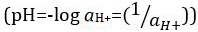 idrogeno. La prima definizione è ora occasionalmente espressa come p[H]. La differenza tra p[H] e pH è piuttosto piccola. È stato affermato che pH = p[H] + 0,04. È pratica comune utilizzare il termine "pH" per entrambi i tipi di misurazioni.
idrogeno. La prima definizione è ora occasionalmente espressa come p[H]. La differenza tra p[H] e pH è piuttosto piccola. È stato affermato che pH = p[H] + 0,04. È pratica comune utilizzare il termine "pH" per entrambi i tipi di misurazioni.
La scala del pH varia tipicamente da 0 a 14. Per una soluzione 1 M di un acido forte, pH=0 e per una soluzione 1 M di una base forte, pH=14. Pertanto, i valori di pH misurati si troveranno per lo più nell'intervallo da 0 a 14, sebbene i valori al di fuori di tale intervallo siano del tutto possibili. L'acqua pura è neutra con pH=7. Un pH inferiore a 7 è acido e un pH superiore a 7 è basico. Poiché la scala del pH è logaritmica, il pH è una quantità adimensionale. Ogni valore di pH intero inferiore a 7 è 10 volte più acido del numero intero successivo. Ad esempio, un pH di 4 è 10 volte più acido di un pH di 5 e 100x (10 x 10) più acido di un pH di 6. Lo stesso vale per i valori di pH superiori a 7, ognuno dei quali è 10 volte più basico (o alcalino) rispetto al successivo valore intero inferiore. Ad esempio, un pH di 10 è 10 volte più semplice di un pH di 9.
Principles
Il pH di una soluzione può essere determinato in modo accurato e semplice mediante misurazioni elettrochimiche con un dispositivo noto come pHmetro con un elettrodo sensibile al pH (protone) (di solito vetro) e un elettrodo di riferimento (di solito cloruro d'argento o calomelo). Idealmente, il potenziale dell'elettrodo, E, per il protone può essere scritto come

dove E è un potenziale misurato, E0 è il potenziale dell'elettrodo standard a H+= 1 mol/L, R è la costante del gas, T è la temperatura in kelvin, F è la costante di Faraday.
L'elettrodo pH utilizza un vetro appositamente formulato, sensibile al pH, a contatto con la soluzione, che sviluppa il potenziale (E) proporzionale al pH della soluzione. L'elettrodo di riferimento è progettato per mantenere un potenziale costante a qualsiasi temperatura e serve a completare il circuito di misurazione del pH all'interno della soluzione. Fornisce un potenziale di riferimento noto per l'elettrodo di pH. La differenza nei potenziali degli elettrodi di pH e di riferimento fornisce un segnale millivolt (mV) proporzionale al pH. In pratica, un elettrodo di vetro combinato ha un elettrodo di riferimento incorporato. È calibrato rispetto a soluzioni tampone di attività nota di ioni idrogeno. La maggior parte dei sensori di pH sono progettati per produrre un segnale 0-mV a 7,0 pH, con una pendenza (teoricamente ideale), o sensibilità, di -59,16 mV / pH a 25 °C. Due o più soluzioni tampone sono utilizzate per adattarsi al fatto che la "pendenza" può differire leggermente dall'ideale. Le soluzioni tampone standard commerciali di solito vengono fornite con informazioni sul valore del pH a 25 °C e un fattore di correzione da applicare per altre temperature.
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. Calibrazione del pH
- Accendere il contatore premendo il pulsante "power".
- Collegare la sonda di compensazione automatica della temperatura (ATC) se è disponibile e/o non è con l'elettrodo.
- Verificare che la modalità di misurazione sia pH. In caso contrario, premere il pulsante "MODE" fino a quando non viene visualizzata la modalità "pH" sul display LCD.
- Consultare la guida di riferimento rapido nella parte inferiore del misuratore o nelle vicinanze per assistenza, se necessario.
- Utilizzare sempre tamponi pH freschi, inutilizzati e non scaduti per la calibrazione. I buffer devono essere alla stessa temperatura delle soluzioni di prova.
- Risciacquare l'elettrodo di pH con acqua distillata e quindi con il tampone utilizzato per la calibrazione(ad esempio,pH 7,00).
- Immergere l'elettrodo di pH in un tampone di pH neutro(cioè, pH 7,00). Mescolare il buffer con una barra magnetica (a una velocità moderata per ~ 30 s) per ottenere i migliori risultati.
- Premere il pulsante "CAL/MEAS" (calibrazione [o standardizzazione]/easurement) per selezionare la funzione "calibrazione (standardizzazione)". Impostare il valore del pH tampone sul display del misuratore su 7.00.
- Quando la "lettura" è stabile, premere il pulsante "INVIO" per accettare. La lettura primaria lampeggerà brevemente prima che la visualizzazione secondaria inizi a scorrere i buffer rimanenti disponibili.
- Risciacquare l'elettrodo di pH con acqua distillata e quindi con il tampone da utilizzare per la successiva calibrazione(ad esempio,pH 4,01).
- Immergere l'elettrodo di pH nel tampone successivo di pH 4,01. Il display del contatore deve essere bloccato sul valore del buffer.
- Quando la "lettura" è stabile, premere "INVIO" per accettare. La lettura primaria lampeggerà brevemente, quindi visualizzerà l'efficienza percentuale (pendenza) prima che il display secondario inizi a scorrere i buffer rimanenti disponibili.
- Ripetere i passaggi 2.2-2.7 per calibrare il tampone pH 10.01.
- Il misuratore tornerà automaticamente in modalità di misurazione al completamento con successo della calibrazione a 3 punti.
Note: (1) I tamponi standard di pH 4,01 e 10,01 possono essere sostituiti con altri tamponi appropriati per l'intervallo di pH dei campioni di prova. (2) Per una calibrazione a singolo punto (neutro) o a 2 punti, premere il pulsante "CAL/MEAS" per tornare alle misurazioni dopo il completamento della calibrazione. (3) La taratura con più di 3 punti può essere utilizzata per misurazioni più precise. (4) Si consiglia di eseguire la calibrazione all'inizio di ogni giornata. Per un lavoro molto preciso, il pHmetro deve essere calibrato prima di ogni misurazione. (5) Regolare manualmente i valori di pH dei tamponi se la temperatura differisce dalla temperatura ambiente standard e non è collegata alcuna sonda ATC.
2. Misure di pH
- Verificare che il misuratore sia in modalità di misurazione del pH.
- Risciacquare accuratamente l'elettrodo di pH tra le misurazioni con acqua distillata per evitare la contaminazione da riporto delle soluzioni testate. Tamponare delicatamente l'elettrodo su un tessuto di pulizia di laboratorio per rimuovere l'acqua di risciacquo in eccesso. Non strofinare la lampadina poiché ciò può causare un accumulo di carica statica. In alternativa, sciacquare l'elettrodo con la soluzione di prova.
- Immergere l'elettrodo di pH in una soluzione di prova o in una sospensione. Mescolare la soluzione con una barra magnetica (~ 30 s) con la stessa velocità di agitazione della calibrazione per ottenere i migliori risultati.
- Il pH viene completato quando la lettura del pH è stabile.
- Se necessario e disponibile, premere il pulsante "HOLD" per bloccare la lettura misurata. Premere di nuovo per riprendere la lettura dal vivo.
- Registrare il valore del pH (e la temperatura se necessario) annotando o premendo il pulsante "MEMORY" (se applicabile) per memorizzare il valore in memoria.
- Ripetere i passaggi 3.2-3.6 per misurazioni multiple.
- Risciacquare accuratamente e conservare l'elettrodo in soluzione di stoccaggio una volta completate tutte le misurazioni.
Note: (1) Il tempo di risposta della sonda di pH in ciascun tampone non deve essere superiore a 60 s, ma può essere più lungo per alcune soluzioni di prova / fanghi. (2) La sonda dell'elettrodo deve essere pulita con la soluzione detergente dell'elettrodo di pH una volta al mese o ogni volta che è sporca. Una soluzione di HCl da 0,1 M può essere utilizzata per la pulizia generale. Il detersivo liquido diluito e la candeggina per bucato domestico possono essere utilizzati per la pulizia di grassi e contaminazioni batteriche. Tuttavia, per evitare problemi imprevisti, la migliore pratica è fare sempre riferimento alle raccomandazioni del produttore dell'elettrodo. (3) Il bulbo dell'elettrodo di pH deve essere umido in ogni momento. Tenerlo nella soluzione di stoccaggio dell'elettrodo fornita con l'elettrodo. Utilizzare la soluzione tampone pH 4 se non è disponibile alcuna soluzione di stoccaggio. Utilizzare la soluzione tampone pH 7 per un breve periodo se non sono disponibili.
Il pHmetro è un dispositivo elettrico che determina l'acidità o la basicità delle soluzioni acquose, uno dei parametri più comunemente monitorati.
Per utilizzare un pHmetro, l'elettrodo di pH viene prima calibrato con soluzioni tampone standard con valori di pH noti che coprono l'intervallo da misurare. Per effettuare una misurazione del pH, l'elettrodo viene immerso nella soluzione campione fino a raggiungere una lettura costante. L'elettrodo viene quindi risciacquato dopo ogni campione e conservato in una soluzione di conservazione dopo che tutte le misurazioni sono state completate.
Questo video dimostrerà come calibrare un pHmetro e ottenere misurazioni del pH, oltre a offrire alcuni suggerimenti sulla gestione del fragile elettrodo.
Quando un acido o una base viene posto in acqua, possono verificarsi reazioni di idrolisi. La quantità di ioni idronio o ioni idrossido prodotti nella reazione determina l'acidità o la basicità della soluzione. Questa importante proprietà è comunemente valutata dalla concentrazione dello ione idronio, che è spesso abbreviato come ione idrogeno o protone. Per la maggior parte delle soluzioni, la concentrazione di ioni idrogeno, espressa in moli per litro, è molto piccola, quindi è stata introdotta una quantità più pratica, pH.
Il pH è definito come il logaritmo negativo della concentrazione molare dello ione idrogeno. La scala del pH varia da 0 a 14. L'acqua pura è neutra con un pH di 7; Il pH inferiore a 7 è acido e il pH superiore a 7 è basico. Poiché la scala del pH è logaritmica, una diminuzione unitaria del pH equivale a un aumento di dieci volte dell'acidità.
Quindi, in che modo il pHmetro misura il pH? Un componente chiave di un pHmetro è un elettrodo sensibile agli ioni idrogeno. La soluzione all'interno di questo elettrodo contiene una concentrazione nota di ioni idrogeno. Quando l'elettrodo è immerso in una soluzione di pH sconosciuto, si sviluppa un potenziale elettrico in funzione della concentrazione di ioni idrogeno nella soluzione di prova. Questo elettrodo sensibile agli ioni idrogeno, insieme a un elettrodo di riferimento con cui è spesso combinato in un unico corpo, è collegato al pHmetro, in modo che il potenziale sviluppato possa essere misurato e convertito nel valore del pH.
Ora che hai capito la teoria alla base di un pHmetro, diamo un'occhiata al suo uso in un ambiente agricolo.
Prima delle misurazioni del pH, il pHmetro viene calibrato. La calibrazione deve essere eseguita all'inizio di ogni giornata o prima di ogni misurazione se sono richiesti dati estremamente precisi.
Scegliere tamponi che coprono l'intervallo di valori di pH dei campioni. In questa dimostrazione, il pHmetro viene calibrato con tre tamponi con pH 4, 7 e 10. Assicurarsi che i buffer siano freschi, inutilizzati e non scaduti.
Per iniziare, accendi il pHmetro premendo il pulsante di accensione.
Quindi, collegare la sonda di pH e la compensazione automatica della temperatura, o sonda ATC, all'unità. Sul display LCD, assicurarsi che la modalità di misurazione sia "pH". In caso contrario, premere il pulsante "MODE" fino a quando non viene visualizzato "pH".
Quindi, rimuovere l'elettrodo di pH dal tampone di stoccaggio. Fare attenzione a non lasciare asciugare la lampadina dell'elettrodo in qualsiasi momento durante l'esperimento. Risciacquare l'elettrodo con acqua distillata, seguito dal tampone standard pH 7.
Quindi, immergere l'elettrodo di pH nel tampone. Mescolare il buffer con una barra magnetica per ottenere i migliori risultati. Per evitare di rompere l'elettrodo fragile, assicurarsi di mantenere una distanza tra l'elettrodo e la barra di agitazione.
Premere il pulsante "CAL(ibration) / MEAS(urement)" per selezionare la funzione di calibrazione. Impostare il valore del pH tampone su 7,00. Quando la lettura è stabile, premere "INVIO". La lettura primaria lampeggia brevemente; quindi il display secondario mostra i buffer rimanenti. L'elettrodo è ora pronto per essere calibrato con il successivo buffer standard.
Risciacquare l'elettrodo di pH come prima, prima con acqua distillata, quindi con il tampone standard pH 4. Quindi, posizionare l'elettrodo nel buffer. Quando la lettura è stabile, premere "INVIO". La lettura primaria lampeggia brevemente, seguita da una visualizzazione dell'efficienza percentuale, o pendenza, prima che i buffer rimanenti vengano visualizzati sul display secondario.
Infine, ripetere le fasi di risciacquo e calibrazione con il tampone standard pH 10. La lettura costante dovrebbe essere pH 10,01. Una volta premuto "Invio", viene eseguita la calibrazione a 3 punti e il misuratore tornerà automaticamente in modalità di misurazione.
Il dispositivo è ora pronto per essere utilizzato per testare campioni di terreno da un campo di patate.
Avviare le misurazioni del pH risciacquando accuratamente l'elettrodo di pH con acqua distillata. Tamponare delicatamente l'elettrodo su un tessuto di pulizia di laboratorio per rimuovere l'acqua in eccesso. Fare attenzione a non strofinare la lampadina in quanto può causare un accumulo di carica statica. La fase di risciacquo deve essere eseguita tra ogni campione per evitare la contaminazione.
Quindi, immergere l'elettrodo di pH in un campione con agitazione. La velocità di agitazione deve essere la stessa di durante la calibrazione. Attendere che la lettura diventi stabile, che dovrebbe richiedere meno di 60 s per la maggior parte dei campioni, quindi registrare il valore del pH. Se necessario, premere il pulsante "HOLD" per bloccare il display di lettura. Premere di nuovo per riprendere la lettura dal vivo. Il valore del pH può essere memorizzato premendo il pulsante "MI" (o inserimento memoria). Il valore della posizione della memoria memorizzata, o StO, verrà visualizzato brevemente.
Ripetere le fasi di risciacquo e misurazione come mostrato in precedenza per tutti i campioni rimanenti. Una volta completate tutte le misurazioni, sciacquare accuratamente l'elettrodo prima di metterlo in soluzione di stoccaggio.
In questo esperimento, è stato misurato il pH di più campioni di terreno provenienti da campi agricoli. Il pH ha numerosi effetti sulla crescita delle colture, tra cui la disponibilità di nutrienti, la tossicità e il controllo delle malattie. Diverse colture hanno intervalli di pH di crescita ottimale. Controllando il pH, la malattia può essere ridotta al minimo aumentando la resa.
I campioni di terreno sono stati raccolti da cinque campi di patate sotto diverse pratiche di rotazione delle colture con o senza irrigazione delle acque sotterranee. L'irrigazione delle acque sotterranee ha costantemente aumentato il pH del suolo in tutti e cinque i campi. Questi dati sono essenziali per fornire raccomandazioni di calcinazione per i campi di patate.
Molti campi della scienza richiedono misurazioni o monitoraggio del pH nella loro ricerca.
Ad esempio, per utilizzare la biomassa in modo più efficiente e comprendere meglio l'architettura della parete cellulare vegetale, è stata effettuata una serie di reazioni per sintetizzare la biomimica del legno, in modo che l'architettura della parete cellulare vegetale possa essere meglio compresa.
Nella prima fase, la fibra di polpa kraft è stata utilizzata per generare cellulosa nanofibrillata. Il pH della miscela di reazione è diminuito quando i gruppi ossidrilici sulla cellulosa sono stati ossidati.
Il pH è stato continuamente monitorato e regolato aggiungendo idrossido di sodio. Una volta ossidati tutti i gruppi ossidrilici accessibili, il pH non cambiava più e la reazione era completa.
In questo studio ambientale, il deflusso dell'acqua è stato analizzato in una struttura che simula paesaggi urbani. Il deflusso ha il potenziale per trasportare nutrienti e sedimenti nei corsi d'acqua e nei laghi locali dove possono contribuire all'eutrofizzazione.
È stata costruita una struttura con più appezzamenti di campo e l'acqua di deflusso è stata raccolta. Il pH dei campioni di deflusso, insieme ad altri costituenti chimici, è stato quantificato.
Nella ricerca sulle scienze della vita, il pH è anche di grande interesse in quanto è strettamente regolato negli organismi viventi. In questo esempio, sono stati sviluppati sensori di pH fluorescenti.
Per calibrare questi sensori in vitro,è stata eseguita una titolazione del pH in una cuvetta, in cui il pH della soluzione del sensore è stato misurato con un microelettrodo e sono stati ottenuti gli spettri di emissione a ciascun pH. In questo modo, l'intensità della fluorescenza potrebbe essere tracciata rispetto al pH per generare una curva di calibrazione.
Questi sensori sono stati poi utilizzati per misurare il pH nelle cellule viventi.
Hai appena visto l'introduzione di JoVE all'uso di un pHmetro. Ora dovresti capire cos'è il pH, come funziona il misuratore e come usarne uno per misurare il pH.
Grazie per l'attenzione!
Subscription Required. Please recommend JoVE to your librarian.
Results
La figura 1 mostra il pH dei terreni agricoli influenzati dalla gestione delle colture e dall'irrigazione delle acque sotterranee. Questi campioni di terreno sono stati raccolti da 5 campi di patate sotto diverse pratiche di rotazione delle colture con o senza irrigazione delle acque sotterranee. Il pH più basso si osserva nei terreni del campo 4 sia nelle serie irrigate a pioggia che in quella sotterranea. L'irrigazione delle acque sotterranee ha costantemente aumentato il pH del suolo in tutti e 5 i campi. Le informazioni sul pH sono essenziali per la raccomandazione di calciare i campi di patate in modo appropriato per promuovere una crescita ottimale.

Figura 1. PH del suolo dei campi di patate sotto diverse pratiche di gestione delle colture con o senza irrigazione subacquea.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Il pH è uno dei parametri chimici più comunemente misurati delle soluzioni acquose. È un parametro critico nel trattamento delle acque e delle acque reflue per applicazioni municipali e industriali, produzione chimica, ricerca agricola e produzione. È anche fondamentale nel monitoraggio ambientale, nella ricerca chimica e nelle scienze della vita, nella ricerca biochimica e farmaceutica, nella produzione elettronica e in molte altre applicazioni. La Figura 2 elenca i valori di pH di alcune sostanze comuni.
L'acqua pura è neutra, con un pH di 7,00. Quando le sostanze chimiche vengono mescolate con acqua, la miscela può diventare acida o basica. Aceto e succo di limone sono sostanze acide, mentre i detersivi per bucato e l'ammoniaca sono di base. Le sostanze chimiche che sono molto basiche o molto acide sono considerate "reattive". Queste sostanze chimiche possono causare gravi ustioni. L'acido della batteria dell'automobile è una sostanza chimica acida che è reattiva. Le batterie delle automobili contengono una forma più forte di uno degli acidi presenti nelle piogge acide. I detergenti per scarichi domestici contengono spesso la lssliglia, una sostanza chimica molto alcalina che è anche reattiva.
Nei sistemi viventi, il pH di diversi compartimenti cellulari, fluidi corporei e organi è solitamente strettamente regolato in un processo chiamato omeostasi acido-base. Il pH del sangue è di solito leggermente basico con un valore di pH 7.365. Questo valore è spesso indicato come pH fisiologico in biologia e medicina. La placca può creare un ambiente acido locale che può causare carie da demineralizzazione. Gli enzimi e altre proteine hanno un intervallo di pH ottimale e possono essere inattivati o denaturati al di fuori di questo intervallo.

Figura 2. La scala del pH e i valori di pH di alcuni elementi comuni.
Subscription Required. Please recommend JoVE to your librarian.




