Overview
Fonte: Laboratório do Dr. Zhongqi He - Departamento de Agricultura dos Estados Unidos
Ácidos e bases são substâncias capazes de doar prótons (H+) e íons hidróxido (OH- ),respectivamente. São dois extremos que descrevem produtos químicos. Misturar ácidos e bases pode cancelar ou neutralizar seus efeitos extremos. Uma substância que não é ácida nem básica é neutra. Os valores de concentração de prótons ([H+]) para a maioria das soluções são inconvenientemente pequenos e difíceis de comparar para que uma quantidade mais prática, pH, tenha sido introduzida. pH foi originalmente definido como o logaritmo decimal da recíproca da concentração molar de prótons, 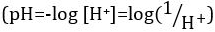 mas foi atualizado para o logaritmo decimal do recíproco da atividade de íons de
mas foi atualizado para o logaritmo decimal do recíproco da atividade de íons de 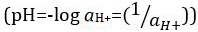 hidrogênio. A primeira definição é agora ocasionalmente expressa como p[H]. A diferença entre p[H] e pH é bastante pequena. Foi declarado que pH = p[H] + 0,04. É prática comum usar o termo 'pH' para ambos os tipos de medições.
hidrogênio. A primeira definição é agora ocasionalmente expressa como p[H]. A diferença entre p[H] e pH é bastante pequena. Foi declarado que pH = p[H] + 0,04. É prática comum usar o termo 'pH' para ambos os tipos de medições.
A escala de pH normalmente varia de 0 a 14. Para uma solução de 1 M de ácido forte, pH=0 e para uma solução de 1 M de base forte, pH=14. Assim, os valores de pH medidos estarão principalmente na faixa de 0 a 14, embora valores fora dessa faixa sejam inteiramente possíveis. A água pura é neutra com pH=7. Um pH menor que 7 é ácido, e um pH maior que 7 é básico. Como a escala de pH é logarítmica, o pH é uma quantidade inafundada. Cada valor de pH inteiro abaixo de 7 é 10x mais ácido do que o próximo inteiro. Por exemplo, um pH de 4 é 10x mais ácido do que um pH de 5 e 100x (10 x 10) mais ácido do que um pH de 6. O mesmo vale para valores de pH acima de 7, cada um dos quais é 10x mais básico (ou alcalino) do que o próximo valor total mais baixo. Por exemplo, um pH de 10 é 10x mais básico que um pH de 9.
Principles
O pH de uma solução pode ser precisamente e facilmente determinado por medidas eletroquímicas com um dispositivo conhecido como medidor de pH com um eletrodo sensível ao pH (geralmente vidro) e um eletrodo de referência (geralmente cloreto de prata ou calomel). Idealmente, o potencial do eletrodo, E, para o próton pode ser escrito como

onde E é um potencial medido, E0 é o potencial de eletrodo padrão em umH+= 1 mol/L, R é a constante do gás, T é a temperatura em kelvin, F é a constante faraday.
O eletrodo pH utiliza um vidro especialmente formulado, sensível ao pH, em contato com a solução, que desenvolve o potencial (E)proporcional ao pH da solução. O eletrodo de referência foi projetado para manter um potencial constante a qualquer temperatura, e serve para completar o circuito de medição de pH dentro da solução. Ele fornece um potencial de referência conhecido para o eletrodo pH. A diferença nos potenciais do pH e dos eletrodos de referência fornece um sinal milivolt (mV) proporcional ao pH. Na prática, um eletrodo de vidro combinado tem um eletrodo de referência embutido. É calibrado contra soluções tampão da atividade de íons de hidrogênio conhecido. A maioria dos sensores de pH são projetados para produzir um sinal de 0-mV a 7,0 pH, com uma inclinação (teoricamente ideal), ou sensibilidade, de -59,16 mV / pH a 25 °C. Duas ou mais soluções tampão são usadas para acomodar o fato de que a "inclinação" pode diferir ligeiramente do ideal. As soluções de buffer padrão comercial geralmente vêm com informações sobre o valor do pH a 25 °C e um fator de correção a ser aplicado para outras temperaturas.
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. pH Calibração
- Ligue a energia do medidor pressionando o botão "power".
- Conecte a sonda de compensação automática de temperatura (ATC) se estiver disponível e/ou não estiver com o eletrodo.
- Verifique se o modo de medição é pH. Caso não, pressione o botão "MODE" até que o modo "pH" apareça no visor LCD.
- Consulte o guia de referência rápido na parte inferior do medidor ou nas proximidades para obter ajuda, se necessário.
- Use sempre tampões pH frescos, não utilizados e não expirados para calibração. Os buffers devem estar na mesma temperatura das soluções de teste.
- Enxágüe o eletrodo pH com água destilada e, em seguida, com o tampão sendo usado para calibração (ou seja,pH 7,00).
- Mergulhe o eletrodo pH em um tampão de pH neutro (ou seja,pH 7,00). Mexa o tampão com uma barra magnética (a uma taxa moderada para ~30 s) para obter melhores resultados.
- Pressione o botão "CAL/MEAS" (calibração [ou padronização]/easurement) para selecionar a função 'calibração (padronização)'. Defina o valor do pH do buffer no visor do medidor para 7,00.
- Quando a "leitura" estiver estável, pressione o botão "ENTER" para aceitar. A leitura primária piscará brevemente antes que o display secundário comece a rolar pelos buffers disponíveis restantes.
- Enxágüe o eletrodo pH com água destilada e, em seguida, com o tampão a ser usado para a próxima calibração (ou seja,pH 4.01).
- Mergulhe o eletrodo pH no próximo buffer de pH 4.01. O visor do medidor deve ser bloqueado no valor do buffer.
- Quando a "leitura" estiver estável, pressione "ENTER" para aceitar. A leitura primária piscará brevemente e exibirá a porcentagem de eficiência (inclinação) antes que o display secundário comece a rolar pelos buffers restantes disponíveis.
- Repita as etapas 2.2-2.7 para calibrar o tampão pH 10.01.
- O medidor retornará automaticamente ao modo de medição após a conclusão bem sucedida da calibração de 3 pontos.
Notas: (1) Os buffers padrão de pH 4.01 e 10.01 podem ser substituídos por outros buffers apropriados de acordo com a gama de pH das amostras de teste. (2) Para uma calibração única (neutra)-, ou de 2 pontos, pressione o botão "CAL/MEAS" para retornar às medições após a conclusão da calibração. (3) Pode ser utilizada a calibração com mais de 3 pontos para medições mais precisas. (4) Recomenda-se realizar a calibração no início de cada dia. Para um trabalho muito preciso, o medidor de pH deve ser calibrado antes de cada medição. (5) Ajuste manualmente os valores de pH dos buffers se a temperatura difere da temperatura ambiente padrão e nenhuma sonda ATC estiver anexada.
2. medidas de pH
- Confirme se o medidor está no modo de medição de pH.
- Enxágue completamente o eletrodo de pH entre as medidas com água destilada para evitar a contaminação das soluções testadas. Limpe suavemente o eletrodo em um tecido de limpeza de laboratório para remover o excesso de água enxágue. Não esfregue a lâmpada, pois isso pode causar um acúmulo de carga estática. Alternativamente, enxágue o eletrodo com a solução de teste.
- Mergulhe o eletrodo pH em uma solução de teste ou suspensão. Mexa a solução com uma barra magnética (~30 s) com a mesma taxa de agitação para calibrar para melhores resultados.
- O pH é concluído quando a leitura de pH é estável.
- Se necessário e disponível, pressione o botão "HOLD" para congelar a leitura medida. Pressione novamente para retomar a leitura ao vivo.
- Registo o valor do pH (e temperatura, se necessário) anotando ou pressionando o botão "MEMORY" (se aplicável) para armazenar o valor na memória.
- Repita as etapas 3.2-3.6 para várias medidas.
- Enxágue completamente e armazene o eletrodo na solução de armazenamento assim que todas as medidas forem concluídas.
Notas: (1) O tempo de resposta do teste de pH em cada buffer não deve ser superior a 60 s, mas pode ser mais longo para algumas soluções/chorumes de teste. (2) A sonda de eletrodo deve ser limpa usando a solução de limpeza pH-eletrodo uma vez por mês ou quando estiver suja. Uma solução de 0,1 M HCl pode ser usada para limpeza geral. Detergente líquido diluído e alvejante doméstico podem ser usados para limpar graxas e contaminações bacterianas. No entanto, para evitar problemas inesperados, a melhor prática é sempre consultar as recomendações do fabricante de eletrodos. (3) A lâmpada de eletrodo de pH deve estar sempre úmida. Mantenha-o na solução de armazenamento de eletrodos que vem com o eletrodo. Use a solução de buffer pH 4 se não houver solução de armazenamento disponível. Use a solução de buffer pH 7 por um curto período de tempo se nenhum deles estiver disponível.
O medidor de pH é um dispositivo elétrico que determina a acidez ou a basicidade das soluções aquosas, um dos parâmetros mais comumente monitorados.
Para usar um medidor de pH, o eletrodo de pH é primeiro calibrado com soluções tampão padrão com valores de pH conhecidos que abrangem a faixa que está sendo medida. Para fazer uma medição de pH, o eletrodo é imerso na solução amostral até que uma leitura constante seja alcançada. O eletrodo é então enxaguado após cada amostra e armazenado em uma solução de armazenamento depois de todas as medidas terem sido concluídas.
Este vídeo demonstrará como calibrar um medidor de pH e obter medições de pH, bem como oferecerá algumas dicas sobre como manusear o frágil eletrodo.
Quando um ácido ou uma base é colocado na água, podem ocorrer reações de hidrólise. A quantidade de íons hidrônios ou íons hidróxidos gerados na reação determina a acidez ou a basicidade da solução. Esta importante propriedade é comumente avaliada pela concentração do íon hidrônio, que muitas vezes é encurtado como íon de hidrogênio ou próton. Para a maioria das soluções, a concentração de íons de hidrogênio, expressa em mols por litro, é muito pequena, por isso uma quantidade mais prática, pH, foi introduzida.
pH é definido como o logaritmo negativo da concentração molar do íon hidrogênio. A escala de pH varia de 0 a 14. A água pura é neutra com um pH de 7; pH menor que 7 é ácido, e pH maior que 7 é básico. Uma vez que a escala de pH é logarítmica, uma diminuição unitária no pH equivale a um aumento de dez vezes na acidez.
Então, como o medidor de pH mede pH? Um componente-chave de um medidor de pH é um eletrodo sensível a íons de hidrogênio. A solução dentro deste eletrodo contém uma concentração conhecida de íons de hidrogênio. Quando o eletrodo está imerso em uma solução de pH desconhecido, um potencial elétrico se desenvolve em função da concentração de íons de hidrogênio na solução de teste. Este eletrodo sensível a íons de hidrogênio, juntamente com um eletrodo de referência com o qual é frequentemente combinado em um corpo, é conectado ao medidor de pH, de modo que o potencial desenvolvido pode ser medido e convertido ao valor do pH.
Agora que você entende a teoria por trás de um medidor de pH, vamos olhar para o seu uso em um ambiente agrícola.
Antes das medições de pH, o medidor de pH é calibrado. A calibração deve ser realizada no início de cada dia ou antes de cada medição, se forem necessários dados extremamente precisos.
Escolha buffers que abrangem a faixa de valores de pH das amostras. Nesta demonstração, o medidor de pH é calibrado com três tampões com pH 4, 7 e 10. Certifique-se de que os buffers estão frescos, não são descomprtos e não expirados.
Para começar, ligue o medidor de pH pressionando o botão de alimentação.
Em seguida, conecte a sonda pH e a compensação automática de temperatura, ou sonda ATC, na unidade. No visor LCD, certifique-se de que o modo de medição seja "pH". Se não, pressione o botão "MODE" até que o "pH" apareça.
Em seguida, remova o eletrodo de pH do buffer de armazenamento. Tenha cuidado para não permitir que a lâmpada de eletrodo seque em nenhum momento durante o experimento. Enxágüe o eletrodo com água destilada, seguido do tampão padrão pH 7.
Em seguida, mergulhe o eletrodo de pH no buffer. Mexa o tampão com uma barra magnética para obter melhores resultados. Para evitar quebrar o eletrodo frágil, certifique-se de manter uma distância entre o eletrodo e a barra de agitação.
Pressione o botão "CAL(ibration) / MEAS(urement)" para selecionar a função de calibração. Defina o valor do pH do buffer para 7,00. Quando a leitura estiver estável, pressione "ENTER". A leitura primária pisca brevemente; em seguida, o display secundário mostra os buffers restantes. O eletrodo está pronto para ser calibrado com o próximo buffer padrão.
Enxágüe o eletrodo pH como antes, primeiro com água destilada, depois o tampão padrão pH 4. Em seguida, coloque o eletrodo no tampão. Quando a leitura estiver estável, pressione "ENTER". A leitura primária pisca brevemente, seguida por uma exibição da eficiência percentual, ou inclinação, antes que os buffers restantes sejam mostrados no visor secundário.
Por fim, repita as etapas de lavagem e calibração com o tampão padrão pH 10. A leitura constante deve ser pH 10,01. Uma vez que "Enter" é pressionado, a calibração de 3 pontos é feita, e o medidor retornará automaticamente ao modo de medição.
O dispositivo está pronto para ser usado para testar amostras de solo de um campo de batata.
Inicie as medições de pH enxaguando completamente o eletrodo pH com água destilada. Limpe suavemente o eletrodo em um tecido de limpeza de laboratório para remover o excesso de água. Tenha cuidado para não esfregar a lâmpada, pois ela pode causar um acúmulo de carga estática. A etapa de lavagem deve ser realizada entre cada amostra para evitar contaminação.
Em seguida, mergulhe o eletrodo de pH em uma amostra com agitação. A velocidade de agitação deve ser a mesma durante a calibração. Aguarde que a leitura fique estável, que deve levar menos de 60 s para a maioria das amostras, em seguida, registo o valor do pH. Se necessário, pressione o botão "HOLD" para congelar o visor de leitura. Pressione novamente para retomar a leitura ao vivo. O valor do pH pode ser armazenado na memória pressionando o botão "MI" (ou inserir memória). O valor do local de localização de memória armazenado, ou StO, será exibido brevemente.
Repita as etapas de lavagem e medição como mostrado anteriormente para todas as amostras restantes. Uma vez concluídas todas as medidas, enxágue completamente o eletrodo antes de colocá-lo na solução de armazenamento.
Neste experimento, foi medido o pH de múltiplas amostras de solo de campos agrícolas. o pH tem inúmeros efeitos no crescimento das culturas, incluindo disponibilidade de nutrientes, toxicidade e controle de doenças. Diferentes culturas têm faixas de pH de crescimento ideal. Controlando o pH, a doença pode ser minimizada ao aumentar o rendimento.
As amostras do solo foram coletadas de cinco campos de batata sob diferentes práticas de rotação de cultivo com ou sem irrigação de águas subterrâneas. A irrigação de águas subterrâneas aumentou consistentemente o pH do solo em todos os cinco campos. Esses dados são essenciais para fornecer recomendação de liming para os campos de batata.
Muitos campos da ciência exigem medições de pH ou monitoramento em suas pesquisas.
Por exemplo, para usar a biomassa de forma mais eficiente e entender melhor a arquitetura da parede celular vegetal, uma série de reações foi realizada para sintetizar a biomimia da madeira, para que a arquitetura da parede celular vegetal possa ser melhor compreendida.
Na primeira etapa, a fibra de polpa kraft foi usada para gerar celulose nanofibrilada. O pH da mistura de reação diminuiu à medida que os grupos de hidroxil na celulose foram oxidados.
O pH foi continuamente monitorado e ajustado pela adição de hidróxido de sódio. Uma vez que todos os grupos hidroxil acessíveis foram oxidados, o pH não mudaria mais e a reação estava completa.
Neste estudo ambiental, o escoamento de água foi analisado em uma instalação que simula paisagens urbanas. O escoamento tem o potencial de transportar nutrientes e sedimentos para riachos e lagos locais onde eles podem contribuir para a eutrofização.
Uma instalação com várias parcelas de campo foi construída, e água de escoamento foi coletada. O pH das amostras de escoamento, juntamente com outros componentes químicos, foi quantificado.
Na pesquisa de ciências da vida, o pH também é de grande interesse, pois é estritamente regulado em organismos vivos. Neste exemplo, foram desenvolvidos sensores de pH fluorescentes.
Para calibrar esses sensores in vitro,foi realizada uma titulação de pH em uma cuvette, onde o pH da solução do sensor foi medido com uma microeletromida, e os espectros de emissão em cada pH foram obtidos. Dessa forma, a intensidade da fluorescência poderia ser traçada contra o pH para gerar uma curva de calibração.
Esses sensores foram então usados para medir pH em células vivas.
Você acabou de assistir a introdução de JoVE para usar um medidor de pH. Agora você deve entender o que é pH, como o medidor funciona e como usar um para medir o pH.
Obrigado por assistir!
Subscription Required. Please recommend JoVE to your librarian.
Results
A Figura 1 mostra o pH dos solos agrícolas impactados pelo manejo do cultivo e irrigação das águas subterrâneas. Estas amostras de solo foram coletadas de 5 campos de batata sob diferentes práticas de rotação de cultivo com ou sem irrigação de águas subterrâneas. O pH mais baixo é observado em solos do Campo 4 em séries irrigadas por chuvas e águas subterrâneas. A irrigação de águas subterrâneas aumentou consistentemente o pH do solo em todos os 5 campos. As informações de pH são essenciais para a recomendação de liming os campos de batata adequadamente para promover o crescimento ideal.

Figura 1. PH de solo de campos de batata sob diferentes práticas de manejo de cultivo com ou sem irrigação subaquática.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
pH é um dos parâmetros químicos mais medidos de soluções aquosas. É um parâmetro crítico no tratamento de água e esgoto para aplicações municipais e industriais, produção química, pesquisa agrícola e produção. Também é fundamental no monitoramento ambiental, pesquisa química e de ciências da vida, pesquisa bioquímica e farmacêutica, produção eletrônica e muitas outras aplicações. A Figura 2 lista valores de pH de algumas substâncias comuns.
A água pura é neutra, com um pH de 7,00. Quando os produtos químicos são misturados com água, a mistura pode se tornar ácida ou básica. Vinagre e suco de limão são substâncias ácidas, enquanto detergentes de lavanderia e amônia são básicos. Produtos químicos muito básicos ou muito ácidos são considerados "reativos". Esses produtos químicos podem causar queimaduras graves. O ácido da bateria do automóvel é um produto químico ácido que é reativo. As baterias do automóvel contêm uma forma mais forte de um dos ácidos encontrados na chuva ácida. Os limpadores de ralo domésticos geralmente contêm lye, um produto químico muito alcalino que também é reativo.
Em sistemas vivos, o pH de diferentes compartimentos celulares, fluidos corporais e órgãos é geralmente fortemente regulado em um processo chamado homeostase de base ácida. O pH de sangue é geralmente ligeiramente básico com um valor de pH 7.365. Esse valor é frequentemente referido como pH fisiológico em biologia e medicina. A placa pode criar um ambiente ácido local que pode resultar em cárie dentária por desmineralização. Enzimas e outras proteínas têm uma gama de pH ideal e podem ficar inativadas ou desnaturadas fora desta faixa.

Figura 2. A escala de pH e os valores de pH de alguns itens comuns.
Subscription Required. Please recommend JoVE to your librarian.




