Overview
Fuente: Laboratorio del Dr. Henrik Sundén, Chalmers University of Technology
Espectroscopia de resonancia magnética nuclear (RMN) es una técnica de análisis fundamental para químicos orgánicos. Con la ayuda de la RMN, se ha facilitado enormemente el trabajo en el laboratorio orgánico. No sólo puede proporcionan información sobre la estructura de una molécula sino que también determinar el contenido y pureza de una muestra. En comparación con otras técnicas comúnmente encontradas para químicos orgánicos, como el análisis térmico y espectrometría de masas (MS), NMR es un método no destructivo que es valioso cuando la recuperación de la muestra es importante.
Una de las más utilizadas técnicas NMR de un químico orgánico es NMR del protón (1H). Los protones presentes en una molécula se comportan diferentemente dependiendo de su entorno químico, lo que permite dilucidar su estructura. Por otra parte, es posible supervisar la realización de una reacción mediante la comparación de espectros de RMN del material de partida que el producto final.
Este video ejemplifica como espectroscopia NMR puede ser utilizada en el trabajo diario de un químico orgánico. Aparecerá lo siguiente: i) preparación de una muestra de NMR. II) con 1H RMN para supervisar una reacción. III) identificar el producto obtenido de una reacción con 1H NMR. La reacción que se mostrará es la síntesis de un E- chalcona (3) de un (1) de aldehído y una cetona (2) (esquema 1). 1
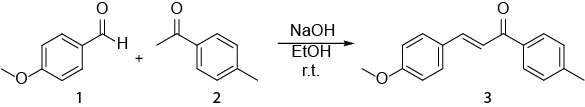
Esquema 1. Síntesis de (2E)-3-(4-methoxyphenyl)-1-(4-methylphenyl)-2-propen-1-one.
Principles
Núcleos con masa impar o número atómico tendrá una propiedad llamada spin, lo que es posible usar NMR para detectar elementos como el hidrógeno (1H), carbono (13C) y fósforo (31P). Las vueltas son al azar y gira en direcciones al azar; sin embargo, al aplicar un campo magnético externo estos núcleos se alinean con o contra el campo magnético aplicado. Estos dos Estados tienen diferentes niveles de energía: un estado de bajo consumo de energía y un estado de alta energía. Irradiación con radiación electromagnética hará que el estado de baja energía a voltear al estado de alta energía. Cuando la radiación es cesada, los núcleos se someterán a la relajación y se obtiene un decaimiento de inducción libre (FID). La FID es que la transformada de Fourier a los picos del espectro NMR. Diferentes elementos tendrán diferentes frecuencias a diferentes cambios químicos (tabla 1). Los espectros de RMN pueden proporcionar diferentes tipos de información acerca de un compuesto; la integral de un pico de proporciona el número de protones representados por él, el acoplamiento constante (J-acoplamiento) da la correlación de los protones y el patrón de división de un pico dice cuántos otros núcleos activos NMR están cercanas (a menudo referido como 'vecinos').
Desde núcleos de 1H NMR medidas 1H es importante utilizar disolventes deuterados; de lo contrario la señal de interés se perderá en el ruido de la señal del solvente.
| Tipo de protón | Cambio (δ, ppm) | Tipo de carbono | Cambio (δ, ppm) |
| Alquilo 1 º, RCH3 | 0,8 – 1,2 | Alquilo 1 º, RCH3 | 0 – 40 |
| 2° Alquilo, R C2H2R | 1.2 – 1.5 | 2° Alquilo, RC2H2R | 10 – 50 |
| Alquilo 3 º, RCHR2 | 1.4 – 1.8 | 3° Alquilo, RCh2 | 15-50 |
| Arílicos, R2C = CRCH3 | 1.6 – 1.9 | Alquenoc=C | 100 – 170 |
| Cetona, RC(=O) CH3 | 2.1-2.6 | Arilo, C en el anillo aromático | 100 – 170 |
| Éter, ROCH2R | 3.3-3.9 | Alcohol o éter, R3COR | 50-90 |
| Alcohol, HOCH2R | 3.3-4.0 | Ácido carboxílico o éster, RC(= O) o |
160-185 |
| Vinil, R2C = CH2 | 4.6 – 5.0 | Aldehído o cetona, RC(= O) R |
182 – 215 |
| Vinil, R2C = CRH | 5.2 – 5.7 | ||
| Aromático, ArH | 6.0 – 8.5 | ||
| Aldehído RC(=O)H | 9.5-10.5 | ||
| Hidroxilo del alcohol, ROH | 0.5-6.0 | ||
| Carboxílico, RC(=O) OH | 10 – 13 |
Tabla 1. Común protón y carbono NMR cambios químicas. 2
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. preparación de la RMN a partir de Material
- Añadir ~ 10 mg a partir de material a un tubo limpio de NMR.
- Disolver el material de partida en disolventes deuterado mL de ~0.7 (ejemplo CDCl3). Una altura adecuada del solvente para un buen espectro es de 4.5-5 cm.
- Cerrar el tubo NMR cuidadosamente y escriba el nombre de la muestra en la tapa.
- Agite la muestra suavemente para asegurar que todo el material se había disuelto. Tenga cuidado para evitar el contacto entre el solvente y la tapa, que podría conducir a la posible contaminación de la muestra.
- Inserte el tubo NMR cuidadosamente en un spinner. La ruleta girará una vez insertado en el imán para asegurar que toda la muestra experimenta un campo magnético homogéneo. Limpie el exterior del tubo NMR y spinner con 2-propanol y laboratorio de los tejidos para eliminar las huellas dactilares y la suciedad.
- Lugar la ruleta en una profundidad de la muestra calibrador para asegurar que la parte inferior del tubo NMR no se inserta demasiado lejos en la sonda NMR, ya posiblemente podría dañar el espectrómetro. Diferentes sondeos con profundidades diferentes de la muestra y el usuario debe ser consciente de la galga de profundidad específicos.
- Colocar la muestra en el espectrómetro de RMN. Aquí se utilizó un espectrómetro Varian de 400 MHz, equipado con un automuestreador.
- Después de la terminación de la medición de RMN, el espectro del proceso y asignar los picos en el espectro.
2. preparación de NaOH de 3 M y síntesis de chalcona
- Añadir 60 mg NaOH a un matraz aforado de 50 mL.
- Disolver el NaOH añadiendo agua desionizada a la mitad del frasco. Diluir la solución aún más añadiendo más agua hasta llega a la marca.
- Añadir 10 mL de etanol a un matraz de fondo redondo de 50 mL equipado con una barra de agitación magnética.
- Después de eso, añadir 680,5 mg 4-metoxi y 5 mL de solución de NaOH preparada en el paso 2.1 en el mismo matraz.
- Añadir 671 mg 4-Metilacetofenona posteriormente a la solución agitada y tapa el frasco y agitar a temperatura ambiente.
- Supervisar el progreso de la reacción por 1H NMR a intervalos de 30 min (ver paso 3) hasta su consumo completo de materiales de partida.
- Añadir 5 mL de agua cuando la reacción ha alcanzado terminación (3 h). El precipitado resultante del filtro y lavar con 20 mL de etanol/agua 1:2. Airee el precipitado seco.
- Calcular el rendimiento del producto obtenido. Preparar una muestra de NMR según paso 1.2.2.7. Compruebe la pureza con 1H NMR. Si no puro, purificar el producto a través de recristalización con etanol.
- Agregar aproximadamente 3 gotas de mezcla de reacción en un tubo de NMR utilizando una pipeta Pasteur y enjuague la pipeta con disolventes deuterados.
- Repita los pasos 1,2 – 1,8.
3. breve interpretación de un espectro de RMN
- Proceso el espectro con un programa adecuado (ejemplo MestReNova).
- Correlacionar los diferentes picos a los NMR cambios en la tabla 1. Los cambios químicos da una pista de qué tipo de ambiente los protones existe en.
- Integrar las cumbres para dar el número de hidrógenos correspondientes a cada pico. Integración de todos los picos da un número relativo de protones total.
- Evaluar la separación de los picos de protones, que indican el número de vecinos.
- Medir el acoplamiento J para ver cómo los protones están conectados entre sí.
Espectroscopia de resonancia magnética nuclear, o RMN, es un método importante para determinar la estructura molecular y la pureza de muestras en química orgánica.
En NMR muestras de espectroscopia se exponen a un campo magnético fuerte. Exposición de ciertos núcleos de transición o resonar, entre discretos niveles de energía. El boquete de energía entre estos niveles puede medir y visualizar espectros. Esta información puede utilizarse para dilucidar la estructura química de la muestra.
No todos los núcleos tienen las propiedades necesarias para ser activos NMR. Isótopos comunes estudiados son 1H, 2H, 13C, 19F y 31P.
Este video se introducen los principios de RMN, paso a través de preparaciones de ejemplo de muestras de NMR de diferentes etapas de una reacción química y discutimos varias aplicaciones.
En el instrumento NMR, helio y nitrógeno líquido se utilizan para refrigerar un imán súper conductor. El imán aplica un campo magnético constante a una muestra. Dentro de la muestra, los núcleos atómicos con un número impar de protones y/o neutrones se alinearán con el campo, la adopción de un estado de bajo consumo de energía, o contra él, adoptando un estado de alta energía.
La diferencia de energía entre los dos niveles es la frecuencia de resonancia, que depende de la fuerza del campo aplicado y el tipo de núcleo. Los imanes usados en NMR, el valor es en la radiofrecuencia, o RF, gama.
Una bobina de RF excita la muestra con un pulso de radiofrecuencia, los núcleos de bajo consumo de energía en movimiento al estado mayor, antes de volver hacia atrás. La bobina detecta estos cambios en la magnetización, que aparecen como picos.
La fuerza de la RMN radica en su capacidad para distinguir a los núcleos, en este caso hidrógeno, por su ambiente químico. Electrones de átomos vecinos se bloque o "protector", los núcleos de algunos de los campos magnéticos. Este campo efectivo cambia la frecuencia de resonancia de los núcleos especiales, llamado un cambio químico. En etanol los protones metileno, hidroxilo y metil todos tienen frecuencias de resonancia única. Determinar el área bajo cada pico aclara el número de cada tipo de protón.
Desde instrumentos con diversas fuerzas magnéticas cambiará las frecuencias resonantes, ellos se hace referencia a una molécula estándar añadida a la muestra, a menudo tetramethylsilane o el TMS. El cambio químico de las frecuencias es muy pequeña, divulgado a menudo en partes por millón, o ppm.
Cuando se utiliza un imán fuerte con alta resolución, picos a veces se dividen en subpeaks. Esto es causado por los núcleos vecinos, algunos de los cuales están alineados con el campo magnético, otros en contra; Además cambiando el campo efectivo aplicado a los núcleos. En el etanol, los protones de metileno 2 divide el pico de metilo dos veces en un trío, y los protones de metilo 3 divide el pico de metileno tres veces en un cuarteto. La distancia de la separación, o J-acoplamiento, se relaciona con la distancia de los núcleos, en descubrimiento cualitativo.
Ahora que usted comprende los principios básicos detrás de NMR, vamos a revisar un procedimiento de ejemplo que utiliza el protón NMR para controlar la síntesis de chalcona de un aldehído y cetona.
Comience usando una pipeta Pasteur para agregar una pequeña cantidad de material de partida a un vaso de precipitados. En la capilla del humo y diluir el material de partida con 0,7 mL de disolventes deuterados. Se utilizan disolventes deuterados, como frecuencia de resonancia del deuterio está fuera del intervalo para los protones.
Utilice una pipeta Pasteur para añadir 0,7 mL de material de partida diluido en un tubo limpio 5 mm NMR, llenar el tubo inferior 4.5 a 5 cm. tapa NMR y etiquetarla. Agitar suavemente el tubo, teniendo cuidado de evitar el contacto entre la muestra y la tapa. A continuación, inserte el tubo en la ruleta.
Limpie el exterior del tubo y cono usando 2-propanol y laboratorio de los tejidos. Luego coloque el conjunto de la muestra en el medidor de profundidad y calibrar la profundidad de inserción.
Después de la calibración, carga el conjunto de la muestra en el espectrómetro de RMN ya sea manualmente o utilizando un muestreador automático. Por último, utilizar una estación de trabajo de la computadora para adquirir el espectro de RMN.
Generan los espectros de RMN utilizando este procedimiento para cada uno de los materiales a partir de la reacción. Para la síntesis de chalcona, se deben generar espectros de metoxi y Metilacetofenona.
A continuación, realizar la síntesis de la muestra mediante la combinación de los materiales de partida y reactivos en un matraz para comenzar la reacción.
A intervalos de 30 min, saque una pequeña alícuota de la mezcla de reacción con una pipeta Pasteur y añadir 3 gotas a un tubo limpio de NMR.
Diluya este producto crudo de reacción con solventes deuterados y prepararse para NMR utilizando el procedimiento anteriormente descrito.
Conforme avanza la reacción, se forma un precipitado amarillo. Cuando la reacción es completa, lavar y filtrar el precipitado y generan espectros de RMN para el producto de reacción purificado.
Ahora que hemos generado espectros de RMN en cada etapa de la reacción química, vamos a analizarlos.
Los picos de los espectros de NMR para cada una de las materias primas se asignan a grupos de protones diferentes dentro de la molécula según sus cambios químicos y el número de protones que contribuyen a cada pico. Aquí, asignamos a los 4 grupos principales protón Metilacetofenona y metoxi, observando el pico de aldehído entre 9.5 y 10.5 ppm. Al comparar los espectros de RMN de los productos de reacción cruda en diferentes puntos del tiempo, la evolución de la reacción química que se sintetiza la chalcona es aclarada. Por ejemplo, el pico del aldehino de la partida metoxi material todavía está presente después de 30 minutos de reacción, pero desaparece completamente después de 3 horas, lo que significa la terminación de la reacción.
Examinando el espectro del producto purificado podemos asignar cada pico a un grupo de protones en la estructura de la chalcona. Por ejemplo, examinando picos 3 y 4 vemos que sus integrales son ambos, correspondiente a grupos que contienen un protón.
Picos de 3 y 4 son llamados dobletes indicando un protón vecino. Ambos tienen constantes de acoplamiento J de 16 Hz, lo que sugiere que los protones se encuentran a través de un E-enlace doble. Mediante la asignación de todos los picos de NMR de producto de la reacción purificado, confirmamos la síntesis de una chalcona puro.
Espectroscopia RMN tiene una amplia gama de aplicaciones y se utiliza en muchos campos científicos y médicos.
En esta aplicación, protón NMR se utiliza para verificar la síntesis y estructura de diamidocarbene y mononoamidocarbine, cuyos espectros de RMN tienen diferentes patrones de separación máxima. Estos carbenos también generan productos de reacción aparentemente diferente cuando se combina con fósforo blanco; DAC1 genera un producto de la reacción de rojo brillante, mientras que MAAC2 produce un producto naranja brillante. Estas diferencias en los productos de reacción fueron confirmadas mediante una segunda aplicación de la RMN, 31P NMR, que genera espectros basados en diferencias en la frecuencia de resonancia de los núcleos de fósforo.
Aquí, la proyección de imagen de resonancia magnética nuclear, o RMN, fue utilizado para generar un mapa anatómico del cerebro y para seleccionar las regiones cerebrales de interés. Luego se utilizó espectroscopia RMN para generar espectros de metabolitos claves. Por último, usando MRI se evaluaron cambios en el metabolismo cerebral en diferentes condiciones experimentales.
En esta aplicación, NMR se utilizó para analizar las propiedades de enlace y proponer una estructura 3D de un péptido de cobre-que ata. En primer lugar, se compararon los espectros de RMN para el péptido no Unido y enlazado a cobre Estados. Luego, mediante técnicas de RMN de 2 dimensiones más avanzadas, se evaluaron diferentes conformaciones posibles de la estructura del péptido. Finalmente, estas limitaciones estructurales derivados de NMR se utilizaron para desarrollar una estructura 3-Dimensional propuesta para el péptido no consolidado.
Sólo ha visto introducción de Zeus a NMR análisis. Ahora debe entender los principios subyacentes detrás de generación de espectros de NMR y análisis, así como un procedimiento para la preparación de la muestra de NMR.
¡Gracias por ver!
Subscription Required. Please recommend JoVE to your librarian.
Results
Comparando los espectros de las materias primas (figuras 1 y 2) para el producto final (figura 5) una clara diferencia entre los espectros puede observarse, lo que indica la formación de la chalcona. Puede ser el punto final de la reacción determina tomando NMR muestras a diferentes intervalos de tiempo; por ejemplo, el pico del protón de aldehído (C(=O)H) (1) puede verse en la figura 3 pero no en la figura 4, lo que significa la terminación de la reacción después de 3 horas. Observando los integrales, división patrones y J-acoplamientos de los picos, es posible validar la estructura de la chalcona. Los integrales de los picos (números bajo el pico, figura 5) muestran la cantidad relativa de hidrógenos presentes que deben se correlacionan con la cantidad de hidrógenos que se encuentran en el producto. Además, el patrón de división da una indicación del número de vecinos; por ejemplo, pico (5) y (1) — ambas camisetas, indican no hay vecinos cercanos con integrales de 3 se correlaciona con el MeO - y el grupo Me respectivamente. Comparando el producto químico cambios en los espectros con la tabla 1 es posible dilucidar que el MeO grupo corresponde a la camiseta en 3,80 ppm y el Me-grupo a 2,45 ppm. Por otra parte, la formación del enlace doble puede verse como dos dobletes (figura 5), ppm 7,80 y 7.44. Mirando el acoplamiento J de 16 Hz indica la formación de un E-alkene; el Z-alkene típicamente tiene un menor valor de 10 a 12 Hz.3 asignar los picos aromáticos verifica la estructura (figura 5). 4

Figura 1. Asignado 1H NMR espectros de 4-Metilacetofenona haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Asignado 1espectros H NMR de 4-metoxi. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Crudo 1espectros H NMR después de 30 minutos que muestra el pico de aldehído residual. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Crudo 1espectros H NMR después de 3 horas no mostrando ningún pico residual de aldehino. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5. 1 H NMR espectros del producto obtenido después del trabajo. La imagen insertada muestra la J -acoplamientos de alkene. Haga clic aquí para ver una versión más grande de esta figura.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
NMR se puede, por ejemplo, utilizado para detectar productos intermedios de reacción, facilitando el trabajo de elucidación de un mecanismo de reacción. Con la ayuda de la RMN también es posible observar las interacciones y movimientos moleculares importantes para el desarrollo de fármacos. Además, NMR puede dar información estructural sobre materiales sólidos; por ejemplo para proporcionar un fundamento para las propiedades del material observadas. Otras aplicaciones de la RMN pueden encontrarse en el campo de la medicina, donde la proyección de imagen de resonancia magnética (MRI) se utiliza con frecuencia para el diagnóstico médico. NMR también se ha utilizado en metabolómica para detectar diferentes metabolitos excretados por el organismo proporcionando una huella metabólica. Los usos de NMR son anchos; de determinar la estructura de una sola molécula a la proyección de imagen del cerebro humano.
Subscription Required. Please recommend JoVE to your librarian.
References
- Ta, L., Axelsson, A., Bijl, J., Haukka, M., Sundén, H., Ionic Liquids as Precatalysts in the Highly Stereoselective Conjugate Addition of α,β-Unsaturated Aldehydes to Chalcones. Chem. Eur. J. 20 (43), 13889-13893 (2014).
- Table adapted from Graham Solomons, T. W. Fryhle, C. B., Organic Chemistry, 10th edition, Wiley, p. 387, 418 (2011).
- Clayden, J., Greeves, N., Warren, S., Wothers, P. Proton nuclear magnetic resonance. Organic Chemistry, Chapter 11, Oxford University Press, 269 (2001).
- Wu, X.-F., Neumann, H., Spannenberg, A., Schulz, T., Jiao, H., Beller, M.,Development of a General Palladium-Catalyzed Carbonylative Heck Reaction of Aryl Halides. J. Am. Chem. Soc. 132 (41), 14596-14602 (2010).




