Overview
Fonte: Laboratorio del Dr. Henrik Sundén – Chalmers University of Technology
La spettroscopia di risonanza magnetica nucleare (NMR) è una tecnica di analisi vitale per i chimici organici. Con l'aiuto di NMR, il lavoro nel laboratorio organico è stato facilitato enormemente. Non solo può fornire informazioni sulla struttura di una molecola, ma anche determinare il contenuto e la purezza di un campione. Rispetto ad altre tecniche comunemente incontrate per i chimici organici – come l'analisi termica e la spettrometria di massa (MS) – la NMR è un metodo non distruttivo che è prezioso quando il recupero del campione è importante.
Una delle tecniche NMR più frequentemente utilizzate per un chimico organico è la NMR protonica(1H). I protoni presenti in una molecola si comporteranno in modo diverso a seconda dell'ambiente chimico circostante, rendendo possibile chiarire la sua struttura. Inoltre, è possibile monitorare il completamento di una reazione confrontando gli spettri NMR del materiale di partenza con quelli del prodotto finale.
Questo video esemplifica come la spettroscopia NMR può essere utilizzata nel lavoro quotidiano di un chimico organico. Verrà mostrato quanto segue: i) preparazione di un campione NMR. ii) Utilizzo di 1H NMR per monitorare una reazione. iii) Identificazione del prodotto ottenuto da una reazione con 1H NMR. La reazione che verrà mostrata è la sintesi di un E-calcone (3) da un'aldeide (1) e un chetone (2) (Schema 1). 1
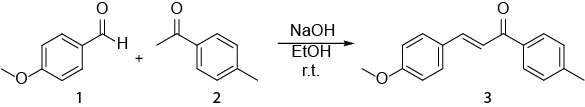
Schema 1. Sintesi di (2E)-3-(4-metossifenil)-1-(4-metilfenil)-2-propen-1-one.
Principles
I nuclei con una massa dispari o un numero atomico avranno una proprietà chiamata spin, rendendo possibile l'uso della NMR per rilevare elementi come idrogeno(1H), carbonio(13C) e fosforo(31P). Gli spin sono casuali e girano in direzioni casuali; tuttavia, applicando un campo magnetico esterno questi nuclei si allineeranno con o contro il campo magnetico applicato. Questi due stati hanno diversi livelli di energia: uno stato a bassa energia e uno stato ad alta energia. L'irradiazione con radiazioni elettromagnetiche farà sì che lo stato a bassa energia si capovolga allo stato ad alta energia. Quando la radiazione è cessata, i nuclei subiranno un rilassamento e si otterrà un decadimento induttivo libero (FID). Il FID è trasformato di Fourier per dare i picchi dello spettro NMR. Elementi diversi avranno frequenze diverse che porteranno a diversi spostamenti chimici (Tabella 1). Gli spettri NMR possono fornire diversi tipi di informazioni su un composto; l'integrale di un picco fornisce il numero di protoni rappresentati da esso, la costante di accoppiamento (J-coupling) fornisce la correlazione dei protoni e il modello di scissione di un picco dice quanti altri nuclei nmR-attivi sono nelle vicinanze (spesso indicati come "vicini").
Poiché 1H NMR misura 1H nuclei è importante utilizzare solventi deuterati; altrimenti il segnale di interesse andrà perso nel rumore del segnale del solvente.
| Tipo di protone | Maiusc (δ, ppm) | Tipo di carbonio | Maiusc (δ, ppm) |
| 1° Alchil, RCH3 | 0.8–1.2 | 1° Alchil, RCH3 | 0–40 |
| 2° Alchil, R2CH2R | 1.2–1.5 | 2° Alchil, R2CH2R | 10–50 |
| 3° Alchil, RCHR2 | 1.4–1.8 | 3° Alchil, RCHR2 | 15–50 |
| Allylic, R2C=CRCH3 | 1.6–1.9 | Alchene, C=C | 100–170 |
| Chetone, RC(=O)CH3 | 2.1–2.6 | Aryl, C in anello aromatico | 100–170 |
| Etere, ROCH2R | 3.3–3.9 | Alcol o etere, R3COR | 50–90 |
| Alcool, HOCH2R | 3.3–4.0 | Acido carbossilico o estere, RC(=O)OR |
160–185 |
| Vinilico, R2C=CH2 | 4.6–5.0 | Aldeide o chetone, RC(=O)R |
182–215 |
| Vinilico, R2C=CRH | 5.2–5.7 | ||
| Aromatico, ArH | 6.0–8.5 | ||
| Aldeide RC(=O)H | 9.5–10.5 | ||
| Idrossile alcolico, ROH | 0.5–6.0 | ||
| Carbossilico, RC(=O)OH | 10–13 |
Tabella 1. Cambiamenti chimici NMR comuni di protoni e carbonio. 2
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. Preparazione del materiale di partenza NMR
- Aggiungere ~ 10 mg di materiale di partenza a un tubo NMR pulito.
- Sciogliere il materiale di partenza in ~0,7 mL di solvente deuterato (esempio dato CDCl3). Un'altezza adatta del solvente per un buon spettro è di 4,5-5 cm.
- Tappare attentamente il tubo NMR e scrivere il nome del campione sul cappuccio.
- Agitare delicatamente il campione per assicurarsi che tutto il materiale si sia sciolto. Fare attenzione ad evitare il contatto tra il solvente e il tappo, che potrebbe portare a possibili contaminazioni del campione.
- Inserire accuratamente il tubo NMR in uno spinner. Lo spinner ruoterà una volta inserito nel magnete per garantire che l'intero campione sperimenti un campo magnetico omogeneo. Pulire l'esterno del tubo NMR e dello spinner con 2-propanolo e tessuti di laboratorio per rimuovere impronte digitali e sporco.
- Posizionare lo spinner in un profondimetro per campioni per assicurarsi che il fondo del tubo NMR non sia inserito troppo lontano nella sonda NMR in quanto ciò potrebbe danneggiare lo spettrometro. Sonde diverse hanno profondità di campionamento diverse e l'utente deve essere a conoscenza del profondimetro specifico.
- Posizionare il campione nello spettrometro NMR. Qui è stato utilizzato uno spettrometro Varian 400 MHz, dotato di un autocampionatore.
- Dopo aver completato la misurazione NMR, elaborare lo spettro e assegnare i picchi nello spettro.
2. Preparazione di 3 M NaOH e sintesi di calcone
- Aggiungere 60 mg di NaOH a un matraccio volumetrico da 50 mL.
- Sciogliere il NaOH aggiungendo acqua deionizzata a metà del pallone. Diluire ulteriormente la soluzione aggiungendo altra acqua fino a raggiungere il segno.
- Aggiungere 10 ml di etanolo a un matraccio a fondo tondo da 50 ml dotato di una barra magnetica.
- Successivamente, aggiungere 680,5 mg di 4-metossibenzaldeide e 5 mL di soluzione di NaOH preparata al punto 2.1 allo stesso matraccio.
- Aggiungere successivamente 671 mg di 4-metilacetofenone alla soluzione agitata e tappare il matraccio e mescolare a temperatura ambiente.
- Monitorare l'avanzamento della reazione mediante 1H NMR a intervalli di 30 minuti (vedere fase 3) fino al pieno consumo di materie prime.
- Aggiungere 5 ml di acqua quando la reazione ha raggiunto il completamento (~3 h). Filtrare il precipitato risultante e lavarlo con 20 ml di etanolo/acqua 1:2. Lasciare asciugare il precipitato all'aria.
- Calcola la resa del prodotto ottenuto. Preparare un campione NMR secondo il punto 1.2.2.7. Controllare la purezza con 1H NMR. Se non puro, purificare il prodotto tramite ricristallizzazione con etanolo.
- Aggiungere circa 3 gocce di miscela di reazione a un tubo NMR utilizzando una pipetta Pasteur e risciacquare la pipetta con solvente deuterato.
- Ripetere i passaggi da 1.2 a 1.8.
3. Breve interpretazione di uno spettro NMR
- Elaborare lo spettro con un programma adatto (esempio dato MestReNova).
- Correlare i diversi picchi agli spostamenti NMR nella Tabella 1. I cambiamenti chimici danno un indizio del tipo di ambiente in cui esistono i protoni.
- Integrare i picchi per dare il numero di idrogeni corrispondenti a ciascun picco. L'integrazione di tutti i picchi dà un numero relativo di protoni totali.
- Valutare la scissione dei picchi di protoni, che indicano il numero di vicini.
- Misurare l'accoppiamento J per vedere come i protoni sono collegati tra loro.
La spettroscopia di risonanza magnetica nucleare, o NMR, è un metodo importante per determinare la struttura molecolare e la purezza dei campioni in chimica organica.
Nella spettroscopia NMR i campioni sono esposti ad un forte campo magnetico. All'esposizione alcuni nuclei passano, o risuonano, tra livelli di energia discreti. Il divario energetico tra questi livelli può essere misurato e visualizzato come spettri. Questi dati possono essere utilizzati per chiarire la struttura chimica del campione.
Non tutti i nuclei hanno le proprietà richieste per essere NMR-attivi. Gli isotopi comuni studiati sono 1H, 2H, 13C, 19F e 31P.
Questo video introdurrà i principi alla base della NMR, esaminerà i preparativi di esempio di campioni NMR da diverse fasi di una reazione chimica e discuterà diverse applicazioni.
Nello strumento NMR, l'azoto liquido e l'elio vengono utilizzati per raffreddare un magnete superconduttore. Il magnete applica un campo magnetico costante a un campione. All'interno del campione, i nuclei atomici con un numero dispari di protoni e/o neutroni si allineeranno con il campo, adottando uno stato a bassa energia, o contro di esso, adottando uno stato ad alta energia.
La differenza di energia tra i due livelli è la frequenza di risonanza, che dipende dalla forza del campo applicato e dal tipo di nucleo. Per i magneti utilizzati nella NMR, il valore è nell'intervallo a radiofrequenza o RF.
Una bobina RF eccita il campione con un impulso a radiofrequenza, spostando i nuclei a bassa energia allo stato superiore, prima di tornare indietro. La bobina rileva questi cambiamenti nella magnetizzazione, che vengono visualizzati come picchi.
La forza della NMR sta nella sua capacità di distinguere i nuclei, in questo caso l'idrogeno, dal loro ambiente chimico. Gli elettroni sugli atomi vicini bloccheranno, o "schermano", i nuclei da parte del campo magnetico. Questo campo efficace cambia la frequenza di risonanza per i nuclei particolari, chiamato spostamento chimico. Nell'etanolo i protoni metilene, idrossile e metile hanno tutti frequenze di risonanza uniche. Determinare l'area sotto ogni picco chiarisce il numero di ciascun tipo di protone.
Poiché gli strumenti con diverse forze magnetiche sposteranno le frequenze di risonanza, si fa riferimento a una molecola standard aggiunta al campione, spesso tetrametilsilano o TMS. Lo spostamento chimico delle frequenze è molto piccolo, spesso riportato in parti per milione, o ppm.
Quando si utilizza un magnete forte ad alta risoluzione, i picchi a volte si dividono in sottopeak. Ciò è causato dai nuclei vicini, alcuni dei quali sono allineati con il campo magnetico, altri contro; modificando ulteriormente il campo effettivo applicato ai nuclei. Nell'etanolo, i 2 protoni di metilene dividono il picco metilico due volte in una tripletta e i 3 protoni metilici dividono il picco di metilene tre volte in un quartetto. La distanza della scissione, o accoppiamento J, è correlata alla distanza dei nuclei, aiutando nella scoperta qualitativa.
Ora che hai compreso i principi di base alla base della NMR, esaminiamo una procedura di esempio che utilizza la NMR protonica per monitorare la sintesi di calcone da un'aldeide e chetone.
Iniziare utilizzando una pipetta Pasteur per aggiungere una piccola quantità di materiale di partenza a un becher. Spostarsi nella cappa aspirante e diluire il materiale di partenza con 0,7 ml di solvente deuterato. Vengono utilizzati solventi deuterati, poiché la frequenza di risonanza del deuterio è al di fuori dell'intervallo per i protoni.
Utilizzare una pipetta Pasteur per aggiungere 0,7 mL del materiale di partenza diluito in un tubo NMR pulito da 5 mm, riempiendo il fondo di 4,5-5 cm. Tappare il tubo NMR ed etichettarlo. Agitare delicatamente il tubo, avendo cura di evitare il contatto tra il campione e il tappo. Quindi, inserire il tubo nello spinner.
Pulire l'esterno del tubo e dello spinner usando 2-propanolo e tessuti di laboratorio. Quindi posizionare l'assieme campione nel profondimetro e calibrare la profondità di inserimento.
Dopo la calibrazione, caricare l'assemblaggio del campione nello spettrometro NMR manualmente o utilizzando un campionatore automatico. Infine, utilizzare una workstation per computer per acquisire lo spettro NMR.
Genera spettri NMR utilizzando questa procedura per ciascuno dei materiali di partenza della reazione. Per la sintesi del calcone, gli spettri dovrebbero essere generati sia per la metossibenzaldeide che per il metilacetofenone.
Quindi, eseguire la sintesi del campione combinando i materiali di partenza e i reagenti in un pallone per iniziare la reazione.
A intervalli di 30 minuti, rimuovere una piccola aliquota della miscela di reazione utilizzando una pipetta Pasteur e aggiungere 3 gocce a un tubo NMR pulito.
Diluire questo prodotto di reazione grezzo con solvente deuterato e prepararsi per la NMR utilizzando la procedura precedentemente descritta.
Man mano che la reazione progredisce, si formerà un precipitato giallo. Quando la reazione è completa, lavare e filtrare il precipitato e generare spettri NMR per il prodotto di reazione purificato.
Ora che abbiamo generato spettri NMR in ogni fase della reazione chimica, analizziamoli.
I picchi degli spettri NMR per ciascuno dei materiali di partenza sono assegnati a diversi gruppi di protoni all'interno della molecola in base ai loro spostamenti chimici e al numero di protoni che contribuiscono a ciascun picco. Qui, assegniamo i 4 principali gruppi di protoni per metilacetofenone e metossibenzaldeide, notando il picco di aldeide tra 9,5 e 10,5 ppm. Confrontando gli spettri NMR dei prodotti di reazione grezzi in diversi punti temporali, viene chiarita l'evoluzione della reazione chimica che sintetizza il calcone. Ad esempio, il picco di aldeide dal materiale di partenza metossibenzaldeide è ancora presente dopo 30 minuti di reazione, ma è completamente scomparso dopo 3 ore, a significare il completamento della reazione.
Esaminando lo spettro del prodotto purificato possiamo assegnare ogni picco a un gruppo protonico nella struttura del calcone. Ad esempio, esaminando i picchi 3 e 4 vediamo che i loro integrali sono entrambi uno, corrispondenti a gruppi contenenti un solo protone.
I picchi 3 e 4 sono i cosiddetti doppietti che indicano un protone vicino. Entrambi hanno costanti di accoppiamento J di 16 Hz, suggerendo che i protoni sono situati attraverso un legame E-doppio. Assegnando tutti i picchi NMR del prodotto di reazione purificato, confermiamo la sintesi di un calcone puro.
La spettroscopia NMR ha una vasta gamma di applicazioni ed è utilizzata in molti campi scientifici e medici.
In questa applicazione, la NMR protonica viene utilizzata per verificare la sintesi e la struttura sia del diamidocarbene che della mononoamidocarbina, i cui spettri NMR hanno diversi modelli di scissione del picco. Questi carbini hanno anche generato prodotti di reazione apparentemente diversi quando combinati con fosforo bianco; DAC1 ha generato un prodotto di reazione rosso vivo, mentre MAAC2 ha prodotto un prodotto arancione brillante. Queste differenze nei prodotti di reazione sono state confermate utilizzando una seconda applicazione di NMR, 31P NMR, che genera spettri basati sulle differenze nella frequenza di risonanza dei nuclei di fosforo.
Qui, la risonanza magnetica nucleare, o MRI, è stata utilizzata per generare una mappa anatomica del cervello e per selezionare le regioni cerebrali di interesse. Quindi la spettroscopia NMR è stata utilizzata per generare spettri di metaboliti chiave. Infine, sono stati valutati i cambiamenti della risonanza magnetica nel metabolismo cerebrale in diverse condizioni sperimentali.
In questa applicazione, NMR è stato utilizzato per analizzare le proprietà di legame e proporre una struttura 3D di un peptide legante il rame. In primo luogo, gli spettri NMR sono stati confrontati per gli stati non legati e legati al rame del peptide. Quindi, utilizzando tecniche NMR 2-dimensionali più avanzate, sono state valutate diverse conformazioni potenziali della struttura del peptide. Infine, questi vincoli strutturali derivati dalla NMR sono stati utilizzati per sviluppare una struttura 3-dimensionale proposta per il peptide non legato.
Hai appena visto l'introduzione di JoVE all'analisi NMR. Ora dovresti comprendere i principi alla base della generazione e dell'analisi degli spettri NMR, nonché una procedura per la preparazione del campione NMR.
Grazie per l'attenzione!
Subscription Required. Please recommend JoVE to your librarian.
Results
Confrontando gli spettri delle materie prime (Figure 1 e 2) con quelli del prodotto finale (Figura 5) si può osservare una chiara differenza tra gli spettri, che indica la formazione del calcone. L'endpoint della reazione può essere determinato prelevando campioni NMR a diversi intervalli di tempo; ad esempio, il picco del protone aldeide (C(=O)H) (1) può essere visto in Figura 3 ma non in Figura 4, a significare il completamento della reazione dopo 3 ore. Osservando gli integrali, i modelli di scissione e gli accoppiamenti J dei picchi, è possibile convalidare la struttura del calcone. Gli integrali dei picchi (numeri sotto il picco, Figura 5)mostrano la quantità relativa di idrogeno presente che dovrebbe essere correlata alla quantità di idrogeno presente nel prodotto. Inoltre, il modello di scissione fornisce un'indicazione del numero di vicini; ad esempio, il picco (5) e (1) - entrambi singlet - indicano che nessun vicino vicino con integrali di 3 è correlato rispettivamente con il gruppo MeO- e Me- . Confrontando gli spostamenti chimici negli spettri con la Tabella 1 è possibile chiarire che il gruppo MeO corrisponde al singoletto a 3,80 ppm e il gruppo Me a 2,45 ppm. Inoltre, la formazione del doppio legame può essere vista come due doppietti (Figura 5), 7,80 e 7,44 ppm. Osservando l'accoppiamento J di 16 Hz si indica la formazione di un E-alchene; l'alchene Zha tipicamente un valore minore di 10-12 Hz.3 L'assegnazione dei picchi aromatici verifica la struttura (Figura 5). 4

Figura 1. Spettri NMR 1H assegnatidi 4-metilacetofenone Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2. Assegnati spettri NMR 1H di 4-metossibenzaldeide. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3. Spettri NMR grezzi da 1 H dopo 30 minuti che mostrano il picco di aldeide residua. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4. Spettri NMR grezzi da 1 H dopo 3 ore che non mostrano alcun picco residuo di aldeide. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5. SpettriNMR 1H del prodotto ottenuto dopo il work-up. L'immagine inserita mostra gli accoppiamenti a Jdell'alchene. Fare clic qui per visualizzare una versione più grande di questa figura.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
La NMR può, ad esempio, essere utilizzata per rilevare intermedi di reazione, facilitando il lavoro di chiarimento di un meccanismo di reazione. Con l'aiuto della NMR è anche possibile osservare movimenti molecolari e interazioni importanti per lo sviluppo di farmaci. Inoltre, NMR può fornire informazioni strutturali sui materiali solidi; ad esempio per fornire una motivazione per le proprietà osservate dei materiali. Altre applicazioni della NMR possono essere trovate nel campo della medicina, dove la risonanza magnetica (MRI) viene spesso utilizzata per la diagnosi medica. La NMR è stata anche utilizzata in metabolomica per rilevare diversi metaboliti escreti da un organismo, fornendo così un'impronta metabolica. Gli usi della NMR sono ampi; dalla determinazione della struttura di una singola molecola all'imaging del cervello umano.
Subscription Required. Please recommend JoVE to your librarian.
References
- Ta, L., Axelsson, A., Bijl, J., Haukka, M., Sundén, H., Ionic Liquids as Precatalysts in the Highly Stereoselective Conjugate Addition of α,β-Unsaturated Aldehydes to Chalcones. Chem. Eur. J. 20 (43), 13889-13893 (2014).
- Table adapted from Graham Solomons, T. W. Fryhle, C. B., Organic Chemistry, 10th edition, Wiley, p. 387, 418 (2011).
- Clayden, J., Greeves, N., Warren, S., Wothers, P. Proton nuclear magnetic resonance. Organic Chemistry, Chapter 11, Oxford University Press, 269 (2001).
- Wu, X.-F., Neumann, H., Spannenberg, A., Schulz, T., Jiao, H., Beller, M.,Development of a General Palladium-Catalyzed Carbonylative Heck Reaction of Aryl Halides. J. Am. Chem. Soc. 132 (41), 14596-14602 (2010).




