Summary
La vía clásica es activada por anticuerpos y que culmina en la lisis de las células diana. El CH
Abstract
El sistema del complemento es un grupo de proteínas que cuando se activa conducir a la lisis celular de destino y facilita la fagocitosis por opsonización. Los componentes individuales del complemento pueden ser cuantificados sin embargo, esto no proporciona ninguna información en cuanto a la actividad de la vía. El CH
Protocol
Preparación de 5x buffer salino veronal (VBS)
- Para preparar la solución salina tamponada con veronal (VBS), tres soluciones distintas que estar preparados.
- Prepare una solución de 1 por disolución de NaCl y 21.25gm 0.94gm de barbital sódico en 350 ml de agua destilada. La concentración final de NaCl y de sodio son barbitona 1.02m y 13 mm respectivamente.
- Prepare una solución de 2 por disolución de 1.44gm barbitona en 125 ml de agua destilada caliente. La concentración final de barbitona es 62,5 mm.
- Prepare una solución de 3 por disolución 20.33gm de MgCl 2 y 4.41gm de CaCl2 en 100 ml de agua destilada. La concentración final de MgCl2 y CaCl2 es 2,18 m y 440 mm respectivamente.
- Mezclar las soluciones 1 y 2 y enfriar a temperatura ambiente.
- Una vez que la solución combinada se ha enfriado, agregue 1.25ml de la solución 3 y ajustar el pH a 7,3-7,5 con HCl 1M.
- Ajustar el volumen final de 500 ml con agua destilada para preparar una solución de 5x.
- Para preparar una solución de trabajo 1x, diluir la 1:05 madre con agua destilada.
Sensibilización de los glóbulos rojos de oveja con hemolisina
- Prepare la hemolisina por un lado se diluye 1:50 con VBS
- A 4 ml de SRBC añadir 6 ml de VBS y mezcle suavemente por inversión
- Centrifugar a 600 g x 5 minutos
- Descartar el sobrenadante y lavar las células otro 2 veces
- Después del último lavado, centrifugación de las células en 900g x 5 minutos para empacar las células
- Eliminar el sobrenadante y resuspender las células en cantidad suficiente VBS para preparar una solución al 10% es decir, 0,5 ml de concentrado de hematíes se resuspenden en 5 ml de solución tampón
- Gota a gota, añadir un volumen igual de hemolisina (conejo anti-oveja de anticuerpos de glóbulos rojos) a las células mientras agita continuamente
- Se incuba a 30 ° C durante 30 minutos en un baño de agua
- Mezclar suavemente las células cada 15 minutos
- Sensibilizados SRBC se pueden almacenar durante la noche a 4 ° C
CH 50 ensayo
- Etiqueta de una serie de tubos por duplicado, con 1:08, 1:16, 1:32, 1:64 y 1:128.
- Prepare una serie de diluciones dobles de serie de control y suero problema en VBS cada una por duplicado
- Comenzará a las 01:04 (100 ml de suero + 300 ml de VBS) y la transferencia de 200 ml de muestra en el tubo con la etiqueta siguiente.
- Mezclar bien las diluciones entre 200 ml y la transferencia a la siguiente dilución con una punta de pipeta.
- Repita hasta que los cinco diluciones.
- Deseche 200ml de la final de 1:128 de dilución.
- Añadir 200 ml de suspensión SRBC sensibilizados a todos los tubos.
- Etiqueta de dos tubos separados como en blanco y añadir 200 ml de SRBC sensibilizados VBS + 200ml. Estos tubos se medirá lisis espontánea del SRBC en el VBS.
- Etiqueta de otros dos tubos separados como lisis total y añadir 200 ml de SRBC sensibilizados + 200 ml de agua destilada.
- Mezclar con cuidado todos los tubos.
- Se incuba a 37 ° C durante 30 minutos en un baño de agua de mezcla después de 15 minutos.
- Centrifugar las muestras a 1500 g durante 5 minutos para sedimentar los glóbulos rojos.
- Transferencia de 100 ml de sobrenadante de cada tubo de un pozo en una placa de fondo plano de 96 pocillos.
- Añadir 100 ml de agua destilada a cada pocillo.
- Leer la absorbancia de las muestras a 540 nm utilizando un espectrofotómetro de placas.
Cálculos
- Calcular la absorbancia media para cada muestra
- Restar la absorbancia del blanco (lisis espontánea) de todas las muestras
- Calcular el% de lisis de cada dilución utilizando la siguiente fórmula:

- Trazar el porcentaje de lisis (eje vertical) frente a la dilución del suero en el eje horizontal.
- Calcular la dilución requerida para el 50% de hemólisis para el control y la prueba de suero (Fig. 2).
Los resultados representativos:
El video incluye un ejemplo de resultados representativos. En la práctica, un suero de control también se ejecuta en el momento mismo que el suero problema y se trata de la misma manera. A continuación (Tabla 1) se muestra de datos de una muestra de suero analizadas. Los datos se manipulan de acuerdo con la ecuación presentada en 5.3.
| Muestra | OD 540 | Media | ||
| En blanco | 0,042, 0,044 | 0.043 | ||
| Lisis total | 0.183, 0.183 | 0.183 | ||
| Dilución | OD 540 | Media | Significa-en blanco | % De lisis |
| 01:08 | 0.200, 0.219 | 0.210 | 0.168 | 116 |
| 01:16 | 0,179, 0,173 | 0.176 | 0.134 | 93 |
| 01:32 | 0.134, 0.110 | 0.122 | 0.08 | 55 |
| 1:64 | 0.053, 0.066 | 0.059 | 0.017 | 12 |
| 1:128 | 0,044, 0,045 | 0.045 | 0.003 | 2 |
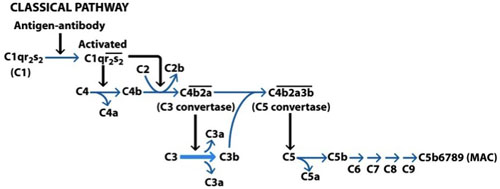
Figura 1. La activación de la vía clásica del complemento. La vía clásica se activa por la unión de inmunoglobulina M (IgM) o inmunoglobulina G (IgG) en la superficie de una célula diana. La porción Fc del Ab se une a C1q, C1r se activa y esta a su vez activa otra molécula de C1r que en conjunto activar dos moléculas de C1s. C1s ahora se unirá C4 que expone el sitio de unión de C2 que también se escinde. La unión de C4b y C2a conduce a la formación de un complejo conocido como una C3 convertasa. Este complejo se unirá ahora la formación de C3 C3a y C3b, algunos de los cuales se combinan con la C3 convertasa C5 convertasa formar una. Este complejo, actúa hoy en el C5, con la que resulta vinculante para C5b C6 iniciar la formación del complejo de ataque a la membrana (MAC). C5b6 actúa en C7, que a su vez actúan en C8 y C9 en última instancia resulta en la formación de la final de MAC. (Goldsby et al, 2003).
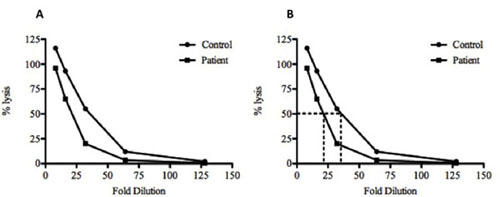
Figura 2. Imprimir los registros de la muestra y el cálculo de la CH50 para un control y muestra de suero. (A), el porcentaje calculado (%) lisis de que tanto el control (•) y test () muestras de suero se trazan contra el factor de dilución. (B) Para el cálculo de la lisis del 50%, se dibuja una línea desde el valor del porcentaje del 50% hasta que se cruza con la línea gráfica y una línea vertical que se dibuja hacia abajo a la dilución. En este ejemplo, una dilución de 35 veces del control y la dilución de 21,6 veces del suero problema se requieren para alcanzar el 50% de lisis. Estos datos indican que hay menos complemento presente en el suero de prueba en comparación con el control, ya que requiere una menor dilución antes de los 50% de lisis se alcanzó. La muestra de control también muestra> 100% de lisis en la dilución 1:08. Esto es más probable debido a la lisis incompleta de los SRBC por el agua destilada y más eficiente la lisis por los componentes del complemento.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
El CH 50 ensayo está sujeto a muchas interferencias. Algunos SRBC son más frágiles que otros, resultando en hemólisis espontánea que no está relacionada con la actividad del complemento. La afinidad de los anticuerpos de conejo varía de un lote a otro y de un fabricante a otro, lo que afecta a la cantidad de anticuerpo que se une a los SRBC. Además, el proceso de sensibilización de SRBC con resultados de anticuerpos en las células con diferentes cantidades de anticuerpos del recubrimiento SRBC. Recogida de muestras y el almacenamiento son una importante fuente potencial de error. Componentes del complemento C1q, por ejemplo, C3, C4 y C5 son muy lábiles, manejo de la muestra adecuada es fundamental. La exposición prolongada al calor disminuye la actividad del complemento y se producen fragmentos inactivos de los componentes del complemento. Para detectar todas las fuentes de error posible, es fundamental para poner a prueba un suero control con un conocido CH 50 valor cada vez que se realiza el ensayo y para reproducir el valor aceptado del suero de control conocidos. Una forma de determinar si existen diferencias entre los diferentes lotes de SRBC y hemolisina es poner a prueba los nuevos materiales de prueba contra un estándar de la muestra de suero en varias ocasiones y luego determinar si hay algún cambio en el nivel basal de hemólisis o en el valor de CH 50 para el suero de control.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
El autor desea agradecer a la Srta. Lora Matthews para la realización de la técnica y el Sr. Pablo Pastor de la cinematografía. Este proyecto fue financiado por la Universidad de Australia del Sur, el programa de Medicina de Laboratorio.
Materials
| Name | Company | Catalog Number | Comments |
| Sheep red blood cells | CSL | 2490201 | Use at 1% final |
| Serum | Human serum | ||
| Rabbit Anti-Sheep Haemolytic serum (RBCs), Unconjugated | AbD Serotec | C12HSB | |
| 96 well flat bottom plate | Sarstedt Ltd | 83.1839 | |
| Veronal buffered saline | Use at 1x final | ||
| Waterbath | |||
| Plate reader | |||
| 37°C room/incubator |
References
- Goldsby, R. A., Kindt, T. J., Osborne, B. A., Kuby, J. Immunology. , W.H. Freeman. (2003).




