Summary
古典経路は、抗体によって活性化し、標的細胞の溶解で最高潮に達しますれる。 CH
Abstract
補体系は、細胞溶解をターゲットにつながる活性化とopsonisationを通して食作用を促進するタンパク質のグループです。個々の補体成分は、しかし、これは経路の活性などの情報を提供しない定量することができる。 CH
Protocol
5倍のベロナール緩衝生理食塩水の調製(VBS)
- ベロナール緩衝生理食塩水(VBS)を準備するには、3つの別々のソリューションが用意する必要があります。
- 蒸留水の350ミリリットルでナトリウムBarbitoneのNaClおよび0.94gmの21.25gmを溶解して溶液1を準備します。 NaClおよびナトリウムBarbitoneの最終濃度は、それぞれ1.02Mと13mmです。
- 熱い蒸留水の125ミリリットルでBarbitoneの1.44gmを溶解して溶液2を準備します。 Barbitoneの最終濃度が62.5mMである。
- 蒸留水の100mlにCaCl 2のMgCl 2と4.41gmの20.33gmを溶解して溶液3を準備。 MgCl 2とCaCl 2の最終濃度は2.18M、それぞれ440mMである。
- ミックスのソリューション1と2と室温まで冷却。
- 組み合わせた溶液を冷却した後、溶液3の1.25ミリリットルを追加し、1M HClを用いて7.3から7.5にpHを調整する。
- 5倍のストック溶液を調製するために蒸留水で500ミリリットルに、最終的な音量を調整します。
- 1Xワーキング溶液を調製するために、蒸留水で株式1:5に希釈する。
溶血素とヒツジ赤血球の感作性
- まず、VBSで1:50希釈して溶血を準備
- VBSのSRBCを追加6ミリリットルの4ミリリットルに、穏やかに転倒混和
- 600グラムX 5分間遠心
- 上清を捨て、細胞をさらに2回洗浄
- 最終洗浄後、細胞をパックに900グラムのx 5分で細胞を遠心分離
- 上清を破棄して、パックされた細胞の10%溶液、すなわち0.5ミリリットルを準備するのに十分なVBSで細胞を再懸は、緩衝液5 mlに再懸濁し、
- 継続的に渦巻くながら、細胞への溶血素の等量(ウサギ抗ヒツジ赤血球抗体)を追加滴下
- 水浴で30分間30℃でインキュベートする
- 静かに細胞ごとに15分を混ぜて
- Sensitised SRBCは4℃で一晩保存することができます
CH 50アッセイ
- 午前1時08分、1:16、1:32、1:64と1:128との重複の管の一連のラベルを付けます。
- 重複してVBSで制御し、試験血清の2倍連続希釈それぞれのシリーズを準備
- 1:4(100ミリリットル血清+ 300ミリリットルVBS)で起動し、次のラベル付きチューブにサンプルの200ミリリットルを転送する。
- 新鮮なピペットの先端で、次の希釈に希釈し、移転の200ミリリットルの間で充分に混合する。
- すべての5つの希釈が行われるまで繰り返します。
- 最後の1:128希釈から200ミリリットルを捨てる。
- すべてのチューブに懸濁感SRBCの200ミリリットルを追加。
- ラベルつの異なるチューブは、BLANKと感作SRBC + 200ミリリットルVBSの200ミリリットルを追加します。これらのチューブは、VBSでSRBCの自発的な溶解を測定します。
- 総溶解などの別の2つの別々のチューブにラベルを付け、感作SRBC + 200ミリリットルの蒸留水200ミリリットルを追加します。
- 静かにすべてのチューブを混ぜる。
- 37℃、15分後に混合水浴で30分間インキュベートします。
- 堆積物に5分間赤血球、1,500 gで、サンプルを遠心分離します。
- 96ウェル平底プレートにウェルに各チューブから上清の100ミリリットルを転送する。
- 各ウェルに蒸留水の100ミリリットルを追加。
- プレート分光光度計を用いて540nmでサンプルの吸光度を読み取る。
計算
- 各サンプルについての平均吸光度を計算する
- すべてのサンプルからブランク吸光度(自発的な溶解を)引く
- 次の式を使用して、各希釈用%の溶解を計算します。

- 横軸上に血清希釈に対する割合の溶解(縦軸)をプロットする。
- 制御および試験血清の50%の溶血(図2)に必要な希釈を計算します。
代表的な結果:
ビデオでは、代表的な結果の例が含まれています。実際には、コントロール血清はまた、テストの血清と同時に実行され、同じ方法で扱われます。以下の(表1)テストされた血清サンプルからサンプルデータです。データは5.3で示した方程式にしたがって操作されます。
| サンプル | OD 540 | 意味 | ||
| 空 | 0.042、0.044 | 0.043 | ||
| 総溶解 | 0.183、0.183 | 0.183 | ||
| 希釈 | OD 540 | 意味 | 平均ブランク | %の溶解 |
| 午前1時08分 | 0.200、0.219 | 0.210 | 0.168 | 116 |
| 1時16分 | 0.179、0.173 | 0.176 | 0.134 | 93 |
| 1時32分 | 0.134、0.110 | 0.122 | 0.08 | 55 |
| 1:64 | 0.053、0.066 | 0.059 | 0.017 | 12 |
| 1:128 | 0.044、0.045 | 0.045 | 0.003 | 2 |
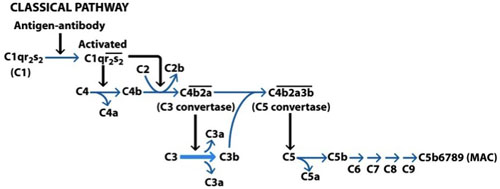
図1。古典的補体経路の活性化。古典経路は、標的細胞の表面に結合免疫グロブリンM(IgM抗体)または免疫グロブリンG(IgG)をによって活性化される。抗体のFc部分がC1qに結合し、C1Rが活性化し、これは順番に一緒にC1sの2つの分子を活性化するC1Rの別の分子を活性化される。 C1sのは、今も切断されるC2の結合部位を公開してC4を切断する。 C4BとC2Aの結合は、C3転換と呼ばれる複合体の形成を導く。この複合体は今C3成形C3aとC3bを切断、C5の転換を形成するC3転換と組み合わせるそのうちのいくつか。この複合体は、現在の膜攻撃複合体(MAC)の形成を開始するC6への結合の結果C5bと、C5に作用する。で、最終的なMACの形成をもたらすC9で、最終的にはC8に行為をオンにしてC7でC5b6行為、。 (Goldsby ら 、2003)。
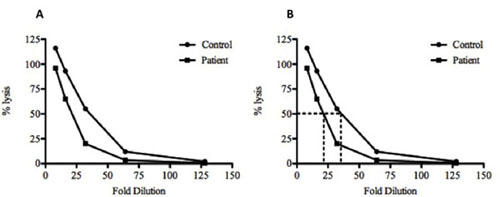
図2。サンプルデータをプロットし、制御と試験血清サンプルのCH50を計算する。()、計算された割合(%)対照(•)と試験(両方の溶解は)血清サンプルを希釈率に対してプロットされています。それはグラフの線と交差して、縦線が希薄にダウン描画されるまで、(B)50%の溶解を計算するには、ラインは50%のパーセント値から描画されます。この例では、制御および試験血清の21.6倍に希釈、35倍希釈、50%の溶解を達成するために必要である。このデータは、50%の溶解に到達される前に以下の希釈、必要に応じて、コントロールに比べてテストの血清中に存在する以下の補数があることを示します。対照サンプルには、1:8の希釈で> 100%の溶解を示しています。これは、多くの場合、補体成分を蒸留水とより効率的な溶解によりSRBCの不完全な溶解によるものです。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
CH 50アッセイは、多くの干渉の対象となります。いくつかのSRBCでの活動を補完する関係がない自発的な溶血の結果、他のものより壊れやすいものです。ウサギの抗体の親和性はロットし、1つのメーカーによって異なりますが、これはSRBCに結合する抗体の量に影響を与えます。また、抗体のコーティングの異なる量のSRBCによる細胞内で抗体の結果とSRBC感作のプロセス。検体採取と保管は、エラーの重要な潜在的なソースです。補体成分などC1q、C3、C4とC5は非常に不安定であるため、適切なサンプルの処理が非常に重要です。熱に長時間さらされるには、補体活性を減少し、補体成分の不活性なフラグメントを生成します。可能な限りエラーの多くの源として検出するために、それは知られているCH 50値で検定が行われ、既知の血清対照の使用可能な値を再現するたびに、コントロール血清をテストすることが重要です。 SRBCと溶血の異なるバッチ間の違いがあるかどうかを判断する一つの方法は、血清中に数回の標準サンプルに対して新しいテストの材料をテストし、溶血の基礎レベルでまたはCH 50値の変更があるかどうかを判断することです。コントロール血清のため。
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
著者は、映画撮影のためのテクニックと氏ポールシェパードを実行するためのミスローラマシューズに感謝したいと思います。このプロジェクトは、南オーストラリア大学、研究室医学のプログラムによって資金を供給された。
Materials
| Name | Company | Catalog Number | Comments |
| Sheep red blood cells | CSL | 2490201 | Use at 1% final |
| Serum | Human serum | ||
| Rabbit Anti-Sheep Haemolytic serum (RBCs), Unconjugated | AbD Serotec | C12HSB | |
| 96 well flat bottom plate | Sarstedt Ltd | 83.1839 | |
| Veronal buffered saline | Use at 1x final | ||
| Waterbath | |||
| Plate reader | |||
| 37°C room/incubator |
References
- Goldsby, R. A., Kindt, T. J., Osborne, B. A., Kuby, J. Immunology. , W.H. Freeman. (2003).




