13.7: La vitesse de réaction dépend de la température
La théorie des collisions
Les atomes, les molécules ou les ions doivent entrer en collision avant de pouvoir réagir les uns avec les autres. Les atomes doivent être proches les uns des autres pour former des liaisons chimique. Cette prémisse est à la base d'une théorie qui explique de nombreuses observations concernant la cinétique chimique, y compris les facteurs influençant les vitesses de réaction.
La théorie des collisions est basée sur les postulats que (i) la vitesse de réaction est proportionnelle à la vitesse des collisions des réactifs, (ii) les espèces qui réagissent entrent en collision selon une orientation permettant le contact entre les atomes qui deviennent liés ensemble dans le produit, et (iii) la collision se produit avec une énergie suffisante pour permettre la pénétration mutuelle des couches de valence des espèces qui réagissent, de sorte que les électrons puissent se réorganiser et former de nouvelles liaisons (et de nouvelles espèces chimiques).
Par exemple, dans une réaction en phase gazeuse entre le monoxyde de carbone et l'oxygène, qui se produit à haute température et pression, la première étape est une collision entre les deux molécules.
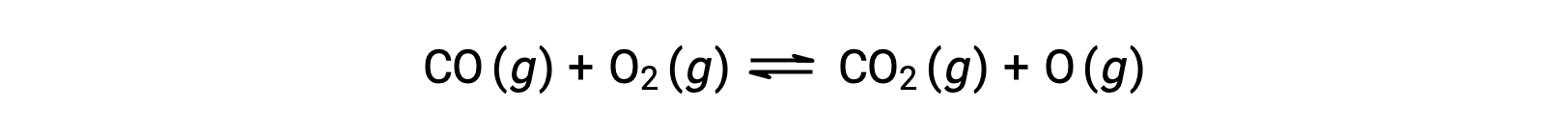
Cependant, il pourrait y avoir de nombreuses orientations relatives différentes dans lesquelles les deux molécules entrent en collision. Par conséquent, l'orientation des molécules qui entrent en collision a une grande importance dans la détermination partielle de la faisabilité d'une réaction se produisant entre elles.
Dans un cas, le côté de l'oxygène dans la molécule de monoxyde de carbone peut entrer en collision avec la molécule d'oxygène. Dans un autre cas, le côté du carbone dans la molécule de monoxyde de carbone peut entrer en collision avec la molécule d'oxygène. Le deuxième cas est plus susceptible de conduire à la formation de dioxyde de carbone, avec un atome de carbone central lié à deux atomes d'oxygène (O = C = O).
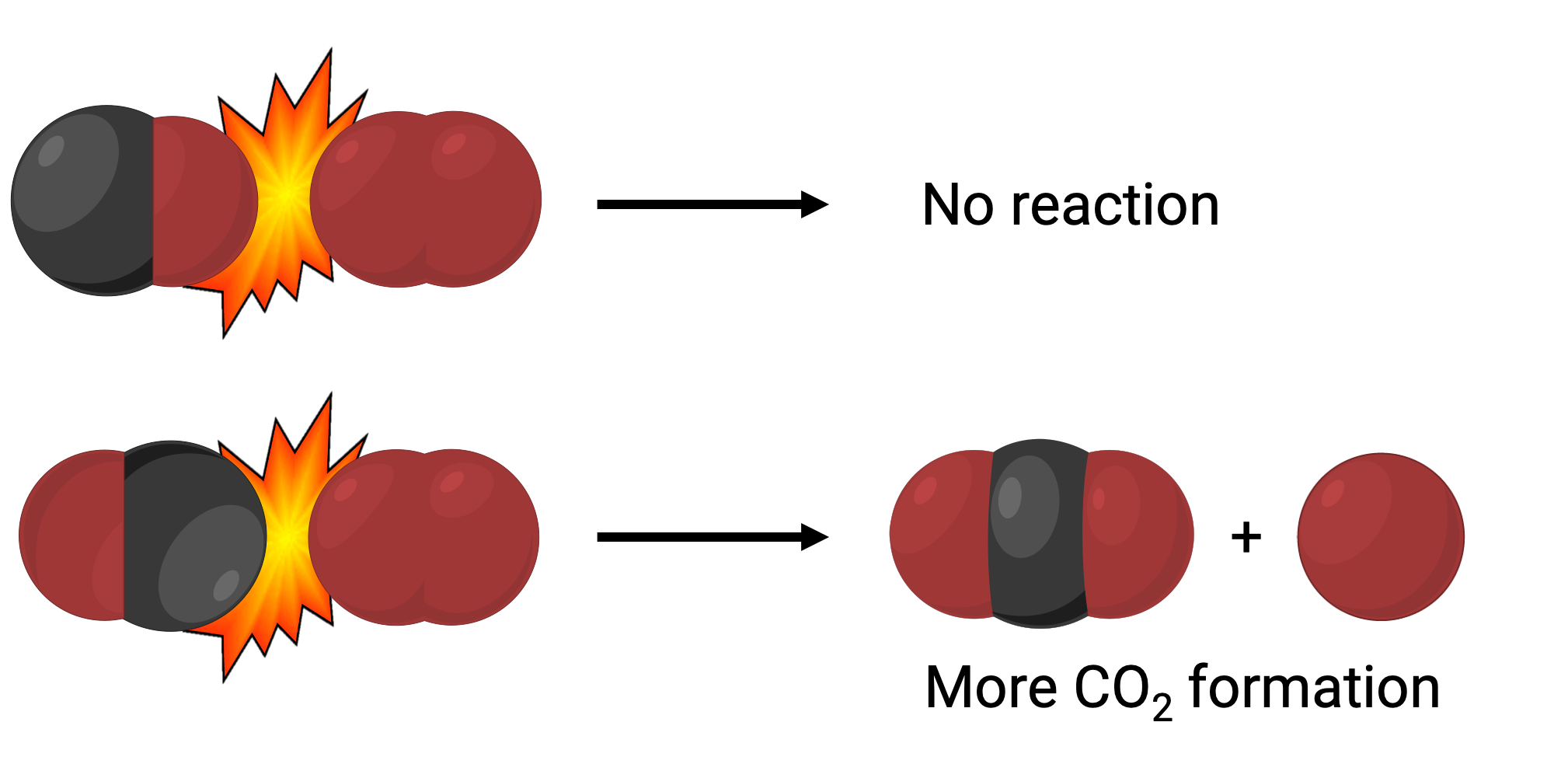
Pourtant, même si le choc a lieu dans la bonne orientation, la garantie que la réaction se fera pour former du dioxyde de carbone est limitée. En effet, en plus de l'orientation appropriée, le choc doit également se produire avec une énergie suffisante, appelée l'énergie d'activation, pour entraîner la formation du produit. Lorsque les espèces qui réagissent entrent en collision en ayant la bonne orientation et une énergie d'activation suffisante, elles se combinent pour former une espèce instable appelée complexe activé ou état de transition. Ces espèces sont de courte durée et habituellement indétectables par la plupart des instruments d'analyse. Dans certains cas, des mesures spectrales sophistiquées peuvent permettre d'observer les états de transition.
La théorie des collisions explique pourquoi la plupart des vitesses de réaction augmentent à mesure que la température augmente ; avec une élévation de la température, la fréquence des chocs augmente. Plus de collisions signifie une vitesse de réaction plus rapide, en supposant que l'énergie des collisions est adéquate.
Énergie d'activation
L'énergie minimale nécessaire pour former un produit pendant lors d'une collision entre les réactifs est appelée énergie d'activation (Ea). La différence entre l'énergie d'activation requise et l'énergie cinétique fournie par les molécules de la réaction qui entrent en collision est un facteur primordial influençant la vitesse d'une réaction chimique. Si l'énergie d'activation est beaucoup plus grande que l'énergie cinétique moyenne des molécules, la réaction se produira lentement, puisque seulement quelques molécules se déplaçant rapidement auront assez d'énergie pour réagir. Si l'énergie d'activation est beaucoup plus petite que l'énergie cinétique moyenne des molécules, une grande fraction de molécules sera suffisamment énergétique et la réaction se fera rapidement.
Les profils de réaction ont largement utilisés en cinétique chimique pour illustrer les diverses propriétés d'une réaction d'intérêt. Il montre comment l'énergie d'un système chimique change lorsqu'il subit une réaction, convertissant les réactifs en produits.
Par exemple, examinez le profil de réaction suivant pour une réaction exothermique : A + B → C + D;
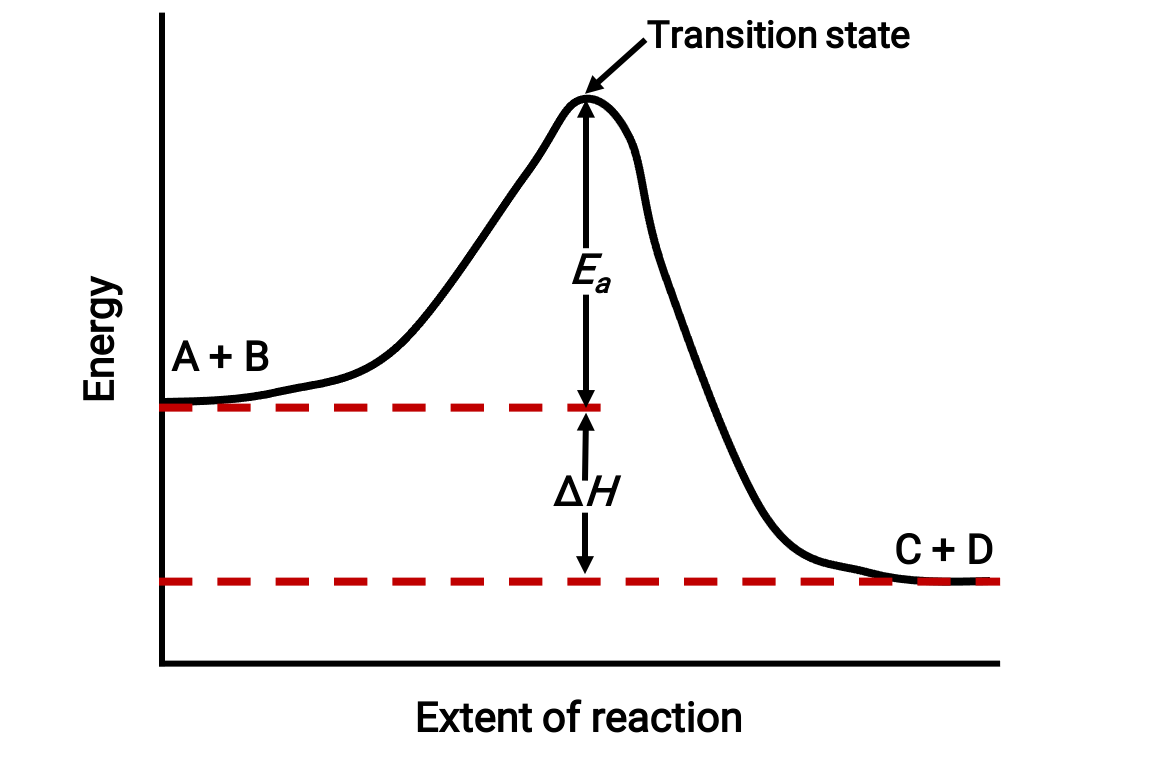
On regarde le profil de gauche à droite. Initialement, le système comprend uniquement des réactifs (A + B). Une fois que les molécules de la réaction ayant une énergie suffisante entrent en collision, elles forment un complexe activé ou un état de transition de haute énergie. L'état de transition instable se dégrade ensuite pour produire des produits stables (C + D).
Le profil représente l'énergie d'activation de la réaction, Ea, comme la différence d'énergie entre les réactifs et l'état de transition. La différence d'énergie entre les réactifs et les produits correspond à la variation d'enthalpie de la réaction (ΔH). Dans ce cas, la réaction est exothermique (ΔH < 0), car elle entraîne une diminution de l'enthalpie du système.
Loi d'Arrhénius
La loi d'Arrhénius, k Ae−Ea/RT, relie l'énergie d'activation et la constante de vitesse, k, pour de nombreuses réactions chimiques.
Dans cette équation, R est la constante du gaz parfait, dont la valeur est de 8,314 J/mol#183;K, T est la température en Kelvin, Ea est l'énergie d'activation en joules par mole, e est la constante de 2,7183 et A est une constante appelée le facteur de fréquence, qui est lié à la fréquence des chocs et à l'orientation des molécules qui réagissent. L'équation d'Arrhénius s'adapte bien aux postulats de la théorie des collisions. Le facteur de fréquence, A, reflète dans quelle mesure les conditions de réaction favorisent les collisions correctement orientées entre les molécules qui réagissent. Une probabilité accrue de collisions orientées efficacement entraîne des valeurs plus élevées pour A et des vitesses de réaction plus rapides.
Le terme exponentiel e−Ea/RT décrit l'effet de l'énergie d'activation sur la vitesse de réaction. D'après la théorie cinétique des gaz, la température de la matière est une mesure de l'énergie cinétique moyenne de ses atomes ou molécules constitutifs — une énergie d'activation plus faible entraîne une fraction plus importante de molécules suffisamment énergétiques et une réaction plus rapide.
Le terme exponentiel décrit également l'effet de la température sur la vitesse de réaction. Une température plus élevée représente une fraction proportionnellement plus grande de molécules possédant une énergie suffisante (RT) pour surmonter la barrière d'activation (Ea). Cela donne une valeur plus élevée pour la constante de vitesse et une réaction de vitesse proportionnellement plus rapide.
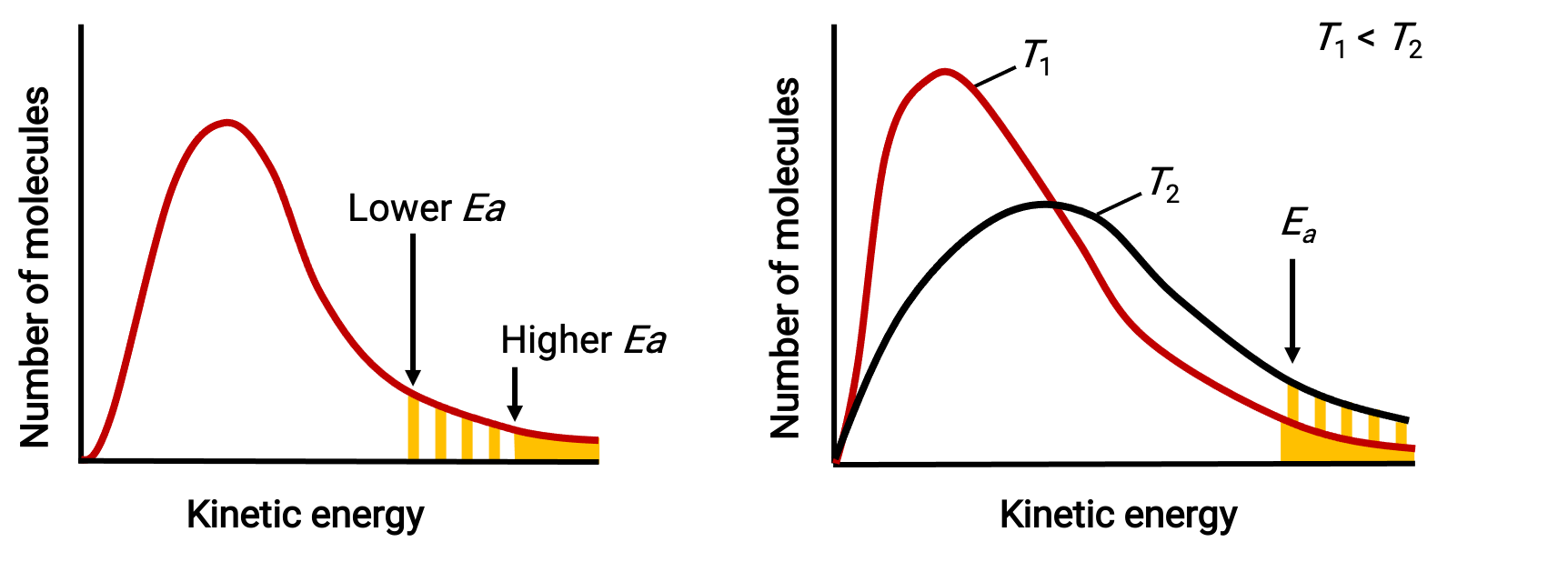
Distributions d'énergie moléculaire montrant des nombres de molécules dont les énergies dépassent deux énergies d'activation différentes à une température donnée, et une énergie d'activation donnée à deux températures différentes.
Ce texte est adapté de Openstax, Chimie 2e, Section 12.5 : Théorie des collisions.


