17.7: Effets de la température sur l'enthalpie libre
La spontanéité d'un processus dépend de la température du système. Les transitions de phase, par exemple, se feront spontanément dans un sens ou dans l'autre, selon la température de la substance en question. De même, certaines réactions chimiques peuvent également présenter des spontanéités dépendant de la température. Pour illustrer ce concept, l'équation reliant la variation d'énergie libre aux variations d'enthalpie et d'entropie pour le processus est envisagée :
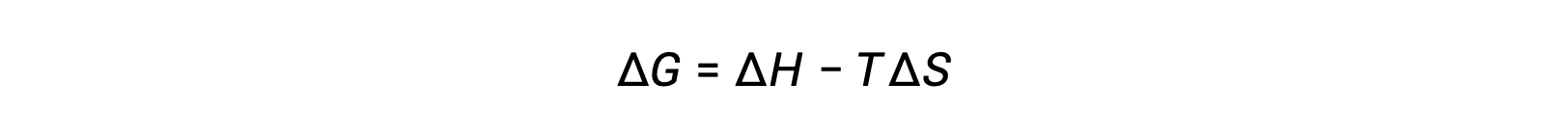
La spontanéité d'un processus, telle qu'elle se reflète dans le signe arithmétique de sa variation d'énergie libre, est alors déterminée par les signes des variations de l'enthalpie et de l'entropie et, dans certains cas, par la température absolue. Étant donné que T est la température absolue (Kelvin), elle ne peut avoir que des valeurs positives. Quatre possibilités existent donc en ce qui concerne les signes des variations d'enthalpie et d'entropie:
- ΔH et ΔS sont tous les deux positifs. Cette condition décrit un processus endothermique qui implique une augmentation de l'entropie du système. Dans ce cas, ΔG sera négatif si la valeur absolue du terme TΔS est supérieure à ΔH. Si le terme TΔS est inférieur à ΔH, la variation d'énergie libre sera positive. Un tel processus est spontané à haute température et non spontané à basse température.
- ΔH et ΔS sont tous les deux négatifs. Cette condition décrit un processus exothermique qui implique une diminution de l'entropie du système. Dans ce cas, ΔG sera négatif si la valeur absolue du terme TΔS est inférieure à ΔH. Si la valeur absolue du terme TΔS est supérieure à ΔH, la variation d'énergie libre sera positive. Un tel processus est spontané à basse température et non spontané à haute température.
- ΔH est positif et ΔS est négatif. Cette condition décrit un processus endothermique qui implique une diminution de l'entropie du système. Dans ce cas, ΔG sera positif quelle que soit la température. Un tel processus est non spontané à toutes les températures.
- ΔH est négatif et ΔS est positif. Cette condition décrit un processus exothermique qui implique une augmentation de l'entropie du système. Dans ce cas, ΔG sera négatif quelle que soit la température. Un tel processus est spontané à toutes les températures.
Ce texte est adapté de Openstax, Chimie 2e, Section 16.4 : Énergie libre.


