Summary
Um protocolo de tratamento de plasma físico frio da elevado-produção de líquidos e células é mostrado. Envolve criação de composições de gás de alimentação diferentes para ignição de plasma, medindo espectros de emissão de plasma e a posterior análise de líquidos e atividade celular após o tratamento de plasma.
Abstract
Na medicina de plasma, gases ionizados com temperaturas próximas dos vertebrados sistemas são aplicados às células e tecidos. TVs de plasma frios geram espécies reativas conhecido por redox regulam processos biológicos na saúde e na doença. Pré-clínicos e clínica evidência aponta para efeitos benéficos do tratamento de plasma na cicatrização de úlcera crônica da pele. Outros temas emergentes, como o tratamento do câncer de plasma, estão recebendo crescente atenção. Pesquisa médica de plasma requer experiência interdisciplinar em física, química e biomedicina. Um dos objetivos da pesquisa de plasma é caracterizar tratados com plasma de células em uma variedade de aplicações específicas. Isso inclui, por exemplo, contagem de células e viabilidade, oxidação celular, atividade mitocondrial, citotoxidade e modo de morte celular, análise de ciclo celular, celular, expressão marcador de superfície e liberação de citocinas. Este estudo descreve os equipamentos essenciais e fluxos de trabalho necessários para tal investigação em biomedicina de plasma. Descreve o funcionamento de um jato de plasma de argônio pressão atmosférica, monitoramento especificamente seus espectros de emissão básicos e configurações de gás para modular a produção de espécies reactivas de alimentação. Usando uma tabela de alta precisão xyz e software de computador, o jato é colocado em milissegundo precisão sobre as cavidades das placas de 96 poços em micrômetro-precisão para máxima reprodutibilidade. Ensaios a jusante para a análise de líquido de moléculas redox-ativo são mostrados, e nas células-alvo são tratados com plasma. Especificamente, as células de melanoma são analisadas em uma sequência eficiente dos diferentes ensaios consecutivos, mas usando as mesmas células: medição da atividade metabólica, área total de celular e marcador de superfície expressão de calreticulin, uma molécula importante para o morte de imunogênicas celular das células cancerosas. Estes ensaios recuperar conteúdo rico informações biológicas sobre os efeitos do plasma de um único prato. No total, este estudo descreve os passos essenciais e protocolos de pesquisa médica de plasma.
Introduction
Espécies reativas são redox importantes reguladores na doença, incluindo anormal ferida cura1 e câncer. 2 importante, estas espécies estão envolvidas na patologia, bem como sua resolução terapêutica. 3 , 4 frio física plasma é um gás ionizado que expele espécies reactivas de muitos tipos. 5 desde o advento da chamada plasma frio que operam na temperatura de corpo6, TVs de plasma frios podem ser aplicados às células e tecidos sem dano térmico. Demonstrando a eficácia e aplicação segura de dispositivos de plasma nas observações pré-clínicos e clínicos, três receberam acreditação como dispositivos médicos na Alemanha. 7 especialmente em matéria de segurança genotóxicos, vários estudos têm mostrado a ausência de eventos mutagênicos, usando o primeiro dispositivo, um jato de plasma de argônio de pressão atmosférica. 8 , 9 , 10 os outros dois dispositivos são as descargas de dita barreira dielétrica (DBD), que operam através de um princípio diferente do que o jato de plasma. Especificamente, jatos permitem bisturi, como tratamento de superfícies e cavidades Considerando que plasmas de DBD são eficientes no tratamento de áreas de tecido maior mas bastante plana. Explorando celular redox sinalização11, o objetivo da técnica é utilizar plasma gerado espécies reactivas para aplicações biomédicas. 12 um aplicativo especialmente promissor de terapia clínica do plasma é o apoio da cicatrização de feridas. 13 , 14 , 15 além disso, o plasma foi mostrado para ter efeitos anticancerígenos em modelos animais. 16 , 17 , 18
Antes de validar a eficácia e segurança de aplicações de plasma em modelos animais, ou mesmo os seres humanos, padronizado em vitro pesquisa precisa ser feita com dispositivos de plasma. Estas experiências são essenciais para explorar aplicações de plasma e para delinear os mecanismos de trabalho. Além disso, é necessária investigação básica para compreender o impacto da composição de espécies reactivas e subsequentes efeitos biológicos. Este estudo demonstra como o plasma pode ser integrado em investigação biomédica para melhor compreender e controlar seus efeitos sobre as células. Descreve o ajuste da composição do gás de alimentação, acompanhamento da produção de espécies reactivas, aplicações de plasma para líquidos, células, tecidos e os resultados resultantes de químicos e biológicos. Além disso, os exemplos são fornecidos que instruir sobre a padronização do tratamento de plasma e ensaios biológicos a jusante, com uma ênfase na pesquisa médica do plasma em placas de 96 poços. Esta abordagem tem vantagens distintas: eu) minimização do número de células necessárias por condição, reagente de custos e tempo de hands-on, por exemplo; II) subsídio de maior precisão dos resultados como duplicados ou triplicados tratamentos podem ser configurados com facilidade; e iii) facilitação da análise a jusante sem emenda no leitor de placas de 96 poços formato, imagem e experimentos de citometria de fluxo.
Protocol
1. plasma espécie monitoramento e instalação de tratamento
-
Espécie de plasma monitoramento
- Use um jato de plasma a pressão atmosférica e um máximo de dois litros padrão por minuto de fluxo de gás de alimentação.
- Perpendicular ao eixo de pluma, posicionar o jato na frente de um Espectrofotômetro de emissão ótica e Fotoemissão registro e usando o comprimento de onda (200-1.000 nm) dedicaram a software.
- Misturar 0,5% de nitrogênio ou oxigênio umidificado ou seco (5%) gás de alimentação.
- Repita a espectroscopia óptica de emissão para cada condição de gás.
- Analise com o software adequado para visualização gráfica de dados.
-
Instalação de tratamento de plasma
- Corrigi o jato para uma tabela-xyz controlado por computador.
- Identificar a posição dos poços e gerar um script de computador para mover o jato juntou-se à mesa, com os tempos de tratamento adequado, acima do centro de cada poço.
- Adicionar 104 de qualquer tipo de células de mamíferos aderentes em 100 µ l de meio de cultura celular completa (RPMI1640 com FCS de 10%, 2% de glutamina e 1% penicilina/estreptomicina) em vários poços sob uma capa de fluxo laminar.
- Permita a adesão celular ocorra durante a noite a 37 ° C numa atmosfera com dióxido de carbono 5% umidificada.
- Tratar as células com plasma por 20 s em alturas diferentes (eixo z) em intervalos de 250 µm.
- Adicione 25 µ l de iodeto de propidium em meio de cultura celular a cada poço.
- Imagem as células sob o microscópio para determinar a altura específica que não induz necrose celular devido a alimentação de gás empurrando o meio de cultura em cima das células à parte.
Nota: Para tempos mais longos de tratamento, identificar a evaporação líquida, a esta altura específica, no plasma e desligar o modo, pelo prato de pesagem antes e após o tratamento de plasma para identificar a quantidade de microlitros de doubledistilled de água necessário para restabelecer homeostase osmótica nas áreas tratadas. - Preparar um protocolo final para a xyz-tabela com tempos do respectivo tratamento (aqui: 20 s, 40 s, 60 plasma s e controle de gás 60 s) e bem as posições, e ter prontas pipetas multicanais e reservatórios para manipulação de líquidos das placas de 96 poços em ensaios subsequentes.
2. análise dos principais componentes reactivos em líquidos tratados com Plasma
-
Análise de tratados com Plasma de peróxido de hidrogênio
- Trate 100 µ l de tampão fosfato salino (PBS) com plasma em triplicado em placas de 96 poços de fundo plano.
- Preparar uma mistura de mestre carregando 100 µ l de PBS com 10 U de peroxidase de rábano e 5 µM de reagente de detecção de peróxido de hidrogênio (suficiente para um bom; scale-up em conformidade).
- Adicione 95 µ l do mix de mestre para cada poço.
Nota: O passo anterior deve ser realizado sob uma bancada limpa ou em um quarto separado da fonte de plasma como o ozônio do ar ambiente pode diminuir a sensibilidade do ensaio. - Em uma placa separada, prepare uma série de dupla diluição de peróxido de hidrogênio em PBS com uma concentração superior de 100 µM em 100 µ l de PBS.
- Adicione 5 µ l de amostras ou padrões de peróxido de hidrogênio a cavidades contendo o reagente de detecção.
- Incluem poços contendo o reagente de detecção somente para subtração de fundo após a leitura.
- Incube a placa no escuro durante 15 minutos à temperatura ambiente.
- Coloque a placa no leitor de microplacas medir fluorescência λex 535 nm e λem 590 nm.
Nota: Se a elevadas concentrações de peróxido são esperadas nas amostras, a diluição de amostra precisa ser aumentado ou leituras precisam ser feitas com tempos de incubação mais curtos para evitar a saturação do ensaio. - Subtrair valores em branco de todas as amostras, calcular a curva padrão de peróxido e quantificar as concentrações de peróxido de amostra desconhecida que a curva de base.
-
Análise de nitrito tratados com Plasma
- Trate 100 µ l de PBS com plasma em triplicado em placas de 96well flatbottom.
- Preparar uma mistura de mestre de solução de deteção de nitrito, adicionando 1 µ l de reagente de quantificação para 99 µ l de doubledistilled água (suficiente para um bom; scale-up em conformidade).
- Adicione 100 µ l por alvéolo para um prato de 96well claro, flatbottom. Aumenta conforme necessário para o número de poços.
- Prepare uma série de diluição dos padrões de nitrito na água doubledistilled.
- Adicione 10 µ l de normas ou amostras à mistura mestre em placas de 96well.
- Incube a placa no escuro por 10 min à temperatura ambiente.
- Adicione 5 µ l de solução de desenvolvedor de quantificação de nitrito para cada poço.
- Lê a fluorescência em um leitor de microplacas a λex 365 nm e λem 450 nm.
- Subtrair valores em branco de todas as amostras, calcular a curva padrão de nitrito e quantificar as concentrações de nitrito de amostra desconhecida de curva de base.
-
Análise de superóxido tratados com Plasma
- Faça uma mistura de mestre de citocromo oxidado (1 mg/mL) e catalase (20 µ g/mL) em PBS.
- Adicione 100 µ l de mistura de mestre aos poços de uma placa de 96 poços claro, de fundo plano.
- Trate a mestre mistura com plasma em triplicado por condição de tratamento.
- Ler a absorvância a 550 nm, utilizando um leitor de microplacas; dados do gráfico.
- Calcule a quantidade de superóxido gerado usando o coeficiente de extinção molar do citocromo C e o comprimento do feixe luminoso de líquido dentro de um poço.
3. a resposta biológica das células expostas ao Plasma
-
Leitura multidimensional das células de Plasma-tratados: atividade metabólica
- Use uma capa de fluxo laminar para todos os procedimentos a seguir.
- Semente 104 células (B16 melanoma murino) em 100 µ l totalmente completada o meio de cultura celular por bem em placas de 96 poços de fundo plano.
- Permita a adesão celular durante a noite a 37 ° C no ambiente umidificado da incubadora com 5% de dióxido de carbono.
- Usando a tabela de xyz, tratar de poços com plasma ou gás de acordo com um esquema predefinido e adicionar as células de volta para a incubadora para 20 h.
Nota: Se desejar, tire sobrenadantes após 20 h para analisar produtos extracelulares; Adicione 100 µ l de meio fresco depois. - Para cada poço, adicione 25 µ l de meio de cultura celular contendo 500 µM resazurina (concentração final 100 µM); Prepare três poços contendo resazurina sozinha no meio de cultura celular sem células para subtração de fundo.
- Incube durante 3 h na incubadora.
- Leia fluorescência λex 535 nm e λem 590 nm em um leitor de microplacas.
- Subtrair a fluorescência de fundo de todas as amostras e normalizar dados para valores de controle.
-
Leitura multidimensional das células de Plasma-tratados: análise de imagem
- Utilize a placa bem de 3.1.7 e descartar o sobrenadante.
- Adicione 100 µ l de meio de cultura fresco célula contendo 1 iodeto de propidium µ g/mL.
- Colocar a placa sob um microscópio com um palco motorizado para cada poço de imagem.
Nota: Detalhes de imagem dependem a questão experimental; aqui, um objectivo X 20 foi usado em um dispositivo de imagem de alto teor de ler 3 x 3 campos de visão em cada poço em um canal de campo claro, canal de contraste de fase digital e canal de fluorescência (iodeto de propidium), utilizando a emissão e luz de excitação adequada filtros. - Software de análise de imagem quantitativa de uso para determinar a área total citosólica em imagens de contraste de fase digital de todos os campos de vista fotografada em cada poço.
Nota: Analise parâmetros adicionais, se desejado, por exemplo, o número de células viáveis e/ou mortas ou atividade mitocondrial usando manchas dedicadas. Se usando outras manchas de descritos neste trabalho, certifique-se que as manchas de fluorescência usadas para microscopia não se sobreponham espectralmente com os fluorochromes usados em experimentos de citometria de fluxo subsequente. - Os dados do gráfico e, se desejado, teste para correlação com os valores obtidos para a atividade metabólica.
-
Leitura multidimensional das células de Plasma-tratados: citometria de fluxo
- Para esta análise, utilize a placa bem da etapa 3.2.5.
- Desprezar o sobrenadante e lavar duas vezes com 200 µ l de PBS contendo cálcio e magnésio (0,9 mM e 0,5 mM, respectivamente).
Nota: Corrigir e/ou permeabilize células nesta fase para mais biológicas leituras não abrangidos nesta contribuição, tais como a coloração intracelular análise antígeno ou ciclo celular. - Para cada poço, adicione 50 µ l de PBS com cálcio e magnésio contendo 50 ng/mL os anticorpos monoclonais antirato calreticulin.
- Incube por 15 min na incubadora.
- Lave duas vezes com 200 µ l de totalmente completada com meio de cultura celular e descarte o líquido no prato.
- Adicione 100 µ l de solução de desprendimento de células a cada poço e incubar durante 20 min na incubadora.
- Use um outro conjunto de células de B16 imaculados em suspensão para configurar o protocolo fluxo cytometric aquisição, retenção de estratégia e ganhos e tensões de fotodetectores.
- Carrega a placa em um citômetro de fluxo, equipado com um amostrador automático para placas de 96 poços.
- Adquira um mínimo de 1.000 células na frente e população de dispersão lateral geralmente associado com células viáveis.
- Usar o software dedicado para análise de citometria de fluxo, .fcs arquivos para portão a população de interesse e determinar a intensidade de fluorescência média de calreticulin.
- Dados do gráfico e se desejado, teste para correlação com os valores obtidos para deposição metabólica de atividade, imagem e/ou oxidante.
Representative Results
Neste estudo, um fluxo de trabalho simplificado foi descrito para pesquisas médicas sobre os efeitos do plasma. A abordagem multidisciplinar utilizada aqui analisa o perfil básico de emissão óptica do jato de plasma, os principais componentes reativos no líquido, e as respostas biológicas de células tratadocom com plasma (Figura 1).
Para realizar este fluxo de trabalho, um número de componentes eram necessários para corretamente configurar a fonte de plasma (Figura 2). Os diferentes gases (aqui principalmente argônio, oxigênio e nitrogênio) foram fornecidos para e controlada por vários controladores de fluxo de massa. Um painel central foi usado para ajustar digitalmente os controladores de fluxo de massa para fluxos de gás de alimentação predeterminada. Para produzir composições de gás de alimentação específicos, os gases foram misturados fisicamente utilizando um painel de válvulas que combinadas de gases de vários controladores de fluxo de massa(Figura 2). A fonte de plasma estava ligada, e o efluente de plasma foi criado na frente de um USB-espectrofotômetro (Figura 2B) com um intervalo ótico de 200 nm a 1.000 nm. Para o tratamento de líquidos e células, um fluxo de trabalho eficiente foi descrito usando placas de 96 poços. Pratos multi bem realizaram-se no lugar usando um frame plástico que foi fixado na placa base com inserções coincidem com os orifícios impressos (Figura 2C). A instalação inteira foi colocada sob uma capa de fluxo laminar (Figura 2D). Esta configuração incluído um xyz-tabela para o qual foi montada a peça de mão do jato de plasma. Os elementos de controle do motor podem ser localizados fora do banco, se este último tiver cabo suficientemente grandes portos de e para a tabela de xyz. Importante, a tabela foi controlada por computador e pode ser programada para focalize o centro de cada poço com precisão do micrômetro o jato para a quantidade de tempo desejada. Além disso, a posição inicial (como em nossa instalação, poço A1) foi livremente escolhida(Figura 2). Junto com o suporte da placa plástica, esta permissão para um tratamento de plasma podem ser reproduzidos com quaisquer variações diárias exclusivamente relacionadas com a instalação dos experimentos biológicos e líquidos.
Espectroscopia de emissão óptica (OES) foi usada para acompanhar os picos distintos ligados aos componentes do plasma reativa em condições de alimentação de gás diferentes(Figura 3). Por exemplo, o segundo sistema positivo de nitrogênio, com picos de 330 nm a espécies de nitrogênio reativo 380 nm representado e o pico no 309 nm representado radicais de hidroxila (seta na Figura 3A). Em comparação com o gás argônio sozinho, a presença de espécies de nitrogênio aumentou com uma mistura de nitrogênio para o gás de alimentação, Considerando que a adição de oxigênio ou umidade diminuída ou reduzida, respectivamente. Por outro lado, a presença de radicais hidroxila foi reduzida com oxigênio ou nitrogênio, mas marcadamente aumentada se umidificado argônio foi usado como gás de alimentação. Para o tratamento de plasma de líquidos, determinou-se a evaporação causada pelo gás argônio e plasma de argônio primeiro (Figura 3B). Importante, ambas as condições não deu resultados semelhantes, porque o plasma também exerce efeitos na temperatura. Em consonância com os resultados OES de radicais hidroxila, deposição de peróxido de hidrogênio significativamente diminuiu com adição de oxigênio ou nitrogênio, mas aumentou com gás de alimentação umidificado (Figura 3C). Além disso, a adição de nitrogênio para o gás de alimentação levou a concentrações de nitrito significativamente maiores em comparação com líquidos de tratados com plasma de argônio (Figura 3-D). Este fluxo de trabalho também pode ser empregado para investigar o impacto do plasma em líquidos com composições diferentes. Por exemplo, concentrações de peróxido de hidrogênio pareciam ser independente da presença de soro fetal bezerro em PBS e RPMI1640 meio de cultura celular (Figura 3E). Nas mesmas amostras, a presença de soro diminuiu as concentrações de nitrito em PBS e célula de meio de cultura em comparação com suas contrapartes contendo não-soro (Figura 3-F). A maioria das superóxido foi produzido nas condições de gás argônio seco com misturas de oxigênio e/ou azoto extinguer significativamente a geração de superóxido, exceto o plasma de argônio-oxigênio umidificado (Figura 3G).
Para tratamento de plasma das células em pratos multi bem, a placa contendo células semearam no dia anterior foi retirada da incubadora e adicionada ao suporte de plástico. Aplicou-se um padrão de tratamento programado, evaporação foi compensada e a placa foi colocada para a incubadora para 20 h. nota que após esta incubação, sobrenadantes de cultura celular poderiam ter sido coletadas em uma placa de 96 poços de nova, vazia e armazenado a- 80 ° C para a avaliação das proteínas de interesse. Em seguida, resazurina foi adicionada às células de cada poço. Volume de negócios de não-fluorescente resazurina para resorufin fluorescente só foi facilitada pela ativas enzimas NADPH-gerando e correlacionou-se com atividade metabólica geral(Figura 4). As intensidades de fluorescência foram semelhantes à percepção visual da placa e indicaram efeitos citotóxicos de tratamento prolongado de plasma (Figura 4B). As condições de gás umidificado eram mais prejudiciais do que as condições de gás seco. As mesmas células na placa foram utilizadas para ensaios de ainda mais a jusante. Células da placa microscopicamente foram investigados (Figura 4C). Usando o software de imagem, vários poços da placa foram examinados para comparação qualitativa (Figura 4-D). Software permitiu a quantificação da área total coberta por células dentro do campos de visão adquiridas em cada poço e os dados resultantes foram normalizados para os respectivos controles (Figura 4E). Uma diminuição da área total da célula foi vista nas amostras de tratamento de plasma, especialmente com as condições de gás de alimentação umidificado. Depois da imagem latente, as células foram lavadas, manchadas com anticorpos antirato calreticulin, desanexadas e analisadas com citometria de fluxo (Figura 4-F). Quer dizer fluorescência intensidades de calreticulin coloração em células viáveis (Figura 4G) foram calculadas e comparadas entre as amostras (Figura 4H). Tratamento de plasma induzido um upregulation de calreticulin na superfície de células de melanoma murino, que correspondia ao tempo de tratamento plasma aplicado com condições de alimentação de gás seco. Para humedecidas condições de alimentação de gás, 20 s e 40 s do tratamento induzido por uma exposição de calreticulin mais forte em comparação com o mais letal 60 s tempo de tratamento. Isto sugere que havia um regulamento não-linear da exposição calreticulin no que se refere a quantidade de oxidantes introduzida para as células.
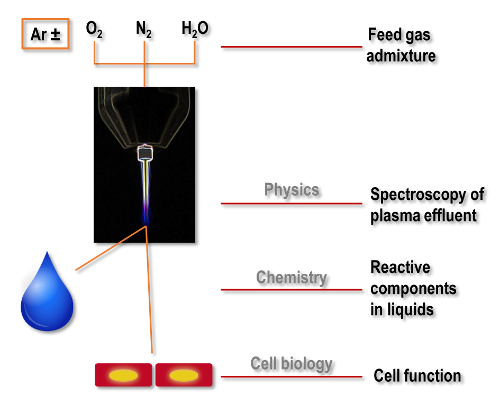
Figura 1 : Fluxo de trabalho de pesquisa médica de plasma da física à biologia. A produção de espécies reactivas do jato de plasma de argônio de pressão atmosférica está sintonizada, modulando o alimentação de gás. Moléculas selecionadas na fase de gás de plasma são monitoradas usando espectroscopia. O plasma é usado para tratar líquidos e investigar a deposição de oxidante. As células cultivadas em microplacas são tratados com plasma e leituras biológicas são executadas. Clique aqui para ver uma versão maior desta figura.

Figura 2 : Instalação da mesa de pesquisa de plasma. (A) diferentes gases em aço inoxidável, tubos são levados em vários controladores de fluxo de massa que são controlados através de um painel central. A composição do gás de alimentação individual é misturada posteriormente usando um painel de válvulas. (B) alguns componentes reactivos do plasma podem ser monitorados usando espectroscopia óptica de emissão para investigar diferenças entre várias composições de gás de alimentação. (C) para pesquisa de plasma de alta produtividade, microplacas de 96 poços são usadas. Para assegurar um constante ponto de partida para o tratamento de plasma programável e automatizado, a placa é adicionada a um quadro garantindo a mesma posição absoluta de pratos do dia-a-dia. (D) o jato de plasma é fixado para uma controlado por computador xyz tabela localizada sob uma capa de fluxo laminar. Todos os 96 localizações exatas e o tempo de interrupção do plasma sobre cada bem escrito em um arquivo de programa para orientar o movimento da fonte de plasma. A caixa principal do aparelho de jato de plasma, bem como os controles de motor estão localizados nas proximidades. (E) automatizado tratamento de plasma de uma placa de 96 poços. Clique aqui para ver uma versão maior desta figura.

Figura 3 : Jato de plasma e líquido análise. (A) espectroscopia de emissão ótica das condições de alimentação de gás diferente é mostrada. O segundo sistema positivo de nitrogênio (330 nm a 380 nm) foi aumentada com a adição de nitrogênio, ausente no caso de adição de oxigênio e marcadamente reduzido com argônio umidificado (lefthand painéis). O pico de radicais hidroxila em 309 nm (seta) diminuiu, em condições de nitrogênio e oxigênio, mas aumentou acentuadamente com argônio umidificado em comparação com o gás argônio sozinho. (B) gás exposição de líquidos leva a evaporação. A quantidade de evaporação por bem em um prato de 96well após o tratamento com plasma e argônio gás sozinho foi determinada por pesagem a placa antes e após o tratamento, usando uma escala bem. Evaporação em amostras de plasmatreated foi maior comparada com a em amostras de gastreated de argônio. (C) geração de peróxido de hidrogênio em plasmatreated líquidos correlacionados em certa medida, com o pico de 309 nm de radicais hidroxila (A). Plasma de argônio umidificado (5%) aumentou as concentrações de peróxido cerca 4fold. (D) nitrito foi elevado quando o nitrogênio foi adicionado ao gás de alimentação, e este efeito foi aumentado com plasma de argônio umidificado. A adição de oxigênio, diminuição da geração de nitrito mas não significativamente. (E, F) Concentrações de hidrogênio peróxido e nitrito é mostrado em diferentes tipos de líquidos, ou seja RPMI1640 meio de cultura celular com (R10F) e sem (R0F) bem como PBS, com e sem soro fetal bezerro (FCS). Níveis de peróxido não diferiu entre diferentes meios de comunicação (E) Considerando que os níveis de nitrito foram significativamente menores em presença de soro. (G) produção de superóxido foi mais alta para alimentação de gás argônio seco gás; adição de oxigênio, nitrogênio ou argônio umidificado deu depoimento de superóxido inferior no líquido. Dados mostrados (B-G) são a média + SEM de dois a três experimentos. Análise estatística foi realizada (C, D) usando a análise de variância One-Way comparando meios de todo o grupo de condições de gás de alimentação seco ou húmido contra o respectivo controle (* * p < 0,01; * * * p < 0,001). Além disso, as condições somente gás plasma de argônio foram comparadas usando a média de todo o grupo e o teste t (# # # p < 0,001). Além disso, análise estatística (F) foi realizada usando t-testes comparando os valores de cada tratamento de plasma e condição média nas amostras com FCS e sem FCS (* p < 0,05; * * p < 0,01); Além disso, FCS ou soluções contendo não-FCS foram comparadas dentro de cada tempo de tratamento de plasma utilizando o teste t (p # < 0,05; # # p < 0,001). Clique aqui para ver uma versão maior desta figura.

Figura 4 : Tratamento de plasma e seu impacto nas células. (A) células foram expostas a plasma e resazurina foi adicionada após 20 h para avaliar a atividade metabólica. (B) atividade diminuiu significativamente em amostras plasmatreated, comparadas aos controles de gás. Uma diminuição acentuada foi vista com umidificação dos gases de alimentação, Considerando que a adição de oxigênio e/ou azoto conduz à toxicidade em ambas as condições de gás argônio seco e úmido. (C) médio contendo iodeto de propidium (PI) foi adicionado. (D) uma visão geral é mostrado dos poços da placa com contraste de fase digital (laranja) que representa a fração citosólica de cada célula e PI (verde) para identificar as células mortas. Ferramentas de imagem permitiu a quantificação da área total dentro do campo de visão de cada um bem coberto com células. (F) as células foram posteriormente lavadas e incubadas com anticorpos ou outros marcadores de célula para caracterizar os efeitos biológicos plasma usando citometria de fluxo. (G) foram empregadas estratégias Gating e marcador análise foi realizada e em comparação entre amostras. Dados mostrados (B, E, H) denotam a média + SEM de um representante de três experimentos independentes. Barra de escala = 200 µm (D). Comparação estatística foi realizada utilizando análise bidirecional de variâncias (B, H), comparando-se, para cada condição de gás, cada tratamento de plasma para o controle do respectivo gás (* p < 0,05; * * p < 0,01; * * * p < 0,001). Além disso, os valores para cada condição das misturas de nitrogênio e/ou oxigênio foram comparados com valores de plasma de gás argônio para seco e úmido condições separadamente (análise bidirecional das variâncias; # # # p < 0,001). Clique aqui para ver uma versão maior desta figura.
Discussion
Pesquisa básica é fundamental para o desenvolvimento de uma compreensão da eficácia de e mecanismos subjacentes medicina de plasma em pesquisa pré-clínica e clínica. Investigação fundamental também promove a investigação de novas aplicações para os tratamentos. Enquanto está bem estabelecido que plasmas de mediam seus efeitos biológicos através da geração de reativas de oxigênio e nitrogênio espécie19, ainda existem três principais desafios para o campo. Primeiro, quais espécies são importantes? Isto pode ser parcialmente respondido modulando a composição do gás de alimentação de plasmas com diagnóstico óptico e biológicas leituras. 20 segundo, que efeitos podem ser visto em alvos biológicos como as células? Isto é, pelo menos em parte, endereçado utilizando experiências da cultura de pilha e uma série de ensaios. Em células eucarióticas, os efeitos são pleiotrópicos incluindo de detenção de ciclo celular21, apoptose22, necrose,23e pele célula estimulação24,25,26, bem como um apoio ou diminuem de célula mobilidade ou atividade metabólica de28,de27,29. O terceiro desafio, relativas a estes efeitos pleiotrópicos, é identificar as principais moléculas que determinam a resposta celular a oxidantes derivados de plasma para explicar diferentes efeitos muitas vezes visto em diferentes tipos de células. Isso pode ser feito por omics técnicas30,31,32 e/ou acima ou downregulation de genes-alvo usando siRNA (redox) sinalização inibidores, antioxidantes e enzimas antioxidantes, bem como a modulação do produção de espécies reactivas do plasma. 33 , 34 , 35 portanto, protocolos do ensaio simplificado são necessários para testar conjuntos maiores de amostra com um grande número de iterações.
Este estudo exemplifica um eficiente fluxo de trabalho experimental, da física à biologia, pesquisas médicas de plasma no que diz respeito aos desafios acima mencionados. Detalhes sobre os aspectos de engenharia da fonte de plasma e geração de plasma têm sido descritos antes. 36 , 37 , 38 todos estes ensaios são realizados em placas de 96well, que tem uma série de vantagens. Por exemplo, amostras como sobrenadantes de cultura de células podem ser facilmente transportadas de ensaio de placas de coleção para investigar, por exemplo, as concentrações de proteína através da enzima-lig--ensaio da imunoabsorção. Se o equipamento científico capaz de ler diretamente a partir de 96 poços está disponível, tal abordagem minimiza custos por amostra e handsontime e maximiza os resultados de ensaios diferentes da mesma amostra de multiplexação. O uso de multicanal pipetas, além disso, acelera o manuseio de amostras. Em princípio, o ensaio descrito aqui pode também ser realizado usando formatos de placa bem com diâmetros bem maiores, embora isso exigiria a pipetagem de etapas adicionais nos outros tubos e vasos para ensaios a jusante. Tipos de placa menores tais como placas de 384well, no entanto, não apresentam a geometria adequada para a investigação biomédica plasma usando jatos com fluxos de gás de alimentação grande. Especificamente, não pode ser garantido que o único single mas não adjacentes poços são afetados durante um tratamento.
Análise de líquidos é essencial para investigar a deposição de espécies pelo plasma. Em peritagens, uma instalação paralela dos diferentes ensaios pode caracterizar plasmatreated líquidos no que se refere a oxidantes diferentes ao mesmo tempo. Esta multiplexação permite o desenvolvimento de uma imagem diferenciada das espécies plasmaderived. A abordagem descrita é altamente sensível para investigar as concentrações de peróxido de hidrogênio39, que muitas vezes é necessário, mas não são sempre suficientes para explicar os efeitos do plasma. 40 , 41 , 42 efeitos biologicamente relevantes também podem ser avaliados em líquidos com um ensaio de glutationa não incluído aqui. 43 o ensaio específico de nitrito é fortemente recomendado pela Griess-ensaios convencionais devido a 10fold maior sensibilidade do ensaio (dados não mostrados). Plasmatreated líquidos também podem ser investigados para a formação de ácido hipocloroso usando o DTNB-ensaio. No entanto, os resultados anteriores não indicaram a formação dessa espécie com nossa fonte de plasma. 19 , 39 , 44 depois de finalizado o tratamento plasma, deterioração da espécie ocorre ao longo do tempo. Nitrito reage ao nitrato; Além disso, peróxido é consumido ao longo do tempo. No entanto, estes processos demorar várias horas. 35 citocromo c absorção é estável ao longo de várias horas também. Portanto, se processos ocorrem dentro da primeira 30 min após o tratamento, variação nas concentrações da espécie longeva descrita aqui são insignificantes. No entanto, deve ter cuidado ao investigar certos tipos de mídia (por exemplo, o meio Eagle modificado de Dulbecco) como ingredientes pode eliminar acima de 90% de peróxido de dentro de 1h (dados não mostrados) levando a uma subestimação da deposição de peróxido de plasma em líquidos.
Um ensaio multiplex é apresentado que varia de investigar a atividade metabólica sobre área de célula (morfologia) a expressão do marcador de superfície celular. Uma combinação destes ensaios pode revelar resultados interessantes. Por exemplo, anteriormente mostramos em monócitos THP1 que contagens de atividade e célula metabólicas não diminuir de forma linear, após a exposição a plasma. Rather 45 , com o aumento do tempo de tratamento de plasma, foram observadas células que foram aumentadas em tamanho e tinha uma maior massa mitocondrial, provocando maiores taxas metabólicas numa base percell. Essencialmente, a combinação de citometria de fluxo, microscopia e leitor multiplate multiplexes informações na resposta celular após o tratamento de plasma. Em células de melanoma, tratamos aqui de efeitos citotóxicos e sua imunogenicidade mediada por calreticulin. 46 em princípio, muitas outras questões podem ser tratadas com esta abordagem, vinculando a atividade metabólica, com resultados de citometria de imagem e fluxo. Por exemplo, a diferenciação celular (por exemplo, polarização de macrófagos), potencial de membrana mitocondrial, análise de ciclo celular, motilidade celular, biomecânica ou formação de micronúcleos para análise de genotoxicidade também pode ser investigada em tratados com plasma de células. Citometria de fluxo multicolor permite ainda mais aplicações em populações de células diferentes ao mesmo tempo. Isso inclui, por exemplo, a análise do status fosforilação de proteínas como fatores de transcrição, quantificação de mRNA, medição de citocinas intracelulares, e/ou avaliação de tióis reduzidas totais em um única célula nível de sinalização. Informações adicionais biologicamente relevantes disponíveis para cada amostra auxilia em continuar a desenvolver a imagem dos efeitos de redox de plasma para compreender melhor as aplicações atuais e futuras de plasma.
Disclosures
Os autores não têm nada para divulgar.
Acknowledgments
Financiamento do Ministério Federal alemão de educação e pesquisa (BMBF conceder 03Z22DN12 e 03Z22DN11 de números) é reconhecido com gratidão.
Materials
| Name | Company | Catalog Number | Comments |
| accutase | BioLegend | 423201 | |
| amplex Ultra Red detection kit (includes horse-radish peroxidase and H2O2) | Thermo | A36006 | |
| argon gas | Air Liquide | N50 | |
| B16F10 murine melanoma cells | ATCC | CRL-6475 | |
| catalase | Sigma | C30 | |
| cell culture incubator | Binder | CB210 | |
| cell culture plastic | NUNC | 156545 | |
| cytochrome c, oxidized | Sigma | C2037 | |
| data analysis | GraphPad software | prism 7.03 | |
| fetal bovine serum | Sigma | batch-tested | |
| fine scale | any with resolution of 0.01mg | ||
| flow cytometer | Beckman-Coulter | CytoFlex S | |
| flow cytometry data analysis | Beckman-Coulter | Kaluza 1.5a | |
| Glutamine | Sigma | G7513 | |
| imaging quantification software | PerkinElmer | Harmony 4.5 | |
| laminar flow hood | Thermo | Maxisafe 2020 | |
| mass flow controller | MKS | G-series | |
| Measure-iT nitrite detection kit | Thermo | M36051 | |
| microscope | PerkinElmer | Operetta CLS | |
| optical emssion spectroscopy | Avantes | AvaSpec-DDDD-2-USB2 | |
| penicilin/streptomycin | Thermo | 15140122 | |
| pipettes | Eppendorf/Brand | single/multi chanel | |
| plate reader | Tecan | M200pro | |
| propidium iodide | BioLegend | 421301 | |
| resazurin | VWR | B21187.06 | |
| RPMI1640 cell culture media | PanbioTech | P04-16500 | |
| xyz table | CNC step | HIGH-Z S-400/T |
References
- Sen, C. K. The general case for redox control of wound repair. Wound Repair Regen. 11 (6), 431-438 (2003).
- Acharya, A., Das, I., Chandhok, D., Saha, T. Redox regulation in cancer: a double-edged sword with therapeutic potential. Oxid Med Cell Longev. 3 (1), 23-34 (2010).
- Sen, C. K. Wound healing essentials: let there be oxygen. Wound Repair Regen. 17 (1), 1-18 (2009).
- Cui, X. Reactive oxygen species: the achilles' heel of cancer cells. Antioxid Redox Signal. 16 (11), 1212-1214 (2012).
- Graves, D. B. The emerging role of reactive oxygen and nitrogen species in redox biology and some implications for plasma applications to medicine and biology. Journal of Physics D-Applied Physics. 45 (26), 263001 (2012).
- Weltmann, K. D., et al. Atmospheric-pressure plasma sources: Prospective tools for plasma medicine. Pure Appl Chem. 82 (6), 1223-1237 (2010).
- Bekeschus, S., Schmidt, A., Weltmann, K. -D., von Woedtke, T. The plasma jet kINPen - A powerful tool for wound healing. Clinical Plasma Medicine. 4 (1), 19-28 (2016).
- Wende, K., et al. Risk assessment of a cold argon plasma jet in respect to its mutagenicity. Mutat Res Genet Toxicol Environ Mutagen. 798-799, 48-54 (2016).
- Kluge, S., et al. Investigating the Mutagenicity of a Cold Argon-Plasma Jet in an HET-MN Model. PLoS One. 11 (9), 0160667 (2016).
- Schmidt, A., et al. One Year Follow-Up Risk Assessment in SKH-1 Mice and Wounds Treated with an Argon Plasma Jet. Int J Mol Sci. 18 (4), 868 (2017).
- Hanschmann, E. M., Godoy, J. R., Berndt, C., Hudemann, C., Lillig, C. H. Thioredoxins, glutaredoxins, and peroxiredoxins--molecular mechanisms and health significance: from cofactors to antioxidants to redox signaling. Antioxid Redox Signal. 19 (13), 1539-1605 (2013).
- Weltmann, K. D., von Woedtke, T. Plasma medicine-current state of research and medical application. Plasma Phys Controlled Fusion. 59 (1), 014031 (2017).
- Metelmann, H. R., et al. Experimental Recovery of CO2-Laser Skin Lesions by Plasma Stimulation. Am J Cosmet Surg. 29 (1), 52-56 (2012).
- Brehmer, F., et al. Alleviation of chronic venous leg ulcers with a hand-held dielectric barrier discharge plasma generator (PlasmaDerm((R)) VU-2010): results of a monocentric, two-armed, open, prospective, randomized and controlled trial (NCT01415622). J Eur Acad Dermatol Venereol. 29 (1), 148-155 (2015).
- Isbary, G., et al. Successful and safe use of 2 min cold atmospheric argon plasma in chronic wounds: results of a randomized controlled trial. Br J Dermatol. 167 (2), 404-410 (2012).
- Brulle, L., et al. Effects of a non thermal plasma treatment alone or in combination with gemcitabine in a MIA PaCa2-luc orthotopic pancreatic carcinoma model. PLoS One. 7 (12), 52653 (2012).
- Mirpour, S., et al. Utilizing the micron sized non-thermal atmospheric pressure plasma inside the animal body for the tumor treatment application. Sci Rep. 6, 29048 (2016).
- Utsumi, F., et al. Effect of indirect nonequilibrium atmospheric pressure plasma on anti-proliferative activity against chronic chemo-resistant ovarian cancer cells in vitro and in vivo. PLoS One. 8 (12), 81576 (2013).
- Jablonowski, H., von Woedtke, T. H. Research on plasma medicine-relevant plasma-liquid interaction: What happened in the past five years. Clinical Plasma Medicine. 3 (2), 42-52 (2015).
- Reuter, S., et al. From RONS to ROS: Tailoring Plasma Jet Treatment of Skin Cells. Ieee Transactions on Plasma Science. 40 (11), 2986-2993 (2012).
- Gherardi, M., et al. Atmospheric Non-Equilibrium Plasma Promotes Cell Death and Cell-Cycle Arrest in a Lymphoma Cell Line. Plasma Processes and Polymers. 12 (12), 1354-1363 (2015).
- Bundscherer, L., et al. Viability of human blood leucocytes compared with their respective cell lines after plasma treatment. Plasma Medicine. 3 (1-2), 71-80 (2013).
- Hirst, A. M., et al. Low-temperature plasma treatment induces DNA damage leading to necrotic cell death in primary prostate epithelial cells. Br J Cancer. 112 (9), 1536-1545 (2015).
- Arndt, S., et al. Effects of cold atmospheric plasma (CAP) on ss-defensins, inflammatory cytokines, and apoptosis-related molecules in keratinocytes in vitro and in vivo. PLoS One. 10 (3), 0120041 (2015).
- Korolov, I., Fazekas, B., Szell, M., Kemeny, L., Kutasi, K. The effect of the plasma needle on the human keratinocytes related to the wound healing process. Journal of Physics D-Applied Physics. 49 (3), 035401 (2016).
- Schmidt, A., von Woedtke, T., Bekeschus, S. Periodic Exposure of Keratinocytes to Cold Physical Plasma: An In Vitro Model for Redox-Related Diseases of the Skin. Oxid Med Cell Longev. 2016, Harmful and Beneficial Role of ROS (HBR) 9816072 (2016).
- Schmidt, A., Bekeschus, S., von Woedtke, T., Hasse, S. Cell migration and adhesion of a human melanoma cell line is decreased by cold plasma treatment. Clinical Plasma Medicine. 3 (1), 24-31 (2015).
- Kalghatgi, S., Friedman, G., Fridman, A., Clyne, A. M. Endothelial cell proliferation is enhanced by low dose non-thermal plasma through fibroblast growth factor-2 release. Ann Biomed Eng. 38 (3), 748-757 (2010).
- Schmidt, A., Bekeschus, S., Wende, K., Vollmar, B., von Woedtke, T. A cold plasma jet accelerates wound healing in a murine model of full-thickness skin wounds. Exp Dermatol. 26 (2), 156-162 (2017).
- Wende, K., et al. Proteomic Tools to Characterize Non-Thermal Plasma Effects in Eukaryotic Cells. Plasma Medicine. 3 (1-2), 81-95 (2013).
- Schmidt, A., et al. Redox-regulation of activator protein 1 family members in blood cancer cell lines exposed to cold physical plasma-treated medium. Plasma Processes and Polymers. 13 (12), 1179-1188 (2016).
- Landsberg, K., et al. Use of Proteomics to Investigate Plasma-Cell Interactions. Plasma Medicine. 1 (1), 55-63 (2011).
- Xu, D., et al. Intracellular ROS mediates gas plasma-facilitated cellular transfection in 2D and 3D cultures. Sci Rep. 6, 27872 (2016).
- Ishaq, M., et al. Atmospheric gas plasma-induced ROS production activates TNF-ASK1 pathway for the induction of melanoma cancer cell apoptosis. Mol Biol Cell. 25 (9), 1523-1531 (2014).
- Winter, J., et al. Tracking plasma generated H2O2 from gas into liquid phase and revealing its dominant impact on human skin cells. Journal of Physics D-Applied Physics. 47 (28), 285401 (2014).
- Dunnbier, M., et al. Ambient air particle transport into the effluent of a cold atmospheric-pressure argon plasma jet investigated by molecular beam mass spectrometry. Journal of Physics D-Applied Physics. 46 (43), 435203 (2013).
- Schmidt-Bleker, A., Bansemer, R., Reuter, S., Weltmann, K. -D. How to produce an NOx- instead of Ox-based chemistry with a cold atmospheric plasma jet. Plasma Processes and Polymers. 13 (11), 1120-1127 (2016).
- Weltmann, K. D., et al. Atmospheric Pressure Plasma Jet for Medical Therapy: Plasma Parameters and Risk Estimation. Contributions to Plasma Physics. 49 (9), 631-640 (2009).
- Bekeschus, S., et al. Hydrogen peroxide: A central player in physical plasma-induced oxidative stress in human blood cells. Free Radic Res. 48 (5), 542-549 (2014).
- Girard, P. M., et al. Synergistic Effect of H2O2 and NO2 in Cell Death Induced by Cold Atmospheric He Plasma. Sci Rep. 6, 29098 (2016).
- Bekeschus, S., et al. Neutrophil extracellular trap formation is elicited in response to cold physical plasma. J Leukoc Biol. 100 (4), 791-799 (2016).
- Girard, F., et al. Formation of reactive nitrogen species including peroxynitrite in physiological buffer exposed to cold atmospheric plasma. Rsc Advances. 6 (82), 78457-78467 (2016).
- Bekeschus, S., von Woedtke, T., Kramer, A., Weltmann, K. -D., Masur, K. Cold Physical Plasma Treatment Alters Redox Balance in Human Immune Cells. Plasma Medicine. 3 (4), 267-278 (2013).
- Wende, K., et al. Identification of the biologically active liquid chemistry induced by a nonthermal atmospheric pressure plasma jet. Biointerphases. 10 (2), 029518 (2015).
- Bekeschus, S., et al. Redox Stimulation of Human THP-1 Monocytes in Response to Cold Physical Plasma. Oxid Med Cell Longev. 2016, 5910695 (2016).
- Obeid, M., et al. Calreticulin exposure dictates the immunogenicity of cancer cell death. Nat Med. 13 (1), 54-61 (2007).



