ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Кластеризованный регулярно interspaced короткие палиндром повторяется/ТРИФОСФАТЫ связанные белком 9 (ТРИФОСФАТЫ/Cas9) система обеспечивает перспективным инструментом для генной инженерии и открывает возможность целенаправленной интеграции трансгенов. Мы описываем гомологии опосредованной конец присоединения (HMEJ)-на основе стратегии для эффективных ДНК интеграции в естественных условиях и целевой терапии гена с помощью ТРИФОСФАТЫ/Cas9.
Abstract
Как перспективный генома редактирования платформы ТРИФОСФАТЫ/Cas9 система имеет большой потенциал для эффективного генетические манипуляции, особенно для целенаправленной интеграции трансгенов. Однако, из-за низкой эффективности гомологичная рекомбинация (HR) и различных indel мутации не гомологичных конца присоединения (NHEJ)-на основе стратегии-деления клеток, в естественных условиях генома редактирования остается большой проблемой. Здесь мы описываем гомологии опосредованной конец присоединения (HMEJ)-основанный ТРИФОСФАТЫ/Cas9 системы для эффективного в vivo точные целевые интеграции. В этой системе, целенаправленных генома и доноров вектор содержащий гомологии оружия (~ 800 bp) в окружении одной руководство РНК (sgRNA) целевой последовательности расщепляется, ТРИФОСФАТЫ/Cas9. Эта стратегия на основе HMEJ достигает эффективного трансген интеграции мыши зигот, а также в гепатоциты в естественных условиях. Кроме того, стратегия на основе HMEJ предлагает эффективный подход для коррекции fumarylacetoacetate гидролазы (фа) мутации в гепатоцитах и спасает фа-дефицит индуцированные поражения печени мышей. Вместе взятые, сосредоточив внимание на целенаправленных интеграции, эта стратегия на основе HMEJ обеспечивает перспективным инструментом для различных приложений, включая создание генетически модифицированных животных моделей и целевых генной терапии.
Introduction
Точные, целенаправленных генома редактирования часто требуется для производства генетически модифицированных животных моделей и клинической терапии. Много усилий был достигнут в разработке различных стратегий для эффективного целенаправленного генома, редактирования, такие как цинковый палец нуклеиназы (ZFN), транскрипции эффекторных активатор как nucleases (Таленс) и ТРИФОСФАТЫ/Cas9 систем. Эти стратегии создания целевых двухнитевые разрывы ДНК (DSB) в геноме и воспользоваться преимуществами встроенных систем ремонта ДНК, таких как гомологичная рекомбинация (HR)1,2, microhomology опосредованной конец присоединения (MMEJ)3 , 4 , 5и не гомологичных конце присоединения (NHEJ)6,,78 побудить целенаправленной интеграции трансгенов1,9. HR-стратегия на основе в настоящее время наиболее часто используемые генома редактирования подход, который является очень эффективным в клеточных линий, но не легко доступной для не деления клеток из-за его ограниченного возникновения в конце S/G2 фазе. Таким образом HR-стратегия на основе не применима для в естественных условиях изменения генома. Недавно была разработана стратегия на основе NHEJ для забивные эффективного гена в ткани мыши8. Тем не менее метод на основе NHEJ обычно вводит indels на перекрестках, что делает его трудно генерировать точные генома редактирования, особенно при попытке построить в кадр фьюжн генов8. На основе MMEJ целенаправленной интеграции способен редактирования точных генома. Однако это лишь незначительно увеличивает эффективность целенаправленной интеграции в предыдущих докладах5. Таким образом повышение эффективности точные целевые интеграции в vivo срочно необходима для широкого терапевтического применения3.
В недавно опубликованной работе, мы продемонстрировали гомологии опосредованной конец присоединения (HMEJ)-на основе стратегии, которая показала высокую эффективность целенаправленной интеграции всех сообщений о стратегии как in vitro и in vivo10. Здесь, мы описать протокол для создания системы HMEJ, а также строительство векторов сингл руководство РНК (sgRNA), ориентация гена интереса и доноров векторы укрывательстве sgRNA целевые сайты и ~ 800 bp гомологии оружия (рис. 1) . В этом протоколе мы также описывают подробные шаги для генерации ДНК забивные мышей и краткие шаги для целенаправленной интеграции в тканях в естественных условиях. Кроме того исследование доказательства в концепция стратегии на основе HMEJ продемонстрировала свою способность исправить Fah мутации и спасти фа- / - печени провал мышей, которые далее показали его терапевтический потенциал.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Все процедуры, включая животных темы были утверждены Комитетом по этике биомедицинских исследований на Шанхай институтов биологических наук (CAS).
1. дизайн доноров плазмиды
-
Выбор sgRNA
- Используйте онлайн-ТРИФОСФАТЫ дизайн инструментов для прогнозирования sgRNAs целевого региона11,12,13,14,15. Для Cdx2 локус, дизайн шести различных sgRNAs (Cdx2-sgRNA1 ~Cdx2-sgRNA6) вокруг стоп кодон с высшего ранга и Нижняя потенциал вне цели (рис. 1A)16.
- Линеаризации 2 мкг Cas9-ЦМВ-EGFP векторы выражения и sgRNA, BbsI пищеварения (1 мкл BbsI втечение 2 ч при 37 ° C в конечной концентрации 1 U/мкл в объеме 20 мкл). Затем очищайте продукт, комплект очистки гель с гель агарозы 1% в 1 × буфер TAE.
- Mix пару sgRNA олигонуклеотидов в 10 мкл 1 × T4 ДНК лигаза буфера до конечной концентрации 50 µM. Инкубируйте oligo решения с помощью градиента температуры 95 ° c до 25 ° C со скоростью изменения температуры на 5 ° C/5 мин (95 ° C за 5 мин затем 90 ° C за 5 мин, 85 ° C за 5 мин и т.д.), который будет отжига oligos.
- Смешайте 4 мкл отожженная продукт, 2 мкл линеаризованного вектора с 1 мкл T4 ДНК лигаза в 10 мкл 1 × T4 ДНК лигаза буфера и затем перевязать при 22 ° C для 1-2 ч (рис. 1Б).
-
Сюрвейер нуклеиназы assay sgRNA
Примечание: Нацеленности эффективности sgRNA, используемый для эксперимента стук в оценивается нуклеиназы пробирного инспектора (также известный как T7 эндонуклеазы I (T7EI) проба)17. Выберите sgRNA с высокой эффективностью расщепления ДНК и низкой расстояние между sgRNA резки и стоп-кодон.- Transfect Cas9-sgRNA-EGFP векторы выражения в N2a линии клетки культивировали в DMEM дополнена плода бычьим сывороточным 10%, 1% ПСЖ и 1% несущественные аминокислот, transfection комплекта (см. Таблицу материалы). Инкубируйте transfected клеток при 37 ° C в 5% CO2.
- После 48 ч инкубации, собрать 5000 transfected клеток (GFP+), активированный флуоресценции клеток, сортируя (FACS) с использованием не transfected клеток как элемент управления.
- Дайджест собранные клетки в 2-5 мкл oflysis buffer (0,1% тритон X-100, 0.1% анимации, 20 и 100 µg/mL протеиназы K) 56 ° C за 30 минут, и затем тепловой инактивации протеиназы K на 95 ° C в течение 10 мин.
- Усилить пример вложенных ПЦР (Таблица 1), используя протокол изготовителя. Размер продуктов ПЦР равен 300-500 bp.
- Смешайте 1 мкл лизис продукта с ДНК-полимеразы и парой праймеров внешних, признавая последовательность вокруг целевого сайта sgRNA (0,1 мкм, конечная концентрация) (Таблица 1) и выполнять основной ПЦР в объеме 20 мкл.
- Активация ДНК-полимеразы на 95 ° C за 5 мин и выполнение основного PCR для 30 циклов при 95 ° C за 30 сек, 60 ° C за 30 s и 72 ° C для 24 s (1 мин/1 КБ), с расширением окончательный при 72 ° C за 5 мин.
- Выполните вторичных ПЦР, используя 1 мкл первичного продукта PCR и парой праймеров вложенные внутренние.
- Денатурировать и повторно отжига 300-600 нг очищенного продукта ПЦР в 20 мкл 1 × T7EI реакции буфера (50 мм NaCl, 10 мм трис-HCl, 10 мм MgCl2, 1 мм DTT рН 7,9) с использованием градиента температуры от 95 ° C до 25 ° C со скоростью от 5 ° C/5 мин.
- 1 мкл T7EI фермента, отожженная продукты PCR и дайджест при 37 ° C на 2 ч. Затем запустите пищеварение продукта на 2% агарозном геле в буфер TAE 1 × 120 V за 40 мин до тех пор, пока фрагменты отделены (см. Таблицу материалы).
- ImageJ используйте для определения группы интенсивности необрезанный ДНК и вырезать. Вычислить indel частоты с использованием методов, ранее сообщили9 (рис. 1C).
-
Строительство доноров вектора
Примечание: Для создания HMEJ доноров векторов для Cdx2 гена, построить доноров ДНК (800 bp HAL-p2A-mCherry-800 bp HAR) рядом с 23 nt Cdx2-sgRNAs ориентация последовательность на обоих концах (рис. 1D и 1 рисунокE). Пэм последовательности целевых объектов был рядом с конца гомологичных руку. Гибсон Ассамблее рекомендуется для HMEJ доноров клонирования.- Усилить 800 руку левой гомологии bp (HAL) с вперед грунт 1F (содержащий последовательность совпадения nt 15-20 от вектора, 23 nt Cdx2-sgRNA определение последовательности и около 20 nt последовательности от HAL) и обратить вспять грунт 1R (содержащий последовательность совпадения bp 15-20 от p2A-mCherry и около 20 nt последовательности от HAL) в конечной концентрации 0,1 мкм с помощью мыши геномной ДНК на 200 нг/мкл (рис. 1D, Таблица 1).
- Усилить p2A-mCherry вставки фрагмента с вперед грунт 2F (содержащий последовательность совпадения nt 15-20 от HAL и около 20 nt последовательность из вставки фрагмента) и обратить вспять грунт 2R (содержащий последовательность совпадения nt 15-20 от Хар и около 20 nt последовательности от Вставка фрагмента) на 0,1 мкм конечной концентрации с использованием геномной ДНК или плазмиду с последовательностями репортер на 100 нг/мкл и 30 нг/мкл (рис. 1D, Таблица 1).
- Усилить 800 руку правой гомологии bp (HAR) с вперед грунт 3Ф (содержащий последовательность совпадения nt 15-20 от вектора, 23 nt Cdx2-sgRNA определение последовательности и около 20 nt последовательность из Хар) и обратить вспять грунт 3R (содержащий последовательность совпадения nt 15-20 от p2A-mCherry и около 20 nt последовательность из Хар) в конечной концентрации 0,1 мкм с помощью мыши геномной ДНК на 200 нг/мкл (рис. 1D, Таблица 1).
- Запустите все продукты PCR на геле агарозы 1% в 1 буфер TAE × и очистить продукты PCR ожидаемого размера, Комплект извлечения геля, согласно инструкциям производителя (Таблица 1).
- Дайджест 50-100 ng вектора конструкции с KpnI и XbaI. Смешайте 2 мкл линеаризованного вектора на 30-40 нг/мкл с тремя ПЦР усиленный фрагментов (1 мкл для каждого, 100-200 нг/мкл) 2 х Гибсон микс. Добавление H2O для окончательного громкость до 10 µL.Incubate смесь на 50 ° C 60 мин.
- Преобразовать сведущее Escherichia coli клеток со всеми собранный продукт и экстракт плазмида создает набор экстракции ДНК согласно инструкциям производителя. Проверьте HMEJ доноров, секвенирования ДНК.
2. геном редактирования в эмбрионов мыши, с помощью метода на основе HMEJ
-
Производство Cas9 мРНК
- Для приготовления Cas9 мРНК добавьте T7 промоутер последовательность Cas9 кодирование региона по амплификации PCR, используя соответствующий грунт пара, перечисленных в таблице 1. В конечной концентрации 0,1 мкм и 20 добавить праймера Cas9 F/R нг Cas9 выражая вектор 1 × высококачественный микс ДНК-полимеразы. Окончательного громкость до 50 мкл с H2O.
- Активация ДНК-полимеразы на 95 ° C за 5 мин и выполнять ПЦР для 36 циклов при 95 ° C за 30 сек, 60 ° C за 30 s и 68 ° C в течение 4 мин (1 мин/1 КБ), с расширением окончательный на 68 ° C в течение 10 мин.
- Очистить продукт PCR T7-Cas9 для в vitro транскрипция (IVT), а затем расшифровать 0,5-1 мкг ДНК по транскрипции Кит мРНК при 37 ° C в течение 8 ч в общем объеме 20 мкл, согласно инструкциям производителя (см. Таблицу материалы).
- 1 мкл DNase в смесь, чтобы удалить шаблон ДНК при 37 ° C на 15 мин добавить хвост поли A для 45 минут при 37 ° C и восстановить Cas9 мРНК, комплект очистки РНК, согласно инструкциям производителя (см. Таблицу материалы).
-
Производство sgRNA
- Создайте шаблон sgRNA, движимый T7 промоутер с высокой точностью ДНК полимеразы как выше. Выберите sgRNA леску, содержащий вектор как шаблон. Праймеры используются, перечислены в таблице 1.
- Очистить продукт PCR T7-sgRNA и использовать 0,5-1 мкг ДНК как шаблон для в vitro транскрипция sgRNA, используя короткий набор транскрипции РНК при 37 ° C для 6 h в общем объеме 20 мкл, согласно инструкциям производителя (см. таблица материалов < / c11 >).
- 1 мкл DNase в смесь и продолжать инкубацию при 37 ° C на 15 минут, чтобы удалить шаблон с ДНК. Очистить sgRNAs, РНК очистки комплект, как указано выше (см. Таблицу материалы).
- Разбавить sgRNA до 500 нг/мкл в РНКазы свободной воды и хранения образцов в −80 ° C на срок до 3 месяцев.
Примечание: ТРИФОСФАТЫ ribonucleoproteins (RNPs) являются альтернативного замещения с лучшей резки эффективность18,19,20.
-
Культуры коллекции, микроинъекции и в пробирке эмбрион
- Superovulate женских B6D2F1 (C57BL/6 × DBA2J) мышей (7-8 недель), беременных Маре гонадотропина сыворотки (ГСЖК), следуют хорионического гонадотропина человека (ХГЧ) 48 ч позже. После инъекции ХГЧ дом самки с B6D2F1 мужчины на ночь.
- Пожертвуйте самки CO2 анестезии, 24 ч после инъекции ХГЧ. Соберите оплодотворенных эмбрионов от их яйцеводов (с 30-50 эмбрионов для каждой девушки) в среде м2.
- Место оплодотворенных эмбрионов (около 300 яиц за один день инъекций) в среду КСОМ (5.55 г/Л NaCl, 0,19 г/Л хлористого калия, 0,05 г/Л х2PO4, 0,05 г/Л MgSO4•7H2O, 0,04 г/Л глюкозы, 1,12 г/Л натрия лактата, 2,1 г/Л NaHCO3 , пируват натрия 0,02 г/Л, 0,25 г/Л CaCl2•2H2O, ЭДТА 0,004 г/Л, 0,146 g/L L-глютамина и 1 г/Л бычьим сывороточным альбумином) при 37 ° C в инкубаторе с 5% CO2.
- Смесь Cas9 мРНК (100 нг/мкл), sgRNA (50 нг/мкл) и HMEJ доноров вектор (100 нг/мкл) и добавьте H2O для окончательного громкость до 10 мкл. поставить смесь на льду.
- Тянуть капиллярного иглы (наружный диаметр 1,0 мм, внутренний диаметр 0,78 мм с накаливания) с помощью съемника микропипеткой (параметры: тепло, давление, 300; задержка, 200; скорость, 80; тянуть, 60, 74. Таблица материалов). Коммерческие иглы бы альтернативной заменой микроинъекции.
- Придать вероятный объем смеси в цитоплазму зигот с четко определенной pronuclei в капли среднего HEPES-CZB, содержащий 5 мкг/мл cytochalasin B с помощью microinjector с постоянным потоком настройки (рисA) (см. Таблица материалов)21.
Примечание: Каждая группа зигот должны быть введены в течение 20-30 мин Cytochalasin B может повысить жизнеспособность зигота мыши после инъекции. Кроме того микроинъекции может эксплуатироваться с пьезо системы, как описано ранее22. - Культура вводят зигот в среде КСОМ при 37 ° C, под 5% CO2 до бластоциста этап после 3,5 дней для флуоресценции наблюдения (цифры 2B и 2C).
-
Перенос эмбрионов и поколение мышей
- Мат эстрального ICR самок мышей с вазэктомии мышей-самцов ICR в тот же день, как инъекции.
- Культура вводят зигот в стадии 2-клеток при 37 ° C под 5 CO2и передачи 25-30 2-клеток эмбрионов в яйцеводов pseudopregnant МГП самок на 0,5 дня пост coitum (dpc). Получателя матери доставить щенков на 19,5 dpc.
-
Генотипирование мыши
- Извлечение мыши геномной ДНК из пальца или хвост образцов, используя набор для экстракции ДНК, согласно инструкциям производителя (см. Таблицу материалы).
- Определение 5' и 3' Джанкшен забивные событий с помощью 200-400 нг геномной ДНК, измеряется УФ вид спектрометрии как шаблон для выполнения amplification ПЦР.
- Активация ДНК-полимеразы на 95 ° C за 5 мин и выполнять ПЦР для 38 циклов при 95 ° C за 30 сек, 60 ° C за 30 s и 72 ° C в течение 1 мин (1 мин/1 КБ), с расширением окончательный при 72 ° C для 10 мин. Для 5' Джанкшен используйте вперед грунт на вверх по течению от HAL, с обратной один на стук в фрагмент (p2A-mCherry). А 3' Джанкшен используйте вперед грунт на стук в фрагмент (p2A-mCherry), с тем обратный по течению Хар (Таблица 1).
- Запуск 6 мкл продукта PCR на геле агарозы 1% в 1 × буфер TAE и проверьте размер ожидаемых фрагментов. Затем проверьте их ДНК последовательности (рис.D).
3. HMEJ-основанный в Vivo генома редактирования в гепатоцитах
- Получателей C57BL/6J мышь (8 недель) в удерживающего устройства и положить хвост через щели.
- Смешайте HMEJ доноров векторов (30 мкг) и векторы выражения spCas9 (30 мкг) в 2 мл физраствора. Для управления эксперимента приостановите HMEJ доноров векторов (30 мкг) в 2 мл физраствора (рисA).
- Очистите хвост мыши с 70% этиловом спирте. Вставка иглу в хвост вен и плазмида ДНК раствор в течение 5-7 s. Удалите иглу и отпустите кнопку мыши из удерживающего устройства.
- Пожертвовать мышей, CO2 анестезии после 5-9 дней после инъекции. Perfuse transcardially мышей с 0,9% физиологического раствора, после чего параформальдегида 4%, с использованием перистальтического насоса и исправить печени на ночь при 4 ° C.
- Обезвоживания тканей, с использованием 30% сахарозы на ночь, до тех пор, пока он тонет в нижней части трубки.
- В разделе замороженные ткани на толщину 10 мкм для печеночных проб.
- Промыть в разделах три раза в 0,1 М фосфат амортизированное (PB) и инкубировать их с основного антитела: кролик анти mCherry (разводят в 5% NGS) на ночь при 4 ° C.
- Вымойте секции три раза в PB и затем инкубировать их с вторичные антитела: Cy3-AffiniPure коза анти кролик IgG втечение 2 ч при комнатной температуре на орбитальный шейкер.
- Изображение в разделах с DAPI 20 мин и горе с глицерином на стеклянных вставках для дальнейшего наблюдения флуоресцирования (рис. 3B).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
HMEJ-основанные геном редактирования в эмбрионов мыши: Чтобы определить стук в эффективности метода, основанного на HMEJ в мыши зигот, мы поставляли Cas9 мРНК, sgRNA ориентации генов Cdx2 и HMEJ доноров в мыши зигот, который был разработан для предохранителя p2A-mCherry Репортер ген для последнего кодон Cdx2 гена (рисA). Вводят зигот превратился в бластоцисты в культуре. Для оценки эффективности забивные, мы проанализировали флуоресценции mCherry с флуоресцентный Микроскоп, и мы обнаружили, что 12,9% бластоцисты, получающих HMEJ доноров были положительными для mCherry, который строго была выражена в трофоэктодерму (цифры 2B 2 C). По виртуализации ПЦР позитивные мышей, мы также обнаружили, что все изучить интеграционные мероприятия были точно в кадр интеграции на 5' и 3'-перекрестки (Рисунок 2D).
HMEJ-основанные геном редактирования во взрослых тканях и HMEJ-опосредованной генной терапии: Расследовать ли изменения на основе HMEJ генома может применяться во взрослых тканях, мы вставить кассету mCherry прямо перед стоп-кодон гена Actb , преобразователя Actb- HMEJ конструкции C57/B6J мыши печень, хвост вен гидродинамические впрыска (рисA). После 7 дней после инъекции мы обнаружили, что почти половина из transfected гепатоцитов выражена mCherry, как витражи на печени участках (рис. 3B).
Изучить возможность использования стратегии на основе HMEJ для генной терапии, мы использовали fumarylacetoacetate гидролазы (фа)-недостаточно мышей. Фа- / - мышь является устоявшейся наследственной Тирозинемия тип I (ИВТ) мыши модель, которая затаивает вставки фрагмента в 5 экзона гена Фах , вызывая мутации фреймшифт в следующей последовательности23. Для поддержания фа- / - мышей, мы относились фа- / - мышей с ингибитором вверх по течению от тирозин катаболические пути, 2-(2-nitro-4-trifluoromethylbenzoyl)-1,3-cyclohexanedione (NTBC)24. Здесь мы устанавливаем чтобы увидеть ли MMEJ - и HMEJ-опосредованной гена коррекции может спасти Fah мутации в фа- / - мышь. Мы эжекции вводят Cas9 конструкция вместе с фа- MMEJ или фа- HMEJ конструкции, предназначенные для вставки Fah cDNA экзона 5-14 в Интрон 4 фа гена, фа - / - мышь (печень Рисунок 3 C). одной недели после инъекции, NTBC был снят вызвать повреждение печени (рис. 3C). После вывода NTBC, фа-Исправлена гепатоцитов фа- / - мышей, получающих фа- HMEJ и Cas9 конструкций показали более эффективного распространения, чем метод на основе MMEJ (рис. 3D ).

Рисунок 1 : HMEJ-опосредованной целевых интеграции в vitro.
(A) экспериментальной схемы для отбора sgRNAs: шесть различных sgRNAs (Cdx2-sgRNA1 ~Cdx2-sgRNA6) вокруг стоп кодон Локус Cdx2 с выше ранг и пробить потенциалом, выбрали основывались на онлайн ТРИФОСФАТЫ дизайн инструмента. Protospacer последовательности смежных мотив (PAM) — красным. (B) экспериментальный дизайн: Cas9-ЦМВ-GFP выражение плазмид выражения sgRNA, Cas9 и ГФП были введены в N2a клетки. GFP+ клетки были разбиты на 3 день для пробирного инспектора. (C) сюрвейера проба для ориентации Cdx2 : 6 различных sgRNAs были разработаны для пробирного инспектора. Нормальный N2a геномной ДНК клетки служит элемент управления. *, sgRNA, для Cdx2-2A-mCherry стучите в эксперимент. (D) Схематический обзор строительства HMEJ доноров с помощью Гибсон Ассамблеи. (E) Схематический обзор гена HMEJ-опосредованной, ориентация стратегии в локусе Cdx2 . HAL/HAR, влево/вправо гомологии руку; треугольники, sgRNA целевых сайтов; ИЗ / OR, Внешняя грунтовка реверса; Если / IR, внутренняя реверса грунтовка. Изменение от предыдущего доклада10рис. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 : Изменения генома в эмбрионов мыши через HMEJ-опосредованной целевых интеграции
(A) экспериментальной схемы микроинъекции: смесь Cas9 мРНК (100 нг/мкл), sgRNA (50 нг/мкл) и доноров плазмид (100 нг/мкл) вводили в мыши зигот. (B) представитель флуоресценции изображения эмбрионов мыши, под редакцией HMEJ стратегии. Бар, 20 мкм. (C) стучите в эффективности указывается процент mCherry+ бластоцисты. Номер выше каждый бар, Общая бластоцисты подсчитано. (D) анализа гена редактировать мышей в локусе Cdx2 последовательности. Продукты PCR, усиливается от 5' и 3' Джанкшен сайтов были упорядочены. Плеча, гомологии; фиолетовый, p2A; красный, mCherry; Хар или HAL, гомологичных руку вправо или влево. Пунктирные линии Марк региона опущены для ясности. Изменение от предыдущего доклада10рис. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3 : HMEJ-опосредованной целевых интеграции в vivo.
(A) Схематичный обзор инъекции Вену гидродинамических хвост. Смесь плазмид, выражая доноров последовательность и sgRNA и выразив spCas9 плазмиды были доставлены в печень через инъекции Вену гидродинамических хвост. (B) представитель иммунофлюоресценции изображения гепатоцитов. Печени разделы были собраны 7 дней поста инъекций. Линейки, 50 мкм. GFP, transfected клеток. Плазмиды (C) либо MMEJ - или HMEJ-опосредованной гена замены стратегии предназначены для вставки Fah cDNA экзона 5-14 в Интрон 4 фа гена были доставлены в фа- / - мышь печень гидродинамических инъекции. NTBC на: фа- / - мышей были сохранены на NTBC воды; NTBC выкл: вывод NTBC воды (в первый день NTBC вывода был определен как день 0, который является 7-й день после инъекции). (D) Fah иммуногистохимия окрашивание участков печени от фа- / - мышей вводят с MMEJ или HMEJ плазмиды. Линейки, 100 мкм. рисунок изменения из предыдущих докладах5,10. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Наиболее важные шаги в строительстве HMEJ плазмид доноров являются: (1) выбор sgRNA с высокой эффективностью расщепления ДНК и низкой расстояние между sgRNA резки и стоп-кодон и (2) надлежащего строительства HMEJ доноров. ТРИФОСФАТЫ/Cas9-опосредованной расщепление на обоих трансген доноров вектор (содержащие sgRNA целевые сайты и ~ 800 bp гомологии оружия) и целевых генома необходима для эффективного и точного целенаправленной интеграции в vivo. Наиболее важные шаги поколения забивные мышей с использованием метода на основе HMEJ являются: (1) подготовки высокого качества Cas9 мРНК и sgRNA (не дегенерации существует в мРНК Cas9 и sgRNA) и (2) подготовка доноров плазмида HMEJ высокого качества. Плазмида показывает никакого токсического эффекта на эмбриональное развитие.
Недавно метод, основанный на NHEJ для эффективного в vivo генома редактирования8также сообщалось. Тем не менее различные виды мутаций indel обычно склоняли развязках, как описано в предыдущих докладах8, что делает его трудно добиться точного интеграции. Здесь на основе HMEJ стратегии, которые мы описали выше показали точные целевые интеграции с вряд ли indel мутации. Таким образом стратегия на основе HMEJ может быть идеальной платформой для замены мутировавших последовательности (например, Точечная мутация) с правильным, которая не применима для метода на основе NHEJ.
Мозаичностью является серьезной проблемой для гена редактирования в эмбрионов. Инъекции Cas9 белка вместо мРНК на ранее эмбриональной стадии может достичь трансген стук в стадии одной ячейки без мозаичностью. Для клинического применения поставка систем ТРИФОСФАТЫ/Cas9 во взрослых тканях до сих пор сложно.
Есть много будущих потенциальных использует редактирования на основе HMEJ геном. Он может использоваться для создания генетически модифицированных животных моделей. Учитывая его высокой стук в эффективности в эмбрионов этот метод может значительно снизить животных число, необходимое для создания генетически модифицированных животных моделей и особенно открывает возможность возникновения генетических моделей нечеловеческих приматов. HMEJ-основанные геном редактирования может типы индивидуальных клеток трассировки линии во взрослых тканях, который особенно полезен для животных моделей, так как нет доступных моделях животных, таких как нечеловеческих приматов. Он может использоваться для целевых генной терапии: наиболее привлекательных применение стратегии на основе HMEJ является генная терапия для клиники использует. В этом исследовании, мы исправили Fah мутации наследственного Тирозинемия типа я мышей гидродинамических инъекции указанных векторов. Однако поставка системы ТРИФОСФАТЫ/Cas9 во взрослых тканях по-прежнему основной технической задачей для клинического применения, как гидродинамическая инъекции вряд ли выполняться в больных. В настоящее время дальнейшее совершенствование стратегии доставки срочно необходима прежде чем переводить этот метод, основанный на HMEJ в клинике.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Авторы не имеют ничего сообщать.
Acknowledgments
Эта работа была поддержана CAS стратегической приоритетной исследовательской программы (XDB02050007, XDA01010409), Национальный Hightech R & D программы (863 программы; 2015AA020307), Национальный фонд естественных наук Китая (NSFC предоставляет 31522037, 31500825, 31571509, 31522038), Китай молодежи тысяч талантов программа (HY), перерыв через проект Академии наук Китая, Шанхай городской комитет по науке и технике проекта (16JC1420202 HY), Министерство науки и техники Китая (наиболее; 2016YFA0100500).
Materials
| Name | Company | Catalog Number | Comments |
| pX330 | Addgene | 42230 | |
| pAAV vector | Addgene | 37083 | |
| pX260 | Addgene | 42229 | |
| AAV_Efs_hSpCas9_NLS_FLAG-SV40 | Addgene | 97307 | AAV vector for encoding a human codon-optimized SpCas9 driven by EFs promoter |
| AAV_Actb HMEJ donor_U6_sgRNA_EF1a_GFP_polyA | Addgene | 97308 | HMEJ donor for fusing a p2A-mCherry reporter to mouse Actb. EGFP driven by EF1a promoter and U6-driven sgRNAs targeting Actb. AAV backbone. |
| AAV_Cdx2 HMEJ donor | Addgene | 97319 | HMEJ donor for fusing a p2A-mCherry reporter to mouse Cdx2. |
| Lipofectamine 3000 Transfection Reagent | Life Technology | L3000015 | |
| Nuclease-Free Water | Life Technologies | AM9930 | |
| Bbs I | New England Biolabs | R0539S | |
| NEB Buffer 2 | New England Biolabs | B7002S | |
| T7 endonuclease I | New England Biolabs | M0302L | |
| NEBuilder HiFi DNA Assembly Master Mix | New England Biolabs | E2621L | |
| Plasmid EndoFree-Midi Kit | Qiagen | 12143 | |
| MMESSAGE MMACHINE T7 ULTRA | Life Technologies | AM1345 | |
| MEGACLEAR KIT 20 RXNS | Life Technologies | AM1908 | |
| MEGASHORTSCRIPT T7 KIT 25 RXNS | Life Technologies | AM1354 | |
| Flaming/Brown Micropipette Puller | Sutter Instrument | P-97 | Micropipette Puller (parameters: heat, 74; pull, 60; velocity, 80; time/delay, 200; pressure, 300) |
| Borosilicate glass | Sutter Instrument | B100-78-10 | type of capillaries (outer diameter 1.0 mm, inner diameter 0.78 mm with filament) |
| FemtoJet microinjector | Eppendorf | ||
| Freezing microtome | Leica | CM1950-Cryostat | thickness of 40 μm for brain, 10 μm for liver |
| Rabbit anti-mCherry | GeneTex | ||
| Cy3-AffiniPure Goat Anti-Rabbit IgG | Jackson Immunoresearch | ||
| DMEM | Gibco | 11965092 | |
| FBS | Gibco | 10099141 | |
| NEAA | Gibco | 11140050 | |
| Pen,Strep,Glutamine | Gibco | 10378016 | |
| Gel Extraction Kit | Omega | D2500-02 | |
| FACS | BD AriaII | ||
| PMSG | Ningbo Sansheng Medicine | S141004 | |
| HCG | Ningbo Sansheng Medicine | B141002 | |
| Cytochalasin B | Sigma | CAT#C6762 | |
| KSOM+AA with D-Glucose and Phenol Red | Millipore | CAT#MR-106-D | |
| M2 Medium with Phenol Red | Millipore | CAT#MR-015-D | |
| Mineral oil | Sigma |
References
- Yang, H., et al. Generation of Mice Carrying Reporter and Conditional Alleles by CRISPR/Cas-Mediated Genome Engineering. Cell. 154 (6), 1370-1379 (2013).
- Hockemeyer, D., et al. Genetic engineering of human pluripotent cells using TALE nucleases. Nature Biotechnology. 29 (8), 731-734 (2011).
- Nakade, S., et al. Microhomology-mediated end-joining-dependent integration of donor DNA in cells and animals using TALENs and CRISPR/Cas9. Nature Communications. 5, 5560 (2014).
- Hisano, Y., et al. Precise in-frame integration of exogenous DNA mediated by CRISPR/Cas9 system in zebrafish. Scientific reports. 5, 8841 (2015).
- Yao, X., et al. Cas9 - Mediated Precise Targeted Integration In Vivo Using a Double Cut Donor with Short Homology Arms. EBioMedicine. , (2017).
- Auer, T. O., Duroure, K., De Cian, A., Concordet, J. P., Del Bene, F. Highly efficient CRISPR/Cas9-mediated knock-in in zebrafish by homology-independent DNA repair. Genome research. 24 (1), 142-153 (2014).
- Maresca, M., Lin, V. G., Guo, N., Yang, Y. Obligate ligation-gated recombination (ObLiGaRe): custom-designed nuclease-mediated targeted integration through nonhomologous end joining. Genome Research. 23 (3), 539-546 (2013).
- Suzuki, K., et al. In vivo genome editing via CRISPR/Cas9 mediated homology-independent targeted integration. Nature. 540 (7631), 144-149 (2016).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Yao, X., et al. Homology-mediated end joining-based targeted integration using CRISPR/Cas9. Cell Research. 27 (6), 801-814 (2017).
- Han, D. W., et al. Direct reprogramming of fibroblasts into epiblast stem cells. Nature Cell Biology. 13 (1), 66-71 (2011).
- Han, D. W., et al. Direct Reprogramming of Fibroblasts into Neural Stem Cells by Defined Factors. Cell Stem Cell. , (2012).
- Ambasudhan, R., et al. Direct reprogramming of adult human fibroblasts to functional neurons under defined conditions. Cell Stem Cell. 9 (2), 113-118 (2011).
- Sparman, M., et al. Epigenetic reprogramming by somatic cell nuclear transfer in primates. Stem Cells. 27 (6), 1255-1264 (2009).
- Schatten, G., Mitalipov, S. Developmental biology: Transgenic primate offspring. Nature. 459 (7246), 515-516 (2009).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nature Biotechnology. 31 (9), 827-832 (2013).
- Cong, L., et al. Multiplex Genome Engineering Using CRISPR/Cas Systems. Science. 339 (6121), 819-823 (2013).
- Quadros, R. M., et al. Easi-CRISPR: a robust method for one-step generation of mice carrying conditional and insertion alleles using long ssDNA donors and CRISPR ribonucleoproteins. Genome Biology. 18 (1), 92 (2017).
- Park, K. E., et al. Targeted Gene Knockin in Porcine Somatic Cells Using CRISPR/Cas Ribonucleoproteins. International journal of molecular sciences. 217 (6), (2016).
- Woo, J. W., et al. DNA-free genome editing in plants with preassembled CRISPR-Cas9 ribonucleoproteins. Nature biotechnology. 33 (11), 1162-1164 (2015).
- Harms, D. W., et al. Mouse Genome Editing Using the CRISPR/Cas System. Current protocols in human genetics. 83, 11-27 (2014).
- Yang, H., Wang, H., Jaenisch, R. Generating genetically modified mice using CRISPR/Cas-mediated genome engineering. Nature protocols. 9 (8), 1956-1968 (2014).
- Grompe, M., et al. Loss of Fumarylacetoacetate Hydrolase Is Responsible for the Neonatal Hepatic-Dysfunction Phenotype of Lethal Albino Mice. Genes & development. 7 (12), 2298-2307 (1993).
- Paulk, N. K., et al. Adeno-associated virus gene repair corrects a mouse model of hereditary tyrosinemia in vivo. Hepatology. 51 (4), 1200-1208 (2010).
Tags
Генетика выпуск 133 ТРИФОСФАТЫ/Cas9 целенаправленной интеграции гомологии опосредованной конец присоединения в естественных условиях эмбрион генетически измененных мышей гидродинамические инъекцийErratum
Formal Correction: Erratum: CRISPR/Cas9-mediated Targeted Integration In Vivo Using a Homology-mediated End Joining-based Strategy
Posted by JoVE Editors on 03/10/2021.
Citeable Link.
An erratum was issued for: Studying TGF-β Signaling and TGF-β-induced Epithelial-to-mesenchymal Transition in Breast Cancer and Normal Cells. The phrases "surveyor assay" and "Surveyor Nuclease" have been updated to "T7E1 assay" to " T7 endonuclease I" respectively.
Step 1.2 in the Protocol has been updated from:
- Surveyor nuclease assay of sgRNA
NOTE: The targeting efficiency of the sgRNA used for the knock-in experiment is evaluated by surveyor nuclease assay (also known as T7 endonuclease I (T7EI) assay)17. Select the sgRNA with high DNA cleavage efficiency and a low distance between the sgRNA cutting site and the stop codon.
to:
- T7 endonuclease assay of sgRNA
NOTE: The targeting efficiency of the sgRNA used for the knock-in experiment is evaluated by T7 endonuclease (T7EI) assay17. Select the sgRNA with high DNA cleavage efficiency and a low distance between the sgRNA cutting site and the stop codon.
Figure 1 in the Representative Results has been updated from:
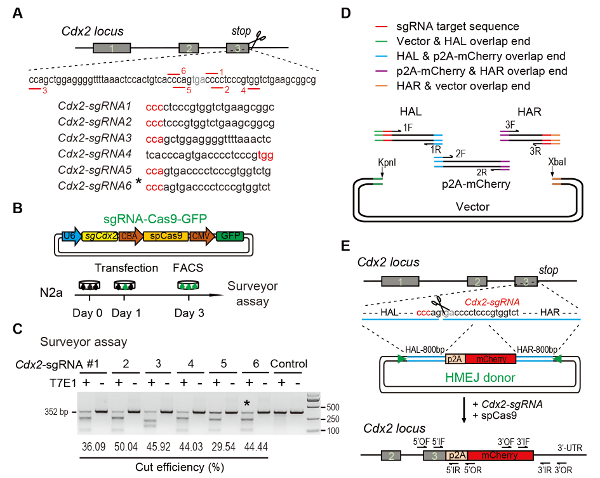
Figure 1: HMEJ-mediated targeted integration in vitro.
(A) Experimental scheme for selection of sgRNAs: Six different sgRNAs (Cdx2-sgRNA1~Cdx2-sgRNA6) around the stop codon of the Cdx2 locus with a higher rank and off-target potential were chosen based on online CRISPR design tool. The protospacer adjacent motif (PAM) sequence is in red. (B) Experimental design: The Cas9-CMV-GFP expression plasmids expressing sgRNA, Cas9, and GFP were introduced into N2a cells. GFP+ cells were sorted at day 3 for surveyor assay. (C) Surveyor assay for Cdx2 targeting: 6 different sgRNAs were designed for surveyor assay. Normal N2a cell genomic DNA serves as control. *, the sgRNA used for Cdx2-2A-mCherry knock-in experiment. (D) Schematic overview of construction of HMEJ donors using Gibson assembly. (E) Schematic overview of HMEJ-mediated gene targeting strategy at Cdx2 locus. HAL/HAR, left/right homology arm; triangles, sgRNA target sites; OF/OR, outer forward/reverse primer; IF/IR, inner forward/reverse primer. Figure modified from previous report10. Please click here to view a larger version of this figure.
to:
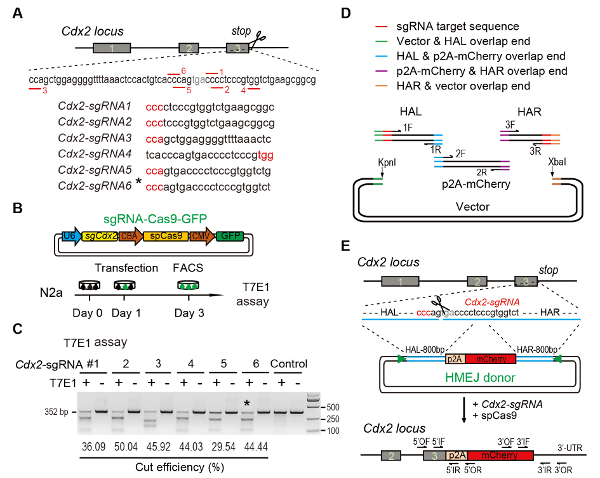
Figure 1: HMEJ-mediated targeted integration in vitro.
(A) Experimental scheme for selection of sgRNAs: Six different sgRNAs (Cdx2-sgRNA1~Cdx2-sgRNA6) around the stop codon of the Cdx2 locus with a higher rank and off-target potential were chosen based on online CRISPR design tool. The protospacer adjacent motif (PAM) sequence is in red. (B) Experimental design: The Cas9-CMV-GFP expression plasmids expressing sgRNA, Cas9, and GFP were introduced into N2a cells. GFP+ cells were sorted at day 3 for T7EI assay. (C) T7EI assay for Cdx2 targeting: 6 different sgRNAs were designed for T7EI assay. Normal N2a cell genomic DNA serves as control. *, the sgRNA used for Cdx2-2A-mCherry knock-in experiment. (D) Schematic overview of construction of HMEJ donors using Gibson assembly. (E) Schematic overview of HMEJ-mediated gene targeting strategy at Cdx2 locus. HAL/HAR, left/right homology arm; triangles, sgRNA target sites; OF/OR, outer forward/reverse primer; IF/IR, inner forward/reverse primer. Figure modified from previous report10. Please click here to view a larger version of this figure.



