Summary
Een protocol voor de synthese van een 1,2-dithiolane gemodificeerde peptide en de karakterisatie van de supramoleculaire structuren die voortvloeien uit de peptide zelf-assemblage.
Abstract
Dit verslag richt zich op de synthese van een N-terminus 1,2-dithiolane gemodificeerde zelfassemblerende peptide en de karakterisatie van de resulterende zelf geassembleerd supramoleculaire structuren. De synthetische route maakt gebruik van solid-phase peptide synthese met de koppeling van de op-hars van de dithiolane voorloper molecule, 3-(acetylthio) -2-(acetylthiomethyl) propanoic acid, en de magnetron-bijgewoonde thioacetate deprotection van de peptide N-terminus vóór definitieve splitsing van de hars aan opbrengst de 1,2-dithiolane bewerkt peptide. Na de zuivering van de krachtige vloeibare chromatografie (HPLC) van de 1,2-dithiolane peptide, afgeleid van de nucleating kern van de Aβ peptide geassocieerd met de ziekte van Alzheimer, is aangetoond dat de peptide zelf monteren in cross-β-amyloïde vezels. Protocollen bij het karakteriseren van de amyloïde vezels door Fourier-transform infrarood spectroscopie (FT-IR), circulair dichroïsme spectroscopie (CD) en transmissie-elektronenmicroscopie (TEM) worden gepresenteerd. De methoden van N-terminal met een 1,2-dithiolane groep aangebrachte goed gekarakteriseerd zelfassemblerende peptiden kunnen nu worden onderzocht als modelsystemen na vergadering wijziging strategieën ontwikkelen en dynamische covalente chemie verkennen op Supramoleculaire peptide nanofiber oppervlakken.
Introduction
De robuuste peptide bond vorming van chemie betrokken bij solid-phase peptide synthese en de mogelijkheid om controle van volgorde lengte en samenstelling maken de peptiden die zelf monteren in supramoleculaire structuren een zwaar onderzocht veld. De factoren die bepalen en stabiliseren van peptide zelf geassembleerde structuren, met inbegrip van de zijketen sterische en elektrostatische interacties, waterstof binding en hydrofobe effecten1, dienen als een set van regels voor het ontwerp. Aangezien het onderzoek naar deze fundamentele ontwerpregels vooruitgang blijft, de logische volgende stap in peptide zelf-assemblage gaat om uitbreiding van de diversiteit van peptide gebaseerde structuren en functies. Tijdens het zelf monteren van peptiden zijn een veelzijdige biomaterial die zijn gebruikt voor vele biomedische toepassingen door de peptide sequentie of vergadering voorwaarden2,3,4, de ontwikkeling van strategieën voor tuning na montage wijzigingen naar peptide nanofibers5,6,7,8,9 blijft een relatief onontgonnen terrein.
Dynamische bisulfide uitwisseling en thiol chemie aan de oppervlakte van supramoleculaire structuren is een gebied dat het potentieel heeft om nieuwe en functionele biomaterialen opleveren. De opneming van 1,2-dithiolane wordt (meestal een derivaat van liponzuur (la) of asparagusic zuur (aa)) zijn gemeld in liposomen systemen10,11, blok copolymeren12,13, en als het organiseren van ankers op oppervlakken14,15. Hierin, rapporteren we de synthese en de karakterisering van een zelfassemblerende peptide afgeleid van de nucleating kern van de Aβ peptide geassocieerd met de ziekte van Alzheimer die is gewijzigd om de N-terminus met een 1,2-dithiolane functionele groep16, 17. De resulterende supramoleculaire vezels dienen nu als een experimenteel platform te bestuderen van de bisulfide-uitwisseling en thiol reactiviteit op het supramoleculaire oppervlak van amyloïde vezels18.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. synthese en zuivering van 1,2-Dithiolane gemodificeerde Peptide
- Synthese van dithiolane precursor, 3-(acetylthio) -2-19propanoic acid (acetylthiomethyl).
- Voeg 1 g 3-bromo - 2-(bromomethyl) propionzuur (1 equiv.) opgelost in een minimale hoeveelheid van 1 M NaOH (ongeveer 4 mL) in een maatkolf van 25 mL ronde bodem reactie met roeren bij 55 ° C. Zegel van de reactiekolf met een septa en onder stikstof atmosfeer te plaatsen.
- Bereid een oplossing met 1,49 g kalium thioacetate (3.2 equiv.) in 4 mL gedeïoniseerd water en 3 mL 2 M zwavelzuur (H2SO4) maken thioacetic zuur in situ.
- Trek de thioacetic zure oplossing in een plastic wegwerp 10 mL spuit en plaats een naald op de spuit. Het mengsel ontkleuring aan toevoegen de reactiekolf door via de septa met de naald piercing. De reactie 's nachts blijven bij 55 ° C.
- De reactie door Dunnelaagchromatografie (TLC) op silica gel 60 F254 platen met behulp van een mengsel van methanol en dichloormethaan (1:9) volgen. Visualiseren van de voortgang van de reactie door broomkresolpurper groene vlek. Het product heeft een R-f = 0.57.
- Nadat de reactie volledig en afgekoeld tot kamertemperatuur is, breng dit mengsel aan de pH 1 met 2 M H2dus4. Een lichtgele olie scheidt uit oplossing.
- Uitpakken van het product met koude chloroform (40 mL x 3). De organische lagen combineren en droog over magnesium-sulfaat. Verwijder de chloroform onder verminderde druk.
- De identiteit bevestigen van het geïsoleerde product, 1, met nucleaire magnetische resonantie (NMR), infraroodspectroscopie zoals in cijfers 1B en C. Verwachten de volgende resultaten: 1H NMR, CDCl3, 300 MHz: d = 10.1 (b, 1 H), 3.2 (m, 4 H), 2.9 (m, 1 H) 2.4 (s, 6 H); 13 C-NMR, CDCl3, 75 MHz: d = 195,1 (CH3COS-), 177.6 (-COOH), 45.1 (-CH2S-), 30,5 (C-H), 29.2 (-SCOCH3).
Opmerking: Het product is een lichtgele olie en heeft een totale rendement van 83%. Gebruik van het product zonder verdere zuivering.
- SPPS en op-hars koppeling van de voorloper van de Dithiolane
Opmerking: De solid-phase peptide synthese hieronder beschreven vond plaats op een geautomatiseerde peptide synthesizer, na de aanbevolen fabrikant protocollen. Instellingen en reagentia kunnen worden aangepast voor andere commerciële instrumenten of bij het gebruik van gespecialiseerde aminozuren.- Weeg 0.156 g van Rink amide 4-methylbenzhydrylamine (MBHA) hars (0.1 mmol) en plaats in een reactievat. De hars in dimethylformamide (DMF) gedurende ten minste 15 minuten vóór de aanvang van de synthese opzwellen.
- Weeg uit 4 equivalenten van elke fluorenylmethyloxycarbonyl (Fmoc) beschermde aminozuur (0.4 mmol) in de volgorde en de 0.152 g van N, N, N', N'- tetramethyl-O-(1H- benotriazol-1-yl) uranium hexafluorfosfaat (0.4 mmol, HBTU) voor elk aminozuur in de reeks. Elke cartridge bevat zowel het aminozuur Fmoc-beschermd als HBTU.
- Na het uitvoeren van alle pre synthese controleert op de synthesizer (vullen reagentia, gespoeld reagens lijnen en drukkend alle reagens flessen), plaatst u de cartridges aminozuur in de carrousel in de C' n ' terminus richting. Plaats een lege cassette na de laatste aminozuur positie voor de laatste stap van de N-terminal Fmoc deprotection.
- Het synthetiseren van de peptide met behulp van de standaard aanbevolen instellingen.
- DEPROTECT de groep van de Fmoc uit de hars met 5 mL van 20% piperidine in DMF (5 min x 2).
- Wassen van de hars met DMF (6 x 5 mL) voordat de koppeling stap.
- Voor een stap één koppeling toevoegen 4 mL 0,4 M N-Methylmorfoline DMF aan het aminozuur Fmoc-beschermd en HBTU. Activeren van het aminozuur Fmoc beveiligde oplossing voor 30 s vóór de overbrenging van de oplossing naar het reactievat.
Opmerking: De geautomatiseerde peptide synthesizer mengt de hars en de oplossing door borrelende N2 gas elke 30 s voor 20 min terwijl de koppeling reactie vindt plaats. Voor handmatige peptide synthese, plaatst u het reactievat op een roteerschudapparaat bij lage snelheid voor de duur van de koppeling stap. - Giet de oplossing en wassen van de hars met DMF (3 x 5 mL).
- Herhaal stap 1.2.4.1 via 1.2.4.4 voor elk aminozuur Fmoc-beschermd in de C' n '-terminus richting voor het synthetiseren van de peptide van belang.
- Na de laatste N-terminal deprotection stap, breng het hars in een wegwerp fritted spuit. Wassen van de hars met DMF (3 x 5 mL) en dichloormethaan (DCM, 3 x 5 mL).
Opmerking: De hars kan na de DCM wassen in een vacuüm exsiccator worden opgeslagen. Als de hars zich bevond vóór de koppeling, ervoor zorgen om het zwellen van de hars in DMF voordat de koppeling reactie. - Koppel de voorloper van de dithiolane (1) aan de N-terminus van de op-hars peptide door 4 equivalenten van 1, 5 mL DMF, 4 equivalenten van HBTU en 10 equivalenten van N, N-diisopropylethylamine (DIPEA) toe te voegen. Vooraf activeren de koppeling mengsel gedurende 10 minuten voordat u toevoegt aan de hars met fritted spuit.
- Schud de reactie van de koppeling voor 2 h. Na 2 uur, wassen van de hars met DMF (3 x 5 mL) en herhaalt u de reactie van de koppeling met 's nachts te schudden.
- Na de tweede koppeling, wassen de hars met DMF (3 x 5 mL) en DCM (3 x 5 mL).
Opmerking: De hars kan worden achtergelaten bij dit punt onder vacuüm tot decollete.
- Thioacetate Deprotection en Peptide decolleté van hars
- Om de groep van de thioacetate uit de voorloper van de dithiolane N-terminus deprotect, de gedroogde hars overbrengen in een magnetron reactiebuis van 10 mL en voeg toe 2 mL DMF. Laat de hars te zwellen, een kleine magnetische roer bar toevoegen aan het betrokken vaartuig en resuspendeer met een lage snelheid van magnetische roeren gedurende 15 minuten.
- Voeg 2 mL geconcentreerd ammoniumhydroxide, cap van het reactievat met de siliconen septa en het reactievat te plaatsen in een reactor van de magnetron met de instellingen van de magnetron van 75 ° C voor 45 min met roeren.
- Nadat de magnetron reactie is voltooid, breng het hars in een schone wegwerp fritted spuit. Wassen met DMF (2 x 5 mL) en methanol (MeOH, 2 x 5 mL).
- Het toevoegen van een oplossing van geconcentreerd ammoniumhydroxide in methanol (1:4), voor een totaal volume van 5 mL. Laten schudden overnachting te verhogen intramoleculaire oxidatie van Zwavelbrug in dithiolane ring.
- Wassen van de hars met MeOH (2 x 5 mL) en DCM (3 x 5 mL).
Opmerking: De gedroogde hars kan worden opgeslagen in een vacuüm exsiccator op dit punt. - De splijting cocktail aan de hars met spuit met voorzichtig schudden voor 1,5 h toevoegen. Het splijten cocktail gebruikt is 95% trifluorazijnzuur (TFA), 2,5% triisopropylsilane (TIPS) en 2,5% water op een totaal volume van 5 mL.
Let op: Werken onder chemische zuurkast alleen. TFA is vluchtige en bijtende.
Opmerking: Voor de meeste peptide reeksen en aminozuur sidechain bescherming van groepen, de bovenstaande decollete cocktail oplossing is voldoende; echter alternatieve decollete cocktails kunnen nodig zijn voor bepaalde aminozuur zijketen groepen (in bepaalde peptiden met Cys, marktgericht, Trp en Arg) of andere hars chemie20te beschermen. - Het neerslaan van de ruwe peptide in 25 mL koude diethylether in een conische tube van 50 mL door toevoeging van de dropwise uit de fritted spuit. De peptide precipitaten als een witte vaste stof. De diethylether pellet de peptide door centrifugeren bij 1300 x g gedurende 10 min. zorgvuldig decanteren in een aparte container voor afvalinzameling.
- Voeg een ander 25 mL diethylether aan de conische buis en resuspendeer de neerslag door vortexing. Herhaal het centrifugeren op 1300 x g gedurende 10 minuten en decanteren van de diethylether opnieuw. Droog de pellet onder vacuüm.
- Zuivering van 1,2-Dithiolane bewerkt Peptide
Opmerking: Zuiveren de ruwe peptide door omgekeerde fase-HPLC. Verzamelen en combineren de peptide pieken en bevestigen van de massa door MALDI-TOF massa spectrometrie.- Los van de ruwe peptide pellet in minimale hoeveelheid acetonitril met 0,1% TFA. Als gevolg van de peptide hydrophobicity en aggregatie neiging, Verwarm zachtjes het monster bij 40 ° C tot hulp in oplosbaarheid.
Opmerking: Vermijd hogere temperaturen en ultrasoonapparaat van de peptide om te voorkomen dat potentiële bisulfide uitwisseling reacties21,22,23. - Om voor te bereiden 1 mL van ruwe peptide voor HPLC zuivering, toevoegen 400 μL van geconcentreerde peptide voorraad acetonitril aan 600 μL van H2O met 0,1% TFA en filter door een 22 μm spuit filter in een flesje van HPLC. Een extra 5% isopropanol kan worden toegevoegd om te voorkomen dat de peptide aggregatie en neerslag.
- Zuiveren van de peptide C-18 semi-preparatieve kolom met een debiet van 3 mL/min over een lineair verloop 15-55% acetonitril in 20 min. Set de UV-detectoren naar 222 nm (amide backbone) en 330 nm (Zwavelbrug). Verzamelen en combineren de pieken van belang (figuur 2A).
- Bevestig de peptide product massa door MALDI-TOF massa spectrometer in de reflectron modus (figuur 2B). P.a., meng 0,5 μL van verzamelde piek op de MALDI-plaat met 0,5 μL van 2,5-dihydroxybenzoic zuur (DHB) matrix (10 mg/mL DHB in 50% acetonitril, 0,1% TFA).
Opmerking: Common adducten in MALDI-TOF massaspectrometrie omvatten het natrium en kaliumzout adduct ([M + nb]+ en [M + K]+) pieken. Ontzouten van het monster vóór de analyse wordt aanbevolen als het zout adduct pieken het signaal van de belangrijkste piek [M + H]+ onderdrukken. Daarnaast een geoxideerde piek van [M + O]+ ook in de 1,2-dithiolane bewerkt peptide wordt ontdekt. Een verslag over laser geïnduceerde oxidatie van de MALDI-ionisatie met behulp van DHB matrix suggereert dat factoren zoals monster concentratie, oplosmiddel en intensiteit van de laser kunnen worden aangepast voor het beperken van de MALDI geïnduceerde oxidatie artefact24. - Lyophilize na MALDI-TOF bevestiging van de juiste massa, de peptide na flash bevriezing. Houd het gelyofiliseerd peptide poeder onder vacuüm tot vergadering.
- Los van de ruwe peptide pellet in minimale hoeveelheid acetonitril met 0,1% TFA. Als gevolg van de peptide hydrophobicity en aggregatie neiging, Verwarm zachtjes het monster bij 40 ° C tot hulp in oplosbaarheid.
2. karakterisering van supramoleculaire structuren zelf-assemblage
-
Vorming van amyloïde vezels
- Weeg 1 mg van het poeder van de peptide met behulp van een analytische balans om te bereiden zelf-assemblage oplossing. Los in een mengsel (pH 7.5) van 20% acetonitril en 10 mM (4-(2-hydroxyethyl)-1-piperazineethanesulfonic zuur (HEPES) in een 1,5 mL microcentrifuge buis, tot een uiteindelijke concentratie van 1 mg/mL peptide vergadering mengsel. Vortex de vergadering-oplossing en laat ze monteren bij kamertemperatuur.
-
Spectroscopische karakterisering van amyloïde vezels
- Volg de peptide assemblage proces via Fourier-transform infrarood spectroscopie van (FTIR) om de paar dagen. Een brede piek gecentreerd rond 1670 cm-1 is de handtekening van de IR die voortvloeien uit gedemonteerde peptiden in de monster17. De peptide vergadering monsters nemen meestal één tot twee weken voor de brede gedemonteerde piek te verdwijnen en rijping te bereiken.
- Droog een aliquoot deel van 8-10 μL van de vergadering-oplossing als een dunne film op de ATR diamant kristallen. Toezicht op de verdwijning van de piek van een groot en breed water uit 1640 tot 1630 cm-1 als de droge film vormen.
- Verwerven IR spectra van 1500-1800 cm-1 gemiddeld 50 scans met een resolutie van 2 cm-1 . Verwerven en aftrekken van de scans van de achtergrond voorafgaand aan elke steekproef scan. De IR-handtekening voor montage van de β-sheet is een scherpe piek tussen 1625 en 1635 cm-1 (figuur 3A)25,26.
- Het karakteriseren van de vergadering van de peptide in β-sheet rijke supramoleculaire structuren door circulair dichroïsme (CD). Het opnemen van de spectra met behulp van een CD-spectropolarimeter met een Peltier temperatuur controlesysteem.
- Pipetteer 30 μL van de oplossing van de vergadering in een 0.1 mm pad lengte microcuvette.
Opmerking: De houder van een cel is nodig om de klem en de positie van de cel korte pad lengte in het instrument. - Voor elke spectrum, stelt u het CD-instrument op de volgende parameters: scannen golflengten van 300 nm tot 180 nm, scannen snelheid van 100/min, bandbreedte van 1 nm, 25 ° C, gemiddelde van drie scans.
- Verzamel een spectrum van de buffer (20% acetonitril/10 mM HEPES, pH 7.5) en aftrekken van elke steekproef scan als controle. De handtekening van de CD voor β-sheets is dat een minimale ellipsiteit gecentreerd rond 220 nm (figuur 3B)27.
- Pipetteer 30 μL van de oplossing van de vergadering in een 0.1 mm pad lengte microcuvette.
- Volg de peptide assemblage proces via Fourier-transform infrarood spectroscopie van (FTIR) om de paar dagen. Een brede piek gecentreerd rond 1670 cm-1 is de handtekening van de IR die voortvloeien uit gedemonteerde peptiden in de monster17. De peptide vergadering monsters nemen meestal één tot twee weken voor de brede gedemonteerde piek te verdwijnen en rijping te bereiken.
-
Microscopie van amyloïde vezels
- Het toestaan van twee tot drie weken voor de peptide monsters om te rijpen in de β-sheet rijke supramoleculaire structuren.
Opmerking: De vergaderingen kunnen worden beeld met behulp van transmissie-elektronenmicroscopie (TEM) in eerdere stadia van de assemblage proces ook.- Pipetteer 10 μL van de peptide montage oplossing op het oppervlak van TEM koolstof raster.
Opmerking: Wees voorzichtig niet te raken van het uiteinde van de pipet op het oppervlak van het raster. Hoge precisie, zelfsluitende pincet zijn gebruikt om het raster TEM tijdens voorbereiding. - Wacht 1-2 min zodat de vergaderingen te adsorberen op het oppervlak van het raster. Verwijder overtollige monster door filterpapier aan de rand van het raster aan te raken.
- Bereid een 2% uranyl acetaat vlek door 100 μl van gedeïoniseerd water toe te voegen aan verkrijgbare 4% uranyl acetaat oplossing. Pipetteer 10 μL van de 2% uranyl acetaat vlek op het oppervlak van het raster en incubeer gedurende 2-3 min. Na de incubatie, verwijderen van overtollige vlek door filterpapier aan de rand van het raster aan te raken.
- Plaats de TEM-rasters in een vacuüm exsiccator 's nachts. Bewaren onder vacuüm tot imaging.
- Het imago van de bereide monsters met TEM (Figuur 3 c). Typische parameters voor microscopie zijn als volgt: beelden bij vergrotingen variërend van 9,300 X tot en met 23, 000 X, gloeidraad van wolfraam met een versnellende voltage van 120 kV.
Opmerking: ImageJ kan worden gebruikt voor het meten van de gemiddelde vezel breedte van de supramoleculaire structuur van verworven TEM beelden28.
Let op: Raadpleeg alle relevante gegevens omtrent de veiligheid (SDS) vóór gebruik. Verschillende chemische stoffen gebruikt in de synthese, zuivering, en karakterisering van de beschreven 1,2-dithiolane bewerkt zelfassemblerende peptiden bijtende of giftig zijn en mag alleen worden gebruikt onder een chemische zuurkast. Altijd gebruik maken van passende persoonlijke beschermingsmiddelen (met inbegrip van veiligheidsbril, laboratoriumjas, volledige lengte broek, gesloten-teen schoenen) bij het werken in het laboratorium.
- Pipetteer 10 μL van de peptide montage oplossing op het oppervlak van TEM koolstof raster.
- Het toestaan van twee tot drie weken voor de peptide monsters om te rijpen in de β-sheet rijke supramoleculaire structuren.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Afgezien van de eerste one-step-synthese van de molecule dithiolane voorloper, de rest van de 1,2-dithiolane bewerkt peptide synthese treedt op op een stevige steun (figuur 1A). De conversie van 3-bromo - 2-(bromomethyl) propionzuur 3-(acetylthio) -2-(acetylthiomethyl) propanoic acid, de voorloper van de dithiolane, wordt bevestigd door 1H en 13C-NMR (figuur 1B en C) voordat het is gekoppeld aan het vrije verkeer N-terminus amine van een peptide nog op-hars. De deprotection van thioacetate naar thiolen met ammoniak hydroxide wordt uitgevoerd met behulp van een magnetron reactor en de 1,2-dithiolane voordat de peptide 1,2-dithiolane gewijzigd is gekloofd uit de hars 's nachts in methanol is geoxideerd. De ruwe peptide wordt gezuiverd door omgekeerde fase HPLC (figuur 2A) en de massa van het product wordt bevestigd door de MALDI-TOF massa spectrometrie (figuur 2B).
De gezuiverde 1,2-dithiolane peptide assembleert zelf in volwassen amyloïde vezels gedurende 2-3 weken. FT-IR (Figuur 3 bis) en CD spectroscopie (figuur 3B) worden gebruikt om de assemblage proces te volgen en te karakteriseren de uitgebreide β-sheet-conformatie. De vezels zijn beeld door TEM (Figuur 3 c).
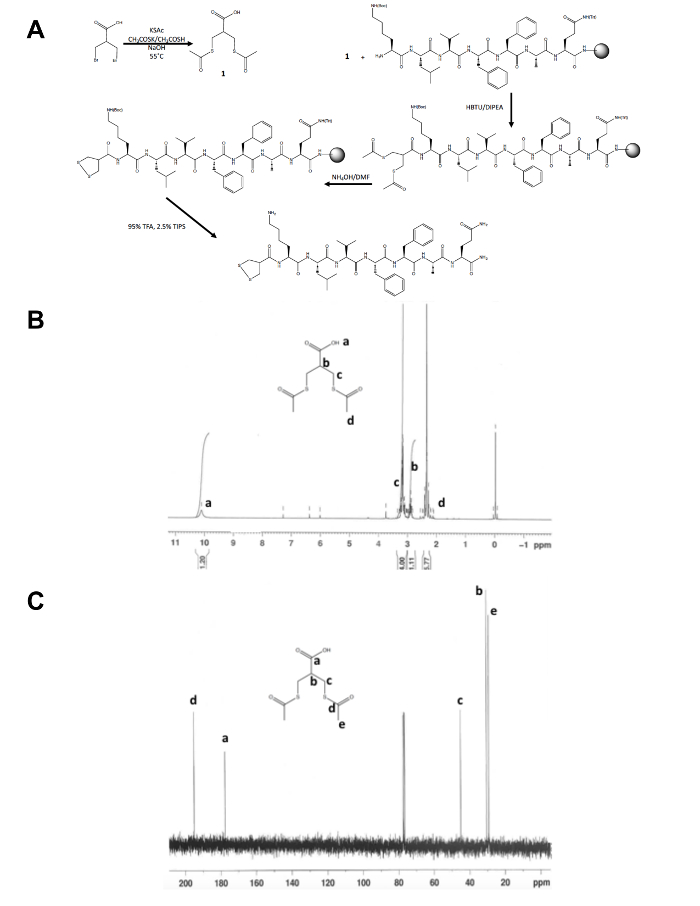
Figuur 1. Synthetische regeling voor de karakterisatie van 1,2-dithiolane voorloper molecuul. (A) synthetische schema van de definitieve 1,2-dithiolane bewerkt peptide, 1,2-dithiolane-KLVFFAQ-NH2. (B) 1H-NMR van 3-(acetylthio) -2 - propanoic acid (acetylthiomethyl) in CDCl,3 bij 300 MHz. (C)13C-NMR van 3-(acetylthio) -2-(acetylthiomethyl) propanoic acid in CDCl,3 op 75 MHz. het Klik hier voor een grotere versie van dit cijfer.

Figuur 2. Synthese van 1,2-dithiolane bewerkt peptide. (A) HPLC chromatogram van de zuivering van 1,2-dithiolane - KLVFFAQ-NH2. (B) MALDI-TOF massa spectrum van de belangrijkste piek van HPLC zuivering (retentietijd van ~17.5 min) in reflectron modus met behulp van DHB matrix bevestigt de berekende massa van 1,2-dithiolane-KLVFFAQ-NH2. Common adducten ook worden geïdentificeerd. Klik hier voor een grotere versie van dit cijfer.

Figuur 3. Supramoleculaire karakterisering van 1,2-dithiolane bewerkt peptide. (A) FT-IR van 1 mg/mL 1,2-dithiolane-KLVFFAQ-NH2 vezels geassembleerd in 10 mM HEPES, pH 7.5 in 20% CH3CN. De piek op 1627 cm-1 strookt met de peptiden geassembleerd in een β-sheet bevleesdheid. (B) CD van 1 mg/mL 1,2-dithiolane-KLVFFAQ-NH2 vezels geassembleerd in 10 mM HEPES, pH 7.5 in 20% CH3CN. De minimale op 218 ellipsiteit nm strookt met de peptiden geassembleerd in een β-sheet bevleesdheid. (C) beeld van de 1,2-dithiolane-KLVFFAQ-NH2 amyloïde vezel (negatieve vlek van 2% uranyl acetaat) door TEM. De bar van de schaal is 100 nm. Klik hier voor een grotere versie van dit cijfer.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Dit artikel behandelt de details van zowel de synthese en de zuivering van een N-terminal 1,2-dithiolane bewerkt zelfassemblerende peptide en de karakterisatie van de resulterende supramoleculaire structuren. De synthese van de 1,2-dithiolane peptide gemeld hier heeft voordelen, met inbegrip van een one-step synthese voor de productie van de dithiolane-precursor, 3-(acetylthio) -2-(acetylthiomethyl) propanoic acid, en de op-hars magnetron deprotection reactie van de voorloper thioacetate groep om de groep van de geoxideerde 1,2-dithiolane met behulp van ammonia, zoals een veiliger alternatief voor de giftige hydrazine deprotection gemeld eerder29te beschermen. De totale solid-phase peptide synthese van de 1,2-dithiolane peptide (figuur 1A) kan eenvoudig worden aangepast door het veranderen van de volgorde lengte en samenstelling, inclusief het gebruik van onnatuurlijke aminozuren Fmoc-beschermd, en C-terminal hars chemie aan veel verschillende onderzoek toepassingen.
Om te voorkomen dat ongewenste peptide bijproducten wanneer de aminozuren met nucleofiele zijketens of de aminozuren met de bescherming van groepen reactieve DISSOCIATIEPRODUCTEN daarvan hebben, moeten extra aaseters worden toegevoegd aan de cocktail van decollete20. Een splitsing van de test van een klein deel (minder dan 10% van de totale hars) kan worden uitgevoerd voordat de magnetron op-hars deprotection stap om ervoor te zorgen een hoge opbrengst reactie te koppelen. Met behulp van de kolom en HPLC voorwaarden beschreven in het verslag, GC de thioacetate beschermde 1,2-dithiolane voorloper peptide piek 5 min na de afgekoppeld gratis amine-peptide. Als een aanzienlijke hoeveelheid vrije amine peptide blijft, een andere koppeling stap met 3-(acetylthio) -2-(acetylthiomethyl) propanoic acid is aanbevolen. De intramoleculaire 1,2-dithiolane Zwavelbrug wordt ontdekt op de HPLC door monitoring van de zwakke disulfide binding absorptie bij 330 nm. De piek van de HPLC overeenkomt met de geoxideerde 1,2-dithiolane wordt bevestigd door het toevoegen van 100 L van 100 mM tris(2-carboxyethyl)phosphine(TCEP) op een steekproef van de peptide in een aparte HPLC uitvoeren. De TCEP verlaagd thiol peptide bevattende zal hebben een verschillende retentietijd dan de geoxideerde bisulfide peptide. De thiol peptide met GC ongeveer 1 min later dan de bisulfide peptide met behulp van de kolom en de voorwaarden beschreven in het verslag. Een geschikte alternatieve MALDI matrix voor peptides is α-cyano-4-hydroxycinnamic zuur (CHCA) en is bereid door toevoeging van 1 mL 50% acetonitril met 0,1% TFA met 5 mg CHCA. De monsters kunnen worden ontzout met behulp van een C18 zip-tip vóór de MALDI-TOF massa analyse als het zout adduct (nb+ en K+) pieken aanzienlijk de piek [M + H]+ onderdrukken.
De volgorde van de peptide gekozen voor deze studies is afgeleid van Nederlandse mutant van het Aβ-peptide geassocieerd met de ziekte van Alzheimer30, en is eerder aangetoond dat zelf monteren in amyloïde vezels van parallelle β-sheets16,17 . Zoals in de representatieve resultaten, figuur 3A-C, assembleert de 1,2-dithiolane-KLVFFAQ-NH2 peptide ook in amyloïde vezels. Het amide van de FTIR ik rekken gecentreerd op 1627cm-1 en CD ellipsiteit minimale op 218 nm zijn spectroscopische handtekeningen van β-sheet assemblages25,26,27, en het stuk van de carbonyl CO 1676 cm-1 overeenkomt met besteld glutamine zijketen interacties suggereren dat de peptiden in parallelle β-strengen16,31,32worden georganiseerd.
Transmissie Electronenmicroscopie beelden, met behulp van 2% uranyl acetaat negatieve vlek, Toon uitgebreide en kronkelende supramoleculaire vezels die ongeveer 10 zijn nm in breedte. De vezels van de N-terminale geacetyleerd peptide, Ac-KLVFFAQ-NH2, zijn glad en recht, met een iets grotere breedte van bijna 12 nm16. Aangezien voorbereiding TEM rasters en het verwerven van beelden een intensief proces van tijd is, is het beste om voor te bereiden van verschillende TEM rasters van hetzelfde monster vergadering tegelijk van het wisselende peptide concentraties. Een verdunde monster voorbereiden door TEM (1:50 of 1:100) naast de oorspronkelijke vergadering oplossing monster. De amyloïde vezels bij hoge concentraties kunnen houden aan het raster in de bosjes of patches en het verwerven van beelden van individuele vezels kan moeilijk worden. Het is belangrijk om te zien de randen van individuele vezels voor breedte metingen en de visualisatie van de vezel helicity is vaak verduisterd door overvolle monsters.
Zoals meer toepassingen met behulp van Supramoleculaire biomaterialen worden onderzocht, is er een noodzaak om potentieel reactieve functionele groepen die loodrecht op de zelf-assemblage proces in de zelfassemblerende monomeren. De in dit verslag beschreven methoden Markeer een op-hars benadering van de synthese van een 1,2-dithiolane bewerkt zelfassemblerende peptide en spectroscopische karakterisering van de supramoleculaire structuren.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs hebben niets te onthullen.
Acknowledgments
De auteurs wil Dr. B. Ellen Scanley bedanken voor haar technische opleiding en hulp bij gebruik van de TEM op de Connecticut State hogescholen en Universiteit (CSCU) centrum voor nanotechnologie en Dr. Ishita Mukerji Wesleyan Universiteit voor toegang tot haar CD spectrofotometer. Het werk die zijn gerapporteerd werd gedeeltelijk ondersteund door het Science Institute at Fairfield University, de NASA Connecticut ruimte Grant Consortium, en door de National Science Foundation onder Grant nummer CHE-1624774.
Materials
| Name | Company | Catalog Number | Comments |
| Rink amide MBHA resin, high load | Gyros Protein Technologies | RAM-5-HL | Avoid contact with skin and eyes; do not inhale |
| N,N-Dimethylformamide | Fisher Scientific | D119-4 | Flammable liquid and vapor; irritating to eyes and skin; Use personal protective equipment; keep away from open flame |
| Fmoc-L-Val-OH | Gyros Protein Technologies | FLA-25-V | Wear personal protective equipment; do not inhale |
| Fmoc-L-Leu-OH | Gyros Protein Technologies | FLA-25-L | Wear personal protective equipment; do not inhale |
| Fmoc-L-Lys(Boc)-OH | Gyros Protein Technologies | FLA-25-KBC | Wear personal protective equipment; do not inhale |
| Fmoc-L-Phe-OH | Gyros Protein Technologies | FLA-25-F | Wear personal protective equipment; do not inhale |
| Fmoc-L-Ala-OH | Gyros Protein Technologies | FLA-25-A | Wear personal protective equipment; do not inhale |
| Fmoc-L-Gln(Trt)-OH | Gyros Protein Technologies | FLA-25-QT | Wear personal protective equipment; do not inhale |
| N,N,N′,N′-Tetramethyl-O-(1H-benzotriazol-1-yl)uronium hexafluorophosphate | Gyros Protein Technologies | 26432 | Causes skin, eye and respiratory irritation; do not inhale; use under hood or in well ventilated area |
| 0.4 M N-methylmorpholine in DMF | Gyros Protein Technologies | PS3-MM-L | highly flammable; wear personal protective equipment; keep away from heat and keep container tightly closed; do not inhale or swallow; wash skin thoroughly after handling |
| 20% piperidine in DMF | Gyros Protein Technologies | PS3-PPR-L | Causes severe eye and skin burns; Flammable Liquid and vapor; Do not inhale |
| dichloromethane | Fisher Scientific | D37-4 | May cause cancer; Do not inhale; Wear personal protective equipment; use under hood only; if contacted rise with water for at least 15 minutes and obtain medical attention |
| acetonitrile | Fisher Scientific | A998-4 | Flammable; irritating to eyes; Use personal protective equipment; Use only under a fume hood; keep away from open flame or hot surface; if contacted rinse wiith water for at least 15 minutes and obtain medical attention |
| trifluoroacetic acid | Fisher Scientific | A116-50 | Causes severe burns; do not inhale; harmful to aquatic life; use personal protective equipment; use only under fume hood; if contacted rinse with water for at least 15 minutes and obain immediate medical attention |
| 4% uranyl acetate | Electron Microscopy Sciences | 22400-4 | Do not inhale; harmful to aquatic life |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Acros Organics | AC172571000 | Do not inhale; use outdoors or in well-ventilated area |
| nitrogen Gas | TechAir | Contents under pressure, may explode if heated | |
| 3-bromo-2-(bromomethyl)propionic acid | Alfa Aesar | AAA1963014 | Do not inhale; causes irritation to skin and eyes; corrosive |
| sodium hydroxide | Fisher Scientific | S318-100 | Use personal protective equipment; use only under fume hood; if contact rinse area for at least 15 minutes and obtain medical attention |
| potassium thioacetate | Acros Organics | AC221300250 | Causes skin and eye irritation; do not inhale; use personal protective equipment |
| sulfuric acid | Fisher Scientific | SA213 | Causes burns; keep away from water; keep away from combustible material; do not inhale; use personal protective equipment; if contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform-d | Acros Organics | AC320690075 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform | Fisher Scientific | C298-4 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| N,N-diisopropylethylamine | Acros Organics | AC367841000 | Highly flammable; harmful to aquatic life; wear personal protective equipment; do not swallow |
| ammonium hydroxide | Fisher Scientific | A669S-500 | Corrosive; do not inhale |
| methanol | Fisher Scientific | A452-4 | Flammable liquid and vapor; use personal protective equipment; do not inhale; If contact rinse area for at least 15 minutes and obtain medical attention |
| triisopropylsilane | Sigma Aldrich | 233781 | Flammable; use personal proctective safety equipment; keep container tightly closed |
| diethyl ether | Fisher Scientific | E138-1 | Extremely flammable; Irritating to skin and eyes; Use personal protective equipment |
| 2,5-dihydroxybenzoic acid | Sigma Aldrich | 39319-10x10MG-F | do not inhale; irritating to skin and eyes |
| alpha-cyano-4-hydroxycinnamic acid | Alfa Aesar | AAJ67635EXK | |
| c18 zip-tip | Millipore | ZTC18S096 | |
| tris(2-carboxyethyl) phospine hydrochloride | Thermo Scientific | PI20490 | |
| silica gel 60 F254 coated aluminum-backed TLC sheets | EMD Millipore | 1.05549.0001 | |
| Thin walled Precision NMR tubes | Bel-Art | 663000585 | 5mm O.D. |
| All-plastic Norm-Ject syringes | Air Tite | AL10 | |
| single-use needle | BD PrecisionGlide | BD 305185 | used needles get disposed on in sharps waste container |
| disposable fritted syringe | Torviq | SF1000LL | 10mL fritted syringes were used in the report, but larger syringes are avaibale if needed for larger scale synthesis. |
| carbon grid | Ted Pella, Inc. | CF200-CU | Make sure to prepare samples and staining on the carbon grid side, not the shiny copper side of grid |
| self-closing tweezers | Electron Microscopy Sciences | 78318-3X | very sharp tips, length: 120 mm |
| 0.1 mm short path length cell | Starna Cells, Inc. | 20/C-Q-0.1 | Fragile |
| 10mL Vessel Caps | CEM | 909210 | |
| 10mL Pressure Vessels | CEM | 908035 | |
| Aeris Semi-Prep HPLC column | Phenomenex | 00F-4632-N0 | 150 x 10mm |
| cell holder | Starna Cells, Inc. | CH-2049 | Needed when using short pathlength cells |
| PS3 peptide synthesizer | Gyros Protein Technologies | ||
| DiscoverSP Microwave Reactor | CEM | ||
| centrifuge | HERMLE | Z 206 A | used a fixed 6x50 mL rotor |
| HPLC | Shimadzu | UV Detector | |
| nuclear magnetic resonance spectrometer | Avance, Bruker | 300 MHz | |
| MALDI-TOF mass spectrometer | Axima Confidence, Shimadzu | ||
| lyophilizer | Millrock Technology | BT85A | |
| Fourier-Transform Infrared Spectrometer | Alpha Tensor, Bruker | ||
| Transmission Electron Microscope | Tecnai Spirit, FEI | Used with Gatan Orius Fiberoptic CCD digital camera. Accessed at CSCU Center for Nanotechnology | |
| Circular Dichroism Spectropolarimeter | J-810, JASCO | Used with a six-cell Peltier temperature controller. Accessed at Wesleyan University. |
References
- Wang, J., Liu, K., Xing, R., Yan, X. Peptide self-assembly: Thermodynamics and kinetics. Chemical Society Reviews. 45, 5589-5604 (2016).
- Dong, R., et al. Functional supramolecular polymers for biomedical applications. Advanced Materials. 27, 498-526 (2015).
- Edwards-Gayle, C. J. C., Hamley, I. W. Self-assembly of bioactive peptides, peptide conjugates, and peptide mimetic materials. Organic and Biomolecular Chemistry. 15, 5867-5876 (2017).
- Goor, O. J. G. M., Hendrikse, S. I. S., Dankers, P. Y. W., Meijer, E. W. From supramolecular polymers to multi-component biomaterials. Chemical Society Reviews. 46, 6621-6637 (2017).
- DiMaio, J. T. M., Doran, T. M., Ryan, D. M., Raymond, D. M., Nilsson, B. L. Modulating supramolecular peptide hydrogel viscoelasticity using biomolecular recognition. Biomacromolecules. 18, 3591-3599 (2017).
- DiMaio, J. T. M., Raymond, D. M., Nilsson, B. L. Display of functional proteins on supramolecular peptide nanofibrils using a split-protein strategy. Organic and Biomolecular Chemistry. 15, 5279-5283 (2017).
- Mahmoud, Z. N., Gunnoo, S. B., Thomson, A. R., Fletcher, J. M., Woolfson, D. N. Bioorthogonal dual functionalization of self-assembling peptide fibers. Biomaterials. 32, 3712-3720 (2011).
- Petkau-Milroy, K., Uhlenheuer, D. A., Spiering, A. J. H., Vekemans, J. A. J. M., Brunsveld, L. Dynamic and bio-orthogonal protein assembly along a supramolecular polymer. Chemical Science. 4, 2886-2891 (2013).
- Li, A., et al. Neurofibrillar tangle surrogates: Histone H1 binding to patterned phosphotyrosine peptide nanotubes. Biochemistry. 53, 4225-4227 (2014).
- Sadownik, A., Stefely, J., Regen, S. L. Polymerized liposomes formed under extremely mild conditions. Journal of the American Chemical Society. 108, 7789-7791 (1986).
- Zhang, N., et al. ATN-161 Peptide functionalized reversibly cross-linked polymersomes mediate targeted doxorubicin delivery into melanoma-bearing C57BL/6 mice. Molecular Pharmaceutics. 14, 2538-2547 (2017).
- Margulis, K., et al. Formation of polymeric nanocubes by self-assembly and crystallization of dithiolane-containing triblock copolymers. Angewandte Chemie International Edition. 56, 16357-16362 (2017).
- Zhang, X., Waymouth, R. 1,2-Dithiolane-Derived Dynamic, Covalent Materials: Cooperative Self-Assembly and Reversible Cross-Linking. Journal of the American Chemical Society. 139, 3822-3833 (2017).
- Sakia, N., Matile, S. Stack exchange strategies for the synthesis of covalent double-channel photosystems by self-organizing surface-initiated polymerization. Journal of the American Chemical Society. 133, 18542-18545 (2011).
- Uji, H., Morita, T., Kimura, S. Molecular direction dependence of single-molecule conductance of a helical peptide in molecular junction. Physical Chemistry Chemical Physics. 15, 757-760 (2013).
- Liang, C., Ni, R., Smith, J. E., Childers, W. S., Mehta, A. K., Lynn, D. G. Kinetic intermediates in amyloid assembly. Journal of the American Chemical Society. 136, 15116-15149 (2014).
- Smith, J. E., et al. Defining the dynamic conformational network of cross-β peptide assembly. Israel Journal of Chemistry. 55, 763-769 (2015).
- Black, S. P., Sanders, J. K. M., Stefankiewicz, A. R. Disulfide exchange: Exposing supramolecular reactivity through dynamic covalent chemistry. Chemical Society Reviews. 43, 1861-1872 (2014).
- Vendetti, A., et al. Dihydroasparagusic acid: Antioxidant and tyrosinase inhibitory activities and improved synthesis. Journal of Agricultural and Food Chemistry. 61, 6848-6855 (2013).
- Stawikowski, M., Fields, G. B. Introduction to peptide synthesis. Current Protocols in Protein Science. 26, (2002).
- Canadell, J., Goossens, H., Klumperman, B. Self-healing materials based on disulfide links. Macromolecules. 44, 2536-2541 (2011).
- Lafont, U., van Zeijl, H., van der Zwaag, S. Influence of cross-linkers on the cohesive and adhesive self-healing ability of polydisulfide-based thermosets. ACS Applied Materials and Interfaces. 4, 6280-6288 (2012).
- Komaromy, D., Stuart, M. C. A., Santiago, G. M., Tezcan, M., Krasnikov, V. V., Otto, S. Self-assembly can direct dynamic covalent bond formation toward diversity or specificity. Journal of the American Chemical Society. 139, 6234-6241 (2017).
- McAvery, K. M., Guan, B., Fortier, C. A., Tarr, M. A., Cole, R. B. Laser-induced oxidation of cholesterol observed during MALDI-TOF mass spectrometry. Journal of the American Society for Mass Spectrometry. 22, 659-669 (2011).
- Krimm, S., Bandekar, J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins. Advances in Protein Chemistry. 38, 181-364 (1986).
- Halverson, K. J., Sucholeiki, I., Ashburn, T. T., Lansbury, P. T. Location of β-sheet-forming sequences in amyloid proteins by FTIR. Journal of the American Chemical Society. 113, 6701-6703 (1991).
- Greenfield, N., Fasman, G. D. Computed circular dichroism spectra for the evaluation of protein confirmation. Biochemistry. 8, 4108-4116 (1969).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. Available from: https://imagej.nih.gov/ij (2016).
- Roy, S., Shinde, S., Hamilton, G. A., Hartnett, H. E., Jones, A. K. Artificial [FeFe]-hydrogenase: On resin modification of an amino acid to anchor a hexacarbonyldiiron cluster in a peptide framework. European Journal of Inorganic Chemistry. 2011, 1050-1055 (2011).
- Van Duinen, S. G., Castano, E. M., Prelli, F., Bots, G. T. A. B., Luyendijk, W., Frangione, B. Hereditary cerebral hemorrhage with amyloidosis in patients of Dutch origin is related to Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America. 84, 5991-5994 (1987).
- Barth, A. The infrared absorption of amino acid sidechains. Progress in Biophysics and Molecular Biology. 74, 141-173 (2000).
- Jayaraman, M., et al. Slow amyloid nucleation via α-helix-rich oligomeric intermediates in short polyglutamine-containing Huntingtin fragments. Journal of Molecular Biology. 415, 881-899 (2012).



