Summary
Målet med denne undersøgelse er at ændre rotte ortotopisk levertransplantation model til bedre at repræsentere menneskers levertransplantation og forbedre modtagerens overlevelse. Den præsenterede metode genetablerer leverarterietilstrømning ved at forbinde donorleverens almindelige leverarterie med recipientleverens rette leverarterie.
Abstract
Den rotte ortopisk levertransplantation (OLT) model er et effektivt værktøj til at studere akut og kronisk afvisning. Men, Det er ikke en fuldstændig repræsentation af menneskelige levertransplantation på grund af fraværet af arteriel gentilslutning. Beskrevet her er en modificeret transplantation procedure, der omfatter inkoration af leverpulsåren (HA) gentilslutning, fører til en markant forbedring i transplantation resultater. Med en gennemsnitlig anhepatisk tid på 12 min og 14 s, HA gentilslutning resulterer i forbedret perfusion af den transplanterede lever og en stigning i langsigtet modtager overlevelse fra 37,5% til 88,2%. Denne protokol omfatter brugen af 3D-printede manchetter og indehavere til at forbinde portalvenen og infrahepatiske ringere vena cava. Det kan gennemføres for at studere flere aspekter af levertransplantation, fra immunrespons og infektion til tekniske aspekter af proceduren. Ved at indarbejde en enkel og praktisk metode til arteriel gentilslutning ved hjælp af en mikrovaskulær teknik, denne modificerede rotte OLT protokol nøje efterligner aspekter af menneskers levertransplantation og vil tjene som en værdifuld og klinisk relevant forskningsmodel.
Introduction
Den globale byrde af leversygdom fortsætter med at stige, med en 30% stigning i leversygdom-relaterede dødsfald fra 2005 til 20131,,2. Levertransplantation er ofte den eneste anvendelse for patienter med leversygdom i slutstadiet. Leveren er det næstmest transplanterede faste organ, og antallet af levertransplantationer, der udføres globalt, steg med 7,25 % fra 2015 til 20161,2. På trods af sin udbredelse er overlevelsesraten efter transplantationenstagneret 3,4,5. Den 15-årige patientoverlevelsesrate rapporteres at være 53 %, og den 20-årige patients overlevelsesrate kan være helt nede på 21 %3,5. Mens der er spændende nye immunbiologiske initiativer, der kan føre til nye behandlinger og forbedrede kliniske resultater, er der endnu ikke en pålidelig lille dyremodel til at teste dem.
Rotten OLT model har været meget udbredt i undersøgelsen af levertransplantation, herunder afvisning6,,7,,8,,9,,10,immuntolerance11, transplantation iskæmi-reperfusion skade12, immunsuppression13, og galdetræ skade14,15,16,17. Men en ulempe ved modellen i sin nuværende form er dens høje postoperative sygelighed og dødelighed18,19. Dette er en alvorlig ulempe, der er i strid med den menneskelige operation, og det kompromitterer evnen til at drage klinisk relevante konklusioner fra model20.
Derudover kan en stor del af denne sygelighed tilskrives en fraværende eller ufuldkommen leverpulsåre (HA) gentilslutning18. Selv om et kritisk skridt i menneskers levertransplantation, tekniske vanskeligheder tendens til at kompromittere HA gentilslutning i rotten OLT model. Som et resultat, galdegang (BD) anastomose er svag og resulterer i høje satser for galde lækage og BD nekrose21. Ud over den høje forekomst af galdekomplikationer22ændrer fravær af arteriel tilstrømning plantetranstatlevers fysiologi efter transplantation23med hypoxi i donorleverttransplantat 24 og leverskader observeret i betændte lapper19,25,26. Rotte OLT uden arteriel gentilslutning også en tendens til at fremme fibrose27. Den rotte OLT protokol beskrevet nedenfor løser disse spørgsmål ved at indarbejde en simpel HA rekonstruktion skridt med en tidligere offentliggjort rotte OLT metode28, hvilket resulterer i bevarelse af leverparenkym og forbedret overlevelsesrater.
Levertransplantation har tre faser: (1) udvinding af levertransplantatet fra donoren, (2) præparat af donorlevertransplantatet og (3) udskiftning af recipientleveren med levertransplantatet. Proceduren indebærer manipulation af fem anatomiske strukturer: suprahepatic ringere vena cava (SHVC), portal vene (PV), infrahepatiske ringere vena cava (IHVC), leverpulsåren (HA), og galdegang (BD).
OLT i rotten blev først introduceret af Lee et al. ved hjælp af mikrosutur anastomose af SHVC, PV og IHVC, og en pull-through teknik til BD29. Denne model blev senere forbedret ved hjælp af to-manchet teknik i 197930. Siden da er flere alternative teknikker blevet foreslået, med de fleste fokus på venøs anastomose og ved hjælp af en to-manchet teknik med et par ændringer31. Selv om HA anastomose er blevet beskrevet tidligere i rotte OLT model ved hjælp af teknikker såsom mikrosutur, manchet, og intraluminaleærmer 26,,31,,32,,33,34, disse teknikker kræver ofte højt uddannede mikrokirurgiske færdigheder, væsentligt ændre rotte fysiologi, og er hæmmet af trombose og / eller galdekomplikationer27,35.
Endvidere kan valget af kirurgisk procedure også påvirke den anhepatiske tid (tid fra PV fastspænding til reperfusion af transplantat gennem rekonstitueret PV), som er afgørende for succes rottelever transplantation. Specifikt, høje overlevelsesrater er observeret med anhepatiske gange på 15-20 min36, og 30 min er den øvre grænse for succes37,38. Derfor er målet med denne metode er at gennemføre en mindre invasiv og lettere adopterbare kirurgisk rotte OLT model, der er i stand til at genoprette den leverpulsåre, fremme en effektiv perfusion af den transplanterede lever, opretholde flow til modtageren galdegang, og bevare modtagerens fysiologiske tilstand.
Beskrevet her er alle trinene i denne reviderede protokol, herunder manipulation af cøliaki stammen af donorlevernen samt brugen af 1) en 1,5 mm stent til at udføre en ekstraluminal ærme forbindelse med modtageren korrekt HA, 2) en løbes sutur til SHVC rekonstruktion, 3) to 3D-printede plast manchetter til PV og IHVCrekonstruktion 39,,40, 4) en mikrovaskulær ærme gentilslutning til HA18,,27,,41 og 5) en tidligere beskrevet BD stenting teknik28. To yderligere trin er også inkluderet: en kold flush via PV, og et antibiotisk regime, der er baseret på tidligere resultater17. Denne optimerede OLT-protokol minimerer perioperative komplikationer og sygelighed og i højere grad modeller den kirurgiske drift procedure ansat i menneskers levertransplantation.
Protocol
Undersøgelsen blev udført i henhold til retningslinjerne for håndtering og kirurgi af gnavere, og forsøgsprotokollen blev godkendt af University Health Network Animal Care Committee (UHN AUP #: 5840.3) og følger retningslinjerne fra Canadian Council of Animal Care. Undersøgelsen bruger mandlige Lewis rotter (stamme LEW / SSNHsd), 12-14 uger gammel, vejer mellem 250-300 g.
1. Opsætning af udstyr
- Hold en 31 G skarp spids med en nåleholder og skab en stump L-formet injektor ved at bøje spidsen gentagne gange frem og tilbage, indtil spidsen klikker af. Ved hjælp af en flad metalfil, stump og glat enden af injektoren.
- Klip portalvenen (PV) og infrahepatiske ringere vena cava (IHVC) manchetter fra den 3D-printede base med en skalpel (supplerende materiale 1, supplerende materiale 2, figur 1, supplerende figur 1).
BEMÆRK: En 3D-design software bruges til at designe manchetter og holdere, som er trykt på en 3D-printer (Tabel af materialer) ved hjælp af autoclavable harpiks39,40 (specifikationer for alle 3D-trykte materiale, der indgår i det supplerende materiale 1-10). - Brug en ny skalpel til at skære 22 G kateteret i et dobbeltsidet skråt rør (3,5 mm i længden). Brug skalpel, forsigtigt ætse linjer på overfladen af galdegang (BD) stent (skær ikke gennem væggen af røret). Disse raderinge vil forhindre bånd i at glide under proceduren.
- Brug en ny skalpel til at skære 24 G kateteret i en ensidig skrå-kant rør (2,0 mm i længden), og skabe flere ridser på overfladen af den nye arteriel stent.
BEMÆRK: Undgå indsnævring eller okklusion af lumen af BD stenten ved at undgå tryk på stenten. Hvis stenten er indsnævret eller tilstæret, vil modtagerens overlevelse blive kompromitteret af galdeobstruktion.
- Klip portalvenen (PV) og infrahepatiske ringere vena cava (IHVC) manchetter fra den 3D-printede base med en skalpel (supplerende materiale 1, supplerende materiale 2, figur 1, supplerende figur 1).
2. Donoroperation
- Indstil en varmepude til 37 °C og placer den under den kirurgiske platform. Tænd temperaturmåleren, så rottens kernetemperatur kan overvåges via rektal sonde. Isoflurananæstesiapparatet er oprettet.
BEMÆRK: Under operationen overvåges dybden af anæstesi ved at bemærke vejrtrækningshastigheden, pulsen, farvningen af organer/slimhinder og tilstedeværelsen af eventuelle pedaltiltrækningsreflekser. - Arranger kirurgisk draperet arbejdsområde med alle nødvendige instrumenter og materialer (dvs. saks, snævler, gaze, heparin, retraktorer, midsektion pad, bomuld tips, 4-0 silke, 7-0 silke, 8-0 ikke-absorberbar steril sutur, og 10-0 ikke absorberes monofilament sutur) placeret bekvemt på siderne af den kirurgiske platform.
- Arranger arbejdsstationen med alle løsninger, herunder Ringers laktatopløsning og 300 IE natrium heparin (se Tabel over materialer).
- Afvej dyret. Bedøve donorrotte ved at placere den i anæstesikammeret med 5% isofluran, 5 L/min luftstrøm og 70% FiO2 til induktion. Når rotten mister bevidstheden, skal bedøvelsen reduceres til 3% isofluran, 0,5 L/min luftstrøm og 70% FiO2. Kontroller, om der ikke er pedalrespons ved at klemme tåen.
- Forbered huden på maven. Brug en elektrisk barbermaskine til at fjerne pelsen fra ventralsiden. Opmærksomt observere donorens respiration sats, indtil det opnår en stabil og dyb sats.
- Læg den kirurgisk draperet rotte, så dens ventrale side vender mod loftet. Anlæg næsen i en anæstesi skyllevæske med 3% isofluran, 0,5 L / min luftstrøm, og 70% FiO2. Forbered bugvæggen med povidone-jod, arbejder fra midterlinjen udad, efterfulgt af 70% ethanol.
- Lav et snit fra xiphoid processen til skambenet symphysis ved hjælp af en rund-tippet kirurgisk saks, derefter forbedre eksponeringen med en bilateral tværgående snit. Stop enhver blødning fra bugvæggen ved hjælp af en bi-polar elektrokirurgisk enhed for ætsning. Efter snittet skal vedligeholdelsesisofluran reduceres til 2 %, 0,5 L/min luftstrøm og 70% FiO2.
BEMÆRK: Juster isoflurandamperen for at opnå en respirationshastighed på ca. et åndedrag pr. sekund, og husk regelmæssigt at vurdere dybden af anæstesi i løbet af operationen. - Placer en 4-0 silke søm i xiphoid processen og bruge suturen til at trække brystvæggen cephalad. Tape silketråd til toppen af den struktur, der holder anæstesi skyllevæske på plads. Hold donorrotterens kropshulrum åben med 3D-printede retraktorer (se supplerende materiale 3) placeret på begge sider af maven (retraktorer holdes på plads med gummibånd fastgjort til magneter på den kirurgiske platform).
BEMÆRK: Mosquito sniver også kan bruges til at forstå xiphoid processen og trække cephalad. Fix myg snævn på plads ved hjælp af tape. - Brug en ikke-vævet gazesvamp (4 cm x 4 cm) dæmpet af Ringers laktatopløsning til at omslutte de små og store tarme. Brug en lille, våd, nonwoven gaze svamp (2 cm x 4 cm) til forsigtigt at dække leveren.
- Placer en lille rullet gaze under midtersektionen for at løfte maven og forbedre eksponeringen af suprahepatic ringere vena cava (SHVC).
- Skær falciform ledbånd. Adskrev venstre diafragma vene fra SHVC ved hjælp af mikro-hvintet. Ligate venstre diafragma vene med 7-0 silke, opholder sig tæt på SHVC.
BEMÆRK: Brug den lille, våde, ikke-vævede gazesvamp, fugtet med Ringes laktat og placeret på leveren, til forsigtigt at trække leveren væk fra xiphoid processen og udsætte venstre diafragma vene. - Skær venstre trekantede og gastro-hepatiske ledbånd med rundspidset saks.
- Eksponere caudate lap ved omhyggeligt at trække tilbage venstre og midterste lapper mod xiphoid processen ved hjælp af en lille, våd, nonwoven gaze svamp. Slip ledbåndet adskille caudate lap fra resten af leveren med en rund-tippet saks.
- Divider og adskille hepato-esophageal ledbånd ved hjælp af en bi-polær elektrokirurgisk enhed tæt på spiserøret.
BEMÆRK: Skift forsigtigt de små og store tarme til venstre side af bughulen og dæk dem med våd, nonwoven gaze. - Dissekere retroperitoneum og fedt, der dækker IHVC. Eksponere og isolere IHVC ned til venstre nyrevene.
- Let fortrænge IHVC med en vatpind til at eksponere og derefter ætse eventuelle små vener fusionerer i højre side af IHVC, ved hjælp af bi-polar elektrokirurgiske enhed. Også ætse nogen lændevener fusionerer ind i IHVC.
- Opdel højre suprarenal (binyre) vene mellem to 7-0 silke ligaturer, opholder sig tæt på IHVC. Befri leveren fra sine bageste ledbånd ved at skære disse under blid trækkraft.
- Isoler højre nyrevene fra højre nyrearterie og fra det tilstødende væv ved hjælp af en fin spids ætsning. Forsegle højre nyrevene åbning med en 8-0 ikke kan absorberes sterile ligatur.
- Fjern fedtet, der dækker PV at finde pyloric vene (højre gastrisk vene) og milt vene på de punkter, hvor de fusionerer PV. Ligate disse vener med 7-0 silke, styrke den side tættest på PV med en 8-0 ikke kan absorberes steril sutur søm. Del venerne mellem båndene.
BEMÆRK: Udsæt PV ved hjælp af små, våde gaze til at trække duodenum tilbage. Indsættelsen af manchetten er lettere, hvis fedt er løsrevet fra PV, som også forhindrer stenose af PV manchetten. - 300 IE heparinnatrium indsprøjtes i IHVC, fortyndet til 1 ml normalt saltvand ved hjælp af en 1 ml sprøjte (31 G nål).
- Lav et snit 5 mm under BD bifurcation og indsæt BD stenten i den fælles BD. Fastgør stenten med en 7-0 silkeligatur 1 mm over snittet. Der kan foretages et ekstra slips under snittet, som er 10 mm under bifurcationen. Når stenten er sikret, skæres BD mellem disse to bånd.
- Klip aldrig BD eller korrekt leverpulsåren (HA). Placer en 10-0 ikke absorberbar steril kirurgisk monofilament sutur søm på 3 klokken position i BD ved snittet som en markør for at forhindre vridning efter gentilslutning.
- Eksponere den korrekte HA og opdele gastroduodenal arterie (GDA) mellem to 7-0 silke ligaturer. Eksponere venstre gastrisk arterie, milt arterie, og cøliaki kuffert. Bind de tre arterier både distally og tæt på deres starter.
- Skær venstre gastrisk arterie, milt arterie, og cøliaki stammen mellem arterien bånd. Sprøjt langsomt 20 ml koldt (4 °C) Ringes laktatopløsning ind i PV'en ved hjælp af en 20 ml sprøjte med en 21,5 G nål. Skær vena cava under det punkt, hvor venstre nyrevene fusionerer med IHVC at tillade flush udstrømning.
BEMÆRK: Nålen skal holdes så langt væk fra hilummet som muligt. Donorleverkolden perfusion bør vare mellem 1-2 min. Mens rødmen leveren, bruge den anden hånd til at sprøjte koldt Ringer's laktat på leveren overflade. - Skær PV stammen under milt venen efter flush. Skær IHVC lige over venstre nyrevene. Skær SHVC direkte ved siden af mellemgulvet.
- Skær ledbånd og bindevæv mellem leveren og retroperitoneum.
BEMÆRK: Sørg for, at der er tilstrækkelig længder af de forreste og bageste SHVC vægge til at lette den øvre caval anastomose. Det er afgørende at skære umiddelbart ved siden af mellemgulvet for at bevare så meget længde som muligt. - Når leveren er fjernet fra maven, skal den hurtigt sættes i en skål fyldt med 4 °C Ringers laktatopløsning. Placer skålen oven på en ispude for at opretholde en kold temperatur.
- Kassér donorrotternes jordiske rester efter institutionelle retningslinjer.
3. Donorrottelever forberedelse ("tilbage bænk")
- Fyld den kolde petriskål med et tilstrækkeligt volumen på 4 °C Ringers laktatopløsning til at nedsænke donorrottelevern. Drej forsigtigt donorleveren, der flyder i skålen, omhyggeligt, så den ringere overflade vender opad. Sæt manchetterne til PV og IHVC (henholdsvis supplerende materiale 1 og supplerende materiale 2)i skålen.
- Træk PV gennem PV manchet og fold enden af venen over manchetten. Bind PV sikkert rundt om manchetten ved hjælp af 7-0 silke. PV'en skylles med 10 ml 4 °C Ringers laktatopløsning.
- Gentag trin 3.2 med IHVC uden skylning.
- Fjern fedtvævet omkring cøliakistammen. Form en større arteriel ærme manchet ved at skære åbne bifurcation af cøliaki stammen, milt arterie, og venstre gastrisk arterie (Figur 2A).
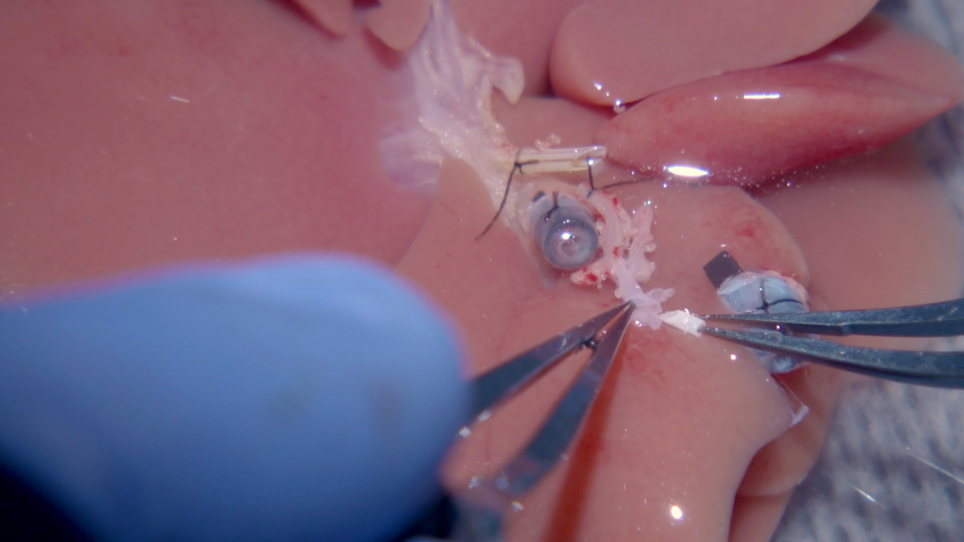
BEMÆRK: Det er vanskeligt at indsætte arteriel stent i den fælles HA. Stræk og ret arterien ud med fakt flere gange, før du indsætter stenten. Sørg for, at stentens facet vender opad, og at arterien ikke er snoet (Figur 2B). - Sæt 1,5 mm længde 24 G arteriel stent i donor fælles HA via arteriel manchet. Fastgør stenten med en 8-0 polypropylenatur (Figur 2C) og skyl stenten med Ringes laktatopløsning (Figur 2D).
- Anlæste en mikroklemme (4-6 mm i længden) på det proksimale IHVC, som er beregnet til at forhindre blodtab efter portalrefusion og undgå luftemboli.
- Roter leveren og udsætte sin overlegne side. Indsæt to 8-0 polypropylen konus suturer på de laterale og mediale kanter af SHVC.
- Hold leveren ved 4 °C, så den er klar til transplantation i donoren.
4. Modtagerhandling
- Se afsnittet om donordrift ovenfor, og gentag trin 2.1-2.4.
BEMÆRK: Han Lewis rotter i alderen 12-14 uger gamle bruges her, vejer 5-20 g tungere end donorerne. Under operationen, overvåge dybden af anæstesi ved at notere vejrtrækning sats, puls, farvning af organer / slimhinder, og tilstedeværelsen af enhver pedal tilbagetrækning reflekser. - Læg den kirurgisk draperet rotte med sin ventrale side vender opad. Placer næsen i anæstesi skyllevæske til isofluran indånding. Fugt øjnene med opthalamic smøremiddel. Forbered bugvæggen med providone-jod først, derefter med 70% ethanol.
- Injicer 5 ml af Ringers laktatopløsning subkutanet på begge nederste sider af bugvæggen. Brug en kirurgisk assistent assistent til at injicere 0,5 ml af 200 mg/kg piperacillin natrium intramuskulært ind i venstre bugvæggen før laparotomi. Desuden administreres 0,5 ml 10 mg/ml bupivacain subkutigt ind i højre bugvæg.
BEMÆRK: Administration af den samme dosis piperacillinnatrium 1x/dag i 3 dage efter operativt. - Forbered bugvæggen igen med providone-jod først og derefter med 70% ethanol. Lav en midterlinje snit fra sternal xiphoid til 1 cm over skambenet symphysis. Reducer isofluran til 2%, 0,5 L/min luftstrøm og FiO2 70% til vedligeholdelse af anæstesi efter snit.
BEMÆRK: Myggeskiver kan bruges til at forstå xiphoid processen og trække cephalad. Fix myg snævn på plads ved hjælp af tape. Kropshulen holdes åbent af 3D-printede retraktorer (se supplerende materiale 3) på begge sider med gummibånd magnetisk holdt til den kirurgiske platform. - Wrap de små og store tarme med en våd, nonwoven gaze svamp (4 cm x 4 cm) dæmpet med Ringer's laktat opløsning. Brug en lille (2 cm x 4 cm), våd, ikke-vævet gaze svamp fugtet med Ringer's laktat opløsning til forsigtigt at dække leveren.
- Anbevis en lille 3D-printet støttepude (rygholder; se supplerende materiale 4)under rottefængslingen for at øge SHVC'ens eksponering ved at bøje centrifugering. Dette kan sikkert udføres hos rotter og udføres af en kirurg assistent.
- Skær falciform ledbånd og bruge den lille, våde nonwoven gaze svamp til forsigtigt at trække leveren væk xiphoid processen og udsætte venstre diafragma vene. Adskrev venstre diafragma vene fra SHVC ved hjælp af mikro-hvintet. Ligate venstre diafragma vene med 7-0 silke tæt på mellemgulvet.
- Skær venstre trekantede og gastro-hepatiske ledbånd med rundspidset saks.
- Træk venstre og midterste lapper fint mod xiphoid processen med en lille, våd nonwoven gaze svamp til at afsløre caudate lap. Afskræn ledbånd, der adskiller caudate lap fra resten af leveren.
- Divider hepato-esophageal ledbånd og koagulere eventuelle blødningspunkter med bi-polar elektrokirurgiske enhed, opholder sig tæt på leveren. Skær ledbånd på den bageste aspekt af leveren.
- Træk de små og store tarme forsigtigt tilbage til venstre side af bughulen og dække dem med våde, nonwoven gaze.
- Dissekere retroperitoneum og fedt på IHVC at udsætte og isolere IHVC ned til højre nyrevene. Let fortrænge IHVC med en vatpind og ætse eventuelle små vener fusionerer i højre side af IHVC, ved hjælp af bi-polar elektrokirurgiske enhed. Tilsvarende ætse nogen lænde vener ind i IHVC.
- Opdel højre suprarenal (binyre) vene mellem to 7-0 silke ligaturer. Befri leveren fra dens bageste ledbånd ved at skære dem under blid trækkraft.
- Brug små, våde gaze dæmpet med Ringer's laktat opløsning til at trække duodenum og udsætte PV. Løsrive fedt fra bifurcation af PV og pyloric vene.
- Opdel BD 0,5 cm under dens hilar bifurcation og indsæt en BD stent i den distale fælles BD. Fastgør stenten på plads med en 7-0 ligatur ca. 0,2 mm under snittet. En ekstra slips kan placeres over snittet, tæt på bifurcation. Skær BD tæt på leveren, men distalt til slips.
- Adskive BD med sniver og undgå klipning af BD eller korrekt HA. Anstænkning på 10-0 ikke-absorberbar monofilamenter (f.eks. ethilon) ved klokken 3 i BD'en som markør for at undgå vridning efter gentilslutning.
- Eksponere den korrekte HA og bifurcation af den fælles HA og GDA. Eksponere venstre HA, midterste HA, og højre HA. Bind de tre arterier distale til CHA bifurcation og skær arterierne tæt på leveren, over båndene.
- Sæt et langt tyndt stykke gaze bag SHVC.
- Anlækning af en 3D-printet IHVC-holder eller "håndtag" (Cava 150g 2.1; se supplerende materiale 5) bag IHVC, og sy enderne af det 3D-printede "håndtag" sammen ved hjælp af 10-0 ikke-absorberbar monofilamentsutur (Figur 3A).
- Anlækningsmateriale 6) bag solcelleanlægret, direkte ringere end leveren, og sy enderne af det 3D-printede "håndtag" sammen ved hjælp af 10-0 usabsorberbar monofilamentsutur.
- Binde en 7-0 silkeligatur under begge 3D-printede holdere (IHVC og PV) (Figur 3A).
- Fastspænd IHVC lige over højre nyrevene, som stadig skal være under den 3D-printede cavalholder.
- Klem PV lige over pyloric vene, som bør være under 3D-printede PV indehaveren. Optag anhepatiske tid, som begynder på dette punkt. Fald til 0,5% isofluran, 0,5 L /min luftstrøm og 70% FiO2 til vedligeholdelse af anæstesi.
- 2 ml 37 °C Ringes laktatopløsning skylles ud via bifurcation af PV ved hjælp af en 3 ml sprøjte med en 27 G kanyle fastgjort.
- Klem SHVC over leveren med en Kitzmiller klemme. Skær under samme klemme, opholder sig så tæt på leveren som muligt.
- Skær over de 3D-printede holdere til både solceller og IHVC (Figur 3A). Fjern modtagerens lever. Forsigtigt orientere donorlever og placere den i modtagerens kropshulen på en sådan måde, at den øvre kakostomose kan oprettes.
- Brug en 8-0 polypropylen kørende sutur for at slutte sig til donorens SHVC med modtagerens SHVC nær mellemgulvet. Først sted ophold suturer af 8-0 polypropylen til venstre og højre aspekter af donor og modtager SHVC. Derefter binde disse ned på ydersiden af venevæggen.
- Brug den venstre 8-0 polypropylen til at sy den bageste væg af SHVC fra venstre mod højre og binde til højre 8-0 Polypropylen. Brug den venstre 8-0 polypropylen til at sy den forreste væg af SHVC anastomose fra venstre mod højre, forlader de sidste to tredjedele af suturlinjen løs. Skyl med 20 ml af Ringes laktat mellem de løse sting, samtidig med at du sørger for at udtrække luftbobler.
- Stram de løse sting og lav et slips på ydersiden af SHVC. Skær de resterende 8-0 polypropylensutur.
BEMÆRK: Klippet holder modtagerens SHVC på plads, hvilket gør det nemmere at sy donoren og modtagerens SHVC sammen. Æd varigheden af SHVC-anastomose. På dette tidspunkt er porta håndtagene fastgjort til holderarmen apparatet (holder arm McGil + holder mini arm LAB + holder arm blød del 1.3; se supplerende materiale 7, supplerende materiale 8, og supplerende materiale 9, henholdsvis), direkte ringere end leveren. Dette apparat understøttes af en 3D-printet holderbase (holderbase 3.1; se supplerende materiale 10). - Sæt PV manchetten (supplerende materiale 1) fra donoren ind i modtagerens PV og stram 7-0 silkeslipsen. Skyl donorens og recipientens pV med Ringes laktatopløsning opvarmet til 37 °C før tilslutningen.
- Fjern den atraumatiske klemme fra SHVC (først), derefter den mikrovaskulære clips til PV (anden). Genopspørg leveren med varmt blod; på dette tidspunkt er den anhepatiske fasetid afsluttet. Optag denne gang.
- Hæld 10 ml varm Ringes laktatopløsning oven på leveren for at varme. Fjern de 3D-printede holdere med en rundspidset saks (skær sikringsstingen).
- Stik donoren IHVC manchet (supplerende materiale 2)i modtagerenS IHVC og fastgør med et 7-0 silkeslips. Fjern først donor-IHVC-klippet, derefter modtagerens klip (Figur 3B). Cavan er fastgjort til holderens apparatur og holderbase som beskrevet ovenfor
- Fjern 3D-printerholderne (porta og cava) med en rundspidset saks (skær sikringsstingstingen over; Figur 3C), hvilket resulterer i en tilsluttet IHVC (Figur 3D).
- Omhyggeligt undersøge området omkring leveren for enhver blødning. Indstil 3 ml 37 °C Ringers laktatopløsning inde i kropshulen.
- Arteriel anastomose: afbrød den del af cøliaki stammen fra donor, der strækker sig ud over stenten.
- Fastspænd modtagerens korrekte HA og afskåret slipset i slutningen. Skær eventuelt ekstra væv af, når fartøjet er omgiver det( figur 4A). Med Ringers laktatopløsning skylles lumen af både donor- og modtagerfartøjets ender.
- Træk modtageren korrekt HA ind i ærmet på donor HA stent at udføre HA anastomose. Placer en 10-0 ethilon gennem venstre aspekt af (donor) HA, 2,5 mm over den distale åbning af stenten (udefra til inde), derefter ud gennem slutningen af stenten, med 10-0 ethilon (4 cm længde) styret af en buet nål (Figur 4B).
- Den korrekte beholder HA 0,5 mm under karskåbningen transfikser den korrekt, og sømmen anbringes først (indefra og udefra) på fartøjets venstre side og derefter (udefra og indefra) til højre side af arterien.
- Anstænsningen gennem højre væg af (donor) HA indefra og ud i en afstand fra stentåbningen, der er identisk med den oprindelige søm. Træk op på de to ender af 10-0 ikke absorberes monofilamenter, som vil glide modtageren korrekt HA op og ind i HA stent (Figur 4C).
BEMÆRK: Overhold for pumpning af blod. En mulighed er at skære donor GDA at bekræfte, at blodet pumper gennem anastomose. Sørg for at binde arterien igen, før du går videre til næste trin i proceduren, hvis GDA'en er afskåret. - Binde 10-0 ikke absorberes monofilamenter med sig selv, over donor HA (Figur 4D). Den arteriel anastomose er nu færdig.
- Biliær anastomose: Placer et slips løst omkring modtageren BD og stent (Figur 5A), fjern derefter BD-stenten. Skyl både recipientens og donorens BD, før galdeforbindelsen er fuldført.
- Sæt donorens BD-stent i modtagerens galdegang (Figur 5B) og stram det slips, der tidligere var placeret omkring modtageren BD (Figur 5C).
- Returner tarmene til kroppen hulrum. Indgyd 2 ml 37 °C Ringers laktatopløsning ind i hulrummet for at skylle den. Soak nogle af løsningen op med gaze.
- Sørg for, at tarmene er tilbage i deres oprindelige position, før du syr op parietal bughinden og huden med 5-0 monokryl.
- Luk snittet i to lag med 5-0 monokryl. Injicer 0,5 ml 0,5% bupivacain omkring den syede parietal bughinde og gentag dette, når huden er syet sammen.
- Swaddle forsigtigt modtageren rotte i en køkkenrulle, når overførsel til buret. Giv dyret fri adgang til vand og mad fra opvågningstidstid. Hold et varmt vand-cirkulerende tæppe under halvdelen af buret i 24-38 timer. En rotte er udpeget til et bur i den umiddelbare post-operative periode.
5. Postoperativ pleje
- Sættetid mad pellets i vand og læg dem i en petriskål på buret gulvet.
- Overvåg pulsen, vejrtrækningshastigheden og hudens farve på rotten.
- Administrere piperacillin på postoperative dage 1, 2 og 3. Administrere buprenorphin subkutanely og overvåge for eventuelle tegn på smerte såsom eventuelle adfærdsændringer, sløvhed, ungroomed pels, depression, lemlæstelse, eller tab af appetit for de første 72 h.
BEMÆRK: Smerter vurderes mindst 2x dagligt i 3 dage efter transplantation, derefter mindst 1x dagligt og fremefter.
Representative Results
Mens oprettelse af en ikke-HA anastomose rotte OLT model ved hjælp af en tidligere beskrevet protokol28, vores team observeret 50% og 37.5% overlevelsesrater på 21 dage og 60 dage efter operationen, henholdsvis. Selv om høje satser for langsigtet overlevelse uden HA anastomose er blevet rapporteret af noglegrupper 28, disse tidlige resultater fremhæve ulemperne ved ikke at have arteriel tilstrømning. I modsætning hertil øgede den optimerede HA-gentilslutningsprocedure en betydelig overlevelse på lang sigt fra 37,5 % til 88,2 % (p = 0,015) (figur 6).
Histologisk analyse af en repræsentativ delmængde af transplanterede dyr uden HA-gentilslutning (ved dag 6 og 13 efter operationen) viste tegn på hypoxisk leverskade med centrilobulær nekrose (Figur 7). Omfattende nekrose af lever var forbundet med voldsomt forhøjede niveauer af alanin aminotransferase (ALT) og aspartat aminotransferase (AST) hos disse dyr (Figur 7). I modsætning hertil viste transplanterede rotter med HA gentilslutning ingen tegn på leverskade, og histologisk analyse afslørede en normal leverparenkym struktur med organiseret acini, lobules (f.eks centrale vene og portal triader med hepatisk vene), arterier, og galdegang (Figur 7).
Selv om den gennemsnitlige anhepatiske tid i løbet af 23 separate operationer var acceptabel (12 min og 14 s [± 78 s]), er det stadig muligt, at overlevelsen i ikke-HA gentilslutningsmodellen i sidste ende kan forbedres med øget praksis. Det er imidlertid værd at bemærke, at tre af de fire dyr, der blev transplanteret uden HA-gentilslutning (som blev fulgt for at overleve på lang sigt) blev aflivet på grund af nød på dag 56, 96 og 111 efter operationen. Desuden afslørede histologisk analyse af leveren reaktive ændringer efter hypoxisk leverskade, herunder markant galdegangsspredning, periportalfibrose og inflammation og forvrænget leverparenkym (supplerende figur 2). Tilstedeværelsen af morfologiske træk ved hypoxisk leverskade bekræfter resultaterne, at HA gentilslutning er vigtigt for effektiv leverperfusion og normal funktion.

Figur 1: Skematisk repræsentation af 3D-printet manchet design for portal vene og infrahepatic ringere vena cava. Det første slips strammes i rillen (ii) tættest på håndtaget (iii), og det andet slips strammes i rillen (i) længst væk fra håndtaget. De udvendige diametre er (iv) 2,38 mm for portalvenen (PV) og 2,15 mm for den infrahepatiske ringere vena cava (IHVC). De indvendige diametre er (v) 1,74 mm for PV og 1,38 mm for IHVC. Længderne er (vi) 2,60 mm for PV og 2,15 mm for IHVC (nøjagtige specifikationer for alle 3D-trykte materialer kan findes i supplerende materialer). Klik her for at se en større version af dette tal.

Figur 2: Leverpulsåren stent indsættelse i transplantat. (A) Den indledende ende af cøliaki stammen (i) udvides ved at skære milt arterie til venstre gastrisk arterie, som udsætter bifurcation af den fælles HA. ii) BD-stenten er bundet før udvinding af donorrottelevern. iii) PV-manchetten og (iv) IHVC-manchetten indsættes og bindes ved at folde beholdernes ender over manchetten. (B) i) For at indsætte HA-stenten strækkes den eksponerede almindelige HA flere gange med snævler. (C) (i) HA-stenten anbringes sikkert i den fælles HA og bindes med 8-0 prolene. (D) i) HA-stenten skylles med (ii) Ringes laktatopløsning (BD = galdegang, IHVC = infrahepatisk ringerl vena cava, HA = leverpulsåren). Klik her for at se en større version af dette tal.

Figur 3: Infrahepatisk ringere vena cava-forbindelse ved hjælp af 3D-printet holder. (A) PV'en (i) tilsluttes ved hjælp af samme teknik som IHVC-forbindelsen. Transplantatet er (ii) fastspændt over (iii) IHVC manchetten. Modtageren IHVC åbning er (iv) sutureret på siderne af åbningen til en 3D-printet holder for at holde den strakt åben. En løs (v) 7-0 silke er bundet omkring modtageren IHVC. BB) Manchetten på transplantatet IHVC indsættes i) i modtagerens IHVC. Det løse slips er nu strammet. CC) Klemmen fjernes, og i) den 3D-printede holder er afmonteret med en saks. (D)En yderligere (i) 7-0 silke er bundet omkring forbindelsen, hvis ikke sikker, men typisk en uafgjort er tilstrækkelig (PV = portal vene, IHVC = infrahepatic ringere vena cava). Klik her for at se en større version af dette tal.

Figur 4: Mikrovaskulær ærmetilslutning af leverpulsåren. (A) (i) BD-stenten er ikke forbundet med modtageren. ii) HA-stenten anbringes i transplantatet, som er knyttet til den (iv) modtagerens rette HA. iii) Solceller er tilsluttet. b) 10-0 ethilon med en i) buet nål trækkes gennem HA-stenten til siderne af modtagerens HA-åbningsende. cC) 10-0 ethilon trækkes tilbage gennem HA-stenten; Derfor trækkes modtagerens rette HA gennem stenten som et ærme. (D) (i) Der bindes med 10-0 ethilon, når modtagerens rette HA trækkes ind i stenten til den del, der først løber gennem HA-stenten. (E) Vist her er en skematisk af HA anastomose beskrevet i (B), (C), og (D) (BD = galdegang, HA = leverpulsåren, PV = portal vene). * Åbningen slutningen af cøliaki stammen er udvidet ved at skære milt arterie til venstre gastrisk arterie. Klik her for at se en større version af dette tal.

Figur 5: Galdegangsforbindelse ved hjælp af to stents. ( A) (i) Graft BD stent indsættes i modtageren BD ved hjælp af (ii) stenten løst bundet ved åbningen af modtagerens BD. (iii) PV er forbundet før BD-forbindelsen, som er placeret bag BD. (B) Stenten ved afslutningen af modtagerens BD fjernes og bruges som en udvidet åbning til i) indsætte BD stent bundet til transplantatet. (C) Det slips, der er løst sikring af modtageren stent bruges nu til at binde forbindelsen, og (i) en anden 7-0 silke bruges til at holde stenten på plads for at undgå at glide eller vride stenten. Klik her for at se en større version af dette tal.

Figur 6: Overlevelse af transplantationsprocent. Ortotopisk rottelever transplantation uden HA gentilslutning (n = 8) og med HA gentilslutning (n = 17). Dyrene følges nøje efter transplantationen for tegn på leversvigt og/eller infektion i mindst 60 dage. Rotter, der viste ingen komplikationer efter operationen blev betragtet som overlevende (* p = 0,015, som beregnet af Kaplan-Meier skøn [lang rang test]). Klik her for at se en større version af dette tal.

Figur 7: Lever histopatologisk vurdering. Repræsentative hematoxylin og eosin-farvede sektioner hos dyr (A) uden og (B) med leverpulsåren (HA) gentilslutning på dag 6 og 13 efter levertransplantation (LTx). (C)Normal leverparenkym viser portal triade (portal vene, arterie, og galdegang), lobules herunder centrale vene, og acini. Hepatocytter ved siden af portalen triade er zone 1 hepatocytter; hepatocytter ved siden af den centrale vene i lobules er zone 3 hepatocytter; og hepatocytter mellem zone 1 og 3 er zone 2 hepatocytter (ALT = alanin aminotransferase, AST = aspartat aminotransferase, CV = central vene). Klik her for at se en større version af dette tal.

Supplerende figur 1: Stent- og manchetdimensioner. Klik her for at se en større version af dette tal.

Supplerende figur 2: Lever histopatologisk vurdering, der viser afbrydelse af leverparenkym. Repræsentativ hematoxylin og eosin-farvede sektioner i dyr uden HA gentilslutning på dag 54, 96 og 111 efter LTx. Klik her for at se en større version af dette tal.
Supplerende materiale 1: Porta manchet 200g - støtte 2,0. Klik her for at se denne fil (Højreklik for at downloade).
Supplerende materiale 2: Cava manchet 200g - støtte 2,0. Klik her for at se denne fil (Højreklik for at downloade).
Supplerende materiale 3: Lever retractor 200g. Klik her for at se denne fil (Højreklik for at downloade).
Supplerende materiale 4: Rygholder - 1.2. Klik her for at se denne fil (Højreklik for at downloade).
Supplerende materiale 5: Cava 150g - 2,1. Klik her for at se denne fil (Højreklik for at downloade).
Supplerende materiale 6: Porta 1.4.1. Klik her for at se denne fil (Højreklik for at downloade).
Supplerende materiale 7: Holder arm McGil. Klik her for at se denne fil (Højreklik for at downloade).
Supplerende materiale 8: Holder mini arm LAB. Klik her for at se denne fil (Højreklik for at downloade).
Supplerende materiale 9: Holder og arm blød del 1.3. Klik her for at se denne fil (Højreklik for at downloade).
Supplerende materiale 10: Holder base - 3.1. Klik her for at se denne fil (Højreklik for at downloade).
Discussion
Små dyrelever transplantation modeller er vigtige for at forstå transplantation immunitet og identificere nye terapeutiske strategier32. Den ideelle lille levertransplantation model replikerer alle trin i den menneskelige procedure, herunder arteriel anastomose. Det kan være udfordrende at fortolke resultater fra rotten OLT model, som de fleste versioner ikke indeholder en HA anastomose trin, hvilket fører til højere satser for komplikationer og sygelighed42. Nogle rekonstruktionsprocedurer har brugt nyrearterien, som kræver fjernelse af nyrerne27. Denne protokol undgår organfjernelse, da det er ud over, hvad der sker i den menneskelige procedure.
Arteriel rekonstruktioner kan også udføres ved at manipulere rotten aorta31. Men disse metoder kræver omfattende dissektion og fastspænding af aorta. Hvis klemmen tid er forlænget, så modtageren rotte vil have dårlige resultater relateret til distale iskæmi43. Hos mennesker, en LT kirurgisk teknik indebærer ligation og opdeling af modtageren gastroduodenal arterie (GDA). Men de fysiologiske og anatomiske træk ved gnavere gør transplantation ved hjælp af denne teknik mere fysiologisk udfordrende og kan føre til komplikationer (dvs. nekrose i bugspytkirtlen og galdegang35 og galde lækage44). Den arterielle gentilslutning i denne protokol er beregnet til at omgå denne udfordring, opretholde kanalen blodgennemstrømning, og forbedre modtagerens resultat.
Brugen af en ærme og stentteknik til rekonstruktion af rotte HA er tidligere blevet beskrevet27. I denne teknik, en stent bruges som en guide, og arterien er rekonstrueret fra donor cøliaki stammen til modtageren fælles HA. Modtageren fælles HA er derefter dissekeret ud, og modtageren GDA er bundet27. Som et resultat, blodforsyningen til den nederste del af modtageren BD og leder af bugspytkirtlen kan blive kompromitteret. Det menes, at den sikkerhedsstillelse omsætning til dette område ofte giver utilstrækkelig blodgennemstrømning til galdegang. For eksempel, denne protokol test-klemmer modtageren GDA først med en mikrovaskulær klip, derefter deler modtageren BD. Med GDA fastspændt, den delte BD ikke bløder. Efter fjernelse af GDA klemme, rask blødning fra BD er observeret. Denne protokol, som opretholder god flow til den delte modtager galdegang, beskytter fysiologi af modtageren levervæv ved at give tilstrækkelig leverblod perfusion og forebygge post-OLT hypoxisk leverskade.
På donorsiden indsættes HA-stenten nemt i cøliakistammen under transplantatpræparatet ved at skabe et plaster fra cøliakistammen, venstre gastrisk arterie og miltarterie. Stenten kan indsættes gennem den brede åbning, hvilket er mindre vanskeligt end at forsøge at indsætte stenten i cøliakistammen alene. Det er blevet konstateret, at 24 G er en ideel størrelse til brug for HA stent. Længden af stenten skal være 1,0-1,5 mm lang, fordi den fungerer som en åben port, så modtagerens korrekte HA let kan trækkes ind i donorens fælles HA. Med omhyggelig opmærksomhed på, hvor 10-0 ethilon sutur er placeret, blod flyder gennem denne forbindelse vil aldrig røre stenten direkte, og modtagerens rette HA vil beskytte det indefra, hvilket reducerer risikoen for komplikationer. Det er vigtigt, at donorens HA aldrig fastspændes for at undgå vasospasme. Succesen med arteriel genopbygning evalueres ved at lade donor GDA åben. Vellykket anastomose resulterer i god blodgennemstrømning fra donor GDA når rekonstruktionen er afsluttet.
I denne protokol, i lighed med andre, SHVC gentilslutning er det langsomste skridt og i sidste ende dikterer varigheden af den anhepatiske fase. Som varigheden af anhepatiske tid stiger, risikoen iskæmisk skade og leverdysfunktion stiger45. En anden kritisk komponent i OLT rotte modeller er størrelsen af transplantat, stents, og manchetter. Hvis transplantatet er for lille, kan transplantatet vride eller vende, hvilket blokerer de vaskulære forbindelser. Størrelsen af stents og manchetter kan kræve justeringer i henhold til alder, køn, vægt, og stamme af rotten. Størrelsen af de manchetter, der anvendes her blev valgt som tidligere beskrevet28, og en manchet størrelse, der kontrolleres for rotte størrelse blev brugt. Der var ingen tegn på angst eller komplikationer (dvs. overbelastning af leveren, ødem, ascites eller splenomegly) i opfølgningsperioden (til dato: median = 133 dage efter operationen, minimum = 115 dage efter op, maksimum = 161 dage efter operationen). Yderligere undersøgelser til bestemmelse af den passende størrelse af PV og IHVC for forskellige rottestammer, der tegner sig for både alder og køn, er berettiget.
Denne modificerede rotte OLT-protokol bruger 3D-printede manchetter til PV og IHVC, som beskrevet tidligere39,40. De eksisterende metoder til tilslutning af solceller og IHVC omfatter en mikrosutureteknik32, manchetteknik46og mikrosuture midlertidig skinneteknik47. Den 3D-printede manchet teknik blev valgt, da det gør det muligt størrelsen af manchetten, der skal standardiseres efter rotte stamme og er let at forberede og bruge. Store mængder manchetter med samme dimensioner kan udskrives på én gang. Den ydre overflade af manchetten har to riller til støtte med at sikre bånd og forhindre glider. En hale er også indarbejdet i manchetten design for at give mulighed for lettere manipulation af manchetten. Samlet set menes det, at indarbejde 3D-printede manchetter fører til høje succesrater og reproducerbarhed af OLT procedure ved at forkorte anhepatisk tid. Det bestemmes, at denne teknik også forkorter den kirurgiske indlæringskurve.
Afslutningsvis, den beskrevne protokol etableret en model, der er mere ligner human levertransplantation ved at indarbejde en arteriel gentilslutning trin. Denne protokol kan tilpasses til at studere mange immunologiske og kirurgiske aspekter af levertransplantation og kan tjene som model til at teste nye terapeutiske indgreb er relevante for transplantation.
Disclosures
Forfatterne har intet at afsløre.
Acknowledgments
Denne forskning blev finansieret gennem midler fra Multi-Organ transplantation program på UHN og støtte fra Toronto General og Toronto Western Foundation.
Materials
| Name | Company | Catalog Number | Comments |
| 10-0 Ethilon | Ethicon | 2830G | 10-0 Ethilon Black 1X5" BV100-4 Taper |
| 10mL Syringe | BD | B302995 | Luer-Lok Tip, Sterile, Disposable |
| 1mL Syringe | BD | B309628 | Luer-Lok Tip, Sterile, Disposable |
| 20mL Syringe | BD | B301031 | Luer-Lok Tip, Sterile, Disposable |
| 3D Printed Cuff for IHVC | Custom | ||
| 3D Printed Cuff for PV | Custom | ||
| 3D Printed Holder for IHVC | Custom | ||
| 3D Printed Holder for PV | Custom | ||
| 3mL Syringe | BD | B309657 | Luer-Lok Tip, Sterile, Disposable |
| 4-0 Sofsilk | Coviden | GS-835 | Wx coded braided silk, 30", Suture 1-Needle 26 mm Length 1/2 Circle Taper Point Needle |
| 5-0 Monocryl | Ethicon | Y433H | Undyed Monofilament 1X27" TF |
| 5mL Syringe | BD | B309646 | Luer-Lok Tip, Sterile, Disposable |
| 7-0 Silk | Teleflex Medical | 103-S | Black |
| 8-0 Prolene | Ethicon | 2775G | 8-0 Prolene Blue 1X24" BV130-5 EVP Double Armed |
| Barraquer Micro Needle Holder Without Catch | Aesculap Surgical Instruments | FD231R | Curved 120 mm, 4 3/4″ |
| Barraquer Needle Holder, Extra Fine Jaws 8.0mm, Curved With Out Lock | Rumex International Co. | 8-025T | Small Size, Titanium |
| Barraquer Needle Holder, Fine Jaws 12.0mm, Curved With Out Lock | Rumex International Co. | 8-021T | Small Size, Titanium |
| BD Insyte Autoguard BC 22 GA x 1.00 IN | BD Angiocath / Autoguard | 382523 | 22 G x 1.00" (0.9 mm x 25 mm) Wingless catheter, 37 mL/min |
| BDPrecisionGlide Single-use Needles: Regular Bevel - Regular Wall. | BD | B305106 | PrecisionGlide stainless-steel needles with translucent, color-coded, polypropylene hubs. 22 G |
| BD Precisionglide Syringe Needle 21G | BD | 305167 | Gauge 21, length 1.5 inch, hypodermic needle |
| BD Precisionglide Syringe Needle 30G | BD | 305128 | Gauge 30, length 1 inch, hypodermic needle |
| Betadine Solution by Purdue Products LP | Purdue Products Lp | 67618-150-17 | 10% povidone–iodine topical solution USP |
| Bupivacaine Injection BP 0.5% | SteriMax Inc. | DIN:02443694 | 0.5% (100mg/20mL) |
| Curved Tying Forceps | Duckworth & Kent | 2-501E | 6mm tying platforms, straight shafts, flat handle, length 88mm |
| DC Temperature Controller | FHC Inc. | 40-90-8D | |
| DK Iris Scissors (Curved) | Duckworth & Kent | 1-211B | Blunt tips, cut length 4mm, tip to pivot length 11mm, round handle, length 107mm |
| Ethanol, 200 proof (100%), USP, Decon Labs | Decon Labs, Inc. | 2716 | Dilute to 70% with d2H2O |
| Fine Adjustable Wire Retractor | Fine Science Tools | 17004-05 | Maximum spread: 3.5cm, Depth 5cm |
| Harvard Apparatus Isoflurane Funnel-Fill Vaporizer | Harvard Appartus Limited | 34-1040SV | |
| Heparin LEO(heparin sodium) | LEO Pharma Inc. | DIN:00453811 | 10,000 i.u./10 mL |
| Ice-Pak | Cryopak | FIP88016 | 4.00 in. x 7.00 in., thickness 1.50 inch |
| Isoflurane United States Pharmacopeia (USP) 99.9% | Piramal Healthcare Limited | DIN: 02231929 | 250 mL, Inhalation Anesthetic, NDC 66794-017-25 |
| Khaw Transconjunctival Adjustable Suture Control Forceps | Duckworth & Kent | 2-502N | 5mm highly polished tying platforms, straight shafts, flat handle, length 84mm |
| Lactate Ringer's Injected USP, 1000mL | Baxter Co. | DIN: 00061085 | JB2324 |
| McPherson Tying Forceps | Duckworth & Kent | 2-500E | 6mm tying platforms, straight shafts, flat handle, length 90mm |
| Metzenbaum Scissors - 14.5 cm | Fine Science Tools | 14024-14 | Straight Sharp/Blunt |
| Micro Kitzmiller Clamp | Scanlan | 3003-630 | Jaw length 23mm, Length 11cm |
| Microscope-Leica M525 F20 | Leica Microsystems | No catalog number | |
| Non-woven Gauze Sponges | Fisherbrand | 22-028-556 | |
| Olsen-Hegar with Suture Cutter | Fine Science Tools | 12002-14 | 15 mm cutting edge, 2mm jaw surface - 14cm |
| OptixCare Eye Lube, 25gm | OptixCare | ES-KE8O-69U1 | Formerly Optixcare Surgical Eye Lubricant |
| Piperacillin sodium salt | Sigma-Aldrich | P8396 | Penicillin analog |
| Puritan 3" Standard Cotton Swab w/Wooden Handle | Puritan Medical Products Company LLC | 803-WC | Regular Cotton Tipped Applicator with Wooden Handle |
| Round Handled Needle Holder Straight w/ Lock | Fine Science Tools | 12075-12 | Round handles allow easy fingertip adjustments - 12.5cm |
| Shea Scissors Curved Blunt | Fine Science Tools | 14105-12 | Transplant scissors with light and delicate pattern - 12cm |
| Stainless Steel Micro Serrefines Curved - 4mm | Fine Science Tools | 18055-06 | Jaw length 4mm, Jaw width 0.75mm, Total length 16mm, Jaw pressure 125g |
| Stainless Steel Micro Serrefines Curved - 6mm | Fine Science Tools | 18055-05 | Jaw length 6mm, Jaw width 1mm, Total length 17mm, Jaw pressure 100g |
| Stainless Steel Micro Serrefines Straight - 6mm | Fine Science Tools | 18055-03 | Jaw length 6mm, Jaw width 1mm, Total length 15mm, Jaw pressure 100g |
| Surgical Platform | Custom, magnetic | ||
| SurgiVet Vaporstick Anesthesia Machine | General Anesthetic Services, Inc | V7015 | |
| T/Pump Localized Therapy | Stryker | TP700 Series | |
| Vacuum-Pressure Pump | Barnant Co. | 400-1901 | |
| Vannas Scissors with Microserrations Straight | Fine Science Tools | 15070-08 | Cutting edge: 5mm, Tip diameter: 0.1mm - 8.5cm |
| Vetergesic Buprenorphine | Ceva Animal Health Ltd | NAC No.:12380352 | 0.324 mg/ml buprenorphine hydochloride Solution for Injection for Dogs and Cats |
| Vetroson V-10 Bipolar Electrosurgical Unit | Summit Hill Laboratories | No catalog number | |
| Surgical Drape | PDC Healthcare | DRP1824 | Multi-purpose sterile clear plastic, 18" x 24", 40/case |
References
- Global Observatory on Donation and Transplantation. Organ Donation and Transplantation Activities. , http://www.transplant-observatory.org/download/2016-activity-data-report (2016).
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Dopazo, C., et al. Analysis of adult 20-year survivors after liver transplantation. Hepatology International. 9 (3), 461-470 (2015).
- Schoening, W. N., et al. Twenty-year longitudinal follow-up after orthotopic liver transplantation: a single-center experience of 313 consecutive cases. American Journal of Transplantation. 13 (9), 2384-2394 (2013).
- Pischke, S., et al. Factors associated with long-term survival after liver transplantation: A retrospective cohort study. World Journal of Hepatology. 9 (8), 427-435 (2017).
- Hamdani, S., et al. Delayed and short course of rapamycin prevents organ rejection after allogeneic liver transplantation in rats. World Journal of Gastroenterology. 23 (38), 6962-6972 (2017).
- Endo, K., et al. Pretransplant replacement of donor liver grafts with recipient Kupffer cells attenuates liver graft rejection in rats. Journal of Gastroenterology and Hepatology. 30 (5), 944-951 (2015).
- Zhao, Z., et al. IL-34 Inhibits Acute Rejection of Rat Liver Transplantation by Inducing Kupffer Cell M2 Polarization. Transplantation. 102 (6), e265-e274 (2018).
- Nagakawa, Y., et al. Over-expression of AIF-1 in liver allografts and peripheral blood correlates with acute rejection after transplantation in rats. American Journal of Transplantation. 4 (12), 1949-1957 (2004).
- Gao, L. H., Zeng, L. X., Chen, H. M., Wan, R. H. Cytomegalovirus infection accelerates the process of chronic rejection in rat liver transplantation. Transplantation Proceedings. 45 (6), 2536-2538 (2013).
- Wu, Y., et al. Effects of combined genes of CTLA4Ig and IDO in post-liver transplantation immune tolerance of rats. Annals of Hepatology. 15 (5), 729-737 (2016).
- He, X. S., et al. Influence of warm ischemia injury on hepatic functional status and survival of liver graft in rats. Hepatobiliary and Pancreatic Diseases International. 2 (4), 504-508 (2003).
- Tamura, A., et al. Combination effect of tacrolimus and FTY720 in liver transplantation in rats. Transplantation Proceedings. 31 (7), 2785-2786 (1999).
- Wang, Z., et al. RhGH attenuates ischemia injury of intrahepatic bile ducts relating to liver transplantation. Journal of Surgical Research. 171 (1), 300-310 (2011).
- Jiang, J. W., et al. Chronic bile duct hyperplasia is a chronic graft dysfunction following liver transplantation. World Journal of Gastroenterology. 18 (10), 1038-1047 (2012).
- Tang, Y., et al. S-Adenosylmethionine attenuates bile duct early warm ischemia reperfusion injury after rat liver transplantation. Molecular Immunology. 95, 83-90 (2018).
- Nosaka, T., Bowers, J. L., Cay, O., Clouse, M. E. Biliary complications after orthotopic liver transplantation in rats. Surgery Today. 29 (9), 963-965 (1999).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47 (3), 428-431 (1989).
- Post, S., et al. The impact of arterialization on hepatic microcirculation and leukocyte accumulation after liver transplantation in the rat. Transplantation. 54 (5), 789-794 (1992).
- Hori, T., et al. Impact of hepatic arterial reconstruction on orthotopic liver transplantation in the rat. Journal of Investigative Surgery. 25 (4), 242-252 (2012).
- Zhou, S., et al. New method of stent-facilitated arterial reconstruction for orthotopic mouse liver transplantation. Journal of Surgical Research. 187 (1), 297-301 (2014).
- Noack, K., Bronk, S. F., Kato, A., Gores, G. J. The greater vulnerability of bile duct cells to reoxygenation injury than to anoxia. Implications for the pathogenesis of biliary strictures after liver transplantation. Transplantation. 56 (3), 495-500 (1993).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26 (1), 198-205 (1997).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62 (5), 582-587 (1996).
- Zhao, D., Wheatley, A. M. Orthotopic liver transplantation in the rat: comparison of models with and without rearterialization of the graft. European Surgical Research. 25 (5), 294-302 (1993).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49 (4), 675-678 (1990).
- Liu, X., He, C., Huang, T., Gu, J. Development of a New Technique for Reconstruction of Hepatic Artery during Liver Transplantation in Sprague-Dawley Rat. PLoS One. 10 (12), e0145662 (2015).
- Oldani, G., Lacotte, S., Morel, P., Mentha, G., Toso, C. Orthotopic liver transplantation in rats. Journal of Visualized Experiments. (65), (2012).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16 (6), 664-669 (1973).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28 (1), 47-50 (1979).
- Kashfi, A., et al. A review of various techniques of orthotopic liver transplantation in the rat. Transplantation Proceedings. 37 (1), 185-188 (2005).
- Chong, A. S., Alegre, M. L., Miller, M. L., Fairchild, R. L. Lessons and limits of mouse models. Cold Spring Harbor Perspectives in Medicine. 3 (12), a015495 (2013).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45 (4), 830-832 (1988).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48 (6), 1080 (1989).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48 (1), 166-168 (1989).
- Shi, Y., et al. Magnetic ring anastomosis of suprahepatic vena cava: novel technique for liver transplantation in rat. Transplant International. 28 (1), 89-94 (2015).
- Dippe, B. E., et al. An improved model for rat liver transplantation including arterial reconstruction and simplified microvascular suture techniques. Journal of Investigative Surgery. 5 (4), 361-373 (1992).
- Kobayashi, E., Kamada, N., Goto, S., Miyata, M. Protocol for the technique of orthotopic liver transplantation in the rat. Microsurgery. 14 (8), 541-546 (1993).
- Oldani, G., et al. Efficient nonarterialized mouse liver transplantation using 3-dimensional-printed instruments. Liver Transplation. 22 (12), 1688-1696 (2016).
- Oldani, G., et al. Manufacturing devices and instruments for easier rat liver transplantation. Journal of Visualized Experiments. (75), e50380 (2013).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22 (2), 62-68 (2002).
- Li, G. L., et al. High incidence of biliary complications in rat liver transplantation: can we avoid it? World Journal of Gastroenterology. 17 (26), 3140-3144 (2011).
- Zammert, M., Gelman, S. The pathophysiology of aortic cross-clamping. Best Practice and Research: Clinical Anaesthesiology. 30 (3), 257-269 (2016).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56 (1), 19-24 (1993).
- Ijtsma, A. J., et al. The clinical relevance of the anhepatic phase during liver transplantation. Liver Transplation. 15 (9), 1050-1055 (2009).
- Miyata, M., Fischer, J. H., Fuhs, M., Isselhard, W., Kasai, Y. A simple method for orthotopic liver transplantation in the rat. Cuff technique for three vascular anastomoses. Transplantation. 30 (5), 335-338 (1980).
- Marni, A., Ferrero, M. E. A four-technique comparative study of orthotopic liver transplantation in the rat. American Journal of Surgery. 156 (3 Pt 1), 209-213 (1988).