Overview
Fonte: Laboratório de Jeff Salacup - Universidade de Massachusetts Amherst
O produto de uma extração de solvente orgânico, um extrato lipídeca total (TLE), é muitas vezes uma mistura complexa de centenas, se não milhares, de diferentes compostos. O pesquisador muitas vezes só está interessado em um punhado de compostos ou, se estiver interessado em muitos, pode precisar remover constituintes indesejados que estão "no caminho" ou co-eluindo. Por exemplo, as concentrações de compostos individuais em uma amostra são frequentemente determinadas em um cromatógrafo gasoso acoplado a um detector de 500 chama (GC-FID), porque a relação entre a resposta fid (em pA) e a quantidade de composto em uma amostra (por exemplo,ng/μL) é linear e sensível. A porção GC do instrumento separa diferentes compostos em uma amostra baseada em seu ponto de ebulição, estrutura química e afinidade com uma fase sólida que pode mudar de acordo com a aplicação. O resultado é um cromatógrafo (Figure 1), mostrando a separação de diferentes componentes químicos no tempo, bem como sua concentração relativa (calculada como a área sob a curva). No entanto, às vezes mais de um composto elutes fora do GC de cada vez (Figure 1). Neste caso, a purificação da amostra é necessária antes que os compostos possam ser quantificados com confiança.
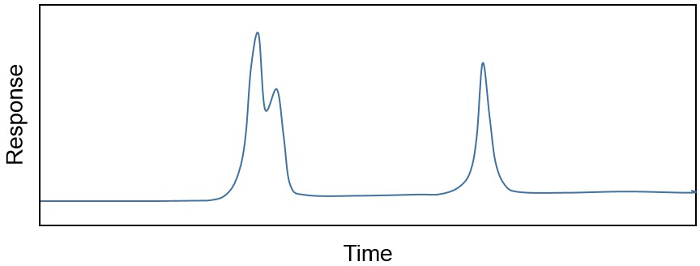
Figura 1. Um cromatógrafo mostrando a separação de diferentes componentes químicos ao longo do tempo e sua concentração relativa (área sob a curva). Picos de eluição e separação são mostrados.
Principles
Os FAMEs (esters de metila ácido graxo) são importantes constituintes de micróbios terrestres e marinhos e são frequentemente usados, em conjunto com técnicas genéticas, para descrever a diversidade microbiana do ecossistema em sistemas modernos e antigos. No entanto, a presença de FAMEs em uma amostra nem sempre é útil. Devido ao seu tamanho e química semelhantes, os FAMEs chamados alkenonatos apenas co-elute com cetonas de alquila de cadeia longa, chamados alkenones(Figura 2). A distribuição de alkenonas em uma amostra relaciona informações sobre a temperatura da superfície do mar no momento e/ou no local onde a amostra foi colhida, e por isso sua caracterização precisa e precisa é importante.
A saponificação é uma técnica comum de purificação usada para converter FAMEs em ácidos graxos, alterando assim suas características químicas o suficiente para removê-las da co-eluição com alkenonas(Figura 3). Saponificação é uma forma de hidrólise. Na hidrólise, a água é usada para dividir moléculas. A saponificação é uma hidrólise acelerada na presença de uma base, como hidróxido de potássio (KOH). KOH dissolve-se em K+ e OH- na água. O antion de hidróxido (OH-, íon carregado negativamente) adiciona ao átomo de carbono terciário ligeiramente carregado positivamente no coração da FAME (Figura 3, topo). No entanto, esta configuração química é instável, (o carbono se uniu a muitos outros átomos) e o alkoxida (ROH-) é expelido. Mas o H da base conjugada esta expulsão forma-se rapidamente para o alcóxido para formar o teor alcoólico metanol e o sal de potássio ácido graxo(Figura 3, meio). Neste ponto, o OFENDING FAME (alquenato) foi convertido em um produto químico que não se co-elutes com ele. No entanto, se desejar também analisar a química FAME, eles podem ser recuperados pela adição de ácido (HCl) à solução, até que o pH atinja ~2. Neste pH, o sal de potássio ácido graxo é dividido para formar um ácido carboxílico e sal iônico (KCl; Figura 3, inferior).

Figura 2. As estruturas químicas de uma alquena com 37 átomos de carbono e 2 ligações duplas (topo) e sua alquenato associado FAME (inferior).

Figura 3. Um esquema da saponificação do ácido palmítico usando hidróxido de potássio (KOH) para aumentar a taxa de hidrólise (http://www.mpbio.com/).
Saponificação é uma técnica comumente usada para remover ésteres de metila ácido graxo de uma mistura orgânica complexa.
Amostras orgânicas complexas são frequentemente analisadas por cromatografia gasosa, que é usada para determinar as concentrações relativas de componentes individuais.
No entanto, compostos semelhantes em tamanho e estrutura não podem ser distinguidos pelo instrumento, distorcendo os resultados. Portanto, compostos indesejados que produzem sinais sobrepostos devem ser removidos para obter resultados precisos.
Este vídeo abrange o uso da saponificação para purificar alkenones para paleoclimatologia. É o primeiro de uma série detalhando a purificação de amostras complexas de biomarcadores. Ele cobrirá o procedimento, bem como alguns outros usos da técnica.
Cetonas de alquila de cadeia longa poli-insaturadas, chamadas alkenonas, têm sido demonstradas para fornecer informações úteis sobre a temperatura da superfície do mar.
No entanto, os organismos que produzem alkenonas muitas vezes criam esteres de metila ácidos graxos que são semelhantes em tamanho e estrutura química, chamados alquenatos. Devido a essas semelhanças, os alquenatos devem ser removidos antes que uma análise precisa possa ser obtida.
A saponificação é uma técnica comum usada para evitar a co-eluição dessas moléculas. A saponificação utiliza água para dividir a ligação molecular de um éster. Uma base se prende ao carbono no coração do alquenato. Esta reação de adição cria um intermediário instável, e o alkoxida é expulso.
O hidrogênio do ácido recém-formado move-se para o alkoxida expelido, e o ânion carboxilato resultante forma uma ligação iônica com a cáção da base. O resultado é um álcool e um sal de ácido graxo. Adicionar um ácido forte irá re-gerar o ácido carboxílico. Neste ponto, o alquenato ofensivo foi convertido em uma forma que não mais se co-elutes com a alkenone de interesse.
Agora que você entende como a saponificação pode ser usada para purificar uma mistura orgânica, você está pronto para começar o procedimento.
Primeiro, adquira um extrato lipídado total seco - ou TLE - que foi obtido utilizando um método de extração de solvente. Em seguida, prepare as soluções de saponificação conforme descrito no protocolo de texto. Certifique-se de que todos os componentes estão puros e livres de hidrocarbonetos. Uma vez que as soluções sejam preparadas, adicione o TLE seco a um frasco de vidro borossilicato de 60 mL. Adicione 2 mL de 2 hidróxido de potássio normal e sele o frasco. Em seguida, aqueça o frasco a 60 °C por 2,5 h para apertar o laço éster. Quando estiver completo, deixe a amostra esfriar até a temperatura ambiente. Uma vez que a amostra tenha esfriado, adicione 2 mL de solução de cloreto de sódio de 5% ao frasco. Tampe o frasco, e agite brevemente. Adicione 6 N de ácido clorídrico em gota até que um pH de 2 seja atingido - usando papel pH para testar. A adição deste ácido protonatorá o ânion carboxilato para formar o produto final - o ácido carboxílico estável.
Agora que a solução acidificada é livre de éster, adicione 5 mL de hexano. Cap e shake vigorosamente por 5 segundos para extrair os compostos orgânicos da água. Deixe a solução descansar até que as fases orgânicas e aquosas se separem completamente. Sais, íons e ácido clorídrico não redigido permanecerão na fase aquosa, enquanto os compostos orgânicos se separarão no hexano. Uma vez que as fases tenham se separado completamente, remova aproximadamente 75% do hexano usando uma pipeta e dispense em outro frasco de 40 mL. Repita este processo de extração duas vezes adicionais, adicionando 5 mL de hexano cada vez. Uma vez que isso esteja concluído, descarte a solução aquosa restante em um recipiente de resíduos adequado. Rotule o frasco contendo a fase orgânica recém-saponizada. Os ácidos carboxílicos produzidos não podem ser injetados nos instrumentos comumente utilizados para análise de alkenone sem maior purificação. Ácidos carboxílicos injetados em um cromatógrafo a gás rapidamente se acumulam e arruinam entradas, forros de entrada e a parte frontal das colunas. Para remover esses ácidos, a amostra primeiro precisa passar por outra técnica de purificação: separação via cromatografia de coluna.
A saponificação tem várias aplicações na extração e purificação de moléculas orgânicas.
A saponificação pode ser usada não apenas para separar biomarcadores, mas também para extrair componentes individuais para uso em produtos comerciais. Neste exemplo, compostos da tabacaria - Nicotiana glauca - foram isolados e analisados para investigar seu potencial como matéria-prima para uma grande variedade de produtos de base biológica, como combustível, calor e uma variedade de compostos químicos.
As folhas foram primeiro homogeneizadas, depois centrifadas, para concentrar as moléculas de interesse. O material concentrado da planta foi então saponizado. O material extraído foi analisado com espectrometria de massa cromatografia líquida, para determinar a concentração de tocopherol - uma família de compostos de vitamina E tipicamente encontrados em plantas.
O material extraído também pode ser reconstituído in vitro à sua composição original. Neste exemplo, a saponificação foi usada para extrair carotenoides de plantas de espinafre, para serem posteriormente reconstituídos in vitro. O espinafre foi primeiro homogeneizado, depois centrifutado, para colher as moléculas de pigmento. Essas moléculas foram então suspensas em uma solução de hidróxido de potássio em um funil separador, iniciando a saponificação. Os carotenoides saponificados separados em uma camada de éter, que foi coletada e seca. Usando uma série de tampões de solução, os carotenoides - e outras moléculas de pigmentação - foram posteriormente reconstituídos in vitro. Esta purificação permitiu a análise desses pigmentos sem a interferência de compostos orgânicos estruturados da mesma forma.
Devido à sua capacidade de hidrolisar ésteres, a saponificação pode ser usada para "libertar" compostos que de outra forma estão ligados a macromoléculas. Neste exemplo, um passo de saponificação anidro é usado para converter etil 4-fluorobenzoato ao sal ácido carboxílico de potássio4-fluorobenzoato. Essa desproteção através da saponificação permite a produção de SFB bruto - uma reação que não seria possível se a molécula permanecesse "presa".
Você acabou de assistir a introdução de JoVE à purificação de Uk'37 amostras através da saponificação. Agora você deve entender como a saponificação funciona, e como usá-la para purificar alkenones em um extrato lipídudo total. Outros processos de purificação serão demonstrados em vídeos subsequentes.
Obrigado por assistir!
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. Instalação e Preparação de Materiais
- Obtenha um extrato lipídeco total (TLE) usando um método de extração de solvente (Sonication, Soxhlet ou Accelerated Solvent Extraction (ASE).
- Prepare uma solução de 2 N KOH em 5% H2O em metanol.
- KOH e metanol podem ser comprados em varejistas químicos. Esses produtos químicos devem ser puros e livres de hidrocarbonetos.
- A massa molar de KOH é ~56 amu rendendo 1 mol de OH- para cada mol de KOH. Assim, para alcançar uma concentração de 2 N, dissolva 112 g de KOH em 0,95 L de água pura e 0,05 L de metanol.
- Note que a dissolução de KOH na água é exotérmica e cria uma grande quantidade de calor. Tome cuidado para adicionar as pelotas KOH à água lentamente para evitar uma reação violenta.
- Dissolva 112 g de pelotas KOH em 0,95 L de água pura em uma placa de agitação automática.
- Adicione 0,05 L de metanol uma vez que todo o KOH é dissolvido para ajudar na dissolução dos biomarcadores orgânicos na solução aquosa.
- KOH e metanol podem ser comprados em varejistas químicos. Esses produtos químicos devem ser puros e livres de hidrocarbonetos.
- Prepare uma solução de ácido clorídrico de 6 N (HCl) em H2O.
- HCl pode ser comprado de varejistas químicos. Este produto químico deve ser puro e livre de hidrocarbonetos.
- HCl geralmente vem concentrado como 13 N. Assim, uma mistura de 1:1 de HCl e água pura produz uma mistura de 6,5 N de HCl, que é perto o suficiente de 6 N para os propósitos deste experimento.
- Certifique-se de adicionar o HCL à água e não o contrário, pois adicionar água ao HCl concentrado é exotermímico e gera calor. Isso pode fazer com que o HCL espirre.
- Despeje suavemente e lentamente 100 mL HCl em um béquer contendo 100 mL de água pura, girando a mistura entre adições de HCl.
- Prepare uma solução de 5% NaCl (sal de mesa) em H2O.
- NaCl pode ser comprado de varejistas químicos. Este produto químico deve ser puro e livre de hidrocarbonetos.
- Calcular e pesar a massa de sal necessária para fazer ~1 L de solução de 5% (w/w). 1 L de água pesa ~1 kg ou 1.000 g. Assim, 50 g de NaCl dissolvido em 950 mL dá uma solução de 5% (50 g+ 950 g = 1.000 g; 50 g / 1.000 g = 0,05 ou 5%).
- Adicione suavemente 50 g de NaCl à água pura em uma placa de agitação automática e espere que ela se dissolva.
- Obtenha os seguintes materiais: 2 frascos de vidro limpos e queimados (550 °C por 6 h) 40 mL borossilicados com tampa forrada com PTFE; um forno aquecido ou blocos de aquecimento; combustíveis (550 °C por 6 h) pipetas e lâmpadas de vidro borossilicato; fita pH (alcance ácido); Hexano (hexano pode ser comprado em varejistas químicos. Este produto químico deve ser Grau Optima ou equivalente).
2. Métodos
- Comece com o TLE seco (contendo ésteres) em um dos frascos de vidro borossilicato de 40 mL.
- Adicione aproximadamente 10 mL de 2 N KOH ao TLE e cap.
- Aqueça no forno ou em um bloco de aquecimento a 60 °C por 2,5 h para apertar a ligação éster(Figura 3).
- Remova a amostra do fogo e deixe esfriar até a temperatura ambiente.
- Adicione aproximadamente 10 mL da solução NaCl de 5% à TLE (Figura 3). Isso ajuda a manter a interface entre a fase aquosa e orgânica (a ser adicionada) da espuma. Cap e shake brevemente.
- Adicione 6 N HCl ao TLE salgado dropwise até que o pH 2 seja alcançado para protonar o O- e formar o produto final, um ácido carboxílico estável(Figura 3; use papel pH para testar). Se o TLE foi colorido, pode haver uma mudança de cor coincidindo com pH 2.
- Adicione aproximadamente 20 mL de hexano à solução acidificada, que agora está livre de éster. Cap e shake vigorosamente para 5 s para extrair compostos orgânicos da água.
- Deixe definir até que as fases aquosas e orgânicas separem completamente. Sais, íons, água e HCl não redigido permanecem na fase aquosa. Compostos orgânicos estão agora no hexano.
- Remova aproximadamente 75% do hexano supernante usando uma pipeta e dispense no outro frasco de vidro borossilicato de 40 mL.
- Repita 2,7 - 2,9 duas vezes, adicionando aproximadamente 10 mL de hexano cada vez.
- Descarte a mistura aquosa restante em um recipiente de resíduos adequado.
- Rotule o frasco contendo hexano e orgânicos sem éster "TLE - saponificado.
Saponificação é uma técnica comumente usada para remover ésteres de metila ácido graxo de uma mistura orgânica complexa.
Amostras orgânicas complexas são frequentemente analisadas por cromatografia gasosa, que é usada para determinar as concentrações relativas de componentes individuais.
No entanto, compostos semelhantes em tamanho e estrutura não podem ser distinguidos pelo instrumento, distorcendo os resultados. Portanto, compostos indesejados que produzem sinais sobrepostos devem ser removidos para obter resultados precisos.
Este vídeo abrange o uso da saponificação para purificar alkenones para paleoclimatologia. É o primeiro de uma série detalhando a purificação de amostras complexas de biomarcadores. Ele cobrirá o procedimento, bem como alguns outros usos da técnica.
Cetonas de alquila de cadeia longa poli-insaturadas, chamadas alkenonas, têm sido demonstradas para fornecer informações úteis sobre a temperatura da superfície do mar.
No entanto, os organismos que produzem alkenonas muitas vezes criam esteres de metila ácidos graxos que são semelhantes em tamanho e estrutura química, chamados alquenatos. Devido a essas semelhanças, os alquenatos devem ser removidos antes que uma análise precisa possa ser obtida.
A saponificação é uma técnica comum usada para evitar a co-eluição dessas moléculas. A saponificação utiliza água para dividir a ligação molecular de um éster. Uma base se prende ao carbono no coração do alquenato. Esta reação de adição cria um intermediário instável, e o alkoxida é expulso.
O hidrogênio do ácido recém-formado move-se para o alkoxida expelido, e o ânion carboxilato resultante forma uma ligação iônica com a cáção da base. O resultado é um álcool e um sal de ácido graxo. Adicionar um ácido forte irá re-gerar o ácido carboxílico. Neste ponto, o alquenato ofensivo foi convertido em uma forma que não mais se co-elutes com a alkenone de interesse.
Agora que você entende como a saponificação pode ser usada para purificar uma mistura orgânica, você está pronto para começar o procedimento.
Primeiro, adquira um extrato lipídado total seco - ou TLE - que foi obtido utilizando um método de extração de solvente. Em seguida, prepare as soluções de saponificação conforme descrito no protocolo de texto. Certifique-se de que todos os componentes estão puros e livres de hidrocarbonetos. Uma vez que as soluções sejam preparadas, adicione o TLE seco a um frasco de vidro borossilicato de 60 mL. Adicione 2 mL de 2 hidróxido de potássio normal e sele o frasco. Em seguida, aqueça o frasco a 60 °C por 2,5 h para apertar o laço éster. Quando estiver completo, deixe a amostra esfriar até a temperatura ambiente. Uma vez que a amostra tenha esfriado, adicione 2 mL de solução de cloreto de sódio de 5% ao frasco. Tampe o frasco, e agite brevemente. Adicione 6 N de ácido clorídrico em gota até que um pH de 2 seja atingido - usando papel pH para testar. A adição deste ácido protonatorá o ânion carboxilato para formar o produto final - o ácido carboxílico estável.
Agora que a solução acidificada é livre de éster, adicione 5 mL de hexano. Cap e shake vigorosamente por 5 segundos para extrair os compostos orgânicos da água. Deixe a solução descansar até que as fases orgânicas e aquosas se separem completamente. Sais, íons e ácido clorídrico não redigido permanecerão na fase aquosa, enquanto os compostos orgânicos se separarão no hexano. Uma vez que as fases tenham se separado completamente, remova aproximadamente 75% do hexano usando uma pipeta e dispense em outro frasco de 40 mL. Repita este processo de extração duas vezes adicionais, adicionando 5 mL de hexano cada vez. Uma vez que isso esteja concluído, descarte a solução aquosa restante em um recipiente de resíduos adequado. Rotule o frasco contendo a fase orgânica recém-saponizada. Os ácidos carboxílicos produzidos não podem ser injetados nos instrumentos comumente utilizados para análise de alkenone sem maior purificação. Ácidos carboxílicos injetados em um cromatógrafo a gás rapidamente se acumulam e arruinam entradas, forros de entrada e a parte frontal das colunas. Para remover esses ácidos, a amostra primeiro precisa passar por outra técnica de purificação: separação via cromatografia de coluna.
A saponificação tem várias aplicações na extração e purificação de moléculas orgânicas.
A saponificação pode ser usada não apenas para separar biomarcadores, mas também para extrair componentes individuais para uso em produtos comerciais. Neste exemplo, compostos da tabacaria - Nicotiana glauca - foram isolados e analisados para investigar seu potencial como matéria-prima para uma grande variedade de produtos de base biológica, como combustível, calor e uma variedade de compostos químicos.
As folhas foram primeiro homogeneizadas, depois centrifadas, para concentrar as moléculas de interesse. O material concentrado da planta foi então saponizado. O material extraído foi analisado com espectrometria de massa cromatografia líquida, para determinar a concentração de tocopherol - uma família de compostos de vitamina E tipicamente encontrados em plantas.
O material extraído também pode ser reconstituído in vitro à sua composição original. Neste exemplo, a saponificação foi usada para extrair carotenoides de plantas de espinafre, para serem posteriormente reconstituídos in vitro. O espinafre foi primeiro homogeneizado, depois centrifutado, para colher as moléculas de pigmento. Essas moléculas foram então suspensas em uma solução de hidróxido de potássio em um funil separador, iniciando a saponificação. Os carotenoides saponificados separados em uma camada de éter, que foi coletada e seca. Usando uma série de tampões de solução, os carotenoides - e outras moléculas de pigmentação - foram posteriormente reconstituídos in vitro. Esta purificação permitiu a análise desses pigmentos sem a interferência de compostos orgânicos estruturados da mesma forma.
Devido à sua capacidade de hidrolisar ésteres, a saponificação pode ser usada para "libertar" compostos que de outra forma estão ligados a macromoléculas. Neste exemplo, um passo de saponificação anidro é usado para converter etil 4-fluorobenzoato ao sal ácido carboxílico de potássio4-fluorobenzoato. Essa desproteção através da saponificação permite a produção de SFB bruto - uma reação que não seria possível se a molécula permanecesse "presa".
Você acabou de assistir a introdução de JoVE à purificação de Uk'37 amostras através da saponificação. Agora você deve entender como a saponificação funciona, e como usá-la para purificar alkenones em um extrato lipídudo total. Outros processos de purificação serão demonstrados em vídeos subsequentes.
Obrigado por assistir!
Subscription Required. Please recommend JoVE to your librarian.
Results
Esta purificação produz um TLE livre de ésteres que podem estar co-eluting com os alkenones. No entanto, a purificação produziu ácidos carboxílicos, que não podem ser injetados em instrumentos comumente usados para analisar amostras para concentrações de alkenona devido à sua baixa volatilidade. Por exemplo, o ponto de ebulição do hexano, um hidrocarboneto de 6 carbonos, é de 68 °C, mas o ponto de ebulição de seu ácido (ácido hexanoico) é de 205 °C. A maioria dos biomarcadores gc tem de 20 a 35 átomos de carbono (o ponto de ebulição geralmente aumenta com um número crescente de átomos), e a maioria dos programas de temperatura GC param em torno de 300 °C. Ácidos carboxílicos injetados em um GC rapidamente se acumulam e arruinam entradas, forros de entrada e a parte frontal das colunas. Para remover esses ácidos, a amostra primeiro precisa passar por outra técnica de purificação por meio da cromatografia da coluna.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Como mencionado anteriormente, a saponificação é comumente usada em laboratórios de geoquímica orgânica para remover ésteres de metila ácidos graxos (FAMEs) de alkenones, chamados alkenoatos, que co-elute com alkenonas em cromatógrafos a gás(Figure 1). A saponificação também é usada para "libertar" ácidos graxos "ligados" a sedimentos ou macromoléculas. A degradação e preservação da matéria orgânica e dos biomarcadores em sedimentos envolve a remoção de grupos funcionais (N, O e S) e a eventual polimerização de biomarcadores individuais em macromoléculas e/ou a adsorção de biomarcadores e macromoléculas em superfícies minerais. Nem todos os biomarcadores em um cenário tornam-se vinculados, e a proporção de biomarcadores vinculados à liberdade pode mudar por definição e idade dos sedimentos por razões ainda não totalmente explicadas. A saponificação, às vezes a temperaturas mais altas do que as aqui discutidas (>200 °C), é usada para libertar esses biomarcadores vinculados no esforço de descrevê-los, sua fonte e os mecanismos responsáveis por sua natureza vinculada.
Subscription Required. Please recommend JoVE to your librarian.




