Overview
Fonte: Meunier Sylvain1,2,3, Perchet Thibaut1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Unità di Linfopoiesi, Dipartimento di Immunologia, Istituto Pasteur, Parigi, Francia
2 INSERM U1223, Parigi, Francia
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, Parigi, Francia
4 Platfrom, Citometria a flusso e biomarcatori UtechS, Center for Translational Science, Pasteur Institute, Parigi, Francia
La difesa contro gli agenti patogeni dipende dalla sorveglianza da parte del sistema immunitario. Questo sistema è complesso e comprende molti tipi di cellule, ognuna con funzioni specifiche. Questa complessa composizione consente risposte immunitarie a una grande varietà di agenti patogeni e lesioni. L'immunità adattativa consente risposte specifiche contro agenti patogeni specifici. La maggior parte delle cellule responsabili di questo tipo di immunità sono i linfociti (cellule B e cellule T). Di solito, le cellule B rispondono alle infezioni extracellulari (come le infezioni batteriche) e le cellule T rispondono alle infezioni intracellulari (come le infezioni virali). I diversi tipi di cellule nelle popolazioni di linfociti possono essere caratterizzati dalla combinazione di proteine di superficie cellulare che esprimono e/o da un pannello di citochine secrete.
La selezione magnetica consente l'arricchimento di popolazioni cellulari mirate utilizzando proprietà magnetiche ed espressione di una o più proteine di superficie cellulare (1, 2). Questa tecnica consiste di tre passaggi. In primo luogo, le cellule vengono incubate con perle magnetiche che sono accoppiate con uno o più anticorpi monoclonali specifici. Le cellule che esprimono proteine di superficie che si legano a questi anticorpi si attaccano alle perle magnetiche. Quindi, le popolazioni cellulari mirate vengono catturate con un magnete. Per finire, le cellule bersaglio vengono eluite dal magnete. Alla fine, si ottengono due prodotti di selezione, uno contenente cellule non etichettate e il secondo contenente le cellule bersaglio accoppiate con le perli magnetiche. Le colonne possono essere utilizzate per migliorare l'efficienza dello smistamento magnetico. Nella colonna, un elemento non magnetico allunga il percorso della cella attraverso la colonna. Quindi, il flusso cellulare viene rallentato, facilitando la cattura cellulare da parte del magnete.
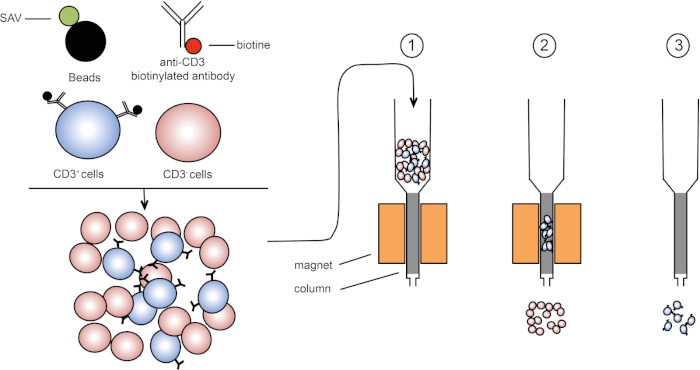
Figura 1: Rappresentazione schematica della separazione magnetica. I leucociti timici sono colorati con anticorpi biotinilati anti-CD3. Dopo il lavaggio, le perle accoppiate alla streptavitina (SAV) fissano specificamente la biotina sugli anticorpi anti-CD3. (1) Le celle vengono trasferite in una colonna. (2) Il magnete non trattiene le celle non etichettate, mentre le celle CD3-positive rimangono nella colonna. Infine, la colonna viene separata dal magnete e (3) le cellule CD3-positive vengono eluite nel mezzo. Fare clic qui per visualizzare una versione più grande di questa figura.
Esistono due tipi di smistamento magnetico (3). Nella selezione positiva, le cellule di interesse vengono catturate con le pere magnetiche. Nella selezione negativa, le cellule indesiderate vengono rimosse catturando con le pere magnetiche che trasportano gli anticorpi appropriati. Questa tecnica MACS consente un buon arricchimento delle cellule bersaglio e migliora la percentuale di cellule recuperate dall'1-20% al 60-98% in un organo. Dopo lo smistamento, è necessario verificare la purezza cellulare e lo smistamento con metodi diversi (ad esempio citometria a flusso). La tecnica MACS è ideale per arricchire una popolazione target per altri esperimenti come la coltura cellulare o l'analisi del ciclo cellulare.
In questo esercizio di laboratorio, dimostriamo come isolare i leucociti timici e successivamente arricchire le cellule timiche CD3-positive dal mix usando la tecnica di selezione delle cellule magnetiche.
Procedure
1. Preparazione
- Prima di iniziare, indossare guanti da laboratorio e indumenti protettivi appropriati.
- Lavare tutti gli strumenti di dissezione, prima con un detergente e poi con etanolo al 70% e poi asciugarli con un tovagliolo di carta pulito.
- Preparare 200 ml di soluzione salina bilanciata di Hank (HBSS) contenente il 2% di siero fetale di vitello (FCS).
2. Dissezione
- Appuntare un topo eutanasizzato su una piastra di dissezione in posizione supina.
- Utilizzando forbici e pinza eseguire una laparotomia longitudinale per accedere alla cavità toracica.
- Rimuovi il cuore per accedere al timo, che si trova sopra il cuore. Quindi, identifica il timo, che è composto da due lobi bianchi e si trova nella cavità toracica sopra il cuore.
- Usando la pinica staccare accuratamente il timo e posizionarlo sulla capsula di Petri con 5 ml di HBSS 2% FCS.
3. Isolamento delle cellule immunitarie
- Posizionare il timo su un colino cellulare da 40 μm sulla stessa capsula di Petri. Schiacciare il timo con uno stantuffo per dissociarlo nello stesso piatto.
- Trasferire il timo dissociato e il fluido in un tubo centrifugo da 15 ml.
- Lavare la capsula di Petri con 5 ml di HBSS 2% FCS e trasferire il mezzo lavato anche nello stesso tubo della centrifuga.
- Centrifugare il tubo a 370 x g per 7 min a 20°C ed eliminare il surnatante evitando il pellet.
- Ricaspendare il pellet in 2 ml di acetato di potassio per lisire gli eritrociti. Attendere 2 minuti e quindi portare il volume fino a 14 ml utilizzando HBSS 2% FCS.
- Centrifugare nuovamente il tubo a 370 x g per 7 min a 20°C. Scartare il surnatante e ricaspenare il pellet in 5 ml di HBSS 2% FCS.
- Stimare la concentrazione cellulare utilizzando il test di colorazione blu tripano e regolare la concentrazione cellulare finale a10 7 cellule / mL utilizzando un volume appropriato di HBSS 2% FCS.
4. Etichettatura magnetica delle cellule immunitarie
- Prendi due tubi FACS. Etichettare un tubo, "cellule T non arricchite", e l'altro tubo, "cellule T arricchite", che saranno separati utilizzando l'etichettatura magnetica.
- Distribuire la soluzione cellulare in ciascuno dei due tubi FACS.
- Centrifugare il tubo "cellule T arricchite" a 370 x g per 3 min a 20°C ed eliminare il surnatante evitando il pellet.
- Spese di sospensione del pellet in 250 μL di miscela di anticorpi biotinilati anti-CD3 (Tabella 1, Miscela 1).
| Mescolare | Etichettatura dei reagenti | Diluizione |
| 1 | Anticorpo biotinilato anti-CD3 | 1/400 (in HBSS 2% FCS) |
| 2 | Pere accoppiate a streptavidina | 1/5 (in HBSS 2% FCS) |
| 3 | Anti-CD3 BV421 | 1/200 (in HBSS 2% FCS) |
Tabella 1: Composizione della miscela di anticorpi. Le miscele 1 e 2 sono utilizzate per la separazione magnetica. Mix 3 viene utilizzato per valutare l'arricchimento cellulare dopo la separazione magnetica.
- Incubare la miscela di sospensione cellulare-anticorpo per 15 minuti a 4°C al buio.
- Aggiungere 3 ml di HBSS 2% FCS a entrambi i tubi e centrifugarli nuovamente a 370 x g per 3 minuti a 20°C.
- Scartare il surnatante e risospenare il pellet in perle accoppiate a streptaviduina da 250 μL (Tabella 1, Miscela 2).
- Incubare la miscela cellulare e le perle per 20 minuti sul ghiaccio.
- Quindi, aggiungere 3 ml di HBSS 2% FCS e mescolare bene e centrifugare nuovamente a 370 x g per 3 minuti a 20 ° C.
- Rispendare il pellet in 2 ml di HBSS 2% FCS.
5. Separazione magnetica delle cellule CD3-positive
- Posizionare la colonna sul magnete e aggiungere 3 ml di HBSS 2% FCS per umidificare il sistema. Attendere 5 minuti.
- Quindi, pipettare le celle etichettate nella colonna.
- Dopo che la sospensione cellulare passa attraverso la colonna, lavare la colonna X3 volte con 3 ml di HBSS 2% FCS.
- Quindi, rimuovere la colonna dal magnete e posizionarla in un tubo di raccolta da 15 ml.
- Per eluire le cellule bersaglio, aggiungere 5 ml di HBSS 2% FCS alla colonna e lavare la colonna con lo stantuffo.
- Ripetere la fase di eluizione con altri 5 ml di HBSS 2% FCS.
6. Valutazione dell'arricchimento delle cellule bersaglio mediante citometria a flusso
- Trasferire 500 μL di sospensione cellulare eluita in un tubo FACS etichettato come "cellule T arricchite". Trasferire 200 μL di sospensione di "cellule T non arricchite" in un secondo FACS.
- Quindi, centrifugare entrambi i tubi a 370 x g per 7 minuti a 20°C.
- Eliminare il surnatante, quindi aggiungere 100 μL di anticorpo fluorescente Mix 3 (vedere Tabella 1) in entrambe le provette.
- Incubare entrambi i tubi per 20 minuti a 4°C al buio.
- Quindi, aggiungere 3 ml di HBSS 2% FCS ai tubi e centrifugarli a 370 x g per 3 minuti a 20 °C.
- Scartare il surnatante, quindi risusediare ogni tubo in 250 μL di HBSS 2% FCS.
- Ora, valuta il tasso di arricchimento cellulare CD3-positivo mediante citometria a flusso.
7. Analisi dei dati
- Apri l'icona 'FlowJo' e trascina i file per ogni tubo nella finestra "Tutti i campioni".
- Fare doppio clic sul file "celle T arricchite" per visualizzare il dot plot che visualizza lo scatter in avanti (FSC-A) sull'asse X e lo scatter laterale (SSC-A) sull'asse Y.
- Clicca su"Poligono"per cerchiare le popolazioni di linfociti.
- Quindi, fai doppio clic sulla popolazione cerchiata per creare una nuova finestra.
- Selezionare "FSC-W" sull'asse Y e "FSC-A" sull'asse X, e cerchiare le celle negative FSA-W. Nella finestra"Identificazione sottopopolazione",denominare la popolazione cellulare "celle singole".
- Fare doppio clic sulla popolazione cerchiata per creare una nuova finestra. Selezionare "CD3" sull'asse Y e cerchiare le celle CD3-positive. Nella finestra"Identificazione sottopopolazione"denominare la popolazione cellulare "Cellule T".
- Ripeti con le "cellule T non arricchite".
- Per visualizzare la popolazione cellulare, fare clic su "Editor layout" e trascinare la popolazione "cellule T" dai file "cellule T arricchite" e "cellule T non arricchite" nella scheda.
- Appariranno i dot plot che rappresentano i linfociti CD3+. Le cellule CD3+ dovrebbero apparire solo nella popolazione di interesse nel tubo arricchito CD3+.
- Per valutare l'arricchimento dei linfociti CD3+ nelle cellule ordinate, fare clic su"Editor tabelle",quindi trascinare la popolazione di "cellule T" dai file "cellule T arricchite" e "cellule T non arricchite" nella tabella.
- Nel menu "Statistiche", selezionare " Frequenza delle celluledei linfociti" per controllare la percentuale di cellule CD3 + in tutti i linfociti, quindi fare clic su "Crea tabella".
- I valori dei parametri verranno visualizzati in una nuova tabella. Per le "cellule T arricchite", la frequenza delle cellule CD3+ dovrebbe essere di circa l'80%.
Lo smistamento cellulare attivato magneticamente, o MACS, è una tecnica che consente ai ricercatori di separare le cellule in base a specifici epitopi espressi sulle loro superfici.
Il processo inizia in genere con l'estrazione di un organo o tessuto, come il timo. Quindi, le cellule vengono separate meccanicamente, di solito schiacciando, fino a quando il tessuto non viene dissociato in singole cellule. Le cellule indesiderate possono essere rimosse in questa fase tramite l'aggiunta di sostanze chimiche. Ad esempio, il cloruro di ammonio-potassio o il tampone ACK possono essere utilizzati per lisi di eritrociti indesiderati.
Successivamente, un anticorpo coniugato a una molecola chiamata biotina viene aggiunto alla sospensione e questi complessi si legano agli epitopi della superficie delle cellule bersaglio. La biotina ha un'alta affinità per un'altra molecola chiamata streptavitina. Nella fase successiva, le molecole di streptavidina fuse in perle magnetiche vengono aggiunte alle cellule etichettate con anticorpi. Quando la biotina e la streptavitina entrano in contatto, si legano strettamente. Il risultato è che le cellule di interesse sono rivestite con perli magnetiche. Questo complesso è a volte indicato come un sandwich. In questo caso, CD3 sulla membrana cellulare sul fondo, quindi anti-CD3 coniugato alla biotina e, infine, streptavitina coniugata a perle magnetiche.
Queste celle etichettate possono ora essere collocate in una colonna contenente una matrice che, assistita dalla gravità, consente alle cellule di passare lentamente da un magnete. Mentre lo fanno, le celle con etichetta magnetica con perli si attaccheranno al bordo del tubo più vicino al magnete, mentre le celle non etichettate continueranno in un tubo di raccolta sottostante. Successivamente, le celle etichettate possono essere rimosse dalla colonna semplicemente rimuovendo il magnete, aggiungendo una soluzione di eluente e applicando una leggera pressione con uno stantuffo per sciacquarle fuori dalla colonna e in un nuovo tubo di raccolta. In definitiva, questo processo consente il recupero dal 60 al 98% delle cellule di interesse.
In questa procedura, isoleremo i leucociti timici da un topo e useremo MACS per risolvere le cellule T CD3-positive prima di confermare l'efficienza dello smistamento utilizzando FACS.
Per iniziare, indossare qualsiasi dispositivo di protezione appropriato, tra cui un camice da laboratorio e guanti. Quindi, lavare un paio di forbici e pinza di dissezione con etanolo al 70% e asciugarli con un tovagliolo di carta pulito. Quindi preparare 200 millilitri di siero fetale al polpaccio HBSS 2%, o FCS, mescolando quattro millilitri di FCS con 196 millilitri di HBSS.
Fissare un topo eutanasizzato in posizione supina su una piastra di dissezione. Usando forbici e pinza, eseguire una laparotomia longitudinale per accedere alla cavità toracica. In primo luogo, rimuovere il cuore per ottenere l'accesso al timo, che si trova sopra il cuore. Quindi identificare il timo, che è composto da due lobi bianchi. Usando la pinica, staccare con cura il timo e posizionarlo su una capsula di Petri con cinque millilitri di HBSS 2% FCS.
Per isolare le cellule immunitarie, prima posizionare il timo su un colino cellulare da 40 micrometri nella capsula di Petri. Schiacciare il tessuto con uno stantuffo per dissociarlo nel piatto. Successivamente, sciacquare lo stantuffo e il filtro con HBSS 2% FCS per recuperare eventuali cellule aderenti. Quindi, pipettare le cellule di timo dissociate e il fluido dalla capsula di Petri in un tubo di centrifuga da 15 millilitri. Lavare la capsula di Petri con cinque millilitri di HBSS 2% FCS e trasferire questa soluzione di lavaggio anche nel tubo della centrifuga da 15 millilitri.
Quindi, centrifugare il tubo a 370 volte g per sette minuti a 20 gradi Celsius. Scartare il surnatante e risuscicare il pellet in due millilitri di tampone di lisi ACK per lisi degli eritrociti. Incubare per due minuti a temperatura ambiente sul piano di lavoro. Quindi, portare il volume a 14 millilitri con HBSS 2% FCS. Centrifugare il tubo a 370 volte g per sette minuti a 20 gradi Celsius. Quindi, scartare il surnatante e risospentare le cellule in cinque millilitri di HBSS 2% FCS.
Stimare la concentrazione cellulare utilizzando un vetrino di Malassez come mostrato nel protocollo per l'isolamento FACS dei linfociti B e regolare la concentrazione cellulare a 10-settima cellula per millilitro con HBSS 2% FCS.
Trasferire 500 microlitri di soluzione cellulare in due tubi FACS. Etichettare un tubo cellule T non arricchite e l'altro tubo T-cellule T arricchite, che saranno separate utilizzando l'etichettatura magnetica.
Centrifugare il tubo delle cellule T arricchito a 370 volte g per tre minuti a 20 gradi Celsius. Scartare il surnatante e risuspare il pellet in 250 microlitri di anticorpo anti CD3 accoppiato a biotina diluito uno su 400 in HBSS 2% FCS. Incubare le cellule per 20 minuti sul ghiaccio e al buio. Aggiungere tre millilitri di HBSS 2% FCS ai tubi e centrifugarli di nuovo a 370 volte g per tre minuti a 20 gradi Celsius. Scartare il surnatante e risuscidere il pellet in 250 microlitri di perle accoppiate a streptavidina diluite una su cinque in HBSS 2% FCS. Incubare la miscela di cellule e perle per 20 minuti sul ghiaccio. Quindi, aggiungere tre millilitri di HBSS 2% FCS al tubo, pipettare su e giù per mescolare e centrifugare di nuovo a 370 volte g per tre minuti a 20 gradi Celsius. Risusciendi il pellet in due millilitri di HBSS 2% FCS.
Posizionare la colonna sul magnete e aggiungere tre millilitri di HBSS 2% FCS per umidificare il sistema. Quindi, pipettare le celle colorate nella colonna. Dopo che la sospensione cellulare passa attraverso la colonna, lavare la colonna tre volte con tre millilitri di HBSS 2% FCS. Quindi, rimuovere la colonna dal magnete e posizionarla in un tubo da 15 millilitro. Per eluire le celle bersaglio, aggiungere cinque millilitri di HBSS 2% FCS alla colonna e sciacquare la colonna con uno stantuffo. Ripeti questo passaggio con altri cinque millilitri di HBSS 2% FCS.
Per valutare l'efficacia dell'isolamento delle cellule bersaglio, trasferire prima 500 microlitri di sospensione cellulare eluita in un tubo FACS ed etichettarlo con cellule T arricchite. Quindi, centrifugare sia i tubi arricchiti che quelli non arricchiti a 370 volte g per sette minuti a 20 gradi Celsius. Scartare il surnatante, quindi aggiungere 100 microlitri di anticorpi fluorescenti diluiti uno su 200 in HBSS 2% FCS a entrambi i tubi. Incubare le cellule per 20 minuti sul ghiaccio e al buio. Quindi, aggiungere tre millilitri di HBSS 2% FCS ai tubi e centrifugarli a 370 volte g per tre minuti a 20 gradi Celsius. Scartare il surnatante, quindi risospenare il pellet in 250 microlitri di HBSS 2% FCS. Ora, valuta il tasso di arricchimento cellulare CD3-positivo utilizzando la citometria a flusso come mostrato nel protocollo FACS.
Ora, determineremo la frequenza dei linfociti CD3-positivi tra tutti i timociti che sono stati isolati dal timo del topo. Per iniziare, fai doppio clic sull'icona FlowJo e trascina i file per ciascun tubo nella finestra di tutti i campioni. Quindi, fare doppio clic sul file delle celle T arricchito per visualizzare le celle registrate da quel campione su un dot plot che visualizza lo scatter in avanti, FSCA, sull'asse x e lo scatter laterale, SSCA, sull'asse y.
Clicca sul poligono per cerchiare le popolazioni di linfociti. Quindi, fai doppio clic sulla popolazione cerchiata per creare una nuova finestra. Selezionare FSC-W sull'asse y e FSC-A sull'asse x e cerchiare le celle FSA-W negative. Nella finestra di identificazione della sottosomis popolazione, denominare la popolazione cellulare Celle singole. Quindi, fai clic su OK nella finestra di identificazione della popolazione secondaria, quindi fai doppio clic sulla popolazione cerchiata per creare una nuova finestra. Selezionate CD3 sull'asse y e circondate le celle CD3-positive. Nella finestra di identificazione della sottosopecificazione, assegnare un nome alle cellule T della popolazione cellulare. Ripetere l'operazione con il file delle cellule T non arricchite. Per visualizzare la popolazione di celle, fare clic su Editor layout e trascinare la popolazione di cellule T da cellule T arricchite e file di cellule T non arricchite nella scheda.
Appariranno dot plot che rappresentano i linfociti CD3-positivi. Le cellule CD3-positive dovrebbero apparire solo nella popolazione di interesse nel tubo arricchito CD3-positivo. Per valutare l'arricchimento dei linfociti CD3-positivi nelle cellule ordinate, fare clic su Editor tabella e quindi trascinare la popolazione di cellule T da cellule T arricchite e file di cellule T non arricchite nella tabella. Nel menu statistico, selezionare Frequenza delle cellule linfocitarie per controllare la percentuale di cellule CD3-positive in tutti i linfociti. Quindi, fai clic su Crea tabella. I valori dei parametri verranno visualizzati in una nuova tabella. Per le cellule T arricchite, la frequenza delle cellule CD3-positive dovrebbe essere di circa l'80% o superiore.
Subscription Required. Please recommend JoVE to your librarian.
Results
In questo protocollo, le cellule CD3-positive sono state arricchite da leucociti timici utilizzando lo smistamento delle cellule magnetiche (Figura 1). Prima dell'arricchimento delle cellule magnetiche le cellule CD3-positive rappresentavano il 53,6% delle cellule timiche totali (Figura 2, pannelli superiori). Dopo l'arricchimento delle cellule magnetiche la percentuale di cellule CD3-positive è aumentata al 95% (Figura 2, pannelli inferiori). Pertanto, MACS è una tecnica di arricchimento cellulare semplice, veloce ed efficiente per arricchire le popolazioni cellulari desiderate da una miscela di sospensione cellulare.

Figura 2: Strategia di Gating e ordinamento dei test di purezza. Le cellule vengono prima recintate in base alla loro morfologia (a sinistra: FSC-A, SSC-A), quindi le cellule vengono tracciate contro CD3 (a destra: CD3, SSC-A). Il pannello superiore rappresenta la sospensione delle cellule di timo prima dell'arricchimento cellulare. Il pannello inferiore rappresenta la sospensione delle cellule di timo dopo lo smistamento delle cellule magnetiche. Fare clic qui per visualizzare una versione più grande di questa figura.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
La tecnologia di separazione magnetica è un metodo comune per ordinare facilmente e rapidamente una popolazione cellulare target. Utilizzando anticorpi specifici delle cellule T e pere magnetiche abbiamo arricchito la frequenza delle cellule T nel nostro campione. Il tasso di purezza alla fine dell'esperimento dipende dalla percentuale di cellule bersaglio nella sospensione cellulare iniziale. Le cellule ottenute dopo lo smistamento delle cellule magnetiche possono essere utilizzate per vari scopi come il trasferimento cellulare o l'analisi del ciclo cellulare. Un altro metodo di selezione, utilizzando la citometria a flusso, può essere utilizzato per arricchire le cellule. Questa tecnica produce un tasso di purezza molto elevato dopo lo smistamento delle cellule, tuttavia richiede più passaggi e richiede più tempo.
Subscription Required. Please recommend JoVE to your librarian.
References
- Owen, C. S. and Sykes, N. L. Magnetic labeling and cell sorting. Journal of Immunological Methods. 73 (1), 41-48 (1984).
- Miltenyi, S., Müller, W., Weichel, W. and Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Plouffe, B. D., Murthy, S. K. and Lewis, L. H. Fundamentals and application of magnetic particles in cell isolation and enrichment: a review. Reports on Progress in Physics. 78 (1), (2014).




