Overview
Fonte: Laboratorio del Dr. Yuriy Román — Massachusetts Institute of Technology
Un potenziostato/galvanostato (spesso indicato semplicemente come potenziostato) è uno strumento che misura la corrente a un potenziale applicato (operazione potenziostatica) o misura il potenziale a una corrente applicata (operazione galvanostatica) (Figura 1). È lo strumento più comunemente utilizzato nella caratterizzazione elettrochimica di materiali anodici e catodici per celle a combustibile, elettrolizzatori, batterie e supercondensatori.
Convenzionalmente, questi materiali anodici e catodici sono interfacciati con un potenziostato tramite una cella elettrochimica a tre elettrodi. Le derivazione dell'elettrodo dal potenziostato sono collegate all'elettrodo di riferimento, al controelettrodo (spesso chiamato elettrodo ausiliario) e all'elettrodo di lavoro (che contiene il materiale di prova di interesse). La cella elettrochimica viene quindi riempita con una soluzione elettrolitica ad alta forza ionica, come una soluzione acida, alcalina o salina. Il supporto per questa soluzione ad alta resistenza ionica è tipicamente acquoso; tuttavia, per le applicazioni che richiedono finestre a più alto potenziale di cella operativa, come batterie e supercondensatori, vengono spesso utilizzati supporti non acquosi. Il mezzo cellulare viene degassato con un gas inerte (per evitare reazioni collaterali indesiderate) o con un gas di prova (se la reazione di prova coinvolge un gas in uno degli elettrodi).
In alternativa, un ponte salino o una membrana viene impiegato per mantenere il contatto ionico se le due semicelle devono essere misurate in elettroliti diversi. Nell'elettrocatalisi eterogenea, questo tipo di cella "a due compartimenti" viene spesso utilizzata se la molecola di prova all'elettrodo di lavoro è anche reattiva al controelettrodo. Ciò accade frequentemente poiché il controelettrodo tipicamente impiegato è il platino, che è un catalizzatore altamente attivo per molte reazioni. Qui verranno utilizzate celle a compartimento singolo, in cui tutti e tre gli elettrodi si trovano nello stesso supporto.
Questo video spiegherà il processo di lucidatura di un elettrodo funzionante, la preparazione di un inchiostro catalizzatore, il montaggio dell'inchiostro catalizzatore sull'elettrodo funzionante, la preparazione della cella elettrochimica e quindi l'esecuzione di misurazioni elettrochimiche. Le misurazioni eseguite includono: voltammetria ciclica (CV), voltammetria lineare a sweep (LSV), cronopotenziometria (CP) e cronoamperometria (CA).
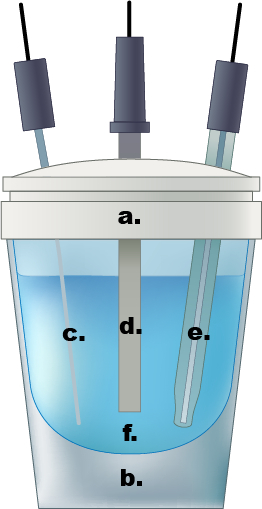
Figura 1. Un esempio di cella elettrochimica a compartimento singolo. a.) Tappo in teflon, b.) cella di vetro, c.) Pt filo contro elettrodo, d.) elettrodo di lavoro, e.) Elettrodo di riferimento Ag/AgCl, f.) 0,5 M soluzione acquosa di elettrolita di acido solforico.
Principles
Il potenziostato può essere utilizzato per applicare un potenziale anodico o catodico costante all'elettrodo di lavoro e misurare la corrente anodica o catodica risultante (cronoamperometria) o il potenziostato può essere azionato galvanostaticamente tramite un circuito di controllo di feedback e applicare una corrente anodica o catodica costante con il potenziale misurato che varia nel tempo per mantenere questa corrente applicata (cronopotenziometria). In alternativa, lo spazio potenziale può essere esplorato con il tempo usando la voltammetria ciclica o la voltammetria lineare per misurare i potenziali anodici e catodici rispetto a una velocità di scansione potenziale applicata (la derivata del potenziale rispetto al tempo).
In tutte queste tecniche, anche durante il funzionamento galvanostatico, il potenziostato controlla il potenziale applicato e misura il flusso di elettroni da (a) l'elettrodo di lavoro a (da) il controelettrodo quando l'elettrodo di lavoro agisce come anodo (catodo). Il potenziale applicato viene fatto riferimento all'elettrodo di riferimento, che contiene un sistema redox (come un elettrodo di cloruro d'argento o un elettrodo di calomela saturo) con un potenziale noto e stabile che viene interfacciato con la soluzione elettrolitica tramite una fritta porosa. Durante il normale funzionamento, il potenziostato aspira una corrente trascurabile ma diversa da zero attraverso l'elettrodo di riferimento in modo che un potenziale accurato possa essere applicato all'elettrodo di lavoro. Mentre il potenziostato misura il flusso di elettroni da o verso una mezza reazione alla successiva, la soluzione elettrolitica completa il circuito impedendo l'accumulo di carica all'anodo o al catodo.
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. Inchiostro catalizzatore e preparazione dell'elettrodo di lavoro
Precauzioni di sicurezza: I metalli supportati sul nerofumo devono essere maneggiati in una cappa aspirante o in un involucro di bilanciamento fino a quando non è in forma di sospensione poiché queste polveri sono rischi per inalazione.
- Utilizzando una bilancia chiusa, pesare 5-10 mg di catalizzatore metallo/nerofumo e aggiungere a un flaconcino di vetro con un tappo.
- Utilizzando una micropipetta, diluire il catalizzatore con acqua in modo tale che la concentrazione finale sia di 7,5 mg di catalizzatore per ml di acqua.
- Durante la sonicazione, 100 μL di soluzione di Nafion 117 per mL di acqua vengono aggiunti alla sospensione.
- L'inchiostro deve essere sonicato per almeno 10 minuti per garantire una dispersione uniforme e la completa miscelazione del supporto nerofumo con l'agente legante.
- Mentre l'inchiostro è sonicante, un elettrodo a disco di carbonio vetroso da 3 mm deve essere pulito e lucidato strofinandolo con un movimento circolare vorticoso su un cuscinetto di allumina morbida coperto con una soluzione di allumina da 0,05 μm. Dovrebbe quindi essere risciacquato abbondantemente con acqua per rimuovere l'allumina.
- Successivamente, 7 μL di inchiostro vengono gocciolati su un elettrodo a disco di carbonio vetroso da 3 mm lucidato e orientato verticalmente. L'elettrodo di lavoro viene quindi essiccato a 80 °C per 1 ora se il catalizzatore è stabile all'aria o evaporato sotto un vuoto debole per 30 minuti se il catalizzatore è sensibile all'aria.
2. Preparazione delle celle elettrochimiche
Precauzioni di sicurezza: Guanti, labcoat e occhiali di sicurezza devono essere sempre indossati, ma è particolarmente importante per lavorare con la soluzione di acido solforico. Se qualche goccia di soluzione si rovescia sui polsi, deve essere lavata con acqua e sapone per 15 minuti. Per le fuoriuscite maggiori, la rimozione degli indumenti contaminati e l'uso del lavaggio oculare o delle docce devono essere utilizzati per 15 minuti seguiti da una consultazione medica. I cavi elettrici non devono essere toccati una volta posizionati sulla cella elettrochimica.
- Una cella di vetro viene riempita con 10 mL di 0,5 M H2SO4 e degassata per almeno 30 minuti con un flusso di azoto ad altissima purezza
- I tappi in teflon delle celle elettrochimiche hanno 3 porte per l'elettrodo di lavoro, il controelettrodo e l'elettrodo di riferimento
- L'elettrodo di riferimento Ag/AgCl viene rimosso dalla sua soluzione di 1 M KCl, risciacquato accuratamente con acqua DI e quindi inserito nella cella.
- Il controelettrodo a filo di platino platinizzato viene risciacquato accuratamente con acqua DI e quindi inserito nella cella.
- L'elettrodo di lavoro essiccato viene risciacquato con acqua DI e quindi inserito nella cella.
- Il potenziostato è acceso.
- Il cavo dell'elettrodo bianco viene collegato per primo e collegato all'elettrodo di riferimento.
- Il cavo dell'elettrodo rosso viene quindi collegato all'elettrodo del contatore del filo Pt.
- Il cavo dell'elettrodo verde viene quindi collegato all'elettrodo di lavoro metallo/nero carbonio.
- Un piccolo flusso di spurgo N2 viene lasciato continuamente gorgogliare nell'elettrolita.
- Assicurarsi che nessun cavo si tocchi e che non vi sia alcun contatto elettrico diretto tra i 3 elettrodi se non con l'elettrolita 0,5 M H2SO4.
3. Analisi elettrochimica
- Dopo aver acceso il potenziostato, eseguire almeno 20 cicli di condizionamento tra 0 e 0,4 V rispetto a RHE a 50 mV/s utilizzando CV. Questo viene eseguito scegliendo CV come tecnica e inserendo i limiti di potenziale superiore e inferiore, nonché la velocità di scansione.
- La voltammetria a sweep lineare (LSV) può quindi essere eseguita scegliendo LSV come tecnica e specificando un potenziale iniziale, un potenziale finale e una velocità di scansione. La velocità di scansione per LSV è in genere molto inferiore a CV, di solito 1 – 2 mV / s in modo che le correnti capacitive diventino molto più basse delle correnti derivanti da reazioni superficiali faradaiche
- La cronoamperometria (CA) viene eseguita scegliendo CA o "Curva amperometrica i-t" come tecnica e specificando il potenziale fisso e il periodo di tempo in cui lo strumento deve contenere l'elettrodo di lavoro come potenziale fisso.
- La cronopotenziometria (CP) viene eseguita scegliendo CP come tecnica. CP può essere eseguito in una serie di passaggi correnti in cui una corrente viene specificata per un certo periodo di tempo seguita da una nuova corrente per un determinato periodo di tempo. Queste correnti applicate possono coprire sia correnti anodiche che catodiche all'interno della stessa misurazione CP.
- Al termine dell'analisi elettrochimica, spegnere il potenziostato.
- Scollegare i conduttori dell'elettrodo e conservarli in un luogo asciutto lontano da liquidi per evitare la corrosione.
- Rimuovere l'elettrodo di riferimento e risciacquare con abbondanti quantità di acqua DI. Quindi riportare l'elettrodo di riferimento direttamente alla sua soluzione di stoccaggio da 1 M KCl. La punta di questo elettrodo non dovrebbe mai essere lasciata asciugare.
- Rimuovere il contatore di fili Pt e risciacquare abbondantemente con acqua DI
- Rimuovere l'elettrodo di lavoro e risciacquare abbondantemente con acqua DI e quindi utilizzare un Kimwipe con acetone per rimuovere facilmente l'inchiostro catalizzatore essiccato dalla superficie dell'elettrodo di lavoro. Si consiglia di lucidare gli elettrodi immediatamente dopo l'uso.
- Disattivare lo spurgo N2.
- Svuotare l'elettrolita usato in un contenitore di rifiuti acido. Risciacquare la cella di vetro e il cappuccio in teflon con abbondanti quantità di acqua DI.
Un potenziostato-galvanostato è lo strumento più comunemente usato nella caratterizzazione elettrochimica e viene utilizzato per comprendere l'effetto dei cambiamenti elettrici su una reazione chimica.
Un potenziostato-galvanostato è uno strumento utilizzato nei sistemi elettrochimici. Misura la corrente a un potenziale applicato in modalità potenziostato, o viceversa in modalità galvanostato. Per semplicità, lo strumento è comunemente chiamato potenziostato.
Le reazioni di ossido-riduzione, o redox, avvengono sulla superficie di un elettrodo e comportano il trasferimento di elettroni. In particolare, la perdita di elettroni in una specie chimica è il caso dell'ossidazione, o il guadagno di elettroni nel caso della riduzione. Questo evento redox può essere indotto da un potenziale applicato, E, chiamato anche tensione.
Questo video dimostrerà l'configurare e le prestazioni dei test elettrochimici utilizzando un potenziostato.
Nella maggior parte dei casi, gli eventi redox sono accoppiati a un potenziostato tramite una cella a tre elettrodi. La cella a tre elettrodi è costituita da un elettrodo funzionante, un elettrodo contatore o ausiliario e un elettrodo di riferimento. L'elettrodo di lavoro è dove si verifica la reazione di interesse e il controelettrodo viene utilizzato per completare il circuito elettrico.
Un potenziale applicato viene misurato rispetto all'elettrodo di riferimento, che contiene un sistema redox con un potenziale dell'elettrodo noto e stabile, E. Gli elettrodi di riferimento comuni sono l'elettrodo di calomela saturo e l'elettrodo di idrogeno reversibile, che vengono utilizzati per scopi di calibrazione. L'elettrodo Ag/AgCl è comunemente usato nei test elettrochimici ed è interfacciato con la soluzione elettrolitica tramite una fritta porosa.
La cella elettrochimica viene riempita con una soluzione elettrolitica ad alta resistenza ionica, come una soluzione acida, alcalina o salina. La soluzione elettrolitica impedisce l'accumulo di carica agli elettrodi.
In un esperimento elettrochimico, potenziale, corrente, tempo e carica possono essere tutti manipolati o misurati dal potenziostato. Quando l'elettrodo di lavoro agisce come catodo, gli elettroni fluiscono dal controelettrodo all'elettrodo di lavoro. Ioni caricati positivamente, o cationi, fluiscono verso il catodo. Il contrario è vero quando l'elettrodo funzionante agisce come anodo. Ioni caricati negativamente, o anioni, fluiscono verso l'anodo.
Selezionando i parametri manipolati e misurati, sono possibili diverse tecniche di misurazione. La cronoamperometria è una tecnica in cui un passo potenziale viene applicato all'elettrodo di lavoro e il cambiamento di corrente risultante viene misurato in funzione del tempo. Quando un passo potenziale è abbastanza grande da causare una reazione elettrochimica all'elettrodo di lavoro, la corrente cambia. Questa tecnica può essere utilizzata per molte applicazioni, come la determinazione dei coefficienti di diffusione nella cinetica di reazione.
Allo stesso modo, la cronopotenziometria è una tecnica in cui viene applicata una corrente costante o variabile e il potenziale viene misurato in funzione del tempo. La corrente applicata fa sì che le specie elettroattive vengano ossidate o ridotte ad un certo ritmo. Questa tecnica viene utilizzata per una vasta gamma di applicazioni, come la determinazione del progresso della reazione.
La voltammetria misura la corrente anodica e catodica rispetto a una potenziale sweep applicata. Questa misurazione esamina l'aggiunta o la rimozione di elettroni da una specie chimica durante l'aumento o la diminuzione del potenziale a un ritmo costante. La voltammetria ciclica, o CV, è trattata in profondità separatamente in un altro video di questa raccolta.
Ora che le basi della voltammetria sono state trattate, la preparazione di una cella a tre elettrodi e di un elettrodo funzionante con un catalizzatore legato alla superficie sarà dimostrata in laboratorio. In questa dimostrazione, verrà preparato e misurato l'inchiostro catalizzatore, che consiste in nanoparticelle di platino in un supporto nerofumo, con un agente legante Nafion. Questo sistema è rappresentativo dell'attuale ricerca sulle celle a combustibile e sulle batterie.
Per iniziare, pesare 7,5 mg di catalizzatore metallo/nero carbonio in una cappa aspirante e aggiungerlo a una fiala di vetro. Diluire il catalizzatore con 1 mL di acqua e aggiungere 100 μL di Nafion 117, quindi tappare il flaconcino.
Sonicare la miscela su ghiaccio per almeno 10 minuti per garantire una dispersione uniforme e la completa miscelazione del supporto nerofumo con il Nafion. Mentre l'inchiostro sta sonicando, preparare l'elettrodo di lavoro, che è un disco di carbonio vetroso da 3 mm.
Pulire e lucidare l'elettrodo strofinandolo delicatamente con un movimento vorticoso e circolare su un cuscinetto morbido coperto con una soluzione di allumina colloidale da 0,05 μm. Dopo la lucidatura, sciacquare abbondantemente l'elettrodo con acqua deionizzata per rimuovere l'allumina.
Successivamente, 7 mL di inchiostro vengono gocciolati sull'elettrodo di carbonio vetroso lucido e orientato verticalmente. Asciugare l'elettrodo di lavoro sotto vuoto a temperatura ambiente. Quindi asciugarlo a 80 °C per un'ora se le nanoparticelle del catalizzatore sono stabili all'aria.
In primo luogo, riempire la cella elettrochimica di vetro con 10 ml di elettrolita. Tappare la cella elettrochimica con un tappo in Teflon con aperture per i tre elettrodi. Degassare l'elettrolita per almeno 30 minuti con gas azoto ad altissima purezza al fine di rimuovere l'ossigeno redox-attivo. Lasciare che l'azoto bolle leggermente durante l'esperimento.
Rimuovere l'elettrodo di riferimento Ag/AgCl dalla sua soluzione di stoccaggio NaCl da 3 M. Risciacquare accuratamente l'elettrodo con acqua deionizzata e inserirlo nella cella elettrochimica.
Quindi, sciacquare l'elettrodo contatore del filo di platino e l'elettrodo di lavoro essiccato con acqua deionizzata e inserirli nella cella. Assicurarsi che gli elettrodi non si tocchino. Accendere il potenziostato e collegare i cavi agli elettrodi di riferimento e di controelettrodo.
Eseguire almeno 20 cicli di condizionamento eseguendo scansioni voltammetriche cicliche tra i limiti di potenziale superiore e inferiore a 50 mV al secondo. Questo passaggio garantisce che le superfici dell'elettrodo siano completamente idratate.
La voltammetria di sweep lineare, o LSV, può essere eseguita specificando i potenziali iniziali e finali e la velocità di scansione. La velocità di scansione per LSV è in genere inferiore a quella per CV. Il risultato è un grafico di potenziale vs corrente con eventi di ossidazione o riduzione visualizzati come picchi nella scansione. In questo caso, il perclorato nell'elettrolita è stato ridotto sulla superficie del catalizzatore nella scansione catodica.
Per eseguire la cronoamperometria, selezionarla come tecnica, quindi specificare il potenziale fisso e il tempo. Il risultato è un grafico di corrente vs. tempo. Il decadimento iniziale è dovuto alla scarica capacitiva, mentre la porzione di stato stazionario è essenzialmente una linea retta. La cronoamperometria è potenziostatica e quindi dopo il decadimento asintotico iniziale degli effetti capacitivi, la corrente attribuita alle reazioni superficiali può essere isolata.
Infine, la cronopotenziometria viene eseguita in una serie di passaggi correnti, in cui una corrente viene specificata per un certo periodo di tempo. Ogni volta che la corrente passa da zero alla corrente di lavoro, c'è un cambiamento asintotico iniziale nel potenziale, seguito da uno stato stazionario. Dopo ogni ciclo di on/off, il materiale catalizzatore stabile richiede lo stesso sovra-potenziale per guidare la corrente specificata.
Le misurazioni elettrochimiche con un potenziostato sono ampiamente utilizzate nell'analisi e nella fabbricazione.
L'elettrochimica viene utilizzata per analizzare il legame delle molecole della sonda agli elettrodi. In questo esempio, gli elettrodi sono stati modellati all'interno di canali microfluidici e funzionalizzati con DNA a singolo filamento. Quando il DNA è stato ibridato con il filamento complementare, la coppia redox è stata bloccata sulla superficie dell'elettrodo.
L'ibridazione del DNA è stata quindi misurata collegando gli elettrodi al potenziostato utilizzando tre elettrodi sonda.
Le misurazioni dell'impedenza, una misura della resistenza al flusso di corrente, hanno mostrato che l'aumento della concentrazione di DNA complementare ha comportato un aumento dell'impedenza e quindi una maggiore ibridazione.
Successivamente, sono stati utilizzati processi elettrochimici per monitorare e caratterizzare la crescita dei biofilm su un elettrodo. Per questo, è stata assemblata una cella a tre elettrodi, con l'elettrolita che è il brodo cellulare.
La crescita del biofilm è stata monitorata utilizzando la cronoamperometria, al fine di ottenere una misurazione esatta e condizioni di coltura riproducibili.
Le tecniche elettrochimiche possono anche essere utilizzate nella fabbricazione di film sottili e strati sulla superficie di un elettrodo. I segnali elettrici attivano ambienti localizzati sulla superficie dell'elettrodo, che possono indurre l'autoassemblaggio dei materiali.
In questo esempio, la deposizione di biomateriali è stata eseguita utilizzando l'elettrodeposizione. Il chitosano, un biopolisaccaride, subisce una transizione sol-gel sulla superficie dell'elettrodo, creando un film.
Hai appena visto l'introduzione di JoVE alla potenziometria. Ora dovresti capire come impostare una tipica cella a tre elettrodi ed eseguire test elettrochimici di base.
Grazie per l'attenzione!
Subscription Required. Please recommend JoVE to your librarian.
Results
Questa procedura si tradurrà in figure contenenti grafici di corrente misurata rispetto al potenziale per ciascuna delle quattro tecniche. Per convenzione per CV e LSV, i grafici saranno anche emessi come corrente misurata rispetto al potenziale, nonostante la realtà che si tratti di tecniche transitorie che misurano la corrente rispetto alla derivata temporale del potenziale.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
CV, LSV, CP e CA sono tecniche indispensabili per determinare l'efficacia di nuovi materiali elettrodici per celle a combustibile, elettrolizzatori, batterie e supercondensatori, nonché per lo sviluppo di campi come l'ossidazione parziale selettiva o la riduzione di sostanze chimiche di base. Questi metodi consentono di determinare i sovrapotenziali delle reazioni su diversi materiali elettrodici rispetto ai loro potenziali di equilibrio termodinamico. Questi metodi consentono anche di determinare la capacità volumetrica o gravimetrica dei supercondensatori. Allo stesso modo, i tassi di carica / scarica degli elettrodi della batteria o dei supercondensatori possono essere determinati con queste tecniche. Queste tecniche consentono anche di determinare la caratterizzazione della stabilità elettrochimica dei materiali. Oltre a queste tecniche di base, le tecniche più avanzate includono la combinazione di tecniche potenziometriche con metodi in situ come IR e spettrometria di massa.
Subscription Required. Please recommend JoVE to your librarian.




