Summary
我们平面膜片钳芯片如何在加拿大国家研究理事会是消毒催芽,介质加载,与细胞接种,制作,用于电生理记录。
Abstract
由于其精湛的敏感性和能力来监视和控制单个细胞的离子通道水平,膜片钳电黄金标准适用于疾病模型和医药屏幕一样1。传统的方法涉及洋溢着一种生理性的解决方案,以便根据其先端2隔离膜的补丁玻璃吸管轻轻地接触一个细胞。在吸管插入一个电极膜修补或破裂时内捕获离子通道的活动,为整个细胞。在过去十年中,膜片钳芯片已提议作为一种替代3,4:暂停膜分离培养基从生理介质中,并在电影中的微型光圈取代移液器的顶点。膜片钳芯片已集成在自动化系统和商业化的高通量筛选5。为了INCR缓解吞吐量,他们包括从悬浮细胞的流体输送,其吸光圈定位,和自动化程序来检测细胞的探头密封,并进入全细胞模式。我们曾经报道过的硅膜片钳芯片制造与优化阻抗和孔的形状,允许在养殖蜗牛神经元动作电位的高品质录音;最近,我们还报道了对哺乳动物神经元的审问7方面所取得的进展。我们的膜片钳芯片制造在加拿大光子学制作中心8,商业铸造,大型系列。我们渴望的electrophysiologists以验证NRCC的技术在不同型号的使用进行合作。芯片根据一般的计划,表示在图1:在一个的有机玻璃文化小瓶和光圈的背面底部的硅芯片是连接到一个地下的陈荫罴EL包两端装有管。细胞培养瓶和测量电极插入在channel.The两个外部干扰最小的细胞流体港口便利的解决方案交换监控探头顶端细胞相比,细胞内的玻璃吸管,这是一个优势灌注。
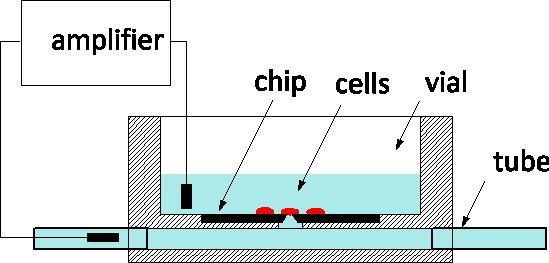
NRCC的膜片钳芯片使用测量原理图1。
我们在这里详细的协议进行消毒和总理的芯片,加载介质,板与细胞,并最终使用电生理记录。
Protocol
1。芯片制造
6结果在3微米厚的独立电影,低1兆欧访问阻力和表面光滑的漏斗状的光圈,有利于细胞9亲密密封过程,见图2。该芯片是单数和粘在有机玻璃包与所面临的一个洞,一个地下通道连接芯片的光圈。胶合被免除的方式,最大限度地减少到标称的17 pF的旁路电容。包配备了两个直径为1.5毫米和6毫米的流体端口的长玻璃管(图3)。

图2。NRCC的膜片钳芯片的聚焦离子束节的扫描电子显微照片显示光滑的二氧化硅表面和漏斗状,有利于亲密的细胞接触,和浅孔为低访问resistanc,占E。

图3。芯片文化小瓶底部粘在地下流体和玻璃管装有有机玻璃包。
2。消毒,清洗和测试
在生物安全柜的光圈,以避免污染或堵塞,应执行以下步骤。
- 消毒,在Harrick基本血浆清洁(www.harrickplasma.com)芯片与0.1-0.3毫巴为15分钟,最大功率为18 W。其他空气等离子系统残留的空气压力,可能会使用,具有同等功率密度(24兆瓦/厘米3),保持产品的功率密度和时间不变。等离子体处理芯片也呈现亲水性,有利于吸。
- 适合玻璃试管,无菌硅橡胶实验室硅胶管,1毫米ID x 2mm的外径(科尔帕默猫。 #96115-08),3英寸的一面,在另一侧的1英寸。
- 填补流体通过无菌过滤标准的磷酸盐缓冲液(PBS)的管,确保无气泡被困。
- 而从短边在1个大气压加压的PBS,剪辑长的硅胶管。通过光圈的PBS池渗出,可能是在小瓶可见。剪辑加压供应的PBS和脱离该供应硅胶管短。
- 填补过滤PBS使用注射器的小瓶。
- 浸银/银:在短管的氯离子电极和反电极在小瓶。阻抗计是用来确认接入电阻之间的300kohm和3Mohm并联电容为10pF和容25pF之间。具有较低的电阻芯片可能有泄漏,和更高的电容被认为是使用不当,因为它可能无法捕捉到细胞的电生理6最快的动态。芯片具有较低的电容或更高的阻力被认为是堵塞,尽管它可能只是泡沫被困在孔口。一些芯片测试1h后,发现有正确的电化学阻抗。
- 用无菌去离子水冲洗的流体通道,空样品瓶和冲洗相同,两次。
- 浸泡30分钟,与新鲜无菌去离子水,管封装芯片,然后在无菌容器中,用无菌去离子水充满了与其他芯片加载。这将确保芯片保持亲水性和不受污染。
3。在细胞生物学实验室芯片的制备
以下步骤进行了HEPA过滤层流罩使用无菌技术,在此过程中使用的所有解决方案必须经过过滤,消毒,使用前用0.22μm的过滤器。
- 打开一个HEPA过滤层流罩下一个芯片的容器和删除conta芯片INER朝下,以避免可能漂浮污染物舀入样品瓶。
- 冲洗小瓶的芯片与新鲜过滤的无菌去离子水的2倍之上,从芯片表面的任何残留碎片。
- 吸过顶瓶的无菌去离子水。
- 将硅胶管连接到一个加压注射器无菌过滤的去离子水的流体通道的一端。在我们的系统与解决方案填补注射器连接设置到20PSI的压缩空气罐加压。 ,以确保无菌,空气被过滤(0.22微米过滤器)之前进入注射器和我们的系统也有一个阀门,让我们停止或施加压力,必要时开/关。
- 使用止血钳,油管钳的输出端。
- 开/关阀,打开加压的解决方案。
- 芯片subterranen流体与新鲜无菌去离子水冲洗,松开油管输出端。
- 为CE通过光圈的水,用止血钳,油管钳输出端。
- 为了避免排水,油管与止血钳输入和输出端和开/关阀关闭。
- 分离的注射器管的输入端。
- 玻璃插头插入油管两端取出止血。
- 样品瓶填充过滤steriled去离子水。
- 放入100毫米无菌菜基地35毫米无菌盘的盖子
- 将芯片上的35毫米和100毫米的盘盖盖盖顶部。
- Image芯片,以确保和芯片的膜孔径的碎片和/或气泡。 在我们的实验室中,我们使用一个堂堂正正的显微镜和20倍长工作距离的目标 。
- 如果碎片和/或气泡存在,反复冲洗流体通道和样品瓶。如果碎片和/或气泡不能被删除,该芯片将被丢弃。
- 一旦芯片影像,返回层流罩,拔下油管两端。
- 将一端的油管加压注射器含有生理媒体。
- 用止血钳,油管钳输出端
- 打开压力阀,从输出端的流体止血和冲洗流体通道与生理媒体
- 冲洗地下流体与生理媒体,开/关阀打开,并取出止血钳从输出端的油管。
- 强行通过光圈的生理媒体,用止血钳,油管钳输出端。
- 用止血钳钳油管输入端和开/关阀关闭。
- 拆下油管从注射器和插头的与GLAS插头油管两端的输入端。
- 取出的止血。
- 删除从顶部小瓶水。
- 填写过滤消毒的生理媒体的样品瓶。
- 100毫米的培养皿放入芯片的背面。
- 将一盘35毫米到100毫米菜基地,填补过滤灭菌去离子水,它以丰富的湿度。
- 覆盖菜,直到它是电镀的时间
4。蜗牛神经元细胞电镀
膜片钳芯片可能是适合各种准备。我们目前正在测试我们的芯片与哺乳动物大脑皮质神经元,并已取得初步结果为14天,这表明我们的杀菌协议是足够的,该芯片是长期培养的细胞毒性细胞。对于本协议的目的,蜗牛神经元的选择,因为它们代表了一个简单但行之有效的模型来研究神经电生理11,它是这些细胞,我们已经取得的最显着的结果10日。详细的细胞分离和培养程序有被描述以前12,13。
从2-3个月的椎实螺钝钳和椎实螺生理盐水麻醉动物,含有10%李施德林stagnalis外壳。
所有后续步骤进行消毒清扫设备和解决方案,在室温下,在无菌层流罩。
- 更换适当的录音解决方案, 使用的Eppendorf移液器生理介质中的流体。在椎实螺神经元的情况下,解决方案包含(毫米):50,氯化钾,氯化镁2,5乙二胺(oxyethylenenitrilo)四乙酸(EGTA)和5 4 5 - (2 -羟乙基)-1-piperazineethanesulfonic磺酸(HEPES,pH值7.4 130 mOsm)14
- 引脚为椎实螺生理盐水充满Sylgard菜的蜗牛和删除整个大脑,如先前所述13
- 治疗的isolat编大脑中定义的媒体(DM)与胰蛋白酶酶(0.2%溶液,西格玛,产品编号的T-9201)18分钟,15分钟,治疗糖尿病和胰蛋白酶抑制剂(西格玛,大豆,产品编号的T-9003)。
- 充满定义媒体的高渗透压成一个小Sylgard菜脚的大脑(HODM - 葡萄糖补充DM 750μL1M葡萄糖溶液20毫升DM)。
- 用细镊子,解剖剪,除去利息节的内,外护套,暴露的神经元。
- 用火抛光玻璃的吸管充满HODM和附加到microsyringe,附近的细胞利息(左踏板背1)适用于温和的吸力,直到大脑和神经分离移液器暂停。
- 玻璃吸管,然后移动到温柔从microsyringe的驱逐允许个别的神经元被轻轻推开了吸管放置在芯片上的个别修补漏洞之上neurochips蘸。
- 让细胞在室温下为最低2H坐在原状,以促进其附着在芯片表面周围的光圈。
5。电生理记录
连接芯片放大器(1 Multiclamp 700B放大器,分子器件,美国加利福尼亚州福斯特城,在我们的例子 )
- 更换在地下流体的解决方案,并在适当的录音解决方案的芯片小瓶。在椎实螺神经元的情况下,上层文化室(单位:mm:51.3氯化钠,1.7氯化钾,氯化钙,1.5氯化镁) 椎实螺生理盐水填充缓冲,以pH值7.9肝素钠14。
- 稳定,胶的芯片上玻片,置于显微镜下。
- 连接芯片放大器(1 Multiclamp 700B放大器,分子器件,福斯特城,加利福尼亚,美国 ) 在我们的例子 ,切断油管的一端,并插入一个silveŕ电线连接头阶段。
- 将参考电极在芯片的顶部小瓶。
- 该芯片是目前录音准备。
- 应用5 mV的步骤与放大器测量的总电阻(R T),并确定了神经元的配置:细胞贴附(R T> 1GΩ的);全细胞(RT = 50-100MΩ加电容瞬态,指示膜破裂,在光圈);或没有密封(R T <5MΩ)。我们在实验的最后一组10,58%%的细胞有高电阻密封,这些细胞的80%表现出兴奋的反应。
6。代表结果
- 申请去极化电流脉冲(增量20 PA)神经元(这种情况LPeD1)。
- 保持在VM接近其静息电位(约 - 60毫伏)的神经元。
- 观察这些去极化脉冲的反应。过度动作电位观察神经元,如果是可行的。
- 图4显示了有代表性的结果,这是在详细讨论了在14,15。

图4。电压响应(顶部)的LPeD1神经元细胞内的脉冲电流(下同)分级系列。适用于VM = - 60mV的电流脉冲。
故障排除
- 电镀前,图像芯片,以确定是否膜和光圈是免费的碎片,并适用于电镀。我们使用一个堂堂正正的显微镜和20倍长工作距离的目标。在我们的实验1的最后一组,67%的芯片被成功引以这种方式。
- 如果碎片和/或气泡存在丢弃芯片和尝试另一个。
- 各种表面处理(浆)或涂料(客运专线,裴等)可以尝试,但成功的可能高度依赖细胞类型后使用。
- 千兆密封和全细胞形成的关键解决方案的流体(“吸管”)组成。调整方案,渗透压,pH值和离子构成的关注。
- 对于长远的文化,开始在微通道中的媒体,然后切换吸取的解决方案之前,通过温和的重力美联储灌注(〜0.5毫升/分钟)记录。
Discussion
NRCC的膜片钳芯片审讯平台是一个潜在的强大的工具,高信息含量的药品检测,并探讨在体外模型的疾病。其玻璃吸管相比的优点是低访问性,这是一个优势,探讨大细胞,尽管有些较大的电容会导致小细胞相媲美的动态。自发细胞光圈密封已定期获得,并观察到自发的14项已全细胞。芯片和玻璃吸管法之间的一个明显差异是探头细胞培养皿中的一部分,并没有手动与细胞膜接触带来的事实。培养细胞,可能是功能性网络的一部分,更多的生物相关模型作为疾病模型的结果,并为不同的机制,确保高细胞探测密封16。然而,通过与细胞悬液相比,愿望cannoT是用来放置一个探头上的细胞。蜗牛等大型细胞,神经元,适合在探头顶部的手动定位。对于小细胞需要更长的培养时间,我们也省却了任何操作的需要,并保持高概率获得顶部的探头,将探头上的细胞图案粘附多肽密封,并表现出对细胞的位置探头17,18。
NRCC的也正在开发聚酰亚胺电容相比,玻璃吸管微芯片膜片钳19。该项目的最终目标,是一个多探头膜片钳芯片,允许从事网络行为,在个别的离子通道的决议14多个神经元的电生理活动的同步监测。这个方法是一个高分辨率的互补方法多电极阵列20。
Disclosures
没有利益冲突的声明。
Acknowledgments
作者要感谢阿列克谢·波格丹诺夫的膜片钳芯片的CPFC,色相陈德良,赵平和马修肇制造与装配援助。 naweed赛义德是由加拿大卫生研究所(CIHR)授予研究所的支持。科林鹿是NSERC和阿尔伯塔省遗产基金会医学研究(AHFMR)奖学金获得者。
References
- Walz, W. Patch-Clamp Analysis: Advanced Techniques. Neuromethods. , 2nd, Springer Protocols. 38 (2007).
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibers. Nature. 260, 799-802 (1976).
- Behrends, J. C., Fertig, N. Ch. 14: Planar Patch-clamp. Neuromethods. , 2nd, (2007).
- Fertig, N., Tilke, A., Blick, R. H. Stable integration of isolated cell membrane patches in a nanomachined aperture. Applied Physics Letters. 77, 1218-1220 (2000).
- Dunlop, J., Bowlby, M., Peri, R., Vasilyev, D., Arias, R. High-throughput electrophysiology: an emerging paradigm for ion-channel screening and hysiology. Nat. Rev. Drug. Discov. 7 (4), 358-368 (2008).
- Py, C., Denhoff, M., Martina, M. A novel silicon patch-clamp chip permits high-fidelity recording of ion channel activity from functionally defined neurons. Biotechnology and Bioengineering. 107 (4), 593-600 (2010).
- Martinez, D., Martina, M., Kremer, L. Development of patch-clamp chips for mammalian cell applications. Micro and Nanosystems. 2 (4), (2010).
- National Research Centre of Canada . , Candian Photonics Fabrication Centre. Available from: http://www.nrc-cnrc.gc.ca/eng/solutions/facilities/prototyping_index.html (c1995-2001).
- Py, C., Salim, D., Monette, R. Cell to aperture interaction in patch-clamp chips visualized by fluorescence microscopy and focused-ion beam sections. Biotechnology & Bioengineering. 108, 1395-1403 (2011).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Bell, H. J., Syed, N. I. Hypoxia-induced modulation of the respiratory CPG. Frontiers in bioscience : a journal and virtual library. 14, 3825-3835 (2009).
- Syed, N. I., Bulloch, A. G. M., Lukowiak, K. In vitro reconstruction of the respiratory central pattern generator of the mollusk Lymnaea. Science. 250, 282-285 (1990).
- Syed, N. I., Zaidi, H., Lovell, P. In vitro reconstruction of neuronal circuits: A simple model system approach. Modern techniques in neuroscience research. Windhorst, U., Johansson, H. , Springer. (1999).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Py, C., Denhoff, M., Martina, M., et al. Silicon patch-clamp chip suitable for high-fidelity recording of ion channel activity from cultured neurons. Biotechnology and Bioengineering. 107 (4), (2010).
- Ong, W. -L., Yobas, L., Ong, W. -Y. A missing factor in chip-based patch clamp assay: gigaseal. Journal of Physics: Conference Series. 34, 187 (2006).
- Charrier, A., Martinez, D., Monette, R. Cell placement and guidance on substrates for neurochip interfaces. Biotechnology and Bioengineering. 105, 368-373 (2010).
- Diaz-Quijada, D., Maynard, C. C. omas, Monette, T., Py, R., A, C. K. rantis, Mealing, G. Surface Patterning with Chemisorbed Chemical Cues for Advancing Neurochip Applications. Industrial & Engineering Chemistry Research. 50 (17), 10029-10035 (2011).
- Martinez, D., Py, C., Denhoff, M., et al. High-fidelity patch-clamp recordings from neurons cultured on a polymer microchip. Biomedical Microdevices. 12, 977-97 (2010).
- Taketani, M., Baudry, M. Advances in Network Electrophysiology: Using Multi-Electrode Arrays. , Springer. (2006).



