ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Her beskriver vi en metode til at visualisere synaptogenese af granulatneuroner i muselillehjernen over tidsforløbet af postnatal hjerneudvikling, når disse celler forfiner deres synaptiske strukturer og danner synapser for at integrere sig i det samlede hjernekredsløb.
Abstract
Neuroner gennemgår dynamiske ændringer i deres struktur og funktion under hjernens udvikling for at danne passende forbindelser med andre celler. Gnaver cerebellum er et ideelt system til at spore udviklingen og morfogenesen af en enkelt celletype, cerebellar granule neuron (CGN), over tid. Her blev in vivo-elektroporation af granulatneuronprogenitorer i muselillehjernen anvendt til sparsomt at mærke celler til efterfølgende morfologiske analyser. Effektiviteten af denne teknik demonstreres i dens evne til at fremvise vigtige udviklingsstadier af CGN-modning med et specifikt fokus på dannelsen af dendritiske kløer, som er specialiserede strukturer, hvor disse celler modtager størstedelen af deres synaptiske input. Ud over at give snapshots af CGN-synaptiske strukturer gennem cerebellar udvikling, kan denne teknik tilpasses til genetisk manipulation af granulatneuroner på en celle-autonom måde for at studere rollen som ethvert gen af interesse og dets virkning på CGN-morfologi, kloudvikling og synaptogenese.
Introduction
Hjernens udvikling er en langvarig proces, der strækker sig fra embryogenese til postnatal liv. I løbet af denne tid integrerer hjernen en kombination af indre og ydre stimuli, der skulpturerer ledningerne af synapser mellem dendritter og axoner for i sidste ende at styre adfærd. Gnaver cerebellum er et ideelt modelsystem til at studere, hvordan synapser udvikler sig, fordi udviklingen af en enkelt neurontype, cerebellar granule neuron (CGN), kan spores, når den overgår fra en stamcelle til en moden neuron. Dette skyldes dels, at et flertal af cerebellar cortex udvikler sig postnatalt, hvilket giver mulighed for nem genetisk manipulation og cellemærkning efter fødslen1.
Hos pattedyr begynder CGN-differentiering i slutningen af embryonal udvikling, når en delmængde af proliferative celler i baghjernen migrerer over rombelæben for at danne en sekundær kimzone på overfladen af lillehjernen 2,3,4. Selvom de er fuldt ud forpligtet til en granulatneuron stamfader (GNP) identitet, fortsætter disse celler med at sprede sig inden for den ydre del af det eksterne granulatlag (EGL) indtil postnatal dag 14 (P14). Spredning af dette lag resulterer i en massiv udvidelse af lillehjernen, da disse celler udelukkende giver anledning til CGN'er5. Når nyfødte CGN'er forlader cellecyklussen i EGL, migrerer de indad mod det indre granulatlag (IGL) og efterlader en axon, der vil bifurcate og rejse i det molekylære lag af cerebellum og danne parallelle fibre, der synapser på Purkinje-celler6. Placeringen af disse fibre i molekyllaget afhænger af tidspunktet for cellecyklusudgang.
CGN'er, der adskiller sig først, forlader deres parallelle fibre mod bunden af molekyllaget, mens axonerne af CGN'er, der adskiller sig senere, er grupperet øverst 7,8. Når CGN-cellelegemerne når IGL, begynder de at uddybe dendritter og danne synapser med nærliggende hæmmende og excitatoriske neuroner. Det modne dendritiske træ af en CGN udviser en stereotyp arkitektur med fire hovedprocesser. I løbet af CGN-modning danner strukturerne i slutningen af disse dendritter en klo, der bliver beriget med postsynaptiske proteiner 9,10. Disse specialiserede strukturer, kaldet dendritiske kløer, indeholder størstedelen af synapserne på granulatneuroner og er vigtige for at modtage både excitatoriske input fra mossy fiberinnerveringer, der stammer fra pons, såvel som hæmmende input fra lokale Golgi-celler. Når de er fuldt konfigureret, tillader de synaptiske forbindelser af CGN'er disse celler at videresende input fra præ-cerebellære kerner til Purkinje-celler, som projicerer ud af cerebellar cortex til de dybe cerebellære kerner.
In vivo postnatal elektroporation af GNP'er er fordelagtig i forhold til andre mærkningsbaserede metoder, såsom virusinfektion og generering af transgene muselinjer, fordi ekspressionen af ønskede konstruktioner kan opnås på en hurtig tidslinje, og metoden er rettet mod en lille population af celler, der er nyttige til at studere celleautonome effekter. Denne metode er blevet anvendt i tidligere undersøgelser til at studere morfologisk udvikling af CGN'er; Disse undersøgelser har imidlertid fokuseret på enten et enkelt tidspunkt eller et kort tidsvindue 9,10,11,12,13. Denne mærkningsmetode blev parret med billedanalyse for at dokumentere ændringerne i CGN-morfologi, der forekommer på tværs af hele CGN-differentieringsforløbet i løbet af de første tre uger af det postnatale liv. Disse data afslører dynamikken i CGN-dendritudvikling, der ligger til grund for konstruktionen af cerebellære kredsløb.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
BEMÆRK: Alle procedurer blev udført under protokoller godkendt af Duke University Institutional Animal Care and Use Committee (IACUC).
1. DNA-forberedelse til in vivo elektroporation eller IVE (1 dag før operation)
- Saml følgende materialer: renset DNA (0,5-25 μg pr. Dyr), 3 M natriumacetat, ethanol, Fast Green farvestof, ultrarent destilleret vand, fosfatbufferopløsning (PBS) (se materialetabellen).
BEMÆRK: For DNA blev en konstruktion, der udtrykker grønt fluorescerende protein (GFP) under en human ubiquitinpromotor, opnået fra Addgene (FUGW, https://www.addgene.org/14883/). Enhver konstruktion, der udtrykker GFP eller et andet fluorescerende protein under kontrol af en allestedsnærværende promotor, skal fungere. CGN-specifik mærkning med denne teknik er ikke afhængig af konstruktionen, men snarere af elektroporationen. - Forbered DNA til elektroporation ved at blande den ønskede mængde DNA, 10 volumenprocent 3 M natriumacetat og 250 volumenprocent 100% iskold ethanol. Bemærk, at DNA'et straks udfældes ud af opløsningen.
- DNA-blandingen fortsætter med at udfældes natten over ved -20 °C eller i en time ved -80 °C.
- Pellet udfældede DNA i en bordpladecentrifuge ved >16.000 × g og vaskes to gange med 70% ethanol.
- Lad DNA-pillen tørre helt, og rekonstituer i en 1x PBS + 0,02% Fast Green-opløsning.

Figur 1: Begrænsning af indsprøjtningsdybden til 1,5 mm ved hjælp af et afstandsstykke. (A) Et segment på 11,2 mm afskæres en ilægningspipette ved hjælp af et barberblad. (B) Afstandsstykket monteres på spidsen af Hamilton-sprøjten (samlet længde er 1,27 cm eller 0,5 tommer) og fastgøres med enten klæbemiddel eller parafilm. Den udsatte spids skal være 1,5 mm lang. Klik her for at se en større version af denne figur.
2. In vivo elektroporation af granulatneuronstamfædre i syv dage gamle postnatale mus
BEMÆRK: Alle elektroporationsoperationer blev udført i en steril og stærkt ventileret kirurgisk suite, og alt personale bar komplet personligt beskyttelsesudstyr, herunder handsker, ansigtsmaske, hårhjelm, kjole og skoovertræk. Alternativt kan operationerne udføres i en ventileret og steril hætte.
- Saml følgende materialer: DNA til elektroporation, lille kirurgisk saks, lille kirurgisk pincet, tilpasset Hamilton-sprøjte, applikator med bomuldsspids, varmepude, betadin, 70% ethanol, 1x PBS, parafilm, vævslim (n-butylester cyanoacrylat), isofluran, elektroporator og pincet-type elektroder (se materialetabellen).
- Skær et afstandsstykke fra en steriliseret påfyldningsspids, så det passer over Hamilton-sprøjten for at begrænse injektionsdybden til 1,5 mm (figur 1A, B). Fastgør afstandsstykket med klæbemiddel eller parafilm.
- Bedøv P7-hvalpen i et isoflurankammer med en leveringshastighed på 0,8 l / min. Bekræft fuld anæstesi ved at overvåge dyret for nedsat åndedræt og mangel på tå- eller haleklemmerespons (figur 2A).
- Når dyret er fuldt bedøvet, placeres hvalpene på en piedestal udstyret med en næsekegle, der konstant leverer 4% isofluran med en leveringshastighed på 0,8 l / min. Rens toppen af hvalpens hoved 3 gange med en steril vatpind af betadin og derefter 70% ethanol, skiftevis mellem de to, for at forberede stedet. Lad opløsningen tørre, før du fortsætter.
- Brug en steriliseret saks til at lave et lille snit med et snit, der spænder over afstanden fra toppen til ørens bund for at afsløre baghjernen (figur 2B).
- Find lillehjernen (figur 2C), indsæt den udsatte spids af Hamilton-sprøjten gennem kraniet, vinkelret på hjernen, og injicer 1,5 μL DNA-blanding i cerebellar parenchyma ved langsomt at skubbe sprøjtens bagstempel. Efter levering af DNA-blandingen trækkes nålen langsomt tilbage for at forhindre spild af ryg, og DNA-opløsningen diffunderes i 30 sekunder.
- Sluk for isofluranen, og anbring hvalpen på en 37 °C varmepude. Forbered pincetelektroden til elektroporation ved at dyppe begge ender i steril 1x PBS.
BEMÆRK: Befugtning af pincetelektroden forhindrer kontaktforbrændinger på hvalpens hud under administration af de elektriske impulser. - Pincetelektroden anbringes over injektionsstedet med plusenden nedad og den negative ende over dyrets hoved (figur 2D). Administrer fem elektriske impulser fra elektroporatoren med følgende indstillinger: 50 ms, 130 V og 950 ms interpulsinterval.
BEMÆRK: Udfør om nødvendigt en testinjektion for at sikre, at injektionsstedet er placeret på cerebellar vermis (figur 2E). - Klem snittet lukket, og forsegl såret med et ikke-giftigt n-butylester cyanoacrylatvævslim. Rens såret med 70% ethanol, da enhver spormængde blod øger sandsynligheden for forældres barnemord og kannibalisme.
- Lad dyret komme sig på en 37 °C varmepude, før ungen sættes tilbage til moderen. Overvåg hvalpen (e) hvert 30. minut i mindst 2 timer efter operationen for at sikre fuld bedring.
BEMÆRK: Barnemord af begge forældre er ret almindeligt. For at forhindre kannibalisme skal du huse faderen i et andet bur, inden elektroporationen påbegyndes, og altid returnere rensede og genoprettede hvalpe (dvs . ingen blodplet, fuldt mobile) til det originale bur på det originale strøelse. Hvalpe kan også tørres af med affald fra det originale bur for at minimere lugten af blod. Brug af en surrogatdæmning kan være nødvendig, hvis den oprindelige dæmning fortsætter med at kannibalisere sine hvalpe.

Figur 2: In vivo cerebellær elektroporation af granulatneuronprogenitorer i P7 vildtype museunger. (A) Hvalpe bedøves med 4% isofluran leveret med en hastighed på 0,8 l / min for at sikre anæstesi under injektionen af DNA-opløsningen. Isofluran indgives med en hastighed på 0,8 l/min. (B) Efter sterilisering af musen 3 gange med betadin og 70% ethanol foretages et snit, der spænder over ørernes afstand og afslører baghjernen. (C) Et forstørret billede af en hvid afgrænsning på kraniet, et vartegn for injektionsstedet. DNA-konstruktion skal injiceres inden for 1 mm over mærket; Stiplede linjer skitserer afgrænsningen, og sort pil angiver injektionsstedet. Ryggene af cerebellar vermis kan være synlige og kan være nyttige til at finde injektionsstedet. (D) Pincet-type elektrodeorientering for effektiv elektroporation. Plus (+) ende skal orienteres nedad for at trække negativt ladet DNA ind i cerebellar parenchyma før administration af elektriske impulser. (E) Testinjektion af 1 μL af et 0,02% Fast Green-farvestof viser, at injektionen er lokaliseret til midten af cerebellar vermis mellem lobules 5-7. Klik her for at se en større version af denne figur.
3. Immunohistokemi af elektroporerede CGN'er
- Følgende materialer indsamles: isofluran, 1x PBS, 4% paraformaldehyd (PFA), 30% saccharose, normalt gedeserum, nonionisk vaske- og rengøringsmiddel, glasskinner, glasdæksel, neglelak, monteringsmedier, Hoechst-kernefarvestof og egnede primære og sekundære antistoffer (se materialetabellen).
- Bedøv forsøgsdyret med isofluran, og bekræft fuld anæstesi med en tå- og haleklemme.
- Udfør en transkardial perfusion ved langsomt at injicere 1x PBS og 4% PFA i venstre ventrikel af dyrets hjerte. Lad blodet dræne fra dyret ved at skære vena cava.
- Fix hjernen natten over ved at nedsænke den i 4% PFA ved 4 ° C. Den følgende dag skylles hjernen hurtigt med 1x PBS, og hjernen overføres til 30% saccharose i 1x PBS til kryobeskyttelse i mindst 24 timer.
- Skær om nødvendigt hjernen i to langs rostral-kaudale aksen, og bekræft ekspressionen af den transfekterede reporterkonstruktion ved hjælp af et opretstående fluorescerende dissekeringsmikroskop.
BEMÆRK: Hold hjernen nedsænket i 1x PBS i en lille skål for at forhindre den i at tørre ud. - Monter hjernen på et frysende mikrotom, skær 25 μm sagittale sektioner i skiver, og lad sektioner udfolde sig i en 1: 1 blanding af 1x PBS og glycerol.
BEMÆRK: Sektioner kan opbevares i denne kryoprotektive opløsning ved -20 °C til langtidsopbevaring. - Vask sektioner tre gange i 1x PBS i 10 minutter hver for at fjerne kryoprotektivt middel, og bloker vævet i 1x PBS + 10% normalt gedeserum + 0,2% nonionisk rengøringsmiddel på en orbitalryster ved stuetemperatur i 1 time.
- Forbered primær antistofopløsning: 1x PBS, 10% normalt gedeserum, 0,2% nonionisk vaskemiddel og anti-GFP-antistof, og centrifuger opløsningen i 5 minutter ved >16.000 × g. Der inkuberes sektioner i antistofopløsningen ved 4 °C på en orbitalryster i 48 timer.
- Vask den primære antistofopløsning af i 15 min fem gange med 1x PBS + 0,2% nonionisk rengøringsmiddel.
- Forbered sekundær antistofopløsning: 1x PBS, 10% normalt gedeserum, 0,2% nonionisk vaskemiddel og et passende sekundært antistof til påvisning af GFP; Opløsningen centrifugeres ved >16.000 × g. Inkuber sektioner i antistofopløsningen på en orbitalryster ved stuetemperatur i 2-3 timer. Beskyt sektionerne mod lyseksponering for at forhindre blegning.
- Vask sekundær antistofopløsning af tre gange med 1x PBS + 0,2% nonionisk rengøringsmiddel i 15 minutter hver gang. Inkuber sektioner i 1x PBS + Hoechst i 5 minutter for at plette kerner.
- Hoechst-opløsningen vaskes af med 1x PBS + 0,2 % nonionisk rengøringsmiddel, og monteres på glasskinner. Dæk sektionerne med monteringsmedier, dæksel gliderne, og forsegl diaset med neglelak for at forhindre fordampning.
4. Morfologiske analyser af CGN'er - tredimensionel (3D) rekonstruktion og overfladeareal og cellulært volumen
- Billede enkelt elektroporerede CGN'er på et konfokalmikroskop ved 63x mål med en 2x zoom, idet du tager z-stack-billeder ved 0,5 μm pr. Stak. Afbild én celle pr. billedvindue for at gøre det nemt at analysere og rekonstruere billeder.
- Installer plug-in'et Simple Neurite Tracer til FIJI ved hjælp af følgende link (https://imagej.net/Simple_Neurite_Tracer:_Basic_Instructions) for nemt og effektivt at spore strukturen af elektroporerede CGN'er i tredimensionelt (3D) rum.
BEMÆRK: Der er en opdateret version af plug-in (https://imagej.net/SNT). - Analyser neuritlængde og dendritisk klodannelse på en blindet måde ved hjælp af Simple Neurite Tracer. Upload enkeltkanals z-stack-billeder af elektroporerede CGN'er til FIJI, og klik på Plugins | Segmentering | Simpelt neuritsporstof (figur 3D).
- Åbn rullemenuen, og vælg Opret ny 3D-fremviser (figur 3D).
- Rul til bunden af en dendrit, hvor den forbinder til cellesoma og start en sti ved at klikke på krydset. Spor stien manuelt ved at klikke gennem de sektioner, hvor celleudfyldningssignalet er klarest, og tryk på [y] for at bevare sporingen. Spor indtil enden af dendritten, hvis den ikke indeholder en klo, eller indtil bunden af kloen, og bekræft stien ved at trykke på [f] (figur 4D).
- Derefter spores kloen ved at starte en sti ved bunden af strukturen og spore indtil slutningen af den længste neurit. Spor sekundære og tertiære grene ved at holde [ctrl] nede på Windows eller [alt] på et Mac OS og klikke på stien. Bekræft stien ved at trykke på [f].
- Bemærk, at målene for sporene er synlige i et separat vindue; Tilføj alle målingerne af klogrenene (primær, sekundær, tertiær) for at opnå den samlede længde for hver klo.
- For at analysere overfladeareal og cellulært volumen af elektroporerede CGN'er, download Imaris celleanalysesoftware (https://imaris.oxinst.com/).
BEMÆRK: FIJI kan også bruges til at rekonstruere celler i 3D fra z-stack-billeder ved hjælp af let tilgængelige og gratis plug-ins. Derudover er der en volumetrisk gengivelsesfunktion i Simple Neurite Tracer, men Imaris blev brugt af nedenstående grunde. - Upload z-stack billede af en elektroporeret CGN på Imaris. Få adgang til værktøjssættet til 3D-rekonstruktion ved at trykke på Overpass.
- Hvis du vil rekonstruere CGN, skal du trykke på Overflader og vælge et interesseområde, der omfatter hele cellen i billedvinduet. Når du er færdig, skal du trykke på den blå pil fremad i nederste højre hjørne under Opret.
- Hvis billedet indeholder flere kanaler til forskellige signaler, skal du vælge den kanal, der indeholder det elektroporerede CGN, og trykke på den blå pil fremad.
- Brug glidebjælken til at indstille en ønsket tærskel, der mest nøjagtigt passer til signalet fra den elektroporerede celle. Zoom tættere ind på cellens overflade for nøjagtigt at bestemme tærsklen. Når du er færdig, skal du trykke på den dobbelte grønne pil for at rekonstruere cellen og få overfladearealet og volumenstørrelsen fra metadataene.

Figur 3: Immunohistokemisk analyse og tredimensionel rekonstruktion af elektroporerede granulatneuroner. P7 CD-1-mus blev elektroporeret med en konstruktion, der udtrykte GFP. Hjerner blev indsamlet og udsat for immunhistokemi, konfokal mikroskopi og 3D-rekonstruktion til morfologisk analyse. (A) Tidslinje fra elektroporation til billedbehandling af en 10-DPI-mus. (B) Maksimalt projektionsbillede af et sagittalt tværsnit af elektroporeret cerebellum 10-DPI; Hvide linjer afgrænser cerebellære lag, og skalabjælken er 25 μm. (C) Maksimalt projektionsbillede af en enkelt elektroporeret granulatneuron 10-DPI og det tilsvarende 3D-spor, skalabjælken er 10 μm. (D) 3D-rekonstruktioner blev genereret ved hjælp af FIJI-pluginet Simple Neurite Tracer. Alle målinger blev sporet gennem z-stakken efter celleudfyldningssignalet. Aksel- og klomålinger blev sporet separat for hver dendrit; Stiplet linje angiver en del af dendrit inden for det aktuelle plan. Forkortelser: 3D = tredimensionel; GFP = grønt fluorescerende protein; DPI = dage efter injektion; PSD-95 = postsynaptisk densitetsprotein 95; BNI = granulatneuronstamfædre; PFA = paraformaldehyd. Klik her for at se en større version af denne figur.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results

Figur 4: Analyse af granulatneuronmorfologi under cerebellær udvikling. A) Maksimale projektionsbilleder af elektroporerede CGN'er fra 3-DPI til 14-DPI (postnatal alder P10 til P21), kerner (blå) og GFP (grøn) pilespidser angiver individuel dendrit, og skalabjælken er 10 μm. (B) Gennemsnitligt antal dendritter. C) Gennemsnitlig dendritlængde målt fra somaens bund til dendrittens spids. D) Brøkdel af dendritter, der indeholder en klo En værdi på 1,00 er 100%, dvs. alle dendritter har klo. E) Samlet længde af dendritisk klo. N > 30 celler pr. tilstand, indsamlet fra mindst 4 dyr pr. tilstand alle målinger blev analyseret af envejs ANOVA og enten en Dunnetts multiple sammenligningstest (B, C og D) eller en Tukeys multiple sammenligningstest (E), **** angiver signifikans med p <0,0001 over tid; fejlbjælker er S.E.M. Forkortelser: GFP = grønt fluorescerende protein; DPI = dage efter injektion; PSD-95 = postsynaptisk densitetsprotein 95; CGN'er = cerebellære granulatneuroner; ANOVA = variansanalyse; S.E.M. = standardfejl i middelværdien. Klik her for at se en større version af denne figur.
For at studere udviklingen af granulatneuronmorfologi in vivo blev en konstruktion, der udtrykte GFP under kontrol af en human ubiquitinpromotor (FUGW), elektroporeret i det udviklende lillehjerne hos CD-1-mus og hjerner indsamlet 3-, 5-, 7-, 10- og 14-dages postinjektion (DPI). Sparsom mærkning af celler ved elektroporation i kombination med konfokal mikroskopi fanger snapshots af CGN'er i perioder med dendritisk beskæring, vækst og modning. For kvantitativt at analysere og spore væksten af CGN synaptiske strukturer blev hver dendrit sporet ved hjælp af FIJI-pluginet Simple Neurite Tracer (SNT). SNT er en nem, hurtig, effektiv og let tilgængelig metode til måling af neurit og klolængde i tredimensionelt (3D) rum. Omvendt blev Imaris brugt til 3D-rekonstruktion af CGN'er for at opnå overfladeareal- og volumenmålinger, fordi programmet giver hurtig og præcis gengivelse af hver celle, og dets tærskelfunktioner er i stand til at isolere mærkede celler fra nærliggende mærkede celleaffald.
Nyfødte CGN'er gennemgår en sprudlende fase af dendritisk vækst efterfulgt af forfining fra P10 til P14 (3- til 7-DPI), der resulterer i beskæring af mere end 50% af overskydende dendritter (figur 4B). Denne begivenhed falder sammen med den gradvise forlængelse af de resterende arbors (figur 4C) og dannelsen af klolignende strukturer i slutningen af hver dendrit (figur 4D), hvilket indikerer, at disse udviklingsprocesser sker samtidigt. Mens kløer findes på ca. 75% af dendritterne ved P14 (7-DPI), fortsætter disse strukturer med at stige i størrelse indtil P21 (14-DPI) (figur 4E).
Ændringerne i dendrit og klomorfologi kunne afspejle enten en generel ændring i total cellestørrelse eller en omfordeling af cellemembranen. For at løse dette spørgsmål blev hver mærket granulatneuron rekonstrueret i Imaris for at kvantificere det samlede somatodendritiske overfladeareal og volumen. CGN-størrelsen forblev relativt konstant på tværs af udviklingen (figur 5A, B), selvom CGN'er ved P14 udviser et signifikant fald på 20% i volumen sammenlignet med P10, P12 og P17 (3-, 5- og 10-DPI) (figur 5B). Disse data tyder på, at membrangenanvendelse fra tilbagetrukne dendritter kan være særlig vigtig for at muliggøre udvidelse af dendritiske ender til kløer og peger på P14 (7-DPI) som et nøgletidspunkt i overgangen fra beskæring til synapseudvikling.

Figur 5: Analyse af granulatneuronstørrelse under cerebellær udvikling. Elektroporerede CGN'er blev rekonstrueret i Imaris for at bestemme cellulær størrelse. (A-B) Overfladeareal og volumetrisk analyse af granulatneuroner (dvs. cellesoma og dendritter) under cerebellær udvikling. N > 30 celler pr. tilstand, indsamlet fra mindst 4 dyr pr. tilstand. Alle målinger blev analyseret ved envejs ANOVA og en Dunnetts multiple sammenligningstest, ** angiver signifikans med p <0,005; fejlbjælker er S.E.M. Forkortelser: DPI = dage efter injektion; CGN'er = cerebellære granulatneuroner; ANOVA = variansanalyse; S.E.M. = standardfejl i middelværdien. Klik her for at se en større version af denne figur.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Cerebellære granulatneuroner er de mest rigelige neuroner i pattedyrhjernen og udgør næsten 60-70% af den samlede neuronpopulation i gnaverhjernen 1,14. Lillehjernen er blevet flittigt udnyttet til at belyse mekanismer for cellulær proliferation, migration, dendritdannelse og synapseudvikling 6,9,10,11,15,16,17,18,19,20 . Desuden har årtiers elektrofysiologiske undersøgelser bidraget til at fastslå granulatneuronernes rolle i langsigtet cerebellær plasticitet, som ligger til grund for kredsløbets involvering i lært motorisk adfærd21,22,23. Således er granulatneuroner et fremragende modelsystem til at forhøre nøglespørgsmål vedrørende synaps og kredsløbsudvikling.
Målet med denne undersøgelse er at fremhæve en teknik, der udnytter lillehjernen til at spore morfologien af en enkelt neurontype in vivo. Elektroporation af cerebellum retter sig mod delende celler; Således er det teknisk i stand til at mærke både granulatneuronstamfædre og gliaceller, selvom fordi granulatneuronforfædre er så talrige, er den elektroporerede befolkning stort set neuronal, selv uden behov for celletypespecifikke promotorer. Derudover kan denne teknik tilpasses til genetisk manipulation af gener in vivo for at studere deres roller i CGN-udvikling. Dette kan opnås ved transfektion af et plasmid, der udtrykker enten korthåret eller småinterfererende RNA'er for at slå gener ned eller et plasmid, der udtrykker Cre-rekombinase, til en transgen musestamme til punktafgiftsområder flankeret af LoxP-steder og slå det tilsigtede gen af interesse 10,24 ud.
Elektroporation har både styrker og svagheder for genetiske undersøgelser. Det giver en hurtigere metode til at manipulere gener sammenlignet med traditionelle transgene strategier, selvom elektroporationens sparsomhed begrænser dens anvendelighed til adfærdsstudier, som kræver et stort antal genetisk modificerede celler for at se effekter. En anden begrænsning er, at den kun pålideligt retter sig mod granulatneuroner mellem lobules 5 og 7, og dette skyldes dels, hvordan cerebellum er orienteret på injektionsstedet. Inden for det elektroporerede område giver denne metode imidlertid et relativt stort antal individuelt mærkede celler, hvilket giver potentialet for statistisk robuste målinger. For eksempel var det ikke kun muligt at følge dendritudviklingen over tid, men også subtile omfordelinger af membran mellem dendritterne og klørne kunne måles, hvilket udvidede tidligere offentliggjorte data20. CGN-kløer er særligt interessante at studere, da udvidelsen af disse dendritiske strukturer giver yderligere fast ejendom til granulatneuroner til dannelse af både excitatoriske forbindelser med mossy fiberterminaler og unipolære børsteceller samt hæmmende forbindelser med nærliggende Golgi-celler. Derfor kan kombination af disse dendritiske målinger med immunohistokemisk mærkning af specifikke præ- og postsynaptiske proteiner være nyttigt for at fremme undersøgelsen af cerebellær kredsløbsdannelse og synapsemodning.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne erklærer ingen interessekonflikter.
Acknowledgments
Arbejdet blev støttet af NIH-tilskud R01NS098804 (A.E.W.), F31NS113394 (U.C.) og Duke University's Summer Neuroscience Program (D.G.).
Materials
| Name | Company | Catalog Number | Comments |
| Betadine | Purdue Production | 67618-150-17 | |
| Cemented 10 µL needle | Hamilton | 1701SN (80008) | 33 gauge, 1.27 cm (0.5 in), 4 point style |
| Chicken anti-GFP | Millipore Sigma | AB16901 | Our lab uses this antibody at a 1:1000 concentration |
| Cotton-tip applicator | |||
| Donkey anti-chicken Cy2 | Jackson ImmunoResearch | 703-225-155 | Our lab uses this antibody at a 1:500 concentration |
| Ethanol (200 proof) | Koptec | V1016 | |
| Electroporator ECM 830 | BTX Harvard Apparatus | 45-0052 | |
| Fast Green FCF | Sigma | F7252-5G | |
| FUGW plasmid | Addgene | 14883 | |
| Glass slides | VWR | 48311-703 | Superfrost plus |
| Glycerol | Sigma-Aldrich | G5516 | |
| Heating pad | Softheat | ||
| Hoescht 33342 fluorescent dye | Invitrogen | 62249 | |
| Imaris | Bitplane | ||
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Micro cover glass | VWR | 48382-138 | |
| Nail polish | Sally Hansen | Color 109 | |
| Normal goat serum | Gibco | 16210064 | |
| O.C.T. embedding compound | Tissue-Tek | 4583 | |
| Olympus MVX10 Dissecting Scope | Olympus | MVX10 | |
| P200 pipette reach tip | Fisherbrand | 02-707-138 | Used for needle spacer |
| Parafilm | Bemis | PM-996 | |
| PBS pH 7.4 (10x) | Gibco | 70011-044 | |
| Simple Neurite Tracer | FIJI | https://imagej.net/Simple_Neurite_Tracer:_Basic_ Instructions |
|
| Sucrose | Sigma | S0389 | |
| Surgical tools | RWD Life Science | Small scissors and tweezers | |
| Triton X-100 | Roche | 11332481001 | non-ionic detergent |
| Tweezertrodes | BTX Harvard Apparatus | 45-0489 | 5 mm, platinum plated tweezer-type electrodes |
| Ultrapure distilled water | Invitrogen | 10977-015 | |
| Vectashield mounting media | Vectashield | H1000 | |
| Vetbond tissue adhesive | 3M | 1469SB | |
| Zeiss 780 Upright Confocal | Zeiss | 780 |
References
- Altman, J., Bayer, S. A. Development of the cerebellar system : in relation to its evolution, structure, and functions. , CRC Press. (1997).
- Rahimi-Balaei, M., Bergen, H., Kong, J., Marzban, H. Neuronal migration during development of the cerebellum. Frontiers in Cellular Neuroscience. 12, 484 (2018).
- Alder, J., Cho, N. K., Hatten, M. E. Embryonic precursor cells from the rhombic lip are specified to a cerebellar granule neuron identity. Neuron. 17 (3), 389-399 (1996).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annual Review of Neuroscience. 18, 385-408 (1995).
- Ben-Arie, N., et al. Math1 is essential for genesis of cerebellar granule neurons. Nature. 390 (6656), 169-172 (1997).
- Borghesani, P. R., et al. BDNF stimulates migration of cerebellar granule cells. Development. 129 (6), 1435-1442 (2002).
- Espinosa, J. S., Luo, L. Timing neurogenesis and differentiation: insights from quantitative clonal analyses of cerebellar granule cells. Journal of Neuroscience. 28 (10), 2301-2312 (2008).
- Markwalter, K. H., Yang, Y., Holy, T. E., Bonni, A. Sensorimotor coding of vermal granule neurons in the developing mammalian cerebellum. Journal of Neuroscience. 39 (34), 6626-6643 (2019).
- Shalizi, A., et al. PIASx is a MEF2 SUMO E3 ligase that promotes postsynaptic dendritic morphogenesis. Journal of Neuroscience. 27 (37), 10037-10046 (2007).
- Shalizi, A., et al. A Calcium-regulated MEF2 sumoylation switch controls poststynaptic differentiation. Science. 311 (5763), 1012-1017 (2006).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain. Science. 303 (5660), 1026-1030 (2004).
- Holubowska, A., Mukherjee, C., Vadhvani, M., Stegmuller, J. Genetic manipulation of cerebellar granule neurons in vitro and in vivo to study neuronal morphology and migration. Journal of Visualized Experiments: JoVE. (85), e51070 (2014).
- Yang, Y., et al. Chromatin remodeling inactivates activity genes and regulates neural coding. Science. 353 (6296), 300-305 (2016).
- Herculano-Houzel, S. Coordinated scaling of cortical and cerebellar numbers of neurons. Frontiers in Neuroanatomy. 4, 12 (2010).
- Wilson, P. M., Fryer, R. H., Fang, Y., Hatten, M. E. Astn2, a novel member of the astrotactin gene family, regulates the trafficking of ASTN1 during glial-guided neuronal migration. Journal of Neuroscience. 30 (25), 8529-8540 (2010).
- Kokubo, M., et al. BDNF-mediated cerebellar granule cell development is impaired in mice null for CaMKK2 or CaMKIV. Journal of Neuroscience. 29 (28), 8901-8913 (2009).
- Schwartz, P. M., Borghesani, P. R., Levy, R. L., Pomeroy, S. L., Segal, R. A. Abnormal cerebellar development and foliation in BDNF-/- mice reveals a role for neurotrophins in CNS patterning. Neuron. 19 (2), 269-281 (1997).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. Journal of Neuroscience. 15 (7), Pt 1 4970-4981 (1995).
- Zhou, P., et al. Polarized signaling endosomes coordinate BDNF-induced chemotaxis of cerebellar precursors. Neuron. 55 (1), 53-68 (2007).
- Dhar, M., Hantman, A. W., Nishiyama, H. Developmental pattern and structural factors of dendritic survival in cerebellar granule cells in vivo. Scientific Reports. 8 (1), 17561 (2018).
- Ito, M. Synaptic plasticity in the cerebellar cortex and its role in motor learning. Canadian Journal of Neurological Sciences. 20, Suppl 3 70-74 (1993).
- Jorntell, H., Hansel, C. Synaptic memories upside down: bidirectional plasticity at cerebellar parallel fiber-Purkinje cell synapses. Neuron. 52 (2), 227-238 (2006).
- Nakanishi, S. Genetic manipulation study of information processing in the cerebellum. Neuroscience. 162 (3), 723-731 (2009).
- Chang, C. H., et al. Atoh1 controls primary cilia formation to allow for SHH-triggered granule neuron progenitor proliferation. Developmental Cell. 48 (2), 184-199 (2019).
Tags
Neurovidenskab udgave 172 Neuronal udvikling cerebellum dendrit synaps granulatneuron elektroporationErratum
Formal Correction: Erratum: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development
Posted by JoVE Editors on 04/06/2023.
Citeable Link.
An erratum was issued for: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development. A figure was updated.
Figure 2 was updated from:
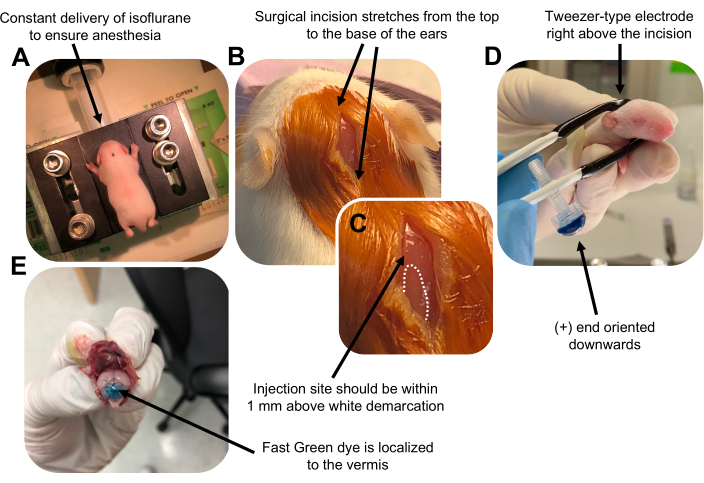
Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.
to:
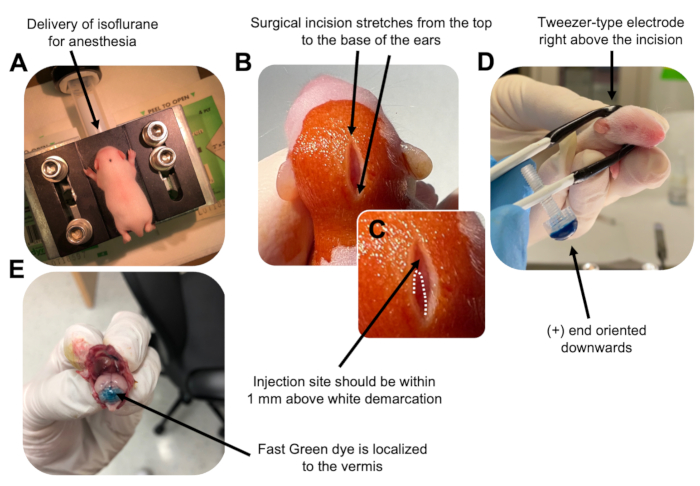
Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.



